基于RNA-seq技术对不同品种猪背最长肌差异表达基因的筛选与注释
2016-07-02李小金刘林清王重龙
李小金,钱 坤,刘林清,王重龙,周 杰
(1 安徽农业大学 动物科技学院,安徽 合肥 230036;2 安徽省农业科学院 畜牧兽医研究所,安徽 合肥 230031)
基于RNA-seq技术对不同品种猪背最长肌差异表达基因的筛选与注释
李小金1,2,钱坤2,刘林清2,王重龙2,周杰1
(1 安徽农业大学 动物科技学院,安徽 合肥 230036;2 安徽省农业科学院 畜牧兽医研究所,安徽 合肥 230031)
[摘要]【目的】 筛选皖南花猪和大约克猪背最长肌组织差异表达基因。【方法】 采集皖南花猪和大约克猪背最长肌(各3头),测定其肉质性状指标,并提取其RNA,采用高通量转录组测序(RNA-seq)技术进行测序,对所获序列进行GO和Pathway显著性富集分析。【结果】 测序后皖南花猪3个样本得到的总序列数分别为65 584 126, 64 327 738和59 244 502 ,其中有效序列达到94.4%,94.3%和94.2%;大约克猪3个样本得到的总序列数分别为 57 969 134,68 254 168和72 298 142,其中有效序列达到93.8%,93.7%和93.8%。测序饱和度良好,证明测序数据真实可靠。差异表达分析结果显示,共筛选到347个差异表达基因,其中包含94个上调基因,253个下调基因。GO 功能显著性富集和Pathway显著性富集分析发现,差异表达基因富集在与糖酵解代谢和肌肉发育相关的生物学过程中以及与脂肪酸代谢和生长性状、胴体性状相关的信号通路上。【结论】 获得了猪背最长肌组织基因表达谱,筛选出了一些与肉质性状和生长性状有关的候选基因。
[关键词]RNA-seq;皖南花猪;大约克猪;差异表达基因;背最长肌
猪肉是人类动物蛋白的主要来源,我国是世界上生猪生产和猪肉消费第一大国。随着社会生产力的提高以及生活水平的改善,人们对高品质和健康优质猪肉的需求也不断增加。因此改善肉品质已经成为猪肉产业的重要课题。骨骼肌是动物体内最丰富的组织,约占动物体质量的40%,猪肌肉生长发育的差异是导致不同品种猪肉质差异的重要原因。由于肉质性状形成的复杂性及不能(或不易)活体测定,传统的选育方法很难从遗传角度对肉质性状改善取得较大进展。因此采用分子生物学手段,深入分析肉质性状遗传机制,从而参考制定合理的遗传改良方案是后基因组时代动物育种研究的热点。
随着后基因组时代的到来, 转录组学、蛋白质组学、代谢组学等各种组学技术相继出现,其中转录组学是率先发展起来的应用最广泛的技术[1]。转录组是在一个或多个细胞中表达的RNA转录物的集合[2]。通过转录组分析可以帮助人们在整体水平上研究细胞中基因转录的情况及转录调控规律。过去的转录组研究通常采用Sanger测序和cDNA芯片方法,而现在的转录组研究越来越多采用高通量测序技术。新一代高通量转录组测序(RNA-seq)与传统的基因芯片测序方法相比,具有高通量、低成本、高灵敏度、重复性好且无需已知参考序列等优点,已逐步取代基因芯片测序方法,成为转录组研究的主要手段[3]。该技术已经应用于小鼠[4]、海鲈鱼[5]和水稻[6]等的RNA测序。2013年杨亚岚[7]利用高通量测序技术筛选出了不同猪种间的差异表达基因,并对其进行了功能注释和分析。
对中外猪种的比较发现,国外猪种具有生长速度快、瘦肉率高和饲料转化率高等优点,但往往存在肌内脂肪少、肉色灰白和系水力低等缺点,而我国地方猪种具有肉色鲜红、系水力强、肌内脂肪含量高和肌纤维直径小等优点[8]。本试验选用肉质优良但生长速度较慢的中国地方猪品种皖南花猪和生长速度快但肉质较差的具有代表性的国外品种大约克猪作为研究对象,采用高通量转录组测序技术对其背最长肌RNA进行测序,构建皖南花猪和大约克猪背最长肌组织的基因表达谱,获得差异表达基因,利用GO分析和pathway分析对差异基因进行筛选,确定调控肉质性状的关键基因,以期加深对肌肉生长发育和脂肪代谢调控的了解,为国内外猪品种在肉质和生长性状方面形成差异的分子机理研究提供分子生物学证据。
1材料与方法
1.1皖南花猪和大约克猪背最长肌样品的采集
采集成年期皖南花猪和大约克猪的背最长肌组织,每个猪种采集3头,样品采集后-80 ℃贮存。
1.2肉质性状的测定
1.2.1肉色评分根据《猪肌肉品质测定技术规范》(NY/T 821-2004),于宰后1~2 h取倒数第3和第4肋骨处的背最长肌,将肉块切为两半,平置于白色瓷盘中,对照肉样和肉色比色板在自然光线下进行目测评分,采用6分制比色板。
1.2.2pH值的测定宰后取倒数第3和第4肋骨处的背最长肌,在常温下放置45 min后使用pHB-29C便携式酸度计进行测定,记为pH45。
1.2.3大理石纹评分宰后取倒数第3和第4肋骨处的背最长肌,采用美制NPPC比色板(1999版)对照眼肌样本给出大理石纹评分。
1.2.4滴水损失的测定猪屠宰后2 h剥离背最长肌,切取试样,将其修整为5 cm×3 cm×2.5 cm的肉块,对肉块称质量(W1)后置于充气的塑料袋中。用细铁丝钩住肉样一端,保持肉样垂直向下,不接触塑料袋,扎紧袋口,悬吊于冰箱中,在4 ℃条件下保存24 h,取出肉样,用洁净滤纸轻轻拭去肉样表层汁液后称质量(W2)。滴水损失(%)=[(W1-W2)/W1]×100%。
1.2.5肌内脂肪的测定精确称量4~5 g肉样绞碎、烘干,按照GB/T 6433-94饲料粗脂肪测定方法测定肌内脂肪,每个样品至少平行测定3次。
1.2.6肌纤维直径的测定宰后2 h内,在左胴体上采集背最长肌和股二头肌肉样,将其修剪成3 mm×3 mm×5 mm的肉块,随后放在体积分数20% HNO3中浸泡24 h,取出肉样放在滴有甘油的载玻片上,用尖镊子将其挑成游离状纤维,在15×40倍并带有目镜测微尺的显微镜下,从上到下、从左到右随机选择弯曲、变形、扭转和重叠的50根肌纤维,测量其直径,取平均值。
1.3背最长肌RNA的提取与测序
总RNA的提取按照TIANGEN Tissue试剂盒中的使用说明书进行操作。提取后各样品的总RNA送交上海伯豪生物技术有限公司采用Solexa测序技术测序。
1.4数据分析
1.4.1原始数据处理测序仪产生的原始图像数据经Base Calling转化为原始序列数据(Raw reads),结果以FASTQ文件格式存储。由于原始序列数据可能包含低质量序列、接头序列等杂质序列,不能直接用于生物信息分析,所以本研究对其进行处理转换为高质量序列数据(Clean reads),利用Tophat(version:2.0.6)软件的spliced mapping算法对Clean reads进行猪基因组mapping。
1.4.2差异表达基因的筛选使用FPKM法[4]计算基因表达量,然后根据基因的表达量(FPKM值)计算基因在不同样本间的差异表达倍数。按照数字化基因表达谱差异基因检测方法[9],对差异检验的P-value作多重假设检验校正,通过错误发现率(FDR)来决定P-value的阈值。FDR值越小,差异倍数越大,表达差异越显著。定义FDR≤0.01和差异倍数绝对值≥2的基因为差异表达基因。
1.4.3GO功能显著性富集分析将所有差异表达基因向Gene Ontology 数据库的各条目映射,计算每个条目的基因数目,然后应用超几何检验从差异表达的基因中找出与整个基因组背景相比显著富集的GO条目,超几何检验P的计算公式为:
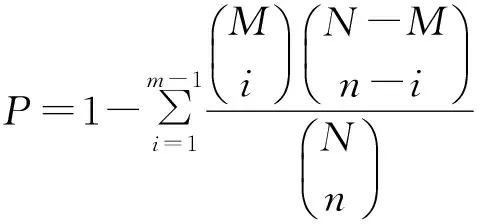
(1)
式中:N为基因组中具有GO注释的基因数目,n为N中差异表达基因的数目,M为基因组中注释为某特定GO条目的基因数目,m为注释为某特定GO条目的差异表达基因数目。计算得到的P值通过Bonferroni校正,以校正后的P值为阈值,满足P<0.01的GO条目定义为在差异表达基因中显著富集的GO条目。通过GO功能显著性富集分析能确定差异表达基因行使的主要生物学功能。
1.4.4Pathway显著性富集分析Pathway 显著性富集分析以KEGG Pathway 为单位,应用超几何检验从差异表达基因中找出与整个基因组背景相比显著性富集的Pathway。该分析的计算公式同式(1),在这里N为芯片中具有Pathway 注释的基因数目,n为N中差异表达基因的数目,M为芯片中注释为某特定Pathway 的基因数目,m为注释为某特定Pathway的差异表达基因数目。P<0.01的Pathway为在差异表达基因中显著富集的Pathway。通过Pathway 显著性富集能确定差异表达基因参与的最主要生化代谢途径和信号转导途径。
2结果与分析
2.1皖南花猪和大约克猪背最长肌的肉质性状
从表1可以看出,皖南花猪背最长肌的肉色、pH值、大理石纹和肌内脂肪显著(P<0.05)高于大约克猪,而滴水损失和肌纤维直径显著(P<0.05) 低于大约克猪。
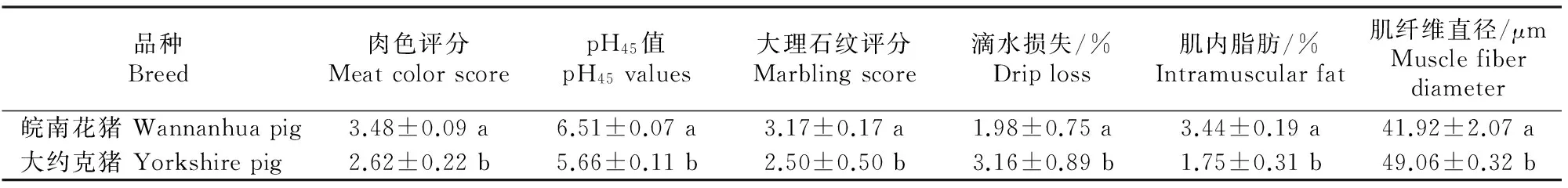
表 1 皖南花猪和大约克猪背最长肌的肉质性状(n=3)
注:同列数据后标不同小写字母表示差异显著(P<0.05)。
Note:Different small letters mean significant difference (P<0.05).
2.2皖南花猪和大约克猪背最长肌基因测序质量
经高通量测序,皖南花猪(WH) 3个样本得到的原始序列数分别为65 584 126,64 327 738和59 244 502,有效率分别达到94.4%,94.3%和94.2%;大约克猪(YY) 3个样本得到的原始序列数分别为57 969 134,68 254 168和72 298 142,其中有效率分别达到93.8%,93.7%和93.8%。可见所测样品中有效序列的比例都占到原始序列的90%以上,表明测序质量较高,所得有效序列数目能够满足试验需要。
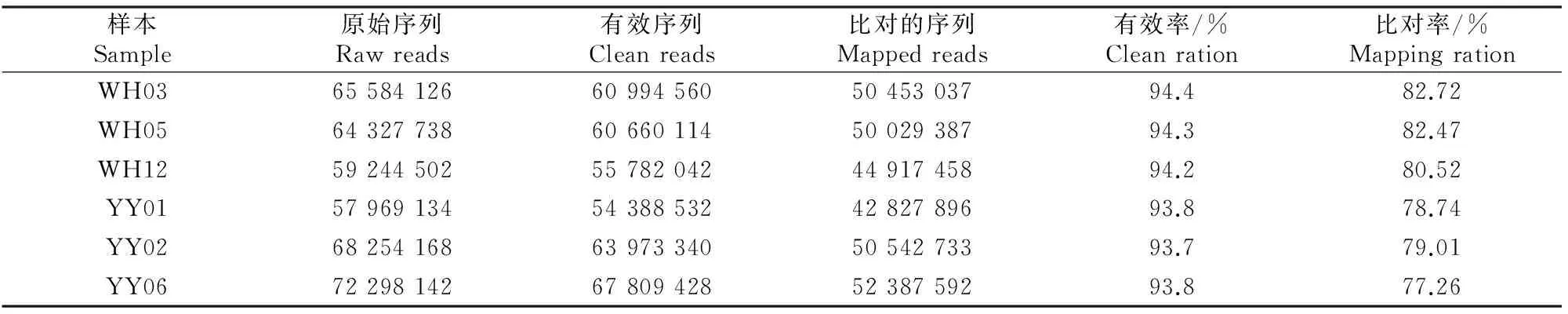
表 2 皖南花猪和大约克猪背最长肌样品的测序结果
注:WH03表示皖南花猪03号样本,YY01表示大约克猪01号样本,其他样本依此类推。
Note:WH03 means the 03 sample of Wannanhua pig,YY01 means the 01 sample of Yorkshire pig,and so as other samples.
2.3皖南花猪和大约克猪差异表达基因及其功能注释
2.3.1差异基因筛选以皖南花猪为对照,大约克猪与之相比,差异表达基因共有347个,其中上调基因有94个,下调基因有253个。
2.3.2差异表达基因的GO功能富集分析GO是一个采用动态更新的标准词汇表来描述基因及其产物功能的数据库,目前被广泛应用于生物的转录组数据分析研究中[10]。图1为2个品种猪背最长肌差异基因GO的功能富集分布图。
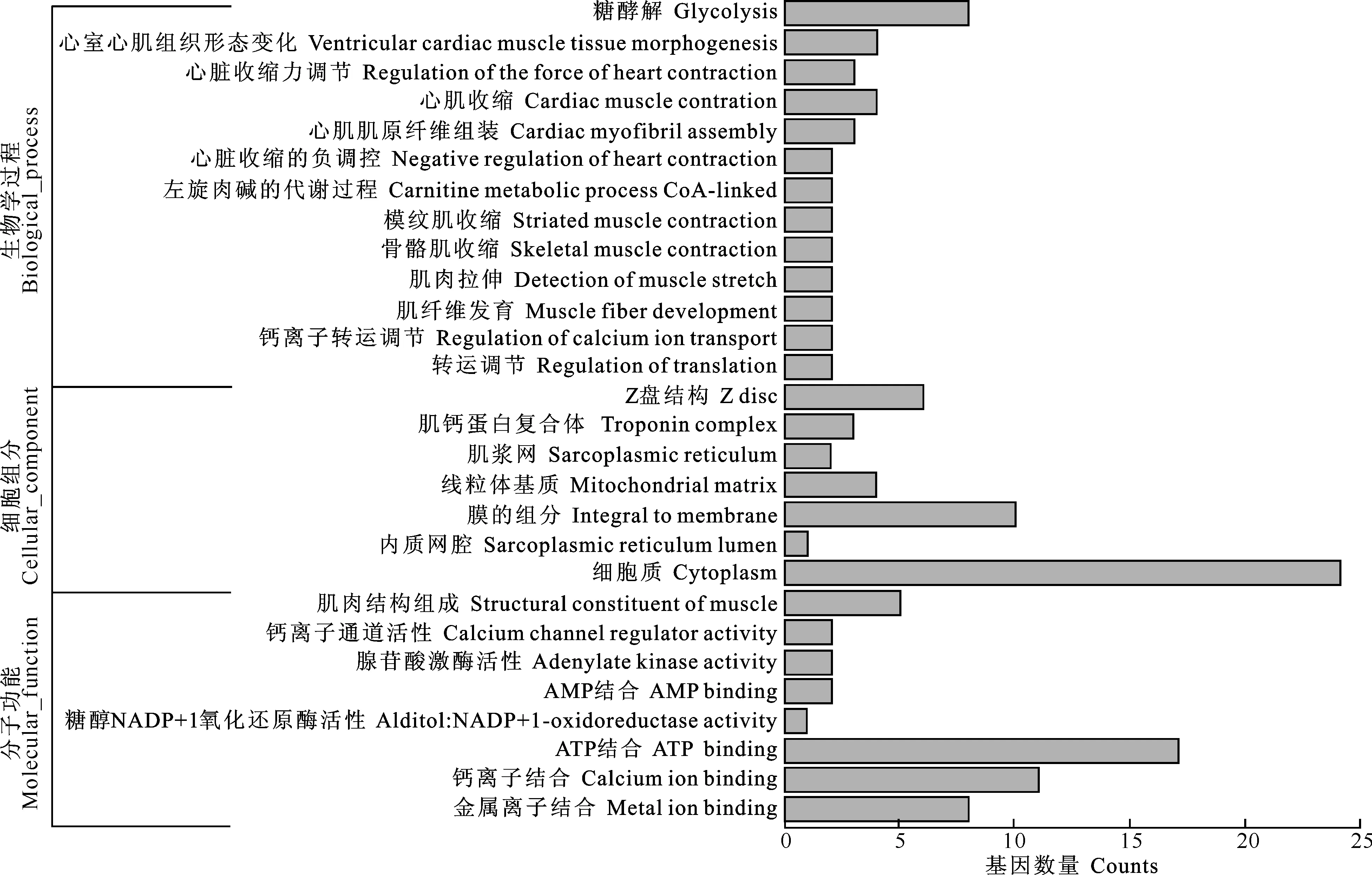
图 1皖南花猪和大约克猪背最长肌差异基因GO的功能富集分布图
Fig.1Enriched GO distribution of differentially expressed genes of longissimus muscle of Wannanhua and Yorkshire pigs
GO总共分为3大功能类,分别描述基因的分子功能(Molecular function,MF)、所处的细胞位置(Cellular component,CC)和参与的生物学过程(Biological process,BP)。背最长肌差异表达基因中已注释的基因有6 937个,其中参与生物工程的基因有353个,参与细胞组分的基因有175个,参与分子功能的基因有185个。GO功能显著富集得到分类条目有487个,其中与细胞组分相关的显著性富集条目有62个,所占比例为12.7%;与分子功能相关的显著性富集条目有116个,所占比例为23.9%;与生物学过程相关的显著性富集条目有309个,所占比例为63.4%。由此可以推测,生物学过程在皖南花猪和大约克猪肉质性状差异中起着重要作用。差异表达基因参与的显著性(P<0.01)生物过程主要包括糖酵解、肌肉纤维的发育、心肌收缩、横纹肌收缩和骨骼肌收缩等;细胞所处位置主要表现在肌原纤维相邻两肌节交接处的盘状(Z盘)结构、肌钙蛋白复合、肌浆网和线粒体基质等;分子功能主要表现在肌肉的结构组成、钙离子通道活性调节、腺苷酸激酶活性和AMP活性等(图1)。
2.3.3差异表达基因的KEGG 富集分析KEGG数据库记录细胞中基因产物的功能以及基因产物的相互作用网络,基于KEGG 通路的分析有助于进一步了解基因的生物学功能[11]。对皖南花猪和大约克猪背最长肌间差异表达基因进行KEGG pathway信号通路分析,结果表明KEGG数据库注释的差异表达基因有6 620个,Pathway显著性富集分析发现这些基因参与了146条生物学代谢通路,其中有22条通路(表3)存在极显著性(P<0.01)富集。差异表达基因中,参与脂肪代谢途径的基因数目最多,有37个,主要包括脂肪酸代谢、PPAR信号通路、丙酸代谢、脂肪酸生物合成、脂肪细胞因子信号转导通路、脂肪酸伸长率和不饱和脂肪酸生物合成,其次是代谢途径、碳代谢、糖酵解和丙酮酸代谢等。说明脂肪代谢相关基因的差异表达可能是皖南花猪和大约克猪肉质差异的重要原因。
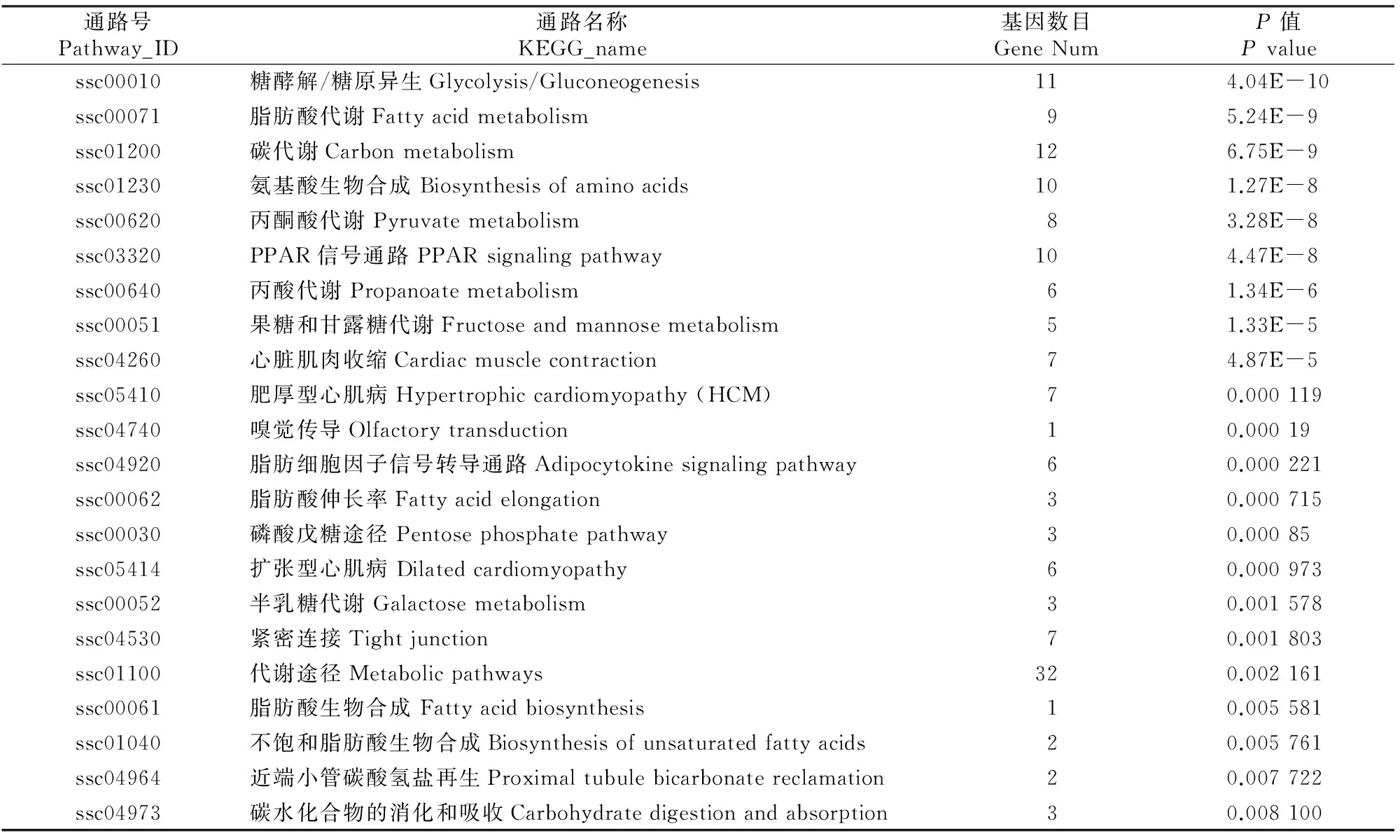
表 3 皖南花猪和大约克猪背最长肌差异表达基因的Pathway显著富集结果
3讨论
本研究选用在生长速度和肉质性状等方面存在较大差异的皖南花猪和大约克猪的背最长肌进行高通量转录组测序,筛选与肉质性状相关的基因。结合GO功能富集分析和Pathway通路富集分析对高通量测序获得的皖南花猪与大约克猪背最长肌间差异表达基因数据进行生物信息学分析,结果发现一些显著通路和生物过程如能量代谢中的糖酵解代谢、脂肪沉积代谢及肌肉发育等中的差异基因在皖南花猪与大约克猪中表达差异较大,其可能与皖南花猪和大约克猪背最长肌肉质性状的差异有关。
糖酵解代谢是影响肉质性状形成的重要生理过程[12-13]。糖酵解潜能(Glycolytic potential,GP)是指动物在屠宰前肌肉含有的发生糖酵解产生乳酸的底物(如肌糖原、葡萄糖-6-磷酸和葡萄糖)以及乳酸的总量。乳酸是影响肉质性状的重要生化指标,对pH和肉色都有较大影响[14]。pH是重要的肉质性状,肉色、保水力、熟肉率等诸多性状都直接或间接地决定于pH的高低。终端pH越低、糖酵解潜力越高,则肉色越苍白,保水力越差[15-16]。本试验发现,GO功能分析的最显著生物过程均与糖酵解代谢有关,差异基因包括GPI、GAPDH、LDHA、PGK1、ENO3、PFKM、TPI1、PGAM2,且这8个基因在大约克猪背最长肌中的表达量显著高于皖南花猪,说明皖南花猪的pH值显著高于大约克猪,这与表1中皖南花猪的pH值显著高于大约克猪相一致。此外,段艳宇等[17]研究发现,猪背最长肌GP与24 h pH值呈显著负相关(r=-0.39,P<0.001)、与b值和L值呈显著正相关(b值:r=0.36,P<0.001;L值:r=0.13,P<0.001),背最长肌GP越高,则肉的终pH值越低,肉色也更加苍白。磷酸甘油酸激酶(PGK)是真核细胞糖酵解过程中的一种主要组成酶,其在将葡萄糖转变为丙酮酸的过程中将1,3-二磷酸甘油酸分子C1上的高能磷酸键转移给二磷酸腺苷(ADP)生成三磷酸腺苷(ATP)。徐德全[18]研究表明,PGK1在肌内脂肪(IMF)含量低的大白猪中高表达,在梅山猪、通城猪中低表达,可能是影响IMF沉积的下调基因,这与本试验中PGK1在大约克猪中高表达、在皖南花猪中低表达的结果相一致。TPI1基因主要参与糖异生、糖酵解和脂肪酸生物合成[19]。Laville等[20]通过对猪背最长肌肌浆蛋白质的双向凝胶电泳发现,嫩度较高肉样中的TPI1含量显著高于嫩度较低的肉样(P<0.05)。
肌纤维类型及组成对调控肉质起着关键作用[21-22],肌纤维类型也显著影响肌肉的生长[23]。猪出生后骨骼肌中主要含4 种肌纤维,根据肌球蛋白重链(MyHC)的不同亚型将其分为Ⅰ型、ⅡA 型、ⅡB 型和ⅡX 型[24]。本试验发现GO功能分析的显著性生物过程均与肌肉纤维发育有关,参与此过程的差异基因包括MLC2V、CHRNB1,且这些基因在皖南花猪背最长肌中的表达量显著高于大约克猪。这说明皖南花猪与大约克猪背最长肌的肌纤维组成存在显著差异,可能与2品种猪肉质差异和生长速度差异有关,这与表1中大约克猪的肌纤维直径显著大于皖南花猪的结果相一致,同时也与以前的报道[25-28]基本一致。在显著性生物过程中还有一些与肌肉组织发育有关的基因,包括CHRNB1、ACTN2、TCAP、CSRP3、TNNT1、PGAM2、ARG2。PGAM2基因编码的蛋白参与糖酵解过程,与横纹肌收缩有关[29],Tang等[30]研究表明PGAM2与骨骼肌的生长发育确实相关。TCAP通过与筒箭毒碱的相互作用,影响生肌细胞前体分泌筒箭毒碱,控制骨骼肌的生长[31]。CSRP3又叫肌肉特异性LIM蛋白(muscle LIM protein,MLP),是骨骼肌发育的一种正性调节因子[32],邱海芳等[33]研究表明,CSRP3与肌肉发育有关。
脂肪性状影响哺乳动物的肉质,由于脂肪水平受品种和年龄的影响,因此哺乳动物体脂的调控是一个复杂的过程。猪脂肪组织的沉积还具有品种差异,不同品种的猪脂肪沉积能力相差较大,表现为脂肪型猪种的脂肪沉积能力强于瘦肉型猪种[34]。在Pathway差异显著的通路中,发现了一些与脂肪代谢显著相关的信号通路,分别是脂肪酸代谢、丙酸代谢、PPAR信号通路、脂肪细胞因子信号通路、脂肪酸伸长率、脂肪酸生物合成和不饱和脂肪酸生物合成,参与这些通路的差异基因包括UBC、RXRG、LDHA、HADHA、ACADM、ACADL、CPT1B、CPT2、ACSL1、ACSL3、ACAA2、ECI1、FABP3、CD36、ACSS1、ACACB、ACSS3、PRKAG1、TECR,说明皖南花猪和大约克猪的背最长肌在脂类代谢方面存在显著差异。此外,李明洲等[35]研究发现,脂肪型猪种太湖猪在不同月龄时脂肪细胞体积、IMF含量等指标均高于瘦肉型猪种长白猪,且在3月龄后差距逐渐明显。杨帆[36]通过对猪生长、胴体及肉质与候选基因集的关联分析发现,丙酸代谢通路与脂肪酸代谢通路内基因间的互作效应显著影响猪生长、胴体及肉质性状。在筛选到的差异表达基因中,FABP3、ACSL1和ACACB是参与脂类代谢的基因且在皖南花猪背最长肌中的表达量都显著高于大约克猪。FABP3又称H-FABP,主要功能是参与细胞内的脂肪酸运输,可将脂肪酸从细胞膜上运到脂肪酸氧化和甘油三酯及磷酸的合成位置。有研究表明,FABP3与畜禽肌内脂肪含量呈正相关,可影响肉质的嫩度、风味和多汁性,故将FABP3基因作为改善肉质的候选基因之一[37-38],这与表1中皖南花猪背最长肌的肌内脂肪显著高于大约克猪相一致。ACSL1和ACACB基因参与胰岛素抵抗和肥胖等代谢过程[39-40],在牛的肌肉组织中,ACSL1基因影响多不饱和脂肪酸的沉积[41];抑制ACACB的表达可以促进肌肉组织的脂肪酸氧化,改善全身葡萄糖动态平衡[42]。在这些差异基因中,目前已有研究证明对猪的肉质性状有重要影响的基因主要有FABP3、CPT1B、CD36、CSRP3、ACSS1、PGAM2、PGK1和PFKM等。还有一些基因尚未见相关报道,如TECR、GPI和MLC2V,但是其已知功能均与细胞生长调控和脂肪酸生物合成及氧化相关,可作为肉质性状候选基因进行深入研究和验证。
猪是人类较为理想的医学模型,通过建立与人类疾病相似的猪医学模型,研究疾病发生的基因调控或作用机制,可为人类疾病防治提供科学依据。本研究发现了7个在肥厚型心肌病和6个在扩张型心肌病通路中差异表达的基因,其中包括MYH7、MYBPC3、TNNT2和TNNI3等已知的与肥厚型心肌病相关的基因[43],以及LMNA、SCN5A、CTLA-4等已知的与扩张型心肌病有关的基因[44],这也预示着可以考虑通过构建肥厚型心肌病病猪和扩张型心肌病病猪模型,来研究这2种病的致病机理以及开发临床用药等。
4结论
本研究利用Solexa测序技术对皖南花猪和大约克猪背最长肌进行转录组测序,通过比对分析,筛选出了347个差异表达基因,其中上调的基因有94个,下调的基因有253 个。 通过对差异表达基因进行GO功能分析、KEGG通路分析共筛选出了GPI、FABP3、CSRP3、CPT1B、ACTN2等5个与肉质性状相关的候选基因,发现了与肉质性状显著相关的糖酵解代谢、脂类代谢和肌肉发育等生物过程和代谢通路,初步揭示了造成皖南花猪和大约克猪之间肉质性状差异的原因,为挖掘新基因和深入研究猪肉质性状遗传因素等奠定了基础。
[参考文献]
[1]Lockhart D J,Winzeler E A.Genomics,gene expression and DNA arrays [J].Nature,2000,405(6788):827-836.
[2]Etebari K,Palfreyman R W,Schlipalius D,et al.Deep sequencing based transcriptome analysis ofPlutellaxylostellalarvae parasitized by Diadegma semiclausum [J].BMC Genomics,2011,12:446.
[3]祁云霞,刘永斌,荣威恒.转录组研究新技术:RNA-Seq及其应用 [J].遗传,2011,33(11):1191-1202.
Qi Y X,Liu Y B,Rong W H.RNA-Seq and its applications:a new technology for transcriptomics [J].Hereditas,2011,33(11):1191-1202.(in Chinese)
[4]Mortazavi A,Williams B A,McCue K,et al.Mapping and quantifying mammalian transcriptomes by RNA-seq [J].Nat Methods,2008,5(7):621-628.
[5]Xiang L X,He D,Dong W R,et al.Deep sequencing based transcriptome profiliing analysis of bactera challengedLateolabraxjaponicusreveals insight into the immune relevant genes in marine fish [J].BMC Genomics,2010,11(1):472.
[6]Zhang G,Guo G,Hu X,et al.Deep RNA sequencing at single base-pair resolution reveals high complexity of the rice transcriptome [J].Genome Res,2010,20(5):646-654.
[7]杨亚岚.不同品种猪骨骼肌表型差异的全基因组甲基化调控研究 [D].北京:中国农业科学院,2013.
Yang Y L.Genome-wide methylation regulation analysis of skeletal muscle phenotypic differences in different pig breeds [D].Beijing:Chinese Academy of Agricultural Sciences Dissertation,2013.(in Chinese)
[8]薛尚军,杨晓奋,刘宏,等.中国地方猪种的肉质特性 [J].国外畜牧学(猪与禽),2011,31(2):92-94.
Xue S J,Yang X F,Liu H,et al.Chinese local breeds of meat characteristics [J].Foreign Animal Science(Pigs and Poultry),2011,31(2):92-94.(in Chinese)
[9]Audic S,Claverie J M.The significance of digital gene expression profiles [J].Genome Res,1997,7(10):986-995.
[10]Conesa A,Gotz S.Blast2GO:a comprehensive suite for functional analysis in plant genomics [J].International Journal of Plant Genomics,2008:619832.
[11]Ogata H,Goto S,Sato K,et al.KEGG:Kyoto encyclopedia of genes and genomes [J].Nucleic Acids Research,1999,27(1):29-34.
[12]Christofk H R,Vander Heiden M G,Harris M H,et al.The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth [J].Nature,2008,452(7184):230-233.
[13]Malfatti E,Birouk N,Romero N B,et al.Juvenile-onset permanent weakness in muscle phosphofructokinase deficiency [J].Neurol Sci,2012,316(1):173-177.
[14]朱学伸.动物宰后肌肉成熟期间乳酸含量与pH的变化 [D].南京:南京农业大学,2007.
Zhu X S.Changes in muscle lactate content and pH during maturation of the animal slaughter [D].Nanjing;Nanjing Agricultural College,2007.(in Chinese)
[15]Hovenier R,Kanis E,Van Asseldonk T,et al.Genetic parameters of pig meat quality traits in a halothane negative population [J].Livest Prod Sci,1992,32(4):309-321.
[16]De Vries A G,Van Der Wala P G,Longb T,et al.Genetic parameters of pork quality and production traits in Yorkshire populations [J].Livest Prod Sci,1994,40(3):277-289.
[17]段艳宇,周利华,袁飞,等.猪肌肉糖原酵解潜能及其组分与肉质、脂肪沉积和血液性状的相关性 [J].江西农业大学学报,2010,32(6):1224-1229.
Duan Y Y,Zhou L H,Ruan F,et al.Correlation of muscle glycolytic potential and its components with meat quality,fat deposition and blood indexes in pigs [J].Journal of Jiangxi Agricultural University,2010,32(6):1224-1229.(in Chinese)
[18]徐德全.猪背最长肌差异表达基因的克隆鉴定及其特征分析 [D].武汉:华中农业大学,2005.
Xu D Q.Longissimus muscle identification and cloning of differentially expressed genes characteristic analysis [D].Wuhan:Huazhong Agricultural University,2005.(in Chinese)
[19]Rozovsky S,McDermott A E.Substrate product equilibrium on a reversible enzyme,triosephosphate isomerase [J].Proceeding of the National Academy of Sciences,2007,104(7):2080-2085.
[20]Laville E,Sayd T,Terlouw C,et al.Comparison of sarcoplasmic proteomes between two groups of pig muscles elected for shear force of cooked meat [J].J Agric Food Chem,2007,55(14):5834-5841.
[21]Choi Y M,Ryu Y C,Kim B C.Influence of myosin heavy and light chain isoforms on early postmortem glycolytic rate and pork quality [J].Meat Science,2007,76:281-288.
[22]Gil M,Angels Olivera M,Gisperta M,et al.The relationship between pig genetics,myosin heavy chain I,biochemical traits and quality ofM.longissimusthoracis [J].Meat Science,2003,65:1063-1070.
[23]Wegner J,Albrecht E,Fiedler I,et al.Growth and breed related changes of muscle fiber characteristics in cattle [J].Anim Sci,2000,78:1485-1496.
[24]Ryu Y C,Kim B C.Comparison of histochemical characteristics in various pork groups categorized by postmortem metabolic rate and pork quality [J].Anim Sci,2006,84:894-901.
[25]杨晓静,赵如茜,陈杰,等.猪背最长肌肌纤维类型的发育性变化及其品种和性别特点 [J].中国兽医学报,2005,25(1):89-94.
Yang X J,Zhao R Q,Chen J,et al.The developmental changes of myofibre types in LD muscle of erhualian and Large White Pigs [J].Chinese Journal Veterinary Science,2005,25(1):89-94.(in Chinese)
[26]郭佳.金华猪和长白猪肌纤维组成差异及ERK基因对肌纤维转化的影响研究 [D].杭州:浙江大学,2011.
Guo J.Comparison of muscle fiber types in Jinhua and Landrace pigs and the effect ofERKgene on muscle fiber transition [D].Hangzhou:Zhejiang University,2011.(in Chinese)
[27]Hu H,Wang J,Zhu R,et al.Effect of myosin heavy chain composition of muscles on meat quality in Laiwu pigs and Duroc [J].Sci in China(Ser C):Life Sci,2008,51(2):127-132.
[28]Lefaucheur L,Milan D,Ecolan P,et al.Myosin heavy chain composition of different skeletal muscles in Large White and Meishan pigs [J].Anim Sci,2004,82(7):1931-1941.
[29]Kawashima N,Mishima M,Shindo R,et al.Partial deficiency of phosphoglycerate mutase with diabetic polyneuropathy:the first Japanese patient [J].Internal Medicine,1996,35(10):799-802.
[30]Tang Z,Li Y,Wan P,et al.Long SAGE analysis of skeletal muscle at three prenatal stages in Tongcheng and Landrace pigs [J].Genome Biol,2007,8(6):R115.
[31]Nicholas G,Thomas M,Langley B,et al.Titin-cap associates with,and regulates secretion of Myostatin [J].Cell physiol,2002,193(1):120-131.
[32]Weiskirchen R,Gunther K.The CRP/MLP/TLP family of LIM domain proteins:acting by connecting [J].Bio Essays,2003,25(2):152-162.
[33]邱海芳,樊斌,徐学文,等.猪染色体MYOD1区域的RH定位和连锁定位 [J].湖北大学学报(自然科学版),2009,31(2):172-175.
Qiu H F,Fan B,Xu X W,et al.The RH and linkage mapping of MYOD1 region of pig chromosome 2 [J].Journal of Hubei University(Natural Science),2009,31(2):172-175.(in Chinese)
[34]Eggert J,Grant A,Schinckel A.Factors affecting fat distribution in pork carcasses [J].The Professional Animal Scientist,2007,23(1):42.
[35]李明洲,李学伟,朱砺,等.脂肪型和瘦肉型猪肌肉生长和脂肪沉积相关基因的差异表达分析和分子网络构建 [J].自然科学进展,2008,18(2):134-144.
Li M Z,Li X W,Zhu L,et al.Differential expression analysis and molecular network reconstruction for genes associated with muscle growth and adipose deposition in obese and lean pigs [J].Progress in Natural Sciences,2008,18(2):134-144.(in Chinese)
[36]杨帆.猪生长、胴体及肉质与候选基因集的关联分析研究 [D].上海:上海交通大学,2012.
Yang F.Study on the association between porcine growth,carcass and meat quality traits with some candidate gene sets [D].Shanghai:Shanghai Jiaotong University,2012.(in Chinese)
[37]Tyra M,Ropka-Molik K.Effect of theFABP3 andLEPRgene polymorphisim and expression levels on intramuscular fat(IMF) and fat cover degree in pigs [J].Livest Sci,2011,142(1):114-120.
[38]Jankowiak H,Sielska N,Kapelanski W,et al.The effect ofH-FABPgene polymorphism on carcass and meat quality in the polish native Zlotnicka spotted pig [J].Journal of Central European Agriculture,2010,11(4):459-464.
[39]Lombardo Y B,Hein G,Chicco A.Metabolic syndrome:effects of n-3 PUFAs on a model of dyslipidemia, insulin resistance and adiposity [J].Lipids,2007,42(5):427-437.
[40]Riancho J A,Vazquez L,Garcia-Perez M A,et al.Association of ACACB polymorphisms with obesity and diabetes [J].Mol Genet Metab,2011,104(4):670-676.
[41]Widmann P,Nuernberg K,Kuehn C,et al.Association of anACSL1 gene variant with polyunsaturated fatty acids in bovine skeletal muscle [J].BMC Genet,2011,12:96.
[42]Giund S,Schoelch C,Thomas L,et al.Inhibition of acetyl-CoA carboxylase 2 enhances skeletal muscle fatty acid oxidation and improves whole-body glucose homeostasis in db/db mice [J].Diabetologia,2012,55(7):2044-2053.
[43]强欢.Rh-GH对扩张型心肌病大鼠的治疗作用及机制研究 [D].西安:第四军医大学,2013.
Qang H.The effects and mechanisms of the rh-GH on dilated cardiomyopathy in the rat [D].Xi’an:The Fourth Military Medical University,2013.(in Chinese)
[44]王怡璐.肥厚型心肌病临床异质性的遗传及环境因素 [D].北京:中国医学科学院,北京协和医学院,2013.
Wang Y L.The genetic and clinical factors for heterogeneity of hypertrophic cardiomyopathy [D].Beijing:Chinese Academy of Medical Sciences,Beijing Union Medical College,2013.(in Chinese)
Screening and annotation of differentially expressed genes in longissimus muscle of different pig breeds based on RNA-seq technology
LI Xiao-jin1,2,QIAN Kun2,LIU Lin-qing2,WANG Chong-long2,ZHOU Jie1
(1CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei,Anhui230036,China;2InstituteofAnimalHusbandryandVeterinaryMedicine,AnhuiAcademyofAgriculturalSciences,Hefei,Anhui230031,China)
Abstract:【Objective】 This study aimed to find differentially expressed genes in longissimus muscle of Wannanhua pig and Yorkshire pig.【Method】 This experiment selected 3 Wannanhua pigs and 3 Yorkshire pigs to obtaine longissimus muscles.Meat quality traits were measured,RNA was extracted,high-throughput transcriptome sequencing (RNA-seq) technology was used to sequence,and GO function annotation and pathway on different genes were analyzed.【Result】 Total numbers of sequencing reads of the three Wannanhua pig samples were 65 584 126,64 327 738 and 59 244 502,respectively.The percentages of clean reads reached 94.4%,94.3% and 94.2%.Total numbers of sequencing reads of the three Yorkshire pig samples were 57 969 134,68 254 168 and 72 298 142,respectively.The percentages of clean reads reached 93.8%,93.7% and 93.8%.The high saturation degree of sequencing demonstrated that the data were realistic and reliable. Differential expression analyses showed that there were 347 differentially expressed genes,in which 94 were up-regulated and 253 genes were down-regulated.Gene Ontology functional enrichment and pathway enrichment analyses revealed that the differentially expressed genes were primarily associated with glycolytic metabolism,biological processes of muscle development and signal pathways related to fatty acid metabolism,growth and carcass traits.【Conclusion】 This study obtained the gene expression profile of porcine longissimus dorsi muscle tissue and identified novel candidate genes for porcine meat quality and growth traits.
Key words:RNA-seq;Wannanhua pig;Yorkshire pig;differentially expressed genes;longissimus muscle
DOI:网络出版时间:2016-05-0314:0510.13207/j.cnki.jnwafu.2016.06.001
[收稿日期]2014-09-29
[基金项目]安徽省生猪产业技术体系项目(AHCYTX-06-10);安徽省生猪现代农业项目(13000101);安徽省农业科学院科技创新团队建设项目(13C0405)
[作者简介]李小金(1988-),男,安徽怀宁人,在读硕士,主要从事动物生理生化研究。E-mail:lxiaojin0823@163.com [通信作者]周杰(1966-),男,福建漳州人,教授,博士,硕士生导师,主要从事动物生理生化研究。E-mail:zhoujie@ahau.edu.cn
[中图分类号]S828.9+12;Q78
[文献标志码]A
[文章编号]1671-9387(2016)06-0001-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160503.1405.002.html
