灵芝酸A对人胶质瘤细胞U251细胞增殖、凋亡和侵袭的影响
2016-06-17刘海鹏郑克彬单小松河北大学附属医院神经外科河北保定071000
刘海鹏,郑克彬,单小松(河北大学附属医院,神经外科,河北保定071000)
灵芝酸A对人胶质瘤细胞U251细胞增殖、凋亡和侵袭的影响
刘海鹏,郑克彬,单小松
(河北大学附属医院,神经外科,河北保定071000)
【摘要】目的 探讨灵芝酸A对人胶质瘤细胞U251细胞凋亡、侵袭及KDR表达的影响。方法 制备灵芝酸A,以人胶质瘤细胞细胞U251细胞为研究对象,根据细胞培养液所含灵芝酸A的不同浓度,将实验分为空白对照组(等量细PBS)、灵芝酸A低浓度组(0. 1 mmol/ L)和高浓度组(0. 5 mmol/ L)。用RT-PCR和Western blot法分别从mRNA水平和蛋白水平检测KDR基因的表达,CCK-8法测定细胞体外增殖能力,流式细胞技术(flowcytometry,FCM)检测各组细胞周期和凋亡情况,TUNEL染色检测各组细胞的的凋亡,细胞侵袭小室法检测各组细胞的体外侵袭力。结果 RT-PCR和Western blot显示,灵芝酸A高浓度组和低浓度组较空白对照组的KDR mRNA和蛋白表达都明显下降;灵芝酸A高浓度组和低浓度组细胞的生长速度明显减慢,降低G1期细胞比例,S期和G2/ M期比例增高;与空白对照组相比,高浓度组和低浓度组细胞的凋亡率明显升高(P<0. 01),增殖、侵袭能力显著下降(P<0. 05);高浓度组和低浓度组细胞相比促进凋亡和抑制KDR表达的作用更明显(P<0. 05)。结论 灵芝酸A可诱导人胶质瘤细胞U251细胞凋亡,抑制其增殖和侵袭能力,并能抑制KdrDR mRNA和蛋白的表达,提示这可能是其抗肿瘤的作用机制之一。
【关键词】灵芝酸A;胶质瘤细胞;血管内皮生长因子受体;细胞周期;凋亡
灵芝又称仙草,属于担子菌纲多孔菌科(Polyporaceae)灵芝属,有提高机体免疫力、降压调脂及抗肿瘤等多种药用价值,目前已引起医疗界的广泛关注,尤其是其在抗肿瘤方面[1]。研究发现,其抗肿瘤的主要成分是从灵芝孢子粉中提取的灵芝酸A[2-3]。神经胶质瘤又称胶质细胞瘤,是原发性中枢神经系统肿瘤中最常见的类型,约占所有颅内原发肿瘤的一半[4]。目前关于灵芝酸A治疗神经胶质瘤的研究颇多,但主要局限于抗肿瘤机制方面,在药理作用及疗效方面还有待进一步的研究[5-6]。血管内皮生长因子受体II激酶功能区受体(vascular endothelial growth factorⅡ,VEGFR2/ kinase domain receptor,KDR)在许多类型肿瘤中高表达,其阻滞剂可调节胶质细胞瘤等多种恶性肿瘤生长[7-8]。本文主要研究灵芝酸A对人胶质瘤U251细胞的生物学影响及KDR表达的关系。
1 材料和方法
1.1材料
实验于2013年8月-2015年8月在河北医科大学动物实验室完成,人胶质瘤细胞系(U251)来源北京大学医学部病理教研室提供,并由本实验室冻存;DMEM、磷酸盐缓冲液(phosphatic buffered saline,PBS)、胎牛血清均购自美国Gibco公司;TRIzol购自Invitrogen公司;逆转录试剂盒购自上海Best- Bio贝博公司;荧光定量PCR试剂盒购自TaKaRa宝生物工程(大连)有限公司、DNA Marker购自广州东盛生物科技有限公司;Western blot及苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、IP细胞裂解液、SDS-PAGE蛋白上样缓冲液(5×)、BCA蛋白浓度测试试剂盒(增强型)、20× TBS缓冲液等均购自江苏碧云天生物技术研究所;PVDF膜购自美国Millipore公司;碘化丙锭PI和RNase酶购自Sigma公司;流式细胞仪购自美国BD公司;凋亡试剂盒购自南京凯基生物科技发展有限公司;灵芝酸A购于大连美仑生物技术有限公司;KDR和GAPDH基因的引物由上海吉玛制药公司合成并通过测序验证;兔抗人KDR单克隆抗体、鼠抗人GAPDH单克隆抗体购自北京中杉金桥生物技术有限公司。
1.2方法
1.2.1细胞培养和分组
将培养于含10%小牛血清、100 U/ mL左氧氟沙星的DMEM培养基中的人胶质瘤细胞株U251细胞,置于37℃5%CO2密闭式孵箱内培养、传代。把用50 mmol/ L甲醇溶解好的灵芝酸A放于4℃的冰箱中保存。依据灵芝酸A的浓度不同分为低浓度组(0. 1 mmol/ L)、高浓度组(0. 5 mmol/ L)和对照组(1%甲醇0. 2 mL)。将3组细胞放于37℃的孵箱内培养,取对数生长期细胞用于后续实验。
1.2.2RT-PCR检测KDR mRNA表达
用TRIzol试剂盒提取培养48 h后U251细胞的总RNA量,并进行反转录。Primer Primer 5.0软件设计引物,KDR上游引物:5 '-CTGGCATGGTCTFCTGTGAAGCA -3’,下游引物:5’-AATACCAGTGGATGTGATGCGG-3’,扩增产物795 bp;内参照GAPDH上游引物:5’-CGTGGAAGGACTCATGACCA-3’,下游引物:5’TCCAGGGGTCTTACTCCTTG-3’,扩增产物为509 bp。PCR反应条件为94℃变性2 min、62℃退火1 min、72℃延伸1 min,循环35次,再于72℃延伸8 min。经1. 2%的琼脂糖凝胶电泳并用凝胶成像仪观察结果,UVI凝胶成像系统摄像,Image-Pro Plus 7. 0软件分析条带灰度值,KDR/ GAPDH比值代表KDR mRNA的相对表达量。
1.2.3Westernblotting检测KDR蛋白表达
提取培养48 h后各组的总蛋白并测定蛋白浓度。将50 μg总蛋白进行上样、8%SDS聚丙烯酰胺凝胶电泳、湿转法转膜并用10%脱脂奶粉封闭2 h,加入KDR、GAPDH(1∶800稀释),于摇床上4℃孵育过夜。用三乙醇胺缓冲盐水溶液洗涤3次,每次10 min,洗膜后加入二抗(1∶5000)。最后暗室曝光,用超敏ECL化学发光试剂检测蛋白条带,获取图像并进行条带灰度值分析,目的蛋白相对表达量=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.2.4CCK8法检测U251细胞的增殖
将U251细胞按4000个/孔的细胞密度接种于96孔板上,加入含10%胎牛血清DMEM培养基200 μL,每组设5个复孔,另设空白孔作为对照。每孔加入CCK-8 20 μL,培养箱孵育4 h后,酶标仪检测490 nm处的吸光度(D)值,取5个复孔的平均数,绘制生长曲线。
1.2.5Transwell小室侵袭实验
将Matrigel按50 μg/孔的浓度置于聚碳酸酯微孔滤膜上进行聚合,每孔下室中加入10%的胎牛血清做条件培养液,上室加入U251细胞悬液100 μL,培养箱中培养24 h后取出,进行固定、染色并光镜下计数膜下表面的细胞。每张微孔膜计数5个随机视野的穿膜细胞数,计算平均数。每组设置3个小室,重复实验3次。细胞侵袭率(%)=穿膜细胞数/上室中接种的细胞总数×100%
1.2.6细胞周期检测
将细胞进行胰酶消化、PBS冲洗、70%乙醇固定,4℃过夜。用PBS冲洗,将细胞混合成1. 0× 105/ mL的细胞悬液,并以细胞悬液∶PI =1∶1加入适量PI液,4℃下避光孵育30 min,300目筛网过滤;流式细胞仪分析DNA含量,软件分析G1、S、G2/ M各期的细胞数及所占比例。
1.2.7流式细胞仪检测细胞凋亡
转染72 h后,将细胞用不含EDTA的胰酶消化,消化完全后移入Ep管,4℃、2 000 r/ min,离心5 min,弃上清。PBS洗涤2次,加入500 μL buffer,5 μL Annexi n V -FITC,混匀;加5 μL PI混匀后室温、避光反应5~15 min;1 h内用流式细胞仪检测(激发波长Ex =488 nm,发射波长Em =530 nm)。
1.2.8TUNEL染色
细胞分组后72 h,行U251细胞爬片并弃培养液,自然晾干;4%多聚甲醛溶液固定,在室温下用新鲜配制的3%H202进行处理,0. 1%TritonX-100(溶于0. 1%枸橼酸钠溶液)打孔,行显色、复染、脱水、透明、封片及观察。每张切片观察3个视野,每个视野连续计数300个细胞,凋亡细胞百分比即为凋亡指数(m)。AI(%)=凋亡细胞彩总细胞数×100%。
1.3统计学处理
应用SPSS16. 0统计软件进行分析,细胞凋亡计量资料两组间比较采用t检验,多组间比较采用单因素方差分析(ANOVA),结果以±s表示,P<0. 05为差异具有统计学意义。
2 结果
2.1灵芝酸A降低KDR mRNA的表达水平
RT-PCR结果显示,经相关干预后U251细胞KDR mRNA水平高浓度组<低浓度组<空白对照组,且任意两组间的比较均满足上述关系,差异具有统计学意义(P<0. 05)。由此说明低浓度和高浓度的灵芝酸A均能抑制KDR mRNA的表达,且高浓度的抑制效果更明显(图1)。

图1 各组KDR mRNA的表达水平Fig. 1 KDR mRNA expression level of each group
2.2灵芝酸A降低KDR蛋白的表达水平
表达量与空白对照组相比明显降低,且差异均有统计学意义(P<0. 05);而低浓度组与空白对照组间相比KDR蛋白的表达量亦明显降低,差异有统计学意义(P<0. 05)。说明低浓度和高浓度的灵芝酸A均能抑制KDR蛋白的表达,且随浓度的升高抑制效果更明显(图2)。

图2 各组KDR蛋白的表达水平Fig. 2 KDR expression levels of each group
2.3CCK-8法检测U251细胞增殖情况
CCK-8法检测结果表明,3组在490 nm处的A值在转染后24、48、72、96和120 h时的大小依次是空白对照组>低浓度组>高浓度组,且任意两组间比较均成立,差异有统计学意义(P<0. 05)。绘制的生长曲线示,高浓度组较空白对照组和低浓度组曲线明显降低(表1),差异有统计学意义(P< 0. 05),低浓度组较空白对照组曲线亦降低,差异有统计学意义(P<0. 05)。表明灵芝酸A抑制U251细胞增殖,且随浓度升高抑制作用更明显。
表1 三组细胞各时间点细胞活力的比较490 nm(±s,n =5)Tab. 1 Comparison of cell viability between three groups of cells at different time points 490 nm(±s,n =5)

表1 三组细胞各时间点细胞活力的比较490 nm(±s,n =5)Tab. 1 Comparison of cell viability between three groups of cells at different time points 490 nm(±s,n =5)
注,Note:P<0. 05
组别 24 h 48 h 72 h 96 h 120 h空白对照组 0. 41±0. 04 0. 63±0. 02 1. 44±0. 07 1. 86±0. 16 2. 92±0. 27低浓度组 0. 36±0. 02 0. 45±0. 05 1. 08±0. 13 1. 43±0. 12 2. 14±0. 15高浓度组 0. 24±0. 03 0. 31±0. 04 0. 62±0. 08 0. 97±0. 14 1. 38±0. 12
2.4灵芝酸A降低细胞体外侵袭力降低
3组穿过滤过膜的细胞数依次为:空白对照组>低浓度组>高浓度组,且差异均有统计学意义(P <0. 01)。实验结果表明灵芝酸A可以抑制U251细胞的体外侵袭力,且随浓度的升高抑制作用增强。
2.5流式细胞术检测细胞周期
由图3及表2可知,与空白对照组相比,低浓度组和高浓度组G1期细胞比例均明显降低(P<0. 05),且高浓度组较低浓度组明显(P<0. 05);而S、G2/ M期细胞比例则明显升高(P<0. 05)。
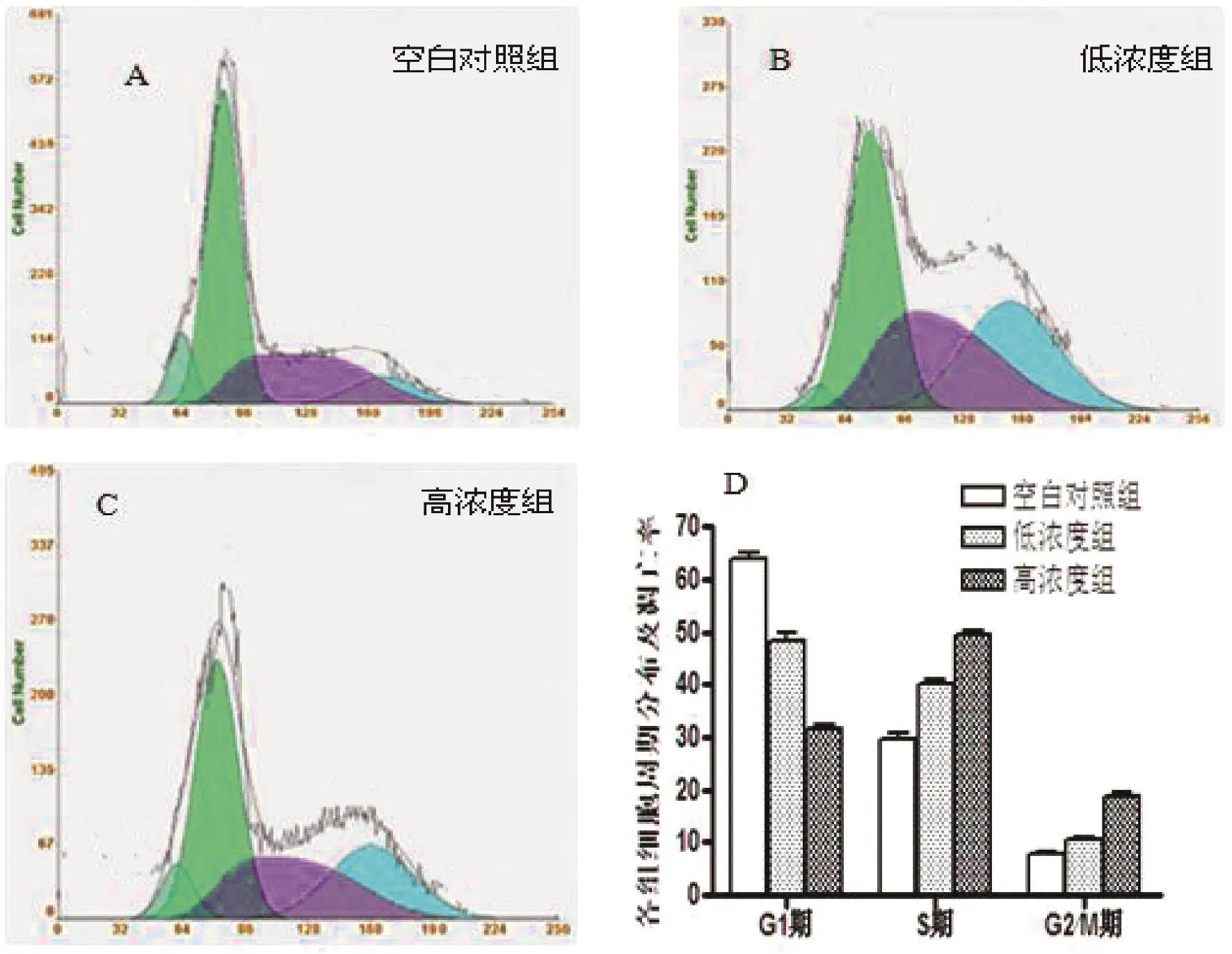
图3 不同组G1、S、G2期的比较Fig. 3 G1,S,G2 phase comparison of different group

表2 各组细胞周期分布及凋亡率(%)Tab. 2 Cell cycle distribution and apoptosis rate(%)
2.6流式细胞术检测细胞凋亡
流式细胞仪检测的DNA直方图显示:3组细胞凋亡率依次为高浓度组>低浓度组>对照组,且差异有统计学意义(P<0. 05),表明灵芝酸A可以明显促进U251细胞的凋亡,且随浓度的增加而增强(图4)。
2.7TUNEL染色观察细胞凋亡
TUNEL染色观察细胞凋亡结果显示,3组中均出现细胞核被染成棕黄色的U251凋亡细胞,且3组细胞凋亡数依次为高浓度组>低浓度组>对照组,且差异有统计学意义(P<0. 05),表明灵芝酸A可以明显促进U251细胞的凋亡,且随浓度的增加而增强(图5)。

图4 流式细胞术检测各组细胞凋亡Fig. 4 Cell apoptosis was detected by flow cytometry of each group

图5 TUNEL染色观察各组细胞凋亡Fig. 5 TUNEL staining of each group
3 讨论
神经胶质瘤是原发性中枢神经系统肿瘤中最常见的类型,迄今为止病因尚未阐明。虽然临床上有手术、药物及放化疗等各种治疗手段,但其病死率、复发率仍居高不下,寻求新的、有效的治疗手段已成为了当务之急[9-10]。
自上世纪80年代以来,灵芝治疗肿瘤的确切机制已引起了医务工作者的广泛兴趣。研究发现,灵芝酸能激活可直接破坏肿瘤细胞核形成的蛋白酶,且抑瘤效果与其含量有明显依赖性[11-12]。与本项研究结果相一致。本实验研究表明灵芝酸A高浓度组和低浓度组较空白对照组的KDR mRNA和蛋白表达均明显下降,证明灵芝酸A在调节肿瘤细胞的增殖力和侵袭力,促进细胞凋亡方面起到关键作用,提示调控KDR基因可能直接或间接地参与人胶质瘤U251细胞周期的调控和凋亡,其基因的表达水平改变与肿瘤细胞侵袭力关系密切[13-14]。可能是其抑瘤作用的潜在机制之一。
人体是一个有机的整体,体外实验不可能做到完全模拟人体生理情况,因此灵芝酸A对人胶质瘤的疗效尚需临床应用数据进行综合分析。目前,从分子机制探讨灵芝酸A的抗肿瘤作用尚处于探索阶段,对于恶性肿瘤的治疗效果也尚处于观察阶段,需要我们继续进行深入的研究以期早日攻克人胶质瘤这一疾病。
参考文献:
[1] Reis FS,Lima RT,Morales P,et al. Methanolic extract of ganoderma lucidum induces autophagy of AGS human gastric tumor cells[J]. Molecules,2015,20(10):17872-17882.
[2] Yao X,Li G,Xu H,et al. Inhibition of the JAK-STAT3 signaling pathway by ganoderic acid A enhances chemosensitivityof HepG2 cells to cisplatin[J]. Planta Med,2012,78(16):1740-1748.
[3] Yajima Y,Miyazaki M,Okita N,et al. Production of Ginkgo leaf-shaped basidiocarps of the Lingzhi or Reishi Medicinal mushroom Ganoderma lucidum(higher Basidiomycetes),containing high levels of α-and β-D-glucan and ganoderic acid A [J]. Int J Med Mushrooms,2013,15(2):175-182
[4] Srinivasan K,Thomas B. Teaching neuroimages:optic nerve glioma with perineural arachnoid gliomatosis in a patient with neurofibromatosis-1[J]. Neurology,2015,84(13):e97.
[5] Ameri A. Ganoderic Acid in the treatment of prostate cancer[J]. Jundishapur J Nat Pharm Prod,2012,7(3):85-86.
[6] Liu RM,Li YB,Zhong JJ. Cytotoxic and pro-apoptotic effects of novel ganoderic acid derivatives on human cervical cancer cells in vitro[J]. Eur J Pharmacol,2012,681(1-3):23-33.
[7] Song J,Song Y,Guo W,et al. Regulatory roles of KDR antisense oligonucleotide on the proliferation of human prostate cancer cell line PC-3[J]. Journal of Buon,2014,19(3):770- 774.
[8] 张家文,冯晓源,姚振威,等. CT灌注成像与大鼠C6胶质瘤CD105表达的相关性[J].中国实验动物学报,2013,21(03):27-30,69,后插5页.
[9] 左龙,赵越,李怀业,等.磁共振示踪法定量测量大鼠C6胶质瘤模型细胞外间隙扩散参数[J].中国比较医学杂志,2014,24(12):1-7.
[10] 王晓武,李康樗,丁桂荣,等. SD大鼠与Wistar大鼠脑胶质瘤动物模型的建立及比较[J].中国比较医学杂志,2010,20 (05)8-11.
[11] 黄书铭,杨新林,王帮武,等.灵芝醇溶酸性组分的抗肿瘤作用[J].天然产物研究与开发,2004,16(2):146-148.
[12] 唐文.灵芝酸T提高多药耐药性肿瘤细胞对阿霉素敏感性的初步研究[J].天然产物研究与开发,2013,25(8):1052 -1055.
[13] 吕贤荣,丁苏明,李国涛,等.体外MTT法对灵芝酸抗人乳腺癌细胞株MCF-7作用的评估[J].医学信息,2014,27(11):92-92.
[14] 邵建立,李志忠,焦根龙,等.灵芝酸A对人骨肉瘤细胞增殖、凋亡和迁移的影响[J].南方医科大学学报,2015,35 (5):619-624.
〔修回日期〕2016-01-20
Effect of Ganoderma acid A to human glioma cells U251 cells on proliferation,apoptosis and invasion
LIU Hai-peng,SHAN Xiao-song,ZHENG Ke-bin
(Affiliated Hospital of Hebei University,neurosurgery department,Hebei Baoding 071000,China)
【Abstract】Objective To investigate the effect of ganoderic acid A(GA-A)on apoptosis,invasion and KDR expression of human U251 cells. Methods Ganoderic acid A(GA-A)was prepared,human U251 cells were treated with 0. 1,and 0. 5 mmol/ L GA-A,and the experiment was divided into blank control,low concentration and high concentration group. The expressions of KDR mRNA and KDR protein was assayed by RT-PCR and Western blot. The effect of GA-A on the proliferation and invasion capability of U251 cells was determined by CCK-8 and transwell assay in vitro,respectively. Flow cytometry was used to detect the influence of GA-A on the cell cycle and apoptosis of U251 cells,and TUNEL staining was detected the cell apoptosis too. Results Compared with the control group,KDR mRNA and protein expression of high concentration and low concentration group were significantly decreased(P<0. 05),GA-A cansignificantly reduce the cell growth rate,reduce the proportion of cells in G1 phase and increase the proportion of S phase and G2 / M phase,cells apoptosis was significantly increased in the high concentration and low concentration group(P<0. 01),and cells proliferation and invasion was significantly decreased(P<0. 05). Compared with low concentration group,the high concentration group induce cell apoptosis and inhibit the expression of KDR more significant(P<0. 05). Conclusions Ganoderma acid A can induce apoptosis in U251 cells,inhibit proliferation and invasion,and can inhibit the expression of KDR mRNA and protein,which may be one of the mechanisms of anti-tumor.
【Key words】Ganoderma acid A;Glioma cells;Vascular endothelial growth factor receptor;Cell cycle;Apoptosis
【中图分类号】R739-45 R-332
【文献标识码】A
【文章编号】1671-7856(2016)03-0064-06
doi:10. 3969. j. issn. 1671-7856. 2016. 03. 013
[作者简介]刘海鹏(1980-),男,硕士生,研究方向:胶质瘤,邮箱:liuhaipengjzl@163. com。
[通讯作者]单小松,E-mail:zhjianjun_123@163. com。
