苯酞类化合物的制备及其抑制胰脂肪酶活性研究❋
2016-06-16段良兴宋姗姗王玉明万升标
段良兴, 宋姗姗, 刘 军, 刘 振, 王玉明, 万升标
(中国海洋大学医药学院, 山东 青岛 266003)
研究简报
苯酞类化合物的制备及其抑制胰脂肪酶活性研究❋
段良兴, 宋姗姗, 刘军, 刘振, 王玉明, 万升标❋
(中国海洋大学医药学院, 山东 青岛 266003)
摘要:奥利司他是到目前为止市场上唯一的脂肪酶抑制剂类减肥药。本文参考奥利司他与胰脂肪酶的单晶复合物,通过计算机辅助药物设计Docking方法,设计并合成了9个具有长疏水侧链的苯酞类新化合物。化合物结构通过HRESIMS、1H NMR、13C NMR确证。对其抑制胃肠道胰脂肪酶的活性进行了初步测定,1 mg/mL的化合物2,5,7对胰脂肪酶活性抑制率分别达到了49%,30%,35%。
关键词:奥利司他; Docking方法; 苯酞类化合物; 减肥药
引用格式: 段良兴, 宋姗姗, 刘军, 等.苯酞类化合物的制备及其抑制胰脂肪酶活性研究 [J]. 中国海洋大学学报(自然科学版), 2016, 46(5): 90-94.
DUAN Liang-Xing, SONG Shan-Shan, LIU Jun, et al. Synthesis and inhibiting activities on pancreatic lipase of novel phthalide compounds [J]. Periodical of Ocean University of China, 2016, 46(5): 90-94.
苯酞类(Phthalides)小分子化合物具有很好的生理活性,广泛存在于天然植物中,特别是正丁基苯酞(N-Butylphathlide),能够明显的增加毛细血管数量,改善脑区的微循环,减轻脑水肿,改善脑区能量代谢,减少血栓,从而抑制神经细胞的凋亡,达到治疗脑缺血的目的[1-2]。
肥胖与癌症之间可能存在着一定的联系,包括乳腺癌、结肠癌、胰腺癌、子宫颈癌以及黑素瘤等[3]。肥胖病是脂肪含量过多或分布异常的一种病态表现,是由多种原因引起的[4]。但大多数的正常人是通过饮食导致,90%的膳食脂肪以甘油三酯的形式进入人体,一半以上的被胰脂肪酶所分解,被人体重新吸收并再次合成脂肪,导致肥胖。为此,开发胰脂肪酶抑制剂对于减肥药的研究就具有重要的意义[5]。
奥利司他是一种新型的减肥药,能够不可逆的抑制胃肠道胰脂肪酶的活性,从而抑制食物中脂类物质的消化和吸收,达到减肥的效果[6]。但是奥利司他的价格昂贵以及近年来不断出现的肝损伤、胰腺炎、肾损伤等报告,使得奥利司他备受质疑[7]。但已有资料未发现奥利司他与其他药物间存在相互作用[8]。
本文应用低毒、小分子的苯酞类化合物模拟奥利司他来设计胰脂肪酶抑制剂,因为苯酞类化合物结构中有2个与奥利司他类似的疏水区,含有1个内酯环,可以成盐,提高溶解性。以苯酞类化合物作为优势骨架现在已经开发成功了多个苯酞类药物,如治疗脑血管病的丁基苯酞、抗胆碱活性的藁本内酯等。
1化合物设计及其合成实验
1.1 仪器与试剂
仪器JEOL JNM-EPC 500 核磁共振仪(内标为TMS);Q-TOF Ultima TMGLOBAL 质谱仪;X-4数字显示显微熔点测定仪;Agilent 6890气相色谱系统;SHB-Ⅲ型循环水式多用真空泵;Laborota 4000旋转蒸发器;IKA MS 3 digital 旋涡混匀器;BQ50-1J蠕动泵;SHA-B水浴恒温振荡器;酶标仪(Model680型);BS 224 s电子天平;超生波细胞粉碎仪(JY92-IIN型);计算机软件SYBYL-X。
试剂2-羧基苯甲醛,AR:99%,北京百灵威科技有限公司;溴代正丁烷,AR:98%,上海晶纯生化科技股份有限公司;苯酞,AR:99%,上海晶纯生化科技股份有限公司;10% Pd/C(含水1%)国药集团化学试剂有限公司;游离脂肪酸测定试剂盒,南京建成生物工程研究所;三油酸甘油酯、猪胰脂肪酶,美国Sigma公司;卵磷脂,天津市博迪化工有限公司;TG、TC试剂盒,中生北控生物科技股份有限公司;胆汁酸试剂盒,南京建成生物工程研究所;胆固醇,天津市博迪化工有限公司;猪胆盐,中国惠兴生化试剂有限公司;其他生化试剂均为国产分析纯。
1.2 化合物设计及其制备
1.2.1 化合物的设计奥利司他通过共价结合脂肪酶,从而抑制脂肪酶的活性[9]。通过分析胰脂酶与奥利司他复合物的单晶结构(见图1),2 308位丝氨酸,2 481位组氨酸以及2 338位天冬氨酸形成“三元体”[10];“活化”的丝氨酸亲核进攻奥利司他,使奥利司他与脂肪酶共价结合,进而不可逆抑制脂肪酶活性。另外,受疏水作用力及氢键的作用,奥利司他以相对固定的构象进入到活性口袋中,使内酯环贴近活化后的丝氨酸,这也使奥利司他能共价结合到脂肪酶。
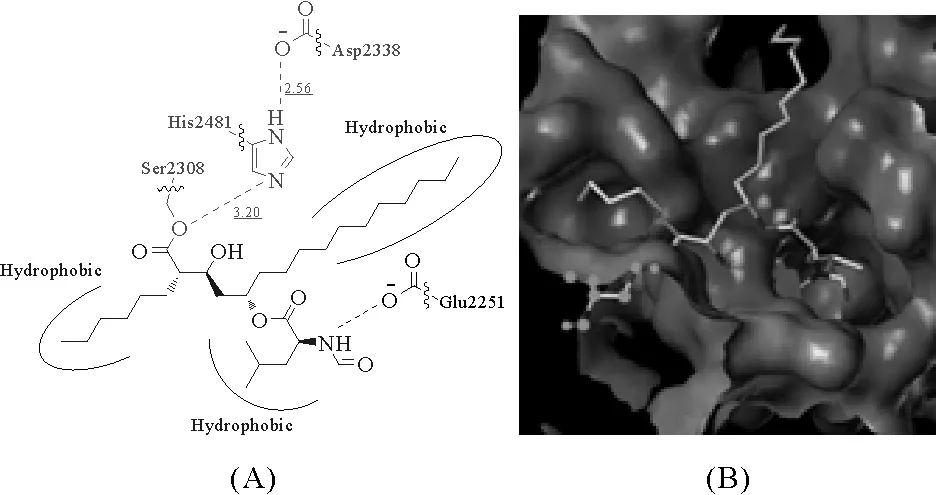
图1 奥利司他与胰脂肪酶结合示意图
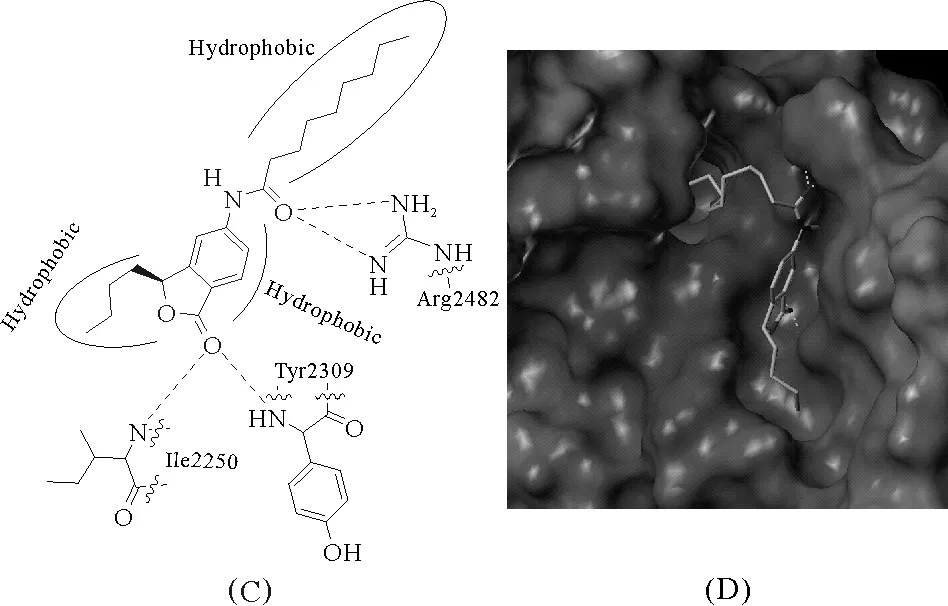
图2 S-构型的化合物7与胰脂肪酶结合
通过模拟化合物7(S构型)与胰脂肪酶的结合模式(见图2)发现,其3个疏水基团(苯环和2个脂肪侧链)正好可以进入胰脂肪酶的3个活性疏水口袋结合,并与Arg2482、Tyr2309、Ile22503个氨基酸形成氢键。
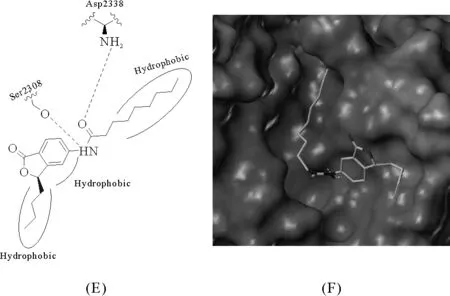
图3 R-构型的化合物7与胰脂肪酶结合
通过模拟化合物7(R构型)与胰脂肪酶的结合模式(见图3)发现,其3个疏水基团(苯环和两个脂肪侧链)正好可以进入胰脂肪酶的3个活性疏水口袋结合,并与Asp2338、Ser23082个氨基酸形成氢键。
1.2.2所设计的目标化合物如图4,在苯酞母核3位分别接正癸基、正十八烷基、正十六烷基设计化合物1,2,3;在苯酞母核6位分别接正癸酰胺基、正十六酰胺基、正十八酰胺基设计化合物4,5,6;在苯酞母核3位接丁基,并在6位分别接正癸酰胺基、正十六酰胺基、正十八酰胺基设计化合物7,8,9(见图4)。
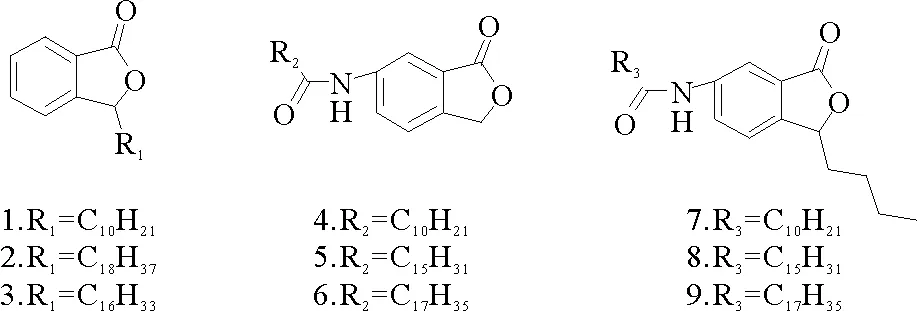
图4 设计的目标化合物
1.2.3目标化合物的合成从图5看出,化合物的合成是以2-羧基苯甲醛10为起始原料,通过格氏反应[11-12],得到化合物1,2,3和中间体丁基苯酞14。再以苯酞11和丁基苯酞14为原料,先经过硝化反应、还原反应[13-16],得到氨基苯酞13和氨基丁苯酞16两个中间体,再与脂肪酸缩合得到化合物4,5,6,7,8,9。
1.2.4目标化合物的制备
3-癸基-1(3H)-异苯并呋喃酮(1)向150 mL 三颈瓶中加入200 mg(8.33 mmol)镁粉,N2保护下,加入少量 I2、5 mL THF,搅拌下慢慢滴加2.14 mL(8.33 mmol)溴癸烷,待 I2的颜色褪去后,加入20 mL THF 稀释并滴完剩余的溴癸烷,回流 2 h。将溶解有邻羧基苯甲醛500 mg 的 THF 溶液 逐滴的滴入上述格氏试剂中,回流反应 3 h,TLC 检测原料反应完全,冷却,慢慢加入稀盐酸20 mL 淬灭反应,室温搅拌2 h。将所得的溶液分液,用二氯甲烷萃取水层3次,蒸干有机层,柱分离(石油醚与乙酸乙酯的体积比为16∶1),得白色固体 369 mg,收率40%. mp: 38~40 ℃,1H NMR (500 MHz, CDCl3) δ 7.72 (d,J= 7.5 Hz, 1 H), 7.55 (t,J= 7.5 Hz, 1 H), 7.37 (t,J= 7.5 Hz, 1 H), 7.35 (d,J= 7.5 Hz, 1 H), 5.34 (dd,J= 7.9, 3.9 Hz, 1 H), 1.96-1.88 (m, 1 H), 1.65-1.57 (m, 1 H), 1.40-1.29 (m, 2 H), 1.24-1.06 (m, 14 H), 0.74 (t,J= 6.9 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 170.4, 150.0, 133.8, 128.8, 125.9, 125.3, 121.8, 81.3, 34.7, 31.8, 29.5, 29.4, 29.3, 29.2, 24.8, 22.6, 14.0. HRESIMS: [M+H+] calcd for C18H27O2: 275.1933; found 275.2006。
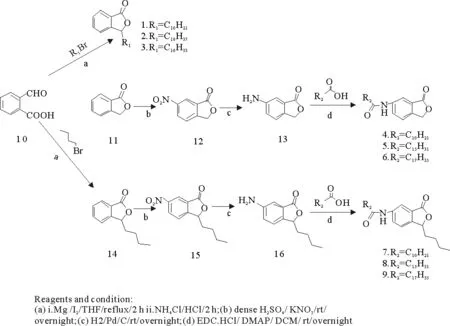
图5 目标化合物的合成路线
3-十八烷基-1(3H)-异苯并呋喃酮(2)实验方法参考化合物1的制备,性状为白色固体,产率47%. mp: 57~59 ℃,1H NMR (500 MHz, CDCl3) δ 7.86 (d,J= 7.5 Hz, 1 H), 7.64 (t,J= 7.5 Hz, 1 H), 7.49 (t,J= 7.5 Hz, 1 H), 7.42 (d,J= 7.5Hz, 1 H), 5.45 (dd,J= 7.8, 3.9 Hz, 1 H), 2.04-1.98 (m, 1 H), 1.75-1.70 (m, 1 H), 1.45 (m, 2 H), 1.34-1.22 (m, 30 H), 0.85 (t,J= 6.8 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 170.6, 150.1, 133.9, 128.9, 126.1, 125.6, 121.7, 81.4, 34.8, 31.9, 29.8, 29.7, 29.6, 29.5, 29.4, 29.3, 24.8, 22.7, 14.1. HRESIMS: [M+H+] calcd for C26H43O2: 387.3185; found 387.3258。
3-十六烷基-1(3H)-异苯并呋喃酮(3) 实验方法参考化合物1的制备,性状为白色固体,产率43%。 mp: 66~67℃,1H NMR (500 MHz, CDCl3) δ 7.86 (d,J= 7.5 Hz, 1 H), 7.64 (t,J= 7.5 Hz, 1 H), 7.49 (t,J= 7.5 Hz, 1 H), 7.42 (d,J= 7.5 Hz, 1 H), 5.45 (dd,J= 7.8, 3.9 Hz, 1 H), 2.04-1.99 (m, 1 H), 1.74-1.71 (m, 1 H), 1.51-1.43 (m, 2 H), 1.35-1.23 (m, 26 H), 0.86 (t,J= 6.7 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 170.6, 150.1, 133.9, 128.9, 126.1, 125.6, 121.7, 81.4, 34.8, 31.9, 29.7, 29.6, 29.5, 29.4, 29.3, 24.8, 22.6, 14.1. HRESIMS: [M+H+] calcd for C24H39O2: 359.287 2; found 359.2946。
6-癸酰胺基-1(3H)-异苯并呋喃酮(4)称取2 g(14.9 mmol)苯酞(化合物11)固体并置于100 mL单口瓶中,搅拌下慢慢加入约40 mL 浓硫酸让其溶解,称取2.3 g(22.4 mmol)硝酸钾在冰水浴条件下加入到上述单口瓶里,反应 10 h。将反应后的悬浊液倒入 150 mL 冰水中,析出2.45 g 硝基苯酞(化合物12),性状为白色固体,产率92%。
将1 g(5.6 mmol)硝基苯酞溶解在50 mL 甲醇和乙酸乙酯(体积比为5∶1)的混合溶液中,搅拌下加入 0.3 g 10% Pd/C,氢气下,室温反应8 h,TLC 点板原料反应完全,过滤钯碳并回收,滤液经柱层析分离得0.69 g 氨基苯酞(化合物13),性状为黄色固体,产率83%。
将200 mg(1.34 mmol)氨基苯酞、277.5 mg(1.26 mmol)正癸酸、514.6 mg (2.68 mmol) EDCI、328.0 mg(2.68 mmol)DMAP,置于50 mL双口瓶中,N2保护下加入30 mL干燥的CH2Cl2,反应12 h,TLC点板显示原料反应完全。将反应液用10% 的稀盐酸和饱和氯化钠溶液的混合液(体积比1∶1)分三次洗涤,无水硫酸镁干燥,硅胶柱分离(石油醚与乙酸乙酯体积比为3∶1),得白色固体354.1 mg,产率87%. mp: 151~152 ℃,1H NMR (500 MHz, CDCl3) δ 8.20 (d,J= 8.4 Hz, 1 H), 8.17 (s, 1 H), 7.93 (s, 1 H), 7.43 (d,J= 8.4 Hz, 1 H), 5.29 (s, 2 H), 2.43 (t,J= 7.5 Hz, 2 H), 1.75-1.71 (m, 2 H), 1.37-1.25 (m, 12 H), 0.85 (t,J= 7.1 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 172.2, 171.2, 141.5, 139.5, 126.3, 126.2, 122.6, 115.9, 69.8, 37.6, 31.8, 29.7, 29.5, 29.4, 29.3, 25.6, 22.7, 14.1. HRESIMS: [M+H+] calcd for C18H26O3N: 304.1834; found 304.1911。
6-软脂酰胺基-1(3H)-异苯并呋喃酮(5) 实验操作参考化合物4的制备,性状为白色固体,产率81%。 mp: 145~146 ℃,1H NMR (500 MHz, CDCl3) δ 8.16 (d,J= 8.1 Hz, 1 H), 7.90 (s, 1 H), 7.71 (s, 1 H), 7.45 (d,J= 8.1Hz, 1 H), 5.30 (s, 2 H), 2.42 (t,J= 7.5 Hz, 2 H), 1.70-1.78 (m, 2 H), 1.42-1.17 (m, 24 H), 0.87 (t,J= 6.7 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 171.8, 170.9, 141.6, 139.3, 126.4, 126.2, 122.7, 115.9, 69.7, 37.7, 31.9, 29.7, 29.6, 29.5, 29.4, 29.3, 25.5, 22.7, 14.1. HRESIMS: [M+H+] calcd for C24H38O3N: 388.2773; found 388.2846.
6-硬脂酰胺基-1(3H)-异苯并呋喃酮(6)实验操作参考化合物4的制备,性状为白色固体,产率74%。 mp: 152~153 ℃,1H NMR (500 MHz, CDCl3) δ 8.12 (d,J= 8.3 Hz, 1 H), 7.89 (s, 1 H), 7.49 (s, 1 H), 7.45 (d,J= 8.3 Hz, 1 H), 5.30 (s, 2 H), 2.41 (t,J= 7.5 Hz, 2 H), 1.71-1.77 (m, 7.5 Hz, 2 H), 1.39-1.24 (m, 28 H), 0.88 (t,J= 6.7 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 171.7, 170.7, 141.6, 139.1, 126.5, 126.1, 122.7, 115.9, 69.6, 37.7, 31.9, 29.7, 29.6, 29.5, 29.4, 29.3, 25.5, 22.7, 14.1. HRESIMS: [M+H+] calcd for C26H42O3N: 416.3086; found 416.3159。
6-癸酰胺基-3-丁基-1(3H)-异苯并呋喃酮(7)实验操作以邻羧基苯甲醛为起始原料,通过格氏反应、硝化反应、还原反应、酰化反应得到。格氏反应的操作参考化合物1的制备,硝化反应、还原反应、酰化反应操作参考化合物4的制备。性状为白色固体,产率83%。 mp: 122~124 ℃,1H NMR (500 MHz, CDCl3) δ 8.65 (s, 1 H), 8.22 (d,J= 8.3 Hz, 1 H), 7.94 (s, 1 H), 7.36 (d,J= 8.3 Hz, 1 H), 5.44 (dd,J= 7.6, 4.2 Hz, 1 H), 2.44 (t,J= 7.5 Hz, 2 H), 1.96-2.03 (m, 1 H), 1.69-1.75 (m, 3 H), 1.43-1.21 (m, 16 H), 0.88 (t,J= 7.0 Hz, 3 H), 0.84 (t,J= 6.9 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 172.6, 171.0, 145.0, 139.8, 126.5, 126.3, 122.2, 115.9, 81.8, 37.6, 34.4, 31.8, 29.5, 29.4, 29.3, 29.2, 26.8, 25.6, 22.6, 22.4, 14.1, 13.8. HRESIMS: [M+H+] calcd for C22H34O3N: 360.246 0; found 360.2533。
6-软脂酰胺基-3-丁基-1(3H)-异苯并呋喃酮(8)实验操作参考化合物7的制备,性状为白色固体,产率76%。mp: 124~126 ℃,1H NMR (500 MHz, CDCl3) δ 8.47 (s, 1 H), 8.25 (d,J= 8.3 Hz, 1 H), 7.91 (s, 1 H), 7.37 (d,J= 8.3 Hz, 1 H), 5.44 (dd,J= 7.6, 4.2 Hz, 1 H), 2.44 (t,J= 7.5 Hz, 2 H), 2.00 (m, 1 H), 1.73 (m, 3 H), 1.42-1.22 (m, 28 H), 0.89 (t,J= 6.4 Hz, 3 H), 0.86 (t,J= 6.8 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 172.5, 170.9, 145.0, 139.7, 126.5, 126.3, 122.3, 115.8, 81.8, 37.6, 34.4, 31.9, 29.7, 29.6, 29.5, 29.4, 29.3, 29.2, 26.8, 25.6, 22.7, 22.4, 14.1, 13.8. HRESIMS: [M+H+] calcd for C28H46O3N: 444.339 9; found 444.3472。
6-硬脂酰胺基-3-丁基-1(3H)-异苯并呋喃酮(9)实验操作参考化合物7的制备,性状为白色固体,产率82%。 mp: 116~118 ℃,1H NMR (500 MHz, CDCl3) δ 8.37 (s, 1 H), 8.25 (d,J= 8.3 Hz, 1 H), 7.90 (s, 1 H), 7.37 (d,J= 8.3 Hz, 1 H), 5.45 (dd,J= 7.6, 4.2 Hz, 1 H), 2.44 (t,J= 7.5 Hz, 2 H), 2.04-1.98 (m, 1 H), 1.71-1.76 (m, 3 H), 1.39-1.22 (m, 32 H), 0.89 (t,J= 5.9 Hz, 3 H), 0.86 (t,J= 6.0 Hz, 3 H).13C NMR (126 MHz, CDCl3) δ 172.4, 170.9, 145.1, 139.7, 126.5, 126.2, 122.3, 115.8, 81.8, 37.6, 34.4, 31.9, 29.7, 29.6, 29.5, 29.4, 29.3, 26.8, 25.6, 22.7, 22.4, 14.1, 13.9. HRESIMS: [M+H+] calcd for C30H50O3N: 472.3712; found 472.3785。
1.3 胰脂肪酶活性测定
胰脂肪酶的活力是以三油酸甘油酯释放游离脂肪酸的释放率来判定的。配制300 units/mL 胰脂肪酶溶液。参照 Han 等报道方法制作脂肪乳剂[17],准确称取80 mg三油酸甘油酯,10 mg卵磷脂,5 mg牛磺胆酸,置于干净的小旋蒸瓶中,60 ℃水浴蒸干。加9 mL的0.1 mol/L的Tris-盐酸溶液(pH=7.0),超生波处理5 min 使其充分乳化。
空白对照为在反应体系中加入100 μL脂肪乳剂,50 μL的胰脂肪酶溶液,以及100 μL的水;实验组为将100 μL水置换为100 μL的各样品溶液。所有离心管于37 ℃恒温孵育30 min,反应结束后,使用游离脂肪酸试剂测定释放的脂肪酸含量,样品活性测定值(见表1)。
2结果与讨论
本论文应用低毒小分子苯酞类化合物模拟奥利司他来设计胰脂肪酶抑制剂,基于模拟奥利司他与胰脂肪酶的单晶复合物结构,结合计算机辅助,设计并合成了9个苯酞类化合物,化合物结构都经过HRESIMS、1H NMR、13C NMR确证。抑制胰脂肪酶活性研究发现,1 mg/mL的化合物2,5,7对胰脂肪酶抑制活性最好,抑制率分别达到了49%,30%,35%。该类化合物对脂肪酶的抑制作用弱于奥利司他,分析对接实验发现,化合物的内酯环离Ser2308较远,推测难以与胰脂肪酶形成共价结合。
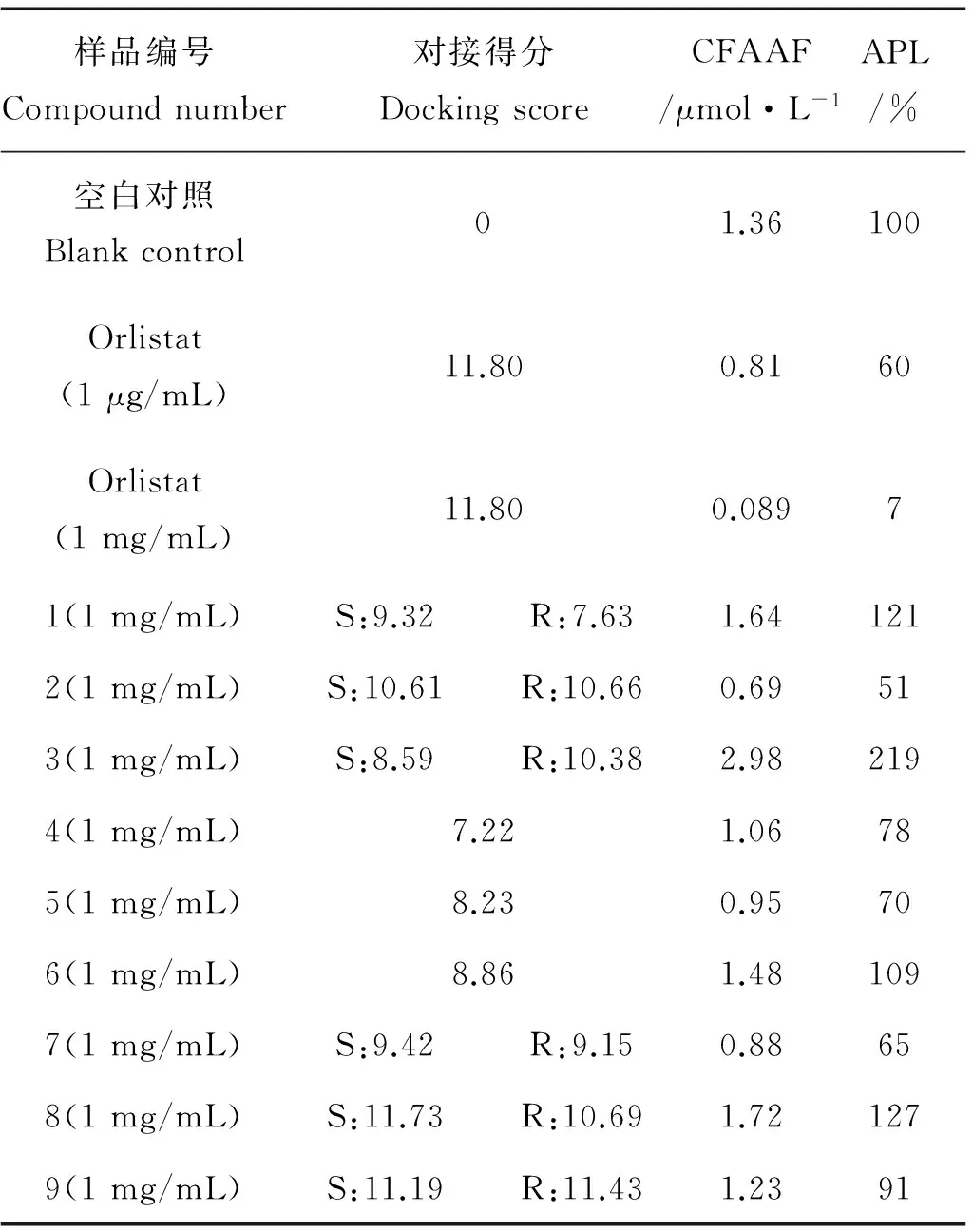
表1 样品活性测定值
注:CFA:5分钟时脂肪酸浓度;APL:胰脂肪酶活性。CFAAF: concentration of fatty acids after 5 min; APL: activity of pancreatic lipase.
化合物1、2、3以苯酞为母核,3位连接18个C脂肪链的化合物2对胰脂肪酶有抑制活性,而连接10个C脂肪链的化合物1和连接16个C脂肪链的化合物3则均没有抑制活性。化合物4、5、6以苯酞母核,6位连接16个C脂肪酰胺基的化合物5,其抑制活性好于连接10个C脂肪酰胺基的化合物4,而6位接18个C脂肪酰胺基的化合物6则没有抑制活性。化合物7、8、9,以丁基苯酞母核,6位连接10个C脂肪酰胺基的化合物7,其抑制活性要好于连接18个C脂肪酰胺基的化合物9,而6位连接16个C脂肪酰胺基的化合物8则没有抑制活性。所设计化合物都具有长脂肪链的结构,进一步结构优化希望通过合成有可能与胰脂肪酶共价结合的化合物,并通过改善其水溶性而提高化合物对胰脂肪酶抑制活性。
参考文献:
[1]Wang F, Chen H, Sun X J, et al. Improvement of cognitive deficits in SAMP8 mice by 3-n-butylphthalide [J]. Neurol Res, 2014, 36(3): 224-233.
[2]鄢学芬, 詹瑾, 黄叶宁,等. 丁苯酞的药理作用与临床评价 [J]. 中国医院药学杂志, 2008, 28(17): 1498-1500.
Yan X F, Zhan J, Huang Y N, et al. Pharmacological action and clinical evaluation of butylphthalide [J]. China Journal of Hospital Pharmacy, 2008, 28(17): 1498-1500.
[3]张楠楠, 高超, 邱渝杰. 肥胖与癌症关系的临床研究最新进展 [J]. 医学综述, 2014, 20(8): 1401-1403.
Zhang N N, Gao C, Qiu Y J. Advancement in clinical researches of correlation between cancer and obesity [J]. Medical Recapitulate, 2014, 20(8): 1401-1403.
[4]冯琼, 周智广. 肥胖与代谢综合征 [J]. 实用糖尿病杂志, 2005, 1(2): 9-11.
Feng Q, Zhou Z G. Obesity and metabolic syndrome [J]. Journal of Practical Diabetology, 2005, 1(2): 9-11.
[5]杨志秋, 詹莉莉, 傅正伟. 脂肪酶抑制剂应用于抗肥胖的研究进展 [J]. 现代生物医学进展, 2011, 11(21): 4178-4181.
Yang Z Q, Zhan L L, Fu Z W. Recent advances of lipase inhibitor in the application of anti-obesity [J]. Progress in Modern Biomedicine, 2011, 11(21): 4178-4181.
[6]Nakai K, Wada R, Iida S, et al. Modeling and Simulation of Orlistat to Predict Weight Loss and Weight Maintenance in Obesity Patients [J]. Drug Metab Pharmacokinet, 2014, 29(3): 278-282.
[7]马凌月, 周颖, 崔一民. 奥利司他的不良反应与药物间相互作用研究 [J]. 中国药房, 2012, 23(22): 2090-2092.
Ma L Y, Zhou Y, Cui Y M. The Research between adverse drug reactions of orlistat and drug-drug interaction [J]. China Pharmacy, 2012, 23(22): 2090-2092.
[8]McNeely W, Benfield P. Orlistat [J]. Drugs, 1998, 56(2): 241-249.
[9]Zhi J, Melia AT, Eggers H, et al. Review of limited systemic absorption of orlistat, a lipase inhibitor, in healthy human volunteers [J]. J Clin Pharmacol, 1995, 35: 1103-1108.
[10]Fako V E, Zhang J T, Liu J Y. Mechanism of Orlistat Hydrolysis by the Thioesterase of Human Fatty Acid Synthase [J]. ACS Catal, 2014, 4: 3444-3453.
[11]高奥, 吕华冲, 蔡金艳,等. 正丁基苯酞的合成及结构表征 [J]. 广东药学院学报, 2013, 29(3): 250-252.
Gao A, Lv H C, Cai J Y, et al. Synthesis and characterization of n-butylphthalide [J]. Journal of Guangdong Pharmaceutical University. 2013, 29(3): 250-252.
[12]王协璜. 醛酮与格氏试剂的反应 [J]. 安徽师大学报(自然科学版), 1994, 17(1): 75-79.
Wang X H. Study on the reaction of alaehyde and ketone with grignard reagent [J]. Journal of Anhui Normal University(Natural Science), 1994, 17(1): 75-79.
[13]王晓晨, 张启虹, 李英姿,等. 嘧啶与吡啶衍生物硝化方法的改进 [J]. 药学进展, 2009, 33(3): 131-133.
Wang X C, Zhang Q H, Li Y Z, et al. Superior methodology for the nitration of pyrimidine and pyridine derivatives [J]. Progress in Pharmaceutical Sciences, 2009, 33(3): 131-133.
[14]祁刚, 屠树滋. 6-硝基香豆素的简便合成 [J]. 生物质化学工程, 2006, 40(2): 23-24.
Qi G, Tu S Z. An improved method for the synthesis of 6-nitrocoumarin [J]. Biomass Chemical Engineering, 2006, 40(2): 23-24.
[15]黄伟, 贾艳秋, 孙盛凯. Pd/C 催化剂研究进展 [J]. 工业催化, 2006, 14(10): 6-11.
Huang W, Jia Y Q, Sun S K. Latest Researches in Pd/C Catalysts [J]. Industrial Catalysis, 2006, 14(10): 6-11.
[16]Khandelwal A, Hall JA, Blagg BS. Synthesis and Structure-Activity Relationships of EGCG Analogues, a recently Identified Hsp90 Inhibitor [J]. J Org Chem, 2013, 78(16), 7859-7884.
[17]Wang Y, Wang J, Yanagita R C, et al. Yanagita. Effects of two sulfated triterpene saponins echinoside A and holothurin A on the inhibition of dietary fat absorption and obesity reduction [J]. Biosci Biotechnol Biochem, 2014, 78(1): 139-146.
责任编辑徐环
Synthesis and Inhibiting Activities on Pancreatic Lipase of Novel Phthalide Compounds
DUAN Liang-Xing, SONG Shan-Shan, LIU Jun, LIU Zhen, WANG Yu-Ming, WAN Sheng-Biao
(School of Medicine and Pharmacy, Ocean University of China, Qingdao 266003, China)
Abstract:Orlistat is by far the only anti-obesity drug of pancreatic lipase on the market. Nine novel phthalide compounds with long lipid chains were designed and synthesized. All new compounds were characterized by1H-NMR,13C-NMR, high resolution electrospray ionization mass. Inhibiting activities on pancreatic lipase of synthesized compounds were tested, and compound 2,5,7 show 49%, 30% and 35% inhibition rate on pancreatic lipase at the concentration of 1 mg/mL.
Key words:orlistat; Docking design; phthalide compounds; anti-obesity drug
基金项目:❋国家自然科学基金项目(NSFC 81172926)资助
收稿日期:2015-02-05;
修订日期:2015-06-04
作者简介:段良兴(1987-),男,硕士生。E-mail:dlx_jx@sina.com ❋❋通讯作者:E-mail:biaowan@ouc.edu.cn
中图法分类号:R914.4
文献标志码:A
文章编号:1672-5174(2016)05-090-05
DOI:10.16441/j.cnki.hdxb.20150031
Supported by National Natural Science Foundation of China (NSFC 81172926)
