神经钙黏蛋白调控Akt/PKB信号通路对神经干细胞增殖的影响
2016-06-03颜建辉黄丽娟陈雁斌华力明
颜建辉 黄丽娟 杨 柳 陈雁斌 华力明
(湘南学院心脑血管研究所,湖南 郴州 423000)
神经钙黏蛋白调控Akt/PKB信号通路对神经干细胞增殖的影响
颜建辉1黄丽娟1杨柳1陈雁斌1华力明1
(湘南学院心脑血管研究所,湖南郴州423000)
〔摘要〕目的探讨神经钙黏蛋白(N-cadherin)调控蛋白激酶(Akt/PKB)信号通路对神经干细胞(NSCs)生长的影响。方法利用RNAi技术将N-cadherin基因的RNA干扰载体pMSCVneo/N-cadherin质粒及pEGFP-MSCVneo对照质粒分别转染至原代培养NSCs,分别作为干扰组和对照组,以原代培养NSCs作为正常组。Western印迹方法检测各组细胞N-cadherin、蛋白激酶(PKB)、蛋白激酶磷酸化(P-PKB)、3-磷酸肌醇依赖性蛋白激酶-1(PDK1)的蛋白表达水平。以MTT法检测NSCs的增殖情况。结果与正常组和对照组相比,干扰组N-cadherin、PKB、P-PKB及PDK1的表达水平显著降低(P<0.05),其NSCs克隆形成率显著减少(P<0.05),NSCs增殖速度也显著减慢(P<0.05)。结论沉默N-cadherin表达可能阻断Akt/PKB信号通路,从而抑制NSCs的增殖。N-cadherin有望成为促进NSCs增殖的潜在靶点。
〔关键词〕神经钙黏蛋白;PKB信号通路;神经干细胞
神经干细胞(NSCs)具有自我更新、多向分化潜能的性质,在脊髓损伤、脑创伤等神经损伤或神经退行性病变中都有潜在治疗价值。正常情况下,NSCs大多处于休眠状态,当受到缺血、外伤等伤害性刺激,能够引起内源性NSCs的增殖,但是其神经再生能力存在局限性,不足以满足自我修复的要求。因此采用合理的干预措施诱导、促进NSCs增殖、再生,以修复损伤神经及重建神经功能,成为目前的研究热点。神经钙黏蛋白(N-cadherin)是黏附分子钙黏蛋白超家族的重要成员,其主要生物学功能为介导间叶细胞间的黏附和迁移〔1〕。在神经系统的继续发育过程中,N-cadherin对神经细胞的迁移、神经突起的生长及突触的形成发挥着重要的作用〔2〕。有文献报道,黑色素瘤细胞中N-cadherin介导的细胞间黏附可以激活Akt/蛋白激酶B(PKB)信号通路,促进癌细胞的存活〔3〕。由此推测,N-cadherin可能通过调控Akt/PKB通路影响NSCs的增殖。
1材料与方法
1.1实验动物15 d清洁级SD孕鼠1只,由湘南学院动物实验中心提供。
1.2主要试剂巢蛋白(Nestin)、多聚赖氨酸(武汉博士德生物有限公司);脂质体Lipofectamine 2000(Invitrogen公司);N-cadherin鼠抗人单克隆抗体(Abcam公司);PKB兔抗人抗体及蛋白激酶磷酸化(p-PKB) 兔抗人多克隆抗体(Santa Cruz公司);3-磷酸肌醇依赖性蛋白激酶-1(PDK1)鼠抗人单克隆抗体(Cell Signaling);B27复合物、胎牛血清、DMEM/F12培养基、G418培养基、PBS缓冲液(Thermo Scientific公司);碱性成纤维细胞生长因子(bFGF)、表皮细胞生长因子(EGF)(北京中杉金桥试剂有限公司);荧光标记FITC试剂、山羊抗鼠 IgG-FITC、DAB显色剂、SABC免疫组化试剂盒(BIO-RAD公司);病毒包装细胞株293T(上海研晶生物科技有限公司);pEGFP-MSCVneo 质粒和pMSCVneo/N-cadherin 质粒(上海研拓生物科技有限公司)。
1.3方法
1.3.1RNAi沉默N-cadherin的表达病毒包装细胞株293T接种至6 孔培养板中,待其汇合达90%~95%时,参照LipofectamineTM2000说明书用脂质体法将pEGFP-MSCVneo质粒和pMSCVneo /N-cadherin质粒分别对其进行转染,分别收集病毒。
1.3.2NSCs的分离、培养取SD孕鼠,处死后取胎鼠分离脑组织,参照文献〔4〕分离NSCs,置于DMEM/F12培养基中传代培养,每隔7 d左右传代1次,收集培养1 w的第2代NSCs悬液,调整浓度至1×105/ml。
1.3.3病毒转染NSCs将上述NSCs悬液等分为3份,分别为正常组、对照组及干扰组。将上述收集的pEGFP-MSCVneo病毒和pMSCVneo/N-cadheri病毒分别转染至对照组和干扰组,然后置于G418培养基中继续培养;正常组不作任何处理,以DMEM/F12培养基继续培养。
1.4检测指标
1.4.1检测NSCs克隆形成率7 d后,取上述各组单细胞悬液,分别按40个细胞/孔传于6孔板,每组6个孔,于倒置显微镜下观察细胞生长情况并计数各孔内的克隆球总数。计数克隆形成率:克隆形成率(%)=克隆球总数/接种活细胞总数×100%。
1.4.2MTT法测定NSCs的生长曲线以无血清培养基将各组NSCs悬液接种于96孔培养板,将细胞浓度调整至1×104个,置于37℃、CO2培养箱中孵育48 h,每孔加入MTT(5 g/L)溶液10 μl,继续培养4 h,收集对数期细胞,每孔加入DMSO 150 μl,震荡10 min,并分别于4、12、20、28和36 h以酶标仪自动测定540 nm波长时吸光值(A),以反映细胞的生长状况。
1.4.3BrdU免疫组化染色及阳性细胞比例取各组NSCs悬液10 μl,接种至预先包被0.01%多聚赖氨酸的24孔培养板中,滴加BrdU抗体,浓度为1∶200,DAB显色,脱水、透明,中性树胶封片,以磷酸盐缓冲液(PBS)作为阴性对照。每张盖片镜下计数5个视野,阳性细胞比例(%)=阳性细胞总数/接种活细胞总数×100%。
1.4.4Western印迹检测N-cadherin、PKB、p-PKB及PDK1的蛋白表达各组NSCs悬液加入裂解液,离心、取上清,获取总蛋白量。凝胶电泳后,转印至PVDF膜,参照试剂盒说明书,分别加入一抗N-cadherin、PKB、p-PKB及PDK1,辣根过氧化物酶标记二抗,以β-actin作为对照,ECL发光显色,以图像分析系统对图中印迹区带进行定量分析。
1.5统计学方法采用SPSS15.0软件行t检验。
2结果
2.1各组NSCs生长情况及克隆球计数正常组NSCs生长良好,呈单个圆球形,培养液中可见数十个细胞组成的细胞克隆球,细胞排列规则紧密,有放射状微小突出伸出。对照组NSCs生长情况与正常组相比无显著差异。干扰组NSCs克隆球计数〔(3.2±0.4)%〕,显著低于正常组和对照组〔(22.8±0.1)%,(21.3±0.2)%〕(P<0.05)。见图1。
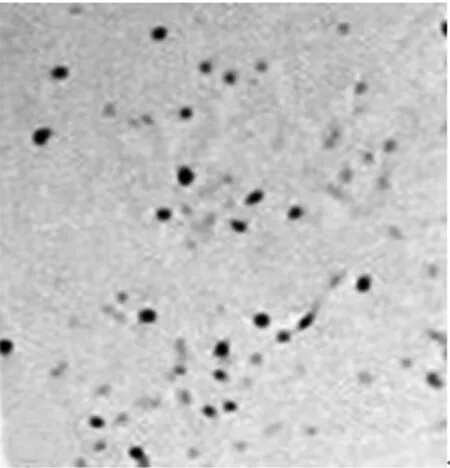
2.2各组NSCs的生长曲线正常组和对照组的A值无显著差异,而干扰组的A值则显著低于正常组及对照组(P<0.05)。见表1。2.3各组BrdU免疫组化染色及阳性细胞比例BrdU阳性细胞呈棕褐色,形态多样,呈圆形、椭圆形或梭性。干扰组BrdU阳性细胞比例〔(35.3±1.1)%〕,显著低于正常组及对照组〔(76.2±1.9)%、(73.4±0.7)%〕(P<0.05)。见图2。
2.4各组N-cadherin、PKB及PDK1的蛋白表达正常组和对照组N-cadherin、PKB、p-PKB及PDK1的蛋白表达无差异,而经过siRNA干扰后,干扰组各项蛋白表达均显著减弱(P<0.05)。见图3,表2。
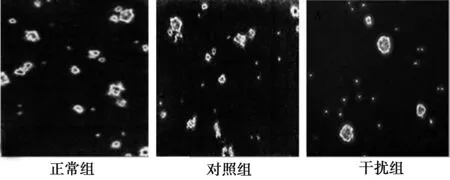
图1 各组NSCs克隆球的细胞形态(×100)
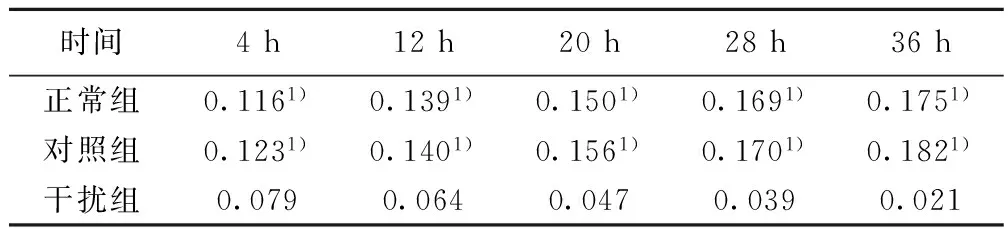
时间4h12h20h28h36h正常组0.1161)0.1391)0.1501)0.1691)0.1751)对照组0.1231)0.1401)0.1561)0.1701)0.1821)干扰组0.0790.0640.0470.0390.021
与干扰组比较:1)P<0.05
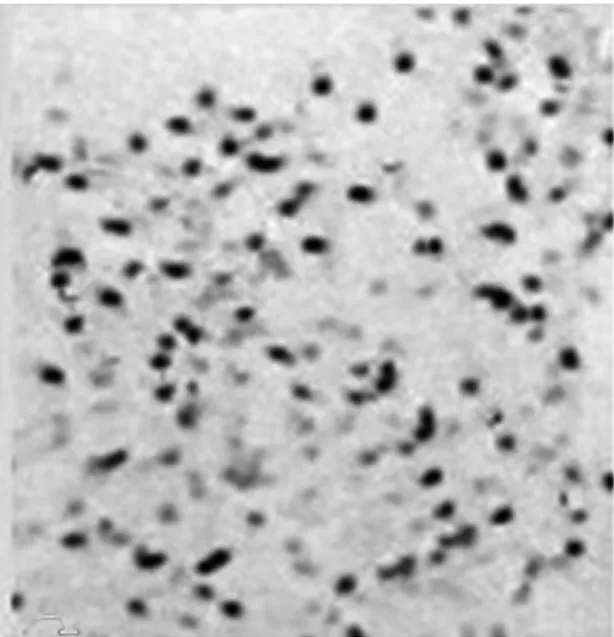
正常组
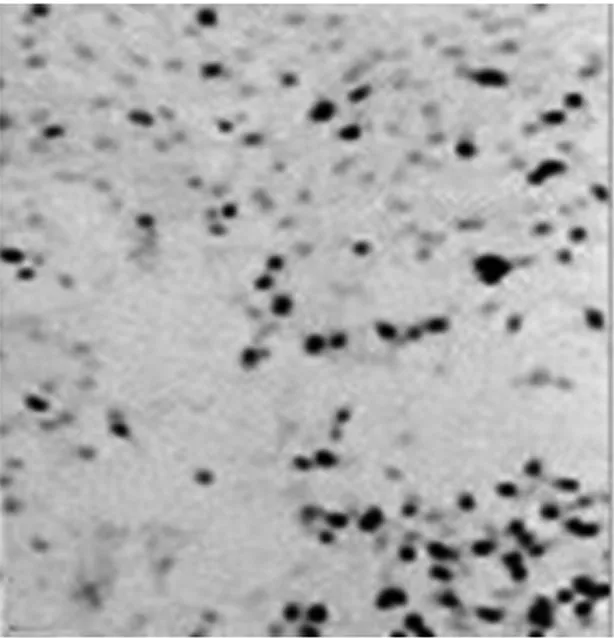
对照组
干扰组
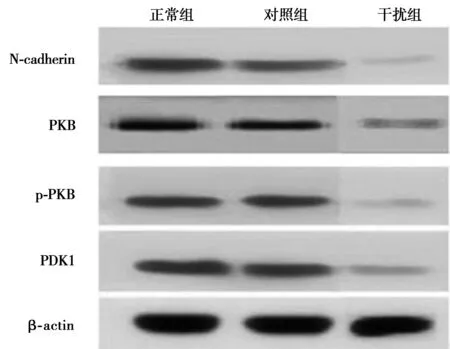
图3 各组N-cadherin、PKB、p-PKB及PDK1的蛋白表达
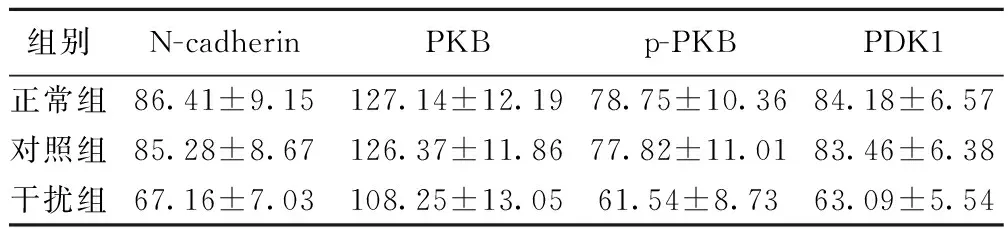
组别N-cadherinPKBp-PKBPDK1正常组86.41±9.15127.14±12.1978.75±10.3684.18±6.57对照组85.28±8.67126.37±11.8677.82±11.0183.46±6.38干扰组67.16±7.03108.25±13.0561.54±8.7363.09±5.54
3讨论
N-cadherin主要有介导间叶细胞间的动态黏附作用,在神经轴突的导向生长、靶向识别以及突触形成中发挥着重要作用〔5〕。近年来研究发现其生物学功能多样化,如介导信号传导、基因激活、细胞凋亡、增殖和迁移等〔6〕。
Akt又称PKB,即蛋白激酶B,在神经干细胞分化、神经信号的传导中起重要作用〔7〕,Akt信号蛋白增多能够降低神经细胞损伤后的自我吞噬能力,同时还具有抗细胞凋亡和促进损伤区血管再生作用〔8〕。研究表明,PDK1是PKB的上游激酶,PDK1和Akt蛋白之间存在一定的关系,PDK1通过与3,4,5-三磷酸磷脂酰肌醇作用可以激活相邻的PKB分子〔9〕;同时,Akt和磷脂相互作用,导致其向膜内的转运,使其磷酸化及被PDK1和PDK2活化,激活的Akt在多种基质作用下调节细胞生存、细胞周期进展和细胞生长〔10〕,最终促进细胞的增殖。Akt/mTOR/p70S6K 通路信号能增加大鼠脊髓损伤后内源性神经元前体细胞的增殖能力,促进新神经元的形成〔11〕。
本实验将提示沉默N-cadherin表达可能会抑制NSCs的增殖。正常组和对照组N-cadherin、pKB、P-pKB及PDK1蛋白表达无显著差异,经过siRNA干扰后,干扰组N-cadherin、PKB、p-PKB及PDK1蛋白表达均显著减弱。因此推测沉默N-cadherin表达,可能会下调PDK1的表达,作为Akt/PKB信号通路的上游靶基因,其表达减弱导致该信号通路被阻断,Akt活性被抑制,从而抑制了NSCs的增殖。
4参考文献
1Maret D,Gruzglin E,Sadrm S,etal.Surface expression of precursor N-cadherin promotes tumor cell invasion〔J〕.Neoplasia,2010;12(2):1066-80.
2Latefi NS,Pedraza L,Schohl A,etal.N-cadherin prodomain cleavage regulates synapse formation in vivo〔J〕.Dev Neurobiol,2009;69(2):518-29.
3Li G,Satyamoorthy K,Herlyn M.N-cadherin-mediated intercellular interactions promote survival and migration of melanoma cells〔J〕.Cancer Res,2001;61(9):3819-25.
4Tong L,Ji LL,Wang ZY,etal.Differentiation of neural stem cells into Schwann-like cells in vitro〔J〕.Biochem Biophy Res Comm,2010;401(4):592-7.
5Latefi NS,Pedraza L,Schohl A,etal.N-cadherin prodomain cleavage regulates synapse formation in vivo〔J〕.Dev Neurobiol,2009;69(8):518-529.
6Ando K,Uemura K,Kuzuya A,etal.N-cadherin regulates p38 MAPK signaling via association with JNK-associated leucine zipper protein:implications for neurodegeneration in Alzheimer disease〔J〕.Biol Chem,2011;286(9):7619-28.
7Zhuang Z,Zhao X,Wu Y,etal.The anti-apoptotic effect of PI3K-Akt signaling pathway after subarachnoid hemorrhage in rats〔J〕.Ann Clin Lab Sci,2011;41(4):364-72.
8张珊珊,罗勇,武磊.PI3K/AKT通路在电针促进局灶脑缺血再灌注大鼠脑内血管再生中的作用〔J〕.第三军医大学学报,2010;32(23):2488-91.
9Ding ZY,Liang JY,Li J,etal.Physical association of PDK1 with AKT1 is sufficient for pathway activation independent of membrane localization and phosphatidylinositol 3 kinase〔J〕.PLoS One,2010;5(3):9910-20.
10Michael AG,Quintin P.Protein kinase Cε:an oncogene and emerging tumor biomarker〔J〕.Mol Cancer,2009;8(9):1-8.
11Hu LY,Sun ZG,Wen YM,etal.ATP-mediated protein kinase B Akt/mammalian target of rapamycin mTOR/p70 ribosomal S6 protein p70S6 kinase signaling pathway activation promotes improvement of locomotor function after spinal cord injury in rats〔J〕.Neuroscience,2010;169(3):1046-62.
〔2014-03-17修回〕
(编辑安冉冉/曹梦园)
〔中图分类号〕R39
〔文献标识码〕A
〔文章编号〕1005-9202(2016)08-1807-03;
doi:10.3969/j.issn.1005-9202.2016.08.007
1湘南学院附属医院
第一作者:颜建辉(1974-),男,副教授,副主任医师,硕士,主要从事脑血管病变研究。
