木薯MeGWD3基因克隆及植物表达载体构建
2016-05-30付莉莉韩冰莹谭德冠孙雪飘张家明
付莉莉 韩冰莹 谭德冠 孙雪飘 张家明

摘要:【目的】克隆木薯葡聚糖水合双激酶(MeGWD3)基因并构建其植物表达载体,为开展木薯MeGWD3基因调控及功能研究提供参考。【方法】采用RT-PCR从木薯华南124(SC124)中克隆MeGWD3基因,对其进行序列分析,并将其连接至改造的pCAMBIA2300载体,构建植物表达载体pCAMBIA2300-MeGWD3。【结果】MeGWD3基因全长3522 bp,编码1173个氨基酸。经序列比对,发现MeGWD3基因序列与木薯Phytozome数据库中公布的GWD基因(cassava4.1_000497m)只存在2个碱基差异,同源性高达99.94%;与NCBI数据库中收录的木薯GWD基因(JN618460)同源性高达99.00%,与蓖麻GWD基因(XM_002518566)同源性达86.00%;成功构建植物表达载体pCAMBIA2300-MeGWD3。【结论】成功构建的植物表达载体pCAMBIA2300可用于MeGWD3基因功能及木薯淀粉代谢研究。
关键词: 木薯;葡聚糖水合双激酶;克隆;植物表达载体
中图分类号: S533 文献标志码:A 文章编号:2095-1191(2016)07-1057-07
0 引言
【研究意义】植物淀粉是食品和工业应用中重要的原材料之一。木薯(Manihot esculenta)块根淀粉含量极高,被誉为淀粉之王。淀粉磷酸化是淀粉代谢的一个重要机制,由一系列酶促反应调控。葡聚糖水合双激酶(Glucan water dikinase,GWD)是淀粉磷酸化作用酶,在淀粉代谢中起关键作用。此外,近年来的研究结果表明,GWD基因还与抗逆和光周期等密切相关(Reimann et al.,2002;Yano et al.,2005;Hejazi et al.,2014)。因此,进行木薯GWD基因克隆及其表达载体构建对开展木薯MeGWD3基因调控及功能研究具有重要意义。【前人研究进展】Lorberth等(1998)最早发现马铃薯淀粉颗粒中存在一种R1蛋白,其含量与淀粉磷酸化程度高度相关,该蛋白被确认为GWD。Yu等(2001)发现GWD基因突变会导致淀粉磷酸化受阻,从而使淀粉降解困难。Nielsen等(2002)研究发现,在大肠杆菌中过量表达GWD,导致糖原磷酸化程度提高了6倍。Theerawitaya等(2012)研究发现,水稻GWD基因转录调控与盐胁迫相关,其机制是通过磷酸化淀粉,加快淀粉在冻害前被淀粉酶降解为可溶性糖的速度。Hejazi等(2014)根据拟南芥野生型和GWD突变体对不同光周期反应,证明GWD基因与光周期密切相关,在淀粉代谢过程起重要作用。Skeffington等(2014)研究发现,超表达GWD基因未加速拟南芥叶片淀粉的降解,直到其表达水平下降70%后,淀粉降解和合成均被抑制。目前,關于木薯淀粉的研究报道主要集中在淀粉结构与性质方面(赵奕玲等,2007;古碧等,2009;安飞飞等,2015),被研究的淀粉代谢相关基因主要有SBE、AGPase、GBSS等(许娟等,2012;郭运玲等,2013;陈会鲜,2014;郭雅静等,2014;刘平平等,2015)。【本研究切入点】有关木薯GWD基因的研究未见报道,其生物学功能也尚未清楚。【拟解决的关键问题】以木薯为材料,利用RT-PCR克隆MeGWD3基因片段并进行序列分析,将其连接至改造的pCAMBIA2300载体,构建植物表达载体pCAMBIA2300-MeGWD3,为进一步开展MeGWD3调控及基因功能研究提供参考。
1 材料與方法
1. 1 试验材料
供试材料为木薯品种华南124(SC124),种植在中国热带农业科学院热带生物技术研究所试验田。大肠杆菌DH5α购于北京全式金生物技术有限公司;改造的pCAMBIA2300载体由中国热带农业科学院热带生物技术研究所实验室保存提供;pMD19-T载体、T4连接酶、DNaseI、DNA Polymerase购自宝生物工程(大连)有限公司;反转录试剂盒RevertAid First Strand cDNA Synthesis Kit和限制性内切酶购自加拿大Fermentas公司;Plant RNA Reagent试剂盒、质粒小提试剂盒、胶回收试剂盒和DNA Marker购自天根生化科技(北京)有限公司;其他试剂均为国产分析纯。
1. 2 试验方法
1. 2. 1 引物设计 根据木薯Phytozome数据库(http://www.phytozome.net/cassava)中公布的GWD基因(cassava4.1_000497m)序列,采用Primer 5.0设计引物,由上海闪晶分子生物科技有限公司合成。为了方便后续植物表达载体的构建,在正向引物FGWDF4(5'-GGGGTACCATGGATTCTCTGCGTGTATTG-3')插入KpnⅠ酶切位点(下划线处),反向引物FG
WDR4(FGWDR4:5'-CGGGATCCCTATGGTTGTGG
GCGTGTC-3')插入BamHⅠ酶切位点(下划线处),并加上保护碱基。这2个酶切位点是pCAMBIA2300载体的多克隆位点,但在MeGWD3基因序列上不存在。
1. 2. 2 总RNA提取及cDNA合成 取新鲜的木薯叶片1.0 g,液氮研磨,根据Plant RNA Reagent试剂盒说明提取总RNA,生物分析仪Agilent 2100测定RNA浓度为395 ng/μL,-80 ℃保存。用反转录试剂盒Revert-Aid First Strand cDNA Synthesis Kit合成cDNA。
1. 2. 3 基因克隆及序列分析 以木薯叶片cDNA为模板进行PCR扩增。反应体系(50.0 μL):cDNA模板1.0 μL,10×LA Taq Buffer 5.0 μL,2.5 mmol/L dNTPs 4.0 μL,5 U/μL LA Taq酶0.5 μL,10 μmol/L正、反向引物各1.0 μL,ddH2O 37.5 μL。扩增程序:94 ℃预变性3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 3.5 min,进行35个循环;最后72 ℃延伸7 min,25 ℃保存。PCR产物于1%琼脂糖凝胶电泳,回收目的片段与TA克隆载体pMD19-T载体连接,并转化大肠杆菌DH5α。提取质粒经双酶切和PCR验证后,选择阳性克隆送至深圳华大基因科技有限公司测序。利用NCBI-BLAST对获得的目的片段进行同源性比对,并利用在线软件(http://www.bio-soft.net/sms/index.html)进行蛋白质氨基酸序列分析,最后利用MEGA 6.0构建MeGWD3基因系统发育进化树。
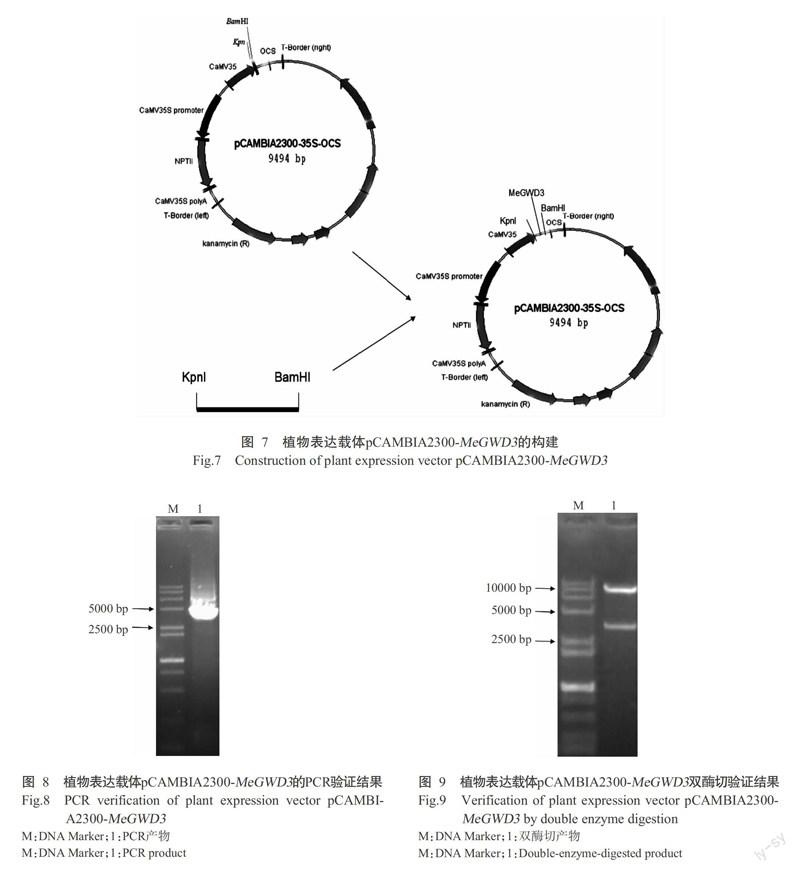
1. 2. 4 植物表达载体构建及阳性克隆筛选 将重组质粒pMD19-T-MeGWD3和pCAMBIA2300载体分别用KpnⅠ和BamHⅠ进行双酶切。酶切体系(20.0 μL):质粒10.0 μL,10×Fast Digest Buffer 2.0 μL,KpnⅠ和BamHⅠ各0.5 μL,ddH2O 7.0 μL,于37 ℃反应3~4 h。酶切产物于1%琼脂糖凝胶上电泳,回收目的条带,将其与pCAMBIA2300载体用T4连接酶于16 ℃连接过夜,构建植物表达载体pCAMBIA2300-MeGWD3,转化大肠杆菌DH5α,通过蓝白斑筛选阳性克隆并进行PCR扩增、双酶切及测序验证。
2 结果与分析
2. 1 木薯总RNA提取结果
木薯叶片总RNA的琼脂糖凝胶电泳结果(图1)表明,RNA完整性较好,可用于后续试验。
2. 2 MeGWD3基因克隆结果
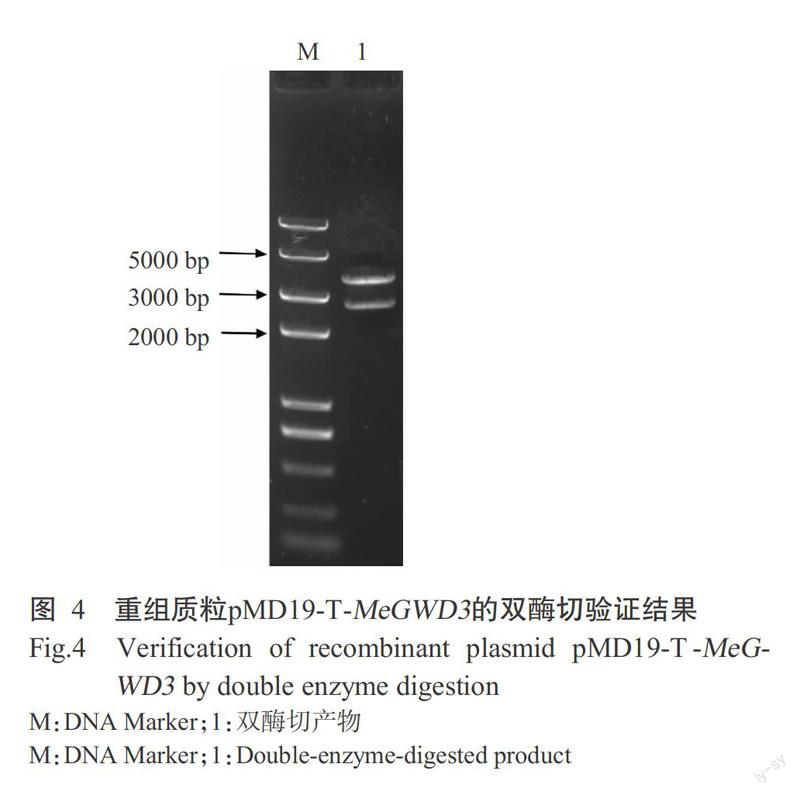
将提取的木薯叶片总RNA反转录成cDNA,再以cDNA为模板进行PCR扩增,获得1条约3500 bp的条带(图2),与预期结果相符。将目的片段切胶回收,回收产物与TA克隆载体pMD19-T连接并转化大肠杆菌DH5α,提取质粒。重组质粒经PCR(图3)和双酶切(图4)验证,结果表明已成功克隆获得MeGWD3基因。
2. 3 MeGWD3基因序列分析结果
MeGWD3基因测序结果如图5所示,该基因含有一个完整的开放阅读框,长度为3522 bp,编码1173个氨基酸。BLAST结果表明,MeGWD3与NCBI中公布的木薯GWD基因(JN618460)同源性高达99.00%,与蓖麻GWD基因(XM_002518566)同源性达86.00%,与木薯Phytozome数据库中公布的GWD基因(cassava 4.1_000497m)只存在2个碱基差异,同源性高达99.94%,进一步证明已成功克隆MeGWD3基因。
为了解MeGWD3与其他植物GWD基因的進化关系,利用MEGA 6.0构建不同植物GWD基因的系统进化树。由图6可知,MeGWD3与蓖麻(Ricinus communis)、麻风树(Jatropha curcas)、杨树(Populus euphratica)的GWD基因亲缘关系较近,而与油菜(Brassica napus)、醉蝶花(Tarenaya hassleriana)的GWD基因亲缘关系较远。
2. 3 植物表达载体pCAMBIA2300-MeGWD3构建
用KpnⅠ和BamHⅠ分别双酶切pCAMBIA2300载体和重组质粒pMD19-T-MeGWD3后,将MeGWD3基因连接至pCAMBIA2300载体上(图7),并转化大肠杆菌DH5α后提取质粒,经PCR(图8)、双酶切(图9)及测序验证,结果表明已成功构建获得植物表达载体pCAMBIA2300-MeGWD3。
3 讨论
GWD在淀粉代谢中起催化淀粉磷酸化的作用(谢淑蓉和浦跃武,2005;孙潇和包劲松,2014)。GWD基因最早是在马铃薯中发现,其蛋白质含量与淀粉磷酸化程度高度相关(Lorberth et al., 1998)。随后,GWD基因从拟南芥(Kaplan and Guy, 2005)、小麦(Ral et al., 2012)和水稻(Boriboonkaset et al., 2013)等不同物种中克隆获得并对其功能开展了研究。序列分析结果表明,拟南芥和马铃薯的GWD基因序列具有较高的保守性,氨基酸序列相似性达79.00%(Hejazi et al., 2012)。本研究采用RT-PCR从木薯SC124中成功克隆MeGWD3基因,长度为3522 bp,编码1173个氨基酸,其序列比对分析结果表明,MeGWD3基因与木薯Phytozome数据库中参考基因的序列同源性高达99.94%,二者间仅存在2个碱基差异,可能是木薯品种间的差异造成的。系统发育进化分析结果表明,MeGWD3与蓖麻GWD基因(XM_002518566)的同源性最高,达86.00%。
随着RNAi、超表达等转基因技术的应用,研究者对GWD基因的功能有了更进一步的认识。如利用反义技术可抑制马铃薯GWD基因表达,而导致淀粉结合磷酸盐减少90%(Lorberth et al., 1998);过量表达GWD基因可使糖原磷酸化程度显著增加(Nielsen et al., 2002)。通过RNAi技术下调GWD基因的表达可增加小麦籽粒生物量(Ral et al., 2012)。由此可见,构建目的基因表达载体,通过转基因技术研究目的基因的功能,已成为常规的分子生物学方法。本研究利用双酶切法将MeGWD3基因片段与pCAMBIA2300载体连接,成功构建植物表达载体pCAMBIA2300- MeGWD3,可为下一步通过转基因技术研究MeGWD3基因功能打下基础。
此外,研究目的基因在多种胁迫条件下的表达差异也是常见的基因功能分析手段之一。如在盐和冻害胁迫下GWD基因的表达量均增加(Kaplan and Guy,2005;Boriboonkaset et al.,2013),据此推测GWD基因具有耐盐和抗冻害的功能。但本研究尚未涉及MeGWD3基因表达的分析,因此,MeGWD3基因對各种胁迫条件的响应有待进一步探究。
4 结论
根据木薯数据库已知的GWD基因序列,采用RT-PCR从木薯SC124中成功克隆获得MeGWD3基因,其cDNA全长3522 bp,编码1173个氨基酸,将其与pCAMBIA2300载体连接,可成功构建植物表达载体pCAMBIA2300-MeGWD3,为进一步研究该基因的功能及木薯淀粉代谢打下基础。
参考文献:
安飞飞,陈松笔,李庚虎,周锴,李开绵. 2015. 华南8号木薯及其四倍体块根淀粉及蛋白表达谱的差异分析[J]. 中国农业科学,48(13):2656-2665.
An F F, Chen S B, Li G H, Zhou K, Li K M. 2015. Comparison analysis of starch and protein expression profiles on cassava tuberous roots cv. SC8 and its tetraploid[J]. Scientia Agricultura Sinica, 48(13): 2656-2665.
陳会鲜. 2014. 木薯块根AGPase和SBE及其同工酶活性与淀粉积累的关系研究[D]. 南宁:广西大学.
Chen H X. 2014. The research of the relationship between the activity of cassavas AGPase, SBE and their isozymes with starch synthesis[D]. Nanning: Guangxi University.
古碧,李开绵,李兆贵,李凯. 2009. 不同木薯品种(系)块根淀粉特性研究[J]. 热带作物学报,30(12):1876-1882.
Gu B, Li K M, Li Z G, Li K. 2009. Starch properties of cassava root[J]. Chinese Journal of Tropical Crops, 30(12): 1876-1882.
郭雅静,罗兴录,陈会鲜. 2014. 木薯淀粉合成关键酶AGPase小亚基基因全长克隆[J]. 南方农业学报,45(7):1147-1153.
Guo Y J, Luo X L, Chen H X. 2014. Cloning and expression analysis of small subunit gene full-length in cassava AGPase[J]. Journal of Southern Agriculture, 45(7): 1147-1153.
郭运玲,孔华,尹奇,左娇,黄启星,贺立卡,郭安平. 2013. 木薯淀粉分支酶SBEⅠ反义基因遗传转化木薯的研究[J]. 中国农学通报,29(9):149-154.
Guo Y L, Kong H, Yin Q, Zuo J, Huang Q X, He L K, Guo A P. 2013. Genetic transformation of cassava with its SBEⅠantisense gene[J]. Chinese Agricultural Science Bulletin, 29(9): 149-154.
劉平平,王英,高和琼,李开绵,庄南生. 2015. 木薯淀粉合成相关基因SBE和GBSS的物理定位[J]. 分子植物育种,13(10):2224-2229.
Liu P P, Wang Y, Gao H Q, Li K M, Zhuang N S. 2015. Physical localization of SBE and GBSS genes from cassava(Manihot esculenta Crantz)[J]. Molecular Plant Breeding, 13(10): 2224-2229.
孙潇,包劲松. 2014. 葡聚糖水合二激酶的生物学功能及其应用[J]. 浙江大学学报(农业与生命科学版),40(6):591-597.
Sun X, Bao J S. 2014. Biological function and application of glucan-water dikinase: a review[J]. Journal of Zhejiang University(Agriculture & Life Science), 40(6): 591-597.
谢淑蓉,浦跃武. 2005. 植物体内淀粉磷酸化的生物学研究进展[J]. 生物技术通报(6):22-24.
Xie S R, Pu Y W. 2005. Progresses in the studies of biological bases of starch phosphorylation in planta[J]. Biotechnology Bulletin,(6): 22-24.
许娟,罗兴录,赵德征. 2012. 木薯淀粉合成相关酶基因的克隆及表达分析[J]. 生物技术通报,(11):101-109.
Xu J, Luo X L, Zhao D Z. Cloning and expression of starch synthesis related enzyme gene in common cassava[J]. Biote-
chnology Bulletin,(11): 101-109.
赵奕玲,廖丹葵,张友全,童张法. 2007. 超声波对木薯淀粉性质及结构的影响[J]. 过程工程学报, 7(6):1138-1143.
Zhao Y L, Liao D K, Zhang Y Q, Tong Z F. 2007. Effects of ultrasonic wave on the properties and structure of cassava starch[J]. The Chinese Journal of Process Engineering, 7(6): 1138-1143.
Boriboonkaset T, Theerawitay C, Yamada N, Pichakum A, Supaibulwatana K, Cha-Um S. 2013. Regulation of some carbohydrate metabolism-related genes, starch and soluble sugar contents, photosynthetic activities and yield attributes of two contrasting rice genotypes subjected to salt stress[J]. Protoplasma, 250(5): 1157-1167.
Hejazi M, Mahlow S, Fettke J. 2014. The glucan phosphorylation mediated by α-glucan, water dikinase(GWD) is also essential in the light phase for a functional transitory starch turn-over[J]. Plant Signaling & Behavior, 9(7): 28892.
Hejazi M, Steup M, Fettke J. 2012. The plastidial glucan, water dikinase(GWD) catalyses multiple phosphotransfer reactions[J]. Febs Journal, 279(11): 1953-1966.
Kaplan F, Guy C L. 2005. RNA interference of Arabidopsis beta-amylase 8 prevents maltose accumulation upon cold shock and increases sensitivity of PSII photochemical efficiency to freezing stress[J]. The Plant Journal, 44(5): 730-743.
Lorberth, R, Ritte G, Willmitzer L, Kossmann J. 1998. Inhibition of a starch-granule-bound protein leads to modified starch and repression of cold sweetening[J]. Nature Biotechnology, 16(5): 473-477.
Nielsen A, Chen P H J, Larsson H, Blennow A, Moller B L. 2002. Production of highly phosphorylated glycopolymers by expression of R1 in Escherichia coli[J]. Carbohydrate Research, 337(4): 327-333.
Ral J P, Bowerman A F, Li Z Y, Sirault X, Furbank R, Pritchard J R, Bloemsma M, Cavanagh C R, Howitt C A, Morell M K. 2012. Down-regulation of glucan, water-dikinase activity in wheat endosperm increases vegetative biomass and yield[J]. Plant Biotechnology Journal, 10(7): 871-882.
Reimann R, Ritte G, Steup M, Appenroth K J. 2002. Association of alpha-amylase and the R1 protein with starch gra-
nules precedes the initiation of net starch degradation in turions of Spirodela polyrhiza[J]. Physiologia Plantarum, 114(1): 2-12.
Skeffington A W, Graf A, Duxbury Z, Gruissem W, Smith A M. 2014. Glucan, water dikinase exerts little control over starch degradation in Arabidopsis leaves at night[J]. Plant Phy-
siology, 165: 866-879.
Theerawitaya C, Boriboonkaset T, Cha-um S, Supaibulwatana K, Kirdmanee C. 2012. Transcriptional regulations of the genes of starch metabolism and physiological changes in response to salt stress rice(Oryza sativa L.) seedlings[J]. Physiology and Molecular Biology of Plants, 18(3): 197-208.
Yano R,Nakamura M, Yoneyama T, Nishida I. 2005. Starch-related alpha-glucan/water dikinase is involved in the col-
dinduced development of freezing tolerance in Arabidopsis[J]. Plant Physiology, 138(2): 837-846.
Yu T S, Kofler H, H usler R E, Hille D, Flügge U I, Zeeman S C, Smith A M, Kossmann J, Lloyd J, Ritte G, Steup M, Lue W L, Chen J, Weber A. 2001. The Arabidopsis sex1 mutant is defective in the R1 protein, a general regulator of starch degradation in plants, and not in the chloroplast hexose transporter[J]. The Plant Cell, 13(8): 1907-1918.
(責任編辑 陈 燕)
