动物肌肉生长发育相关microRNAs的表达模式和调控机制
2016-04-19黄金秀齐仁立重庆市畜牧科学院荣昌402460农业部养猪科学重点实验室荣昌402460
王 敬 王 琪 黄金秀,2 齐仁立,2∗(.重庆市畜牧科学院,荣昌402460;2.农业部养猪科学重点实验室,荣昌402460)
动物肌肉生长发育相关microRNAs的表达模式和调控机制
王敬1王琪1黄金秀1,2齐仁立1,2∗
(1.重庆市畜牧科学院,荣昌402460;2.农业部养猪科学重点实验室,荣昌402460)
摘要:microRNAs(miRNA)是生物体内自然存在的一种非编码小RNA,能够靶向调控众多基因的表达,进而参与多种生命活动的调节。动物肌肉组织的生长发育是一个复杂的过程,受到诸多调控因子的精密控制。本文综述了miRNA特别是一些肌特异性miRNA在动物肌肉生长发育过程中的表达模式和调控机制。
关键词:micorRNAs;肌肉;肌细胞;肌特异性miRNA
肌肉是动物体内一种极为重要的组织器官,肌肉的正常生长发育保障了机体运动系统的正常运作并维持能量代谢的平衡。除此以外,肌肉(肌纤维)的数量、类型和状态对于动物肉产品品质也有极为重要的影响。肌肉的形成和发育大概包括成肌细胞分化形成、成肌细胞迁移增殖和多核肌细胞/肌管形成3个阶段[1]。肌细胞是肌肉的基本组成单元,在胚胎发育后期肌细胞数量趋于稳定,动物出生以后则是肌细胞体积膨大和肌纤维数量增加[2]。此外,在动物的肌肉创伤修复过程中也存在肌细胞的大量增殖。
肌肉组织的生长发育是一个复杂的调控过程,肌前体细胞在大量调控因子的精密调控下生长分化为多核肌细胞(肌管)。碱性螺旋-环-螺旋蛋白质家族的生肌因子5(myofactor-5,Myf5)、成肌细胞的增殖和分化生肌决定因子(myogenicdeterminationgene,MyoD)、肌肉发生调控因子(muscleregulatoryfactors-4,Mrf4)和肌细胞生成素(myogenin,MyoG)等生肌调节因子或肌源性分化因子、MADS同源盒蛋白、锌指蛋白和Wnt家族成员等基因的顺序表达对肌细胞的形成、分化和肌组织形态的构建起着重要作用[2-6]。
1 MicroRNAs(miRNA)的生成和调控
miRNA是一类广泛存在于动植物体内具有调控功能的非编码小RNA。在真核生物的基因组上通常为基因间区或内含子区的初级转录本miRNA (pri-miRNA),在Drosha(RNA酶Ⅲ家族成员之一)和其辅助因子Pasha[双链RNA(double-stranded RNA,dsRNA)结合蛋白]的作用下,转变成长度约70 nt具有茎环结构的前体miRNA(pre-miRNA)。然后,RNA-三磷酸鸟苷(GTP)和输出蛋白5(exportin 5)将pre-miRNA输送到细胞质中,Dicer(RNA酶Ⅲ家族成员之一)将其剪切成为约22 nt长度的具有功能的miRNA成熟体。与长链非编码RNA、环状非编码RNA和piRNA等其他非编码RNA相比,miRNA的调控机制相对简单。成熟体miRNA 5′端的2~8个核酸序列被称为“种子序列”,能够与靶基因的3′非翻译区(3′UTR)互补结合,进而引导沉默复合体降解靶mRNA或阻遏靶mRNA的翻译[7-8]。miRNA的生成和调控机制见图1[9]。
目前在动物上发现和确认的miRNA在不断增多,miRBASE数据库(v21.0)已经收录了1 920个小鼠、430个猪和1 009个鸡的miRNA成熟体。这些数量庞大的miRNA既可以单独发挥作用,也可以由数个miRNA组成协同调控网。值得注意的是,许多miRNA基因在染色体上成簇排列形成基因群(称为miRNA簇),它们常位于一个多顺反子内,通过共表达在胚胎发育、细胞周期和细胞分化等诸多方面发挥协同调控的功能[10]。通常,1 个miRNA可以调控多达数百个靶mRNA,而1个基因也可能同时受到多个miRNA的影响[11]。凭借对大量靶基因的调控,miRNA参与机体内的多种生命活动,包括细胞的增殖、分化、死亡、应激反应、胞内代谢和信号传导[11-12]。
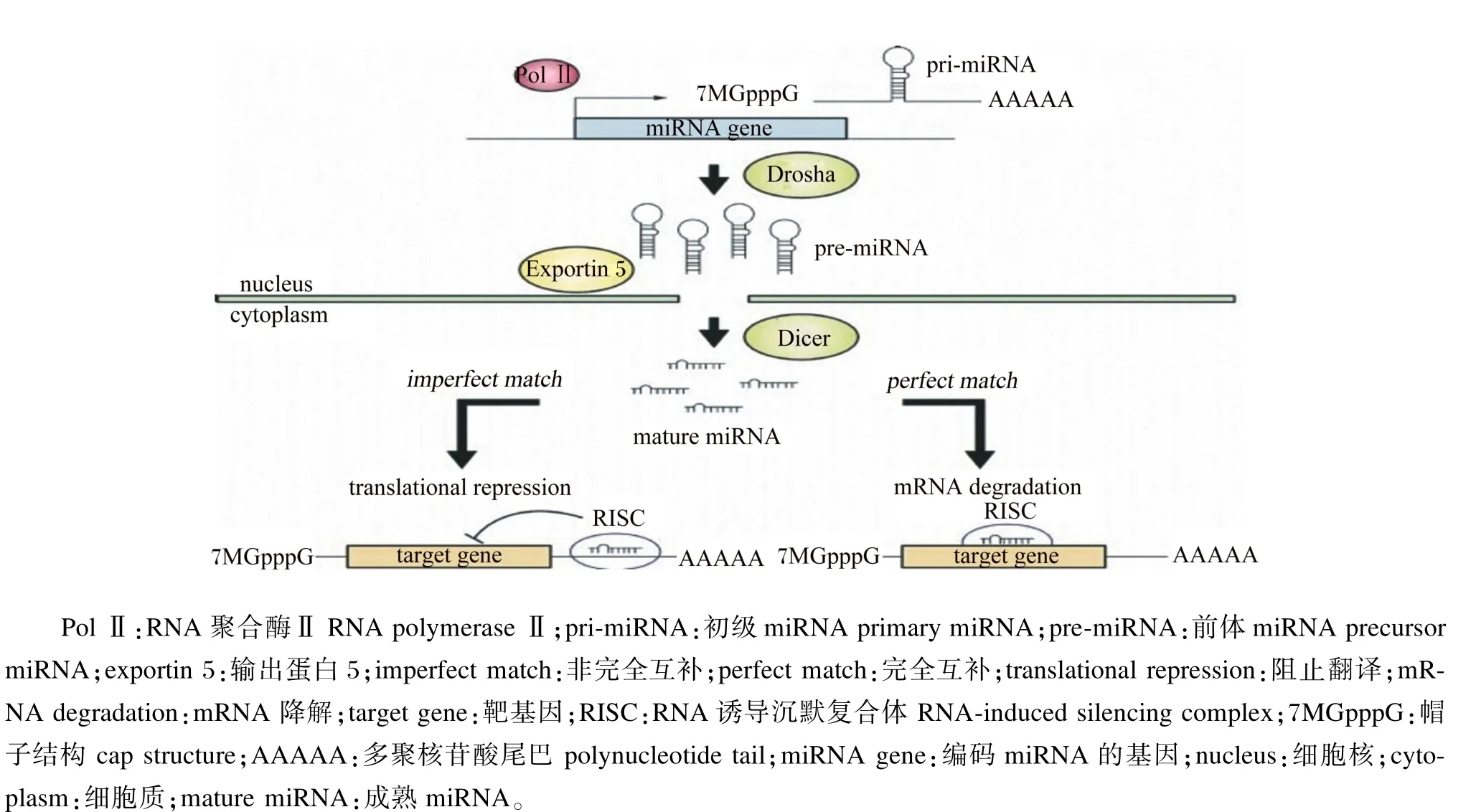
图1 miRNA的生成和调控机制Fig.1 The production and regulatory mechnism of miRNA[9]
2 miRNA的表达模式
miRNA的表达具有组织特异性。Babak等[13]使用基因芯片检测了小鼠17个不同的组织器官中miRNA的表达情况,检测到的78个miRNA中至少有1/2存在组织特异性分布。Liang等[14]检测了345个miRNA在40个人类器官中的表达情况,通过聚类分析把miRNA分为8个组织特异性表达组,分别是肌肉、胃肠道/上皮细胞、脑、脑/外周血单核细胞、心脏、肝脏、胎盘和睾丸。miRNA的表达模式还具有时空特异性,在成年小鼠[15]和猪[14]的肌肉组织中检测到100多种miRNA的稳定表达,它们中的多数在胚胎期和生长早期表达水平较低,随着动物的生长,其表达水平显著升高,但有少部分miRNA则表现出相反的表达趋势。此外,还有一些miRNA则随时间延长呈现波浪式的表达[16]。
miRNA的正常表达对肌肉的形成和生长是必不可少的。Dicer是哺乳动物体内miRNA成熟体加工过程中所必需的核酸内切酶。在条件性敲除Dicer后,小鼠的骨骼肌发育受阻,表现出增生不全[17],表明miRNA对于骨骼肌的发育有重要意义。另外,心肌和骨骼肌肥大、肌肉萎缩以及心力衰竭等与肌肉相关的疾病都伴随着明显的miRNA异常表达[17-19]。
肌细胞特有表达或者高表达一些miRNA,它们被认为是肌特异性(muscle-specific)的miRNA,例如骨骼肌特异性的miR-1、miR-133和miR-206以及心肌特异性的miR-208a/ b等。多数肌特异性miRNA都可以直接或间接作用于Myf5和MyoD等生肌基因,进而影响肌细胞的增殖、分化和凋亡。此外,肌细胞中一些非肌特异性miRNA也被确认参与了分子调控网络,影响着肌细胞的生长。这些miRNA或直接靶向调控肌细胞增殖分化调控因子,或通过参与细胞内信号传导和转录分子调控间接参与肌细胞的生命活动。此外,miRNA的正常表达不但对于胚胎期肌细胞的形成发挥重要作用,对于成年期肌肉损伤后的修复也有重要影响。
随着高通量测序和基因芯片等新技术的快速发展,越来越多参与肌肉生长调节的miRNA被发现和确认。许多miRNA除了在不同组织器官具有表达特异性外,在不同类型的肌肉中也都存在明显的差异。聂晶[20]通过Solexa测序发现有363 个miRNA在猪的背最长肌和腰大肌中都有表达,而且有193个miRNA的表达存在显著差异,其认为这可能与肌纤维类型的差异有关。Ma等[21]分别从猪的红肌、白肌和混合肌等肌纤维中提取RNA构建small RNA文库,测序发现miRNA表达水平在不同类型的肌肉中存在差异(图2)。这些研究提示我们在以后的研究中要更加严格区分miRNA对于肌纤维类型和功能的差异调控。

图2 miRNA在不同类型肌肉中的差异表达Fig.2 The differential expression of miRNAs in diverse types of muscle[21]
3 miRNA对动物骨骼肌的调控及其机制
3.1肌特异性miRNA
miR-1、miR-133a、miR-206是相对研究最多的肌特异性miRNA,它们只在动物的心脏和骨骼肌高表达,调控肌细胞的增殖和分化,是肌肉形成的关键。在小鼠基因组中,miR-1、miR-133和miR-206形成3个基因簇,即18号染色体的miR-1-2 和miR-133a-1、2号染色体的miR-1-1和miR-133a-2以及1号染色体的miR-206和miR-133b,它们能够形成双顺反子转录本同时进行转录,但是它们的调控作用却并不相同。除此以外,近年新发现的miR-208a/ b、miR-486和miR-499等miRNA也都被认为是肌特异性miRNA。
Chen等[22]最早报道了miR-1可以靶向调控肌肉生长抑制因子组蛋白去乙酰化酶4(HDAC4)基因的表达,从而促进肌肉生长。2010年,Chen等[23]进一步研究发现miR-1和miR-206可以促进骨骼肌卫星细胞分化,显著抑制其增殖。配对盒基因(paired box,Pax)7是Pax基因家族的一员,它能够诱导多能干细胞转变为生肌细胞,肌肉干细胞的出现就取决于Pax3和Pax7的正常表达。Chen等[23]确认Pax7是miR-1和miR-206共同的直接靶标,它们通过调节Pax7的表达来影响肌细胞的发育。下调miR-1和miR-206能够增加Pax7蛋白水平并促进肌细胞增殖,然而miR-1和miR-206的缺失会降低Pax7的表达并抑制肌细胞的分化。后续试验也证实了miR-1和miR-206在C2C12细胞分化中的关键调控作用[24]。Nakajima等[25]试验比较了miR-1对C2C12肌细胞成肌分化、成骨分化和成脂分化的差异调控作用,结果发现,过表达miR-1可以显著促进成肌分化和肌管的形成,而对于诱导条件下C2C12细胞的成骨分化和成脂分化没有显著影响。这一试验结果也表明肌特异性miRNA的定向调控功能较为稳定。
基于基因敲出鼠的研究发现,单独敲除miR-133a-1或miR-133a-2并没有对小鼠肌肉生长发育造成显著的影响,但是两者一起缺失则会造成快肌纤维的病变,并伴随着线粒体损伤和快、慢肌纤维之间的类型转换[26]。这一试验结果直接反映了miR-133a在维持肌肉生长发育和功能正常方面的重要作用。但是,基因缺失鼠并没有表现出更加极端的肌肉损伤性病变。这可能是由于许多miRNA都有共同的靶基因,一旦某一miRNA表达失常,动物机体会通过其他miRNA进行功能性的补偿。在细胞试验中,miR-133可以通过靶向血清反应因子(serum response factor,SRF)促进肌细胞的增殖[22],并通过抑制神经多聚嘧啶序列结合蛋白(polypyrimidine track-binding protein,nPTB)的表达,使得nPTB调控的骨骼肌分化过程中不同转录本基因剪切模式产生变化,从而发挥抑制骨骼肌细胞分化的作用[27]。关于miR-133b对肌肉生长的影响还不清楚,但是有研究发现病人在患心肌梗死时候心肌中存在miR-133b的表达下调[28]。
许多研究都确认了miR-206的促肌肉生长作用,在体外试验中它能够显著促进生肌细胞的分化和肌管融合,一系列生肌负调控因子都是它的靶标,包括Notch3、Igfbp5、Meox2、视黄酸受体β (RARB)、Fzd7、丝裂原蛋白激酶激酶激酶激酶3 (MAP4K3)、氯离子通道蛋白3(CLCN3)、活化T细胞核因子5(NFAT5)和基质金属蛋白酶3[29]。多数研究都认为miR-206和miR-1共同发挥作用。此外,在生肌阶段miR-206和miR-29一起抑制转化生长因子-β(TGF-β)信号通路,而该信号通路是肌细胞分化的负调控者[30]。
3.2非肌特异性miRNA
大量的非肌特异性miRNA在不同试验中也都表现出了对肌肉生长发育的调控作用。虽然这些miRNA在动物的不同组织都有广泛表达,但是它们在肌肉组织或者肌细胞中的表达异常会对肌肉的生长发育产生正面或负面的影响。
一些广泛表达的miRNA在肌肉生长发育过程中发挥了正向调控作用。过表达miR-148a能够促进C2C12肌细胞系和小鼠原代骨骼肌细胞的分化,促进肌肉生成,而miR-148的生肌作用是通过降解Rho相关卷曲螺旋形成蛋白激酶1 (ROCK1)来实现的[31]。云青等[32]发现miR-143-3p在骨骼肌和成肌细胞中均有表达,过表达miR-143-3p能够促进C2C12肌细胞分化。miR-29对于肌肉的形成也有促进作用,它能够下调丝氨酸/苏氨酸蛋白激酶(Akt3)基因的表达,抑制骨骼肌细胞的增殖并促进其分化[33]。miR-181则可以通过抑制同源盒-A1(homeobox-A1,Hox-A1)基因的表达,促进成肌细胞分化[34]。
还有一些miRNA在动物的肌肉生长和发育过程中具有负调控作用。Wang等[35]预测分析发现,miR-23a的种子序列能够结合肌球重链基因(fast myosin heavy chain,MYH),包括MYH1、2和4。在随后的试验中,他们发现小鼠肌肉组织中的miR-23a表达模式与肌肉的生长过程高度负相关,在C2C12细胞上进行的功能性试验也证明miR-23a能够抑制肌细胞的分化。但是,miR-23a的正常表达也是肌肉生长不可或缺的。在肌肉萎缩过程中会产生大量MAFbx/ atrogin-1、MuRF1、E3连接酶,在肌肉萎缩和退化中调控黏膜萎缩变化。miR-23a能够抑制MAFbx/ atrogin-1、MuRF1的表达,从而抑制肌肉萎缩[36]。这些不同的试验结果表明miR-23a在肌肉的生长和损伤修复过程中都扮演了极其重要的角色。Seok等[37]的研究表明,miR-155可以靶向调控生肌因子肌肉细胞特异性增强因子2A(MEF2A)的表达,进而影响骨骼肌细胞的分化。熊燕等[38]研究发现,miR-155能够抑制C2C12肌细胞的分化,减少肌管的形成,预测并验证了T细胞因子4(TCF4)是miR-155的一个靶基因,而TCF4是经典Wnt通路调控成肌分化的关键因子,在动物的胚胎阶段对肌肉的形成发挥重要作用,是肌细胞终末分化和卫星细胞定向的关键调控因子。
此外,miR-27a/ b、miR-31、miR-489等多个miRNA对生肌细胞激活、细胞肌原性维持和肌细胞增殖与分化也表现出调控作用。
4 miRNA对动物心肌的调控及其机制
心肌与骨骼肌的结构基本相似,也是横纹肌的一种。与骨骼肌的多核细胞不同,心肌细胞通常只有1个细胞核。多种心脏疾病和心脏功能损伤都与心肌生长异常有关,而miRNA表达异常被视为心肌疾病的一个重要标志。miR-208a、miR-208b被认为是心肌特异性miRNA,且miR-208b只在心脏组织特异性表达。miR-208a、miR-208b与心肌纤维形成、心肌缺血、心肌肥厚和心力衰竭都有密切关系,它们可以作为心肌损伤的血清标志物用于临床诊疗[39-41]。此外,miR-1、miR-133等对于心肌的生长发育同样具有重要影响。在心肌细胞中过表达miR-1,能够显著抑制苯肾上腺素所诱发的心肌细胞肥大,进一步研究表明miR-1可能通过负调节双解丝蛋白1(TWF1)的表达参与心肌肥厚的发生过程[42]。在小鼠或果蝇中上调或下调miR-1的表达,小鼠和果蝇的心脏无一例外出现发育畸形[43-44]。鼠的缺血性心脏病伴随着心肌层的miR-1水平显著升高[45]。此外,在氧化应激诱导的心肌细胞凋亡过程中,miR-1发挥了促凋亡作用,而miR-133则抑制凋亡发生[46]。目前,关于miRNA在心脏发育和心肌损伤中的研究主要集中在特异性miRNA上,更多非特异性miRNA的表达和功能还有待进一步的探索。
5 miRNA对动物平滑肌的调控及其机制
平滑肌也称无纹肌,在无脊椎动物躯体肌中广泛分布,也是脊椎动物大部分内脏器官的主要肌纤维类型,其纤维类型和代谢特点与横纹肌(骨骼肌和心肌)有明显的区别。与骨骼肌相比,miRNA对平滑肌生长调控方面的研究还相对匮乏。现有的研究表明,miR-29、miR-145、miR-143等数个miRNA参与了平滑肌特别是血管平滑肌生长发育的调控。miR-145能够抑制胚胎干细胞的自我更新,促进其定向分化。Xu等[47]发现miR-145主要通过抑制细胞核多能性因子八聚体结合转录因子4(OCT4)、SOX2及Kruppel样因子4(KLF4)基因转录表达,促进多能干细胞向血管平滑肌细胞的定向分化,并且OCT4能够抑制miRNA的启动子,它们之间可能存在双向负反馈调节机制。在miR-29缺失的肺远端血管中,血管平滑肌细胞中F-框蛋白32(FBXO32)表达量显著提高,这表明miR-29可能通过调节FBXO32的表达在平滑肌细胞中发挥重要作用[48]。另外,miR-124对肺动脉平滑肌细胞的增殖分化具有显著的调控作用[49]。
6 miRNA与畜禽肌肉生长
目前,在产肉家畜上关于miRNA的研究还十分有限,但是可以肯定的是miRNA与动物肌肉生长和肉质性状关系密切。由于miRNA普遍具有进化上的保守性和功能上的稳定性,不同动物体内miRNA的合成途径都是完全一样的,且miRNA的靶位点也具有高度保守性。例如,肌特异性miR-1几乎在所有脊椎动物上都存在,与肌肉的产生和发育具有密切关系。所以,基于小鼠等模式动物上的机制研究具有一定的外推性。但是,畜牧科研工作者有必要在家畜和家禽上开展更为具体的研究,以期更有针对性的指导动物生产工作。
近年来,一些研究开始关注于猪、鸡和反刍动物上肌肉相关miRNA的表达和功能,但这些研究的主要内容还集中在miRNA表达特征的检测和影响肉质的主要miRNA筛选方面。McDaneld等[50]、Nielsen等[51]和Hou等[52]的研究团队分别使用高通量测序的方法检测并分析了猪骨骼肌中的miRNA在不同生长阶段和不同组织的表达情况,在猪的肌肉组织中鉴定出一批新的miRNA,为进一步研究肌肉miRNA调控作用提供了基础。李虹仪[53]主要比对了不同品种猪的miRNA表达差异,结果发现蓝塘猪和大白猪肌肉组织中miRNA表达相似性达到90%,10个显著差异的miRNA涉及肌肉的生长发育。测序研究表明,山羊的肌肉组织有517个物种间保守的miRNA和2个山羊基因组特有的miRNA,其中306个稳定表达[54]。韩志玲等[55]检测了miR-1、miR-133和miR-24等7个miRNA在绒山羊肌肉中的表达模式,其中miR-1和miR-133具有相似的表达规律,并受到年龄和性别的影响。综合这些试验结果表明品种、性别、生长阶段不同的动物肌肉中的miRNA表达都会有明显差异。此外,阉割会对动物肌肉中miRNA表达产生影响。检测发现公牛和阉牛的肌肉组织有32个miRNA存在显著差异[56]。营养水平和某些营养素的摄入也能够影响动物肌肉生长发育和肌肉中miRNA的表达,例如氨基酸、不饱和脂肪酸、吡啶羧酸铬等[19,57-58]。这些在大动物上开展的研究工作有助于我们更好地理解动物肉品质形成机理和调控机制,并通过遗传改良和营养调控技术手段来改良动物肉品质。
7 小 结
miRNA广泛参与不同生命活动的调节,因此受到越来越多的关注。随着研究技术不断提高,将会有更多涉及肌肉生长发育调控的miRNA及其调控靶位点被发现和确认。研究肌肉组织中miRNA的表达、功能和靶位点以及其对肌肉生长发育的调控作用能够深入揭示肌肉形成的分子调控机制。这些研究工作一方面有助于开发肌肉相关疾病的检测标志物和靶向诊疗药物,另一方面有助于通过遗传改良和营养手段针对性提高动物的肉品质。
参考文献:
[1] CHARGÉ S B P,RUDNICKI M A.Cellular and molecular regulation of muscle regeneration[J].Physiological Reviews,2004,84(1):209-238.
[2] WIGMORE P M,STICKLAND N C.Muscle development in large and small pig fetuses[J].Journal of A-natomy,1983,137(2):235-245.
[3] SABOURIN L A,RUDNICKI M A. The molecular regulation of myogenesis[J].Clinical Genetics,2000,57(1):16-25.
[4] BASKIN K K,WINDERS B R,OLSON E N.Muscle as a“mediator”of systemic metabolism[J].Cell Metabolism,2015,21(2):237-248.
[5] RUDNICKI M A,SCHNEGELSBERG P N J,STEAD R H,et al.MyoD or Myf-5 is required for the formation of skeletal muscle[J].Cell,1993,75(7):1351-1359.
[6] OJIMA K,ICHIMURA E,YASUKAWA Y,et al.Dynamics of myosin replacement in skeletal muscle cells [J]. American Journal of Physiology:Cell Physiology,2015,doi:10.1152/ ajpcell.00170.2015.
[7] AMBROS V.The functions of animal microRNAs[J]. Nature,2004,431(7006):350-355.
[8] BARTEL D P. MicroRNAs:genomics,biogenesis,mechanism,and function[J]. Cell,2004,116(2):281-297.
[9] HUANG Y,ZOU Q,SONG H T,et al. A study of miRNAs targets prediction and experimental validation [J].Protein&Cell,2010,1(11):979-986.
[10] 张雁峰,张锐,宿兵.MicroRNA基因簇的多样性与进化[J].中国科学C辑:生命科学,2009,39(1):114-120.
[11] ZENG Y,YI R,CULLEN B R.MicroRNAs and small interfering RNAs can inhibit mRNA expression by similar mechanisms[J]. Proceedings of the National Academy of Sciences of the United States of America,2003,100(17):9779-9784.
[12] FRIEDMAN R C,FARH K K H,BURGE C B,et al. Most mammalian mRNAs are conserved targets of microRNAs[J]. Genome Research,2009,19(1):92 -105.
[13] BABAK T,ZHANG W,MOEEIS Q,et al. Probing microRNAs with microarrays:tissue specificity and functional inference[J].RNA,2004,10(11):1813-1819.
[14] LIANG Y,RIDZON D,WONG L,et al.Characterization of microRNA expression profiles in normal human tissues[J].BMC Genomics,2007,8:166.
[15] LAGOS-QUINTANA M,RAUHUT R,YALCIN A,et al.Identification of tissue-specific microRNAs from mouse[J].Current Biology,2002,12(9):735-739.
[16] HUANG T H,ZHU M J,LI X Y,et al.Discovery of porcine microRNAs and profiling from skeletal muscle tissues during development[J]. PLoS One,2008,3(9):e3225.
[17] BERNSTEIN E,KIM S Y,CARMELL M A,et al. Dicer is essential for mouse development[J].Nature Genetics,2003,35(3):215-217.
[18] 朱猛进,赵书红.miRNA与肌肉发育[J].猪业科学,2007,24(3):78-80.
[19] 黄志清,陈小玲,余冰,等.MicroRNA在骨骼肌发育中的功能及其表达的营养调控[J].动物营养学报,2011,23(10):1647-1650.
[20] 聂晶.猪不同部位肌肉组织中miRNA的差异表达分析[D].硕士学位论文.雅安:四川农业大学,2012:10-37.
[21] MA J D,WANG H M,LIU R,et al.The miRNA transcriptome directly reflects the physiological and biochemical differences between red,white,and intermediate muscle fiber types[J]. International Journal of Molecular Sciences,2015,16(5):9635-9653.
[22] CHEN J F,MANDEL E M,THOMSON J M,et al. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J].Nature Genetics,2005,38(2):228-233.
[23] CHEN J F,TAO Y Z,LI J,et al.microRNA-1 and microRNA-206 regulate skeletal muscle satellite cell proliferation and differentiation by repressing Pax7[J]. The Journal of Cell Biology,2010,190(5):867-879.
[24] GOLJANEK-WHYSALL K,PAIS H,RATHJEN T,et al.Regulation of multiple target genes by miR-1 and miR-206 is pivotal for C2C12 myoblast differentiation [J].Journal of Cell Science,2012,125(15):3590-3600.
[25] NAKAJIMA N,TAKAHASHI T,KITAMURA R,et al.MicroRNA-1 facilitates skeletal myogenic differentiation without affecting osteoblastic and adipogenic differentiation[J]. Biochemical and Biophysical Research Communications,2006,350(4):1006-1012.
[26] LIU N,BEZPROZVANNAYA S,WILLIAMS A H,et al.MicroRNA-133a regulates cardiomyocyte proliferation and suppresses smooth muscle gene expression in the heart[J].Genes&Development,2008,22(23):3242-3254.
[27] BOUTZ P L,CHAWLA G,STOILOV P,et al. MicroRNAs regulate the expression of the alternative splicing factor nPTB during muscle development[J]. Genes&Development,2007,21(1):71-84.
[28] BOŠTJANCˇICˇE,ZIDAR N,ŠTAJER D,et al. MicroRNAs miR-1,miR-133a,miR-133b and miR-208 are dysregulated in human myocardial infarction[J].Cardiology,2010,115(3):163-169.
[29] KIM H K,LEE Y S,SIVAPRASAD U,et al.Musclespecific microRNA miR-206 promotes muscle differentiation[J].The Journal of Cell Biology,2006,174 (5):677-687.
[30] WINBANKS C E,WANG B,BEYER C,et al.TGF-β regulates miR-206 and miR-29 to control myogenic differentiation through regulation of HDAC4[J].Journal of Biological Chemistry,2011,286(16):13805-13814.
[31] ZHANG J,YING Z Z,TANG Z L,et al.MicroRNA-148a promotes myogenic differentiation by targeting the ROCK1 gene[J].Journal of Biological Chemistry,2012,287(25):21093-21101.
[32] 云青,吴国芳,魏欢,等.miR-143-3p促进C2C12成肌细胞分化[J].中国生物化学与分子生物学报,2013,29(6):569-577.
[33] WEI W,HE H B,ZHANG W Y,et al.MiR-29 targets Akt3 to reduce proliferation and facilitate differentiation of myoblasts in skeletal muscle development[J]. Cell Death and Disease,2013,4(6):e668.
[34] NAGUIBNEVAI,AMEYAR-ZAZOUAM,POLESSKAYA A,et al.The microRNA miR-181 targets the homeobox protein Hox-A11 during mammalian myoblast differentiation[J].Nature Cell Biology,2006,8(3):278-284.
[35] WANG L,CHEN X,ZHENG Y Y,et al.MiR-23a inhibits myogenic differentiation through down regulation of fast myosin heavy chain isoforms[J].Experimental Cell Research,2012,318(18):2324-2334.
[36] WADA S,KATO Y,OKUTSU M,et al.Translational suppression of atrophic regulators by microRNA-23a integrates resistance to skeletal muscle atrophy[J]. Journal of Biological Chemistry,2011,286(44):38456-38465.
[37] SEOK H Y,TATSUGUCHI M,CALLIS T E,et al. MiR-155 inhibits expression of the MEF2A protein to repress skeletal muscle differentiation[J]. Journal of Biological Chemistry,2011,286(41):35339-35346.
[38] 熊燕,王禹,卫宁,等.过表达miR-155抑制C2C12成肌分化[J].生物工程学报,2014,30(2):182-193.
[39] CAI B Z,PAN Z W,LU Y J.The roles of microRNAs in heart diseases:a novel important regulator[J].Current Medicinal Chemistry,2010,17(5):407-411.
[40] OLIVEIRA-CARVALHO V,CARVALHO V O,BOCCHI E A.The emerging role of miR-208a in the heart[J].DNA and Cell Biology,2013,32(1):8-12.
[41] 贺付成,赵雪,高峰,等.急性冠脉综合征患者血浆miR-208b和miR-145的表达水平及临床意义[J].第二军医大学学报,2013,34(1):109-111.
[42] 宋晓伟.MiR-1和miR-199在心肌肥厚中的功能和机制研究[D].硕士学位论文.上海:第二军医大学,2009:3-6.
[43] ZHAO Y,SAMAL E,SRIVASTAVA D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J]. Nature,2005,436(7048):214-220.
[44] KWON C,HAN Z,OLSON E N,et al. MicroRNA1 influences cardiac differentiation in Drosophila and regulates Notch signaling[J].Proceedings of the National Academy of Sciences of the United States of A-merica,2005,102(52):18986-18991.
[45] XU C Q,LU Y J,PAN Z W,et al.The muscle-specific microRNAs miR-1 and miR-133 produce opposing effects on apoptosis by targeting HSP60,HSP70 and caspase-9 in cardiomyocytes[J].Journal of Cell Science,2007,120(17):3045-3052.
[46] LUO X B,LIN H X,PAN Z W,et al.Down-regulation of miR-1/ miR-133 contributes to re-expression of pacemaker channel genes HCN2 and HCN4 in hypertrophic heart[J]. Journal of Biological Chemistry,2008,283(29):20045-20052.
[47] XU N,PAPAGIANNAKOPOULOS T,PAN G J,et al.MicroRNA-145 regulates OCT4,SOX2,and KLF4 and represses pluripotency in human embryonic stem cells[J].Cell,2009,137(4):647-658.
[48] CUSHING L,COSTINEAN S,XU W,et al. Disruption of miR-29 leads to aberrant differentiation of smooth muscle cells selectively associated with distal lung vasculature[J]. PLoS Genetics,2015,11(5):e1005238.
[49] KANG K,PENG X,ZHANG X Y,et al.MicroRNA-124 suppresses the transactivation of nuclear factor of activated T cells by targeting multiple genes and inhibits the proliferation of pulmonary artery smooth muscle cells[J]. Journal of Biological Chemistry,2013,288 (35):25414-25427.
[50] MCDANELD T G,SMITH T P L,DOUMIT M E,et al. MicroRNA transcriptome profiles during swine skeletal muscle development[J]. BMC Genomics,2009,10:77.
[51] NIELSEN M,HANSEN J H,HEDEGAARD J,et al. MicroRNA identity and abundance in porcine skeletalmuscles determined by deep sequencing[J]. Animal Genetics,2010,41(2):159-168.
[52] HOU X H,TANG Z L,LIU H L,et al.Discovery of microRNAs associated with myogenesis by deep sequencing of serial developmental skeletal muscles in pigs[J].PLoS One,2012,7(12):52123.
[53] 李虹仪.猪垂体、肌肉有脂肪miRNA的挖掘及靶向TNF-α miRNA的功能分析[D].博士学位论文.广州:华南农业大学,2012:1-2.
[54] 凌英会,张晓东,王丽娟,等.山羊肌肉组织microRNA Solexa测序与生物信息学分析[J].畜牧兽医学报,2013,44(3):481-487.
[55] 韩志玲,赵德超,付绍印,等.绒山羊骨骼肌miRNAs及其靶基因表达谱分析[J].畜牧兽医学报,2012, 43(10):1539-1546.
[56] 夏广军.MiRNA与功能基因转录组联合分析筛选延边黄牛肉质性状候选基因[D].博士学位论文.延吉:延边大学,2014:3-8.
[57] 潘英姿,吕新慧,黄春晓,等.吡啶羧酸铬对肉鸡miRNA的表达研究[J].畜牧与兽医,2012,44(增刊):117-118.
(责任编辑菅景颖)
[58] DRUMMOND M J,GLYNN E L,FRY C S,et al.Essential amino acids increase microRNA-499,-208b,and -23a and downregulate myostatin and myocyte enhancer factor 2C mRNA expression in human skeletal muscle[J].The Journal of Nutrition,2009,139(12):2279-2284.
Expression Patterns and Regulation Mechanisms of MicroRNAs Relate in Growth and Development of Muscle in Animals
WANG Jing1WANG Qi1HUANG Jinxiu1,2QI Renli1,2∗
(1. Chongqing Academy of Animal Science,Rongchang 402460,China;2. The Key Laboratory of Pig Industry Sciences,Ministry of Agriculture,Rongchang 402460,China)
Abstract:MicroRNAs(miRNA),a kind of non-coding small RNA,extensively exists in a variety of organisms. MiRNA is able to participate in almost all life events through regulating expression of various target genes. Growth and development of muscle in animals is a complex process,which is controlled by numerous regulatory factors. This review summarized the expression patterns and regulation mechanisms of miRNA,especially several muscle-specific miRNA,in the growth and development of muscle in animals.[Chinese Journal of Animal Nutrition,2016,28(3):687-694]
Key words:micorRNAs;muscle;muscle cell;muscle-specific miRNA
Corresponding author∗,assistant professor,E-mail:qirenli1982 @163.com
通信作者:∗齐仁立,助理研究员,E-mail:qirenli1982@163.com
作者简介:王 敬(1990—),女,重庆人,研究实习员,研究方向为动物肌肉发育调控。E-mail:1962680788@qq.com
基金项目:国家973资金资助项目(2012CB124702);重庆市畜牧科学院基本科研业务费(14441)
收稿日期:2015-09-29
doi:10.3969/ j.issn.1006-267x.2016.03.008
中图分类号:S828
文献标识码:A
文章编号:1006-267X(2016)03-0687-08
