高同型半胱氨酸血症对大鼠颈总动脉平滑肌细胞增殖及Caspase-12蛋白表达的影响
2016-03-02范茂丹史承勇
周 磊,范茂丹,史承勇
·论著·
高同型半胱氨酸血症对大鼠颈总动脉平滑肌细胞增殖及Caspase-12蛋白表达的影响
周磊1,范茂丹1,史承勇2
[摘要]目的研究高同型半胱氨酸血症对大鼠颈总动脉平滑肌细胞增殖及Caspase-12蛋白表达的影响。方法选取雄性SD大鼠40只,随机数字表法分为4组,每组10只。分别以不同剂量蛋氨酸饮食喂饲12周后分离颈总动脉。HE染色观察颈总动脉增殖情况;利用免疫荧光染色法观察并测定颈总动脉内增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)表达情况;利用免疫组织化学染色法及蛋白免疫印迹法检测Caspase-12蛋白表达情况。结果不同剂量蛋氨酸饮食导致大鼠颈总动脉不同程度增殖,颈总动脉内PCNA、Caspase-12蛋白表达增加,并呈浓度依赖性。结论高同型半胱氨酸血症通过激活血管平滑肌细胞内质网应激反应导致Caspase-12蛋白表达增加,加重血管损伤,促进平滑肌细胞增殖,进一步加重动脉粥样硬化。
[关键词]同型半胱氨酸;平滑肌细胞;动脉粥样硬化;Caspase-12
作者单位:1. 310002浙江杭州,南京军区杭州疗养院海勤疗养区干部疗养科;2. 310013浙江杭州,解放军117医院心血管内科
引用格式:周磊,范茂丹,史承勇.高同型半胱氨酸血症对大鼠颈总动脉平滑肌细胞增殖及Caspase-12蛋白表达的影响[J].东南国防医药,2016,18(1):21-24,46.
同型半胱氨酸(homocysteine, Hcy)是体内正常蛋氨酸循环产生的中间产物[1]。高同型半胱氨酸血症(hyperhomocystinemia, HHcy)是各种原因导致的蛋氨酸循环障碍,造成血浆中的Hcy水平>15 μmol/L[2]。近年来,大量研究发现,Hcy是一种反应性血管损伤氨基酸,HHcy与动脉粥样硬化的形成发展密切相关[3]。血管平滑肌细胞的凋亡及异常增殖是动脉粥样硬化形成的重要病理特征及主要发病过程。因此,本研究中利用喂饲SD大鼠不同剂量高蛋氨酸饮食建立高同型半胱氨酸血症模型。在同一时间、同等条件下,利用免疫荧光染色法测定颈总动脉内增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)表达情况,评估颈总动脉平滑肌细胞增殖状态;利用免疫组织化学染色法及蛋白免疫印迹法检测Caspase-12蛋白表达情况,旨在明确HHcy对颈总动脉平滑肌细胞增殖的影响,为探究HHcy引起动脉粥样硬化的发病机制提供线索。
1材料与方法
1.1实验材料实验动物:成年雄性SD大鼠40只,体质量(150±28)g,购于第二军医大学实验动物中心,动物许可证号:SYXK(沪)2012-0003。建模过程中SD大鼠均清洁级饲养,定时喂食、喂水,室温维持在22~24 ℃,每日8~22时光照。
实验试剂: Dako Denmark A/S抗兔/鼠通用型免疫组化试剂盒、PCNA抗体(购于上海谷歌生物有限公司),Caspase-12抗体(购于美国Biovision公司),BSA(购于Roche公司),肝素、水合氯醛、多聚甲醛、1%盐酸酒精、PBS液等。
1.2高同型半胱氨酸血症模型的建立及Hcy浓度的测定随机数字表法将40只SD大鼠分为4组,每组10只,各组大鼠鼠龄、体重均无显著差异(P>0.05)。各组大鼠分别以不同剂量蛋氨酸饮食喂饲。对照组喂饲常规普通饲料,2%蛋氨酸组喂饲含2%蛋氨酸的高蛋氨酸饲料,4%蛋氨酸组喂饲含4%蛋氨酸的高蛋氨酸饲料,6%蛋氨酸组喂饲含6%蛋氨酸的高蛋氨酸饲料。各组大鼠分别于喂饲8、10、12周时抽取静脉血,抗凝管收集,应用美国贝克曼库尔特AU 680型全自动生化分析仪检测血浆Hcy浓度,计算3次测量值的平均值代表各组实验动物的血浆Hcy浓度。
1.3颈总动脉取材各组大鼠建模12周后取材:水合氯醛麻醉成功后将大鼠固定在操作台上,常规备皮、消毒。取颈正中切口,钝性分离皮下组织,暴露气管,游离血管鞘,分离与左颈总动脉伴行的迷走神经,以动脉夹孤立颈总动脉后剪下。用含肝素的生理盐水冲洗3遍,将分离的颈总动脉以4%多聚甲醛固定24 h后常规石蜡切片。
1.4HE染色观察颈总动脉增殖将已固定并包埋的颈总动脉石蜡切片脱蜡,苏木素染色5 min,流水冲洗后以1%盐酸酒精分化30 s,分化满意后流水冲洗。1%氨水溶液返蓝30 s,满意后伊红染色3 min,充分脱水后中性树胶封片。
1.5免疫荧光染色法测定PCNA表达将已固定并包埋的颈总动脉血管组织石蜡切片放入65 ℃的烘箱中烘片脱蜡,PBS液冲洗后置于EDTA缓冲液中微波修复,冷却后置入3%过氧化氢溶液,室温孵育10 min后5% BSA封闭20 min,滴加1:200稀释的兔源抗鼠PCNA单克隆抗体,4 ℃过夜,次日PBS液洗净后,每张切片中加100 μL荧光素标记驴抗兔IgG(Donkey Anti-rabbit/FITC抗体),避光室温下孵育1 h,PBS液洗净后,每张切片中加入100 μL DAPI,避光细胞核染色5 min,用抗荧光淬灭封片剂封片,4 ℃下避光保存,用Bio-Red Radiance 2100型激光扫描共聚焦显微镜操作系统,氩离子激光系统扫描FITC标记的阳性反应物,阳性反应物经Laser Sharp2000软件摄像分析。
1.6免疫组织化学染色法检测Caspase-12蛋白表达将已固定并包埋的颈总动脉石蜡切片脱蜡至水洗,链霉亲和素-生物素-过氧化物酶免疫组织化学方法(SABC)检测Caspase-12蛋白,兔源抗鼠Caspase-12多克隆抗体用5%BSA抗体稀释液按1∶100稀释,4 ℃过夜;二抗用5%BSA抗体稀释液按1∶2000稀释,DAB显色后复染、脱水、透明、封片。在光镜下观察Caspase-12蛋白阳性颗粒。
1.7蛋白免疫印迹法检测Caspase-12蛋白表达将备用的颈总动脉血管组织液氮预冷后研磨成粉,含1%蛋白酶抑制剂的组织裂解液裂解,12 000 r/min离心并收集总蛋白提取液,经转膜、封闭、浸泡、摇床,加入兔源抗鼠Caspase-12多克隆抗体(用5%BSA抗体稀释液按1∶1000稀释)后4 ℃过夜,二抗(用5%BSA抗体稀释液按1∶1000稀释)摇床杂交2 h,加显色剂避光显色5 min,终止反应。将胶片扫描、存档,凝胶成像分析仪分析处理,以β-actin作为内参,以Caspase-12/β-actin积分光密度值的比值表示Caspase-12蛋白相对表达水平。

2结果
2.1各实验组血浆Hcy浓度各实验组分别于喂饲8、10、12周时抽取静脉血检测Hcy浓度,结果提示在不同剂量高蛋氨酸饮食喂饲12周后,2%、4%及6%蛋氨酸组大鼠分别出现不同程度的高同型半胱氨酸血症,见表1。
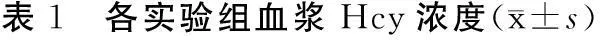

组别nHcy浓度(μmol/L)对照组207.22±1.202%蛋氨酸组1017.23±3.25*4%蛋氨酸组1022.45±1.65*6%蛋氨酸组1027.32±3.02* 注:与对照组比较,*P<0.05

A:对照组;B:2%蛋氨酸组;C:4%蛋氨酸组;D:6%蛋氨酸组图1 各组颈总动脉结构(HE ×200)
2.2高同型半胱酸血症对大鼠颈总动脉血管形态学的影响对照组大鼠颈总动脉壁各层结构完整,内膜光滑,中膜血管平滑肌细胞排列整齐有序。2%蛋氨酸组、4%蛋氨酸组及6%蛋氨酸组大鼠颈总动脉内膜增厚,内膜中平滑肌细胞出现不同程度的增殖,见图1。
2.3高同型半胱酸血症对大鼠颈总动脉血管壁PCNA表达的影响FITC免疫荧光染色后,颈总动脉中的PCNA呈现绿色信号。对照组大鼠颈总动脉内PCNA绿色信号较少,2%、4%、6%蛋氨酸组大鼠颈总动脉内PCNA绿色信号较对照组明显增多,6%蛋氨酸组中PCNA绿色信号最多,见图2。免疫荧光染色后,各组随机选取10张图片经Laser Sharp2000软件分析后,行荧光强度测定和PCNA阳性细胞计数,结果见表2。

表2 各组颈总动脉血管壁PCNA表达荧光强度

A:对照组;B:2%蛋氨酸组;C:4%蛋氨酸组;D:6%蛋氨酸组图2 各组颈总动脉血管壁PCNA表达(FITC ×200)

A:对照组;B:2%蛋氨酸组;C:4%蛋氨酸组;D:6%蛋氨酸组图3 免疫组织化学染色法检测Caspase-12蛋白(SABC ×400)
2.4高同型半胱酸血症对大鼠颈总动脉血管壁Caspase-12蛋白表达的影响免疫组织化学染色后,Caspase-12蛋白呈棕黄色颗粒,光镜下观察各组颈总动脉血管组织切片发现, 对照组大鼠颈总动脉血管组织中Caspase-12蛋白阳性颗粒较2%蛋氨酸组、4%蛋氨酸组及6%蛋氨酸组稀疏,染色较淡,6%蛋氨酸组中颈总动脉血管组织中Caspase-12蛋白阳性颗粒最为致密,且染色较深,见图3。
Western blot检测各组颈总动脉内Caspase-12蛋白表达情况,结果发现,2%、4%、6%蛋氨酸组Caspase-12蛋白表达较对照组明显增多,6%蛋氨酸组中Caspase-12蛋白表达最多,并且与Hcy呈浓度依赖性(P<0.05),见图4。
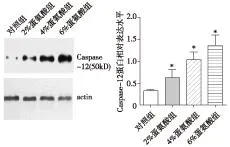
与对照组比较,*P<0.05图4 Western blot检测Caspase-12蛋白结果及表达
3讨论
高同型半胱氨酸血症是以血浆Hcy水平异常增高为特征的病理状态[4-5],是动脉粥样硬化形成前的亚临床状态。异常增高的Hcy是引起动脉粥样硬化的新的、独立的、重要的危险因素[6-7],可以视为高血压、高血糖、脂代谢异常、吸烟等传统危险因素之外的心血管病剩留危险因素。目前,Hcy对血管平滑肌细胞增殖的影响的实验研究主要基于离体实验,而离体细胞培养不能完全复制Hcy在体内的代谢及病理生理过程。本研究中,笔者利用喂饲高蛋氨酸饮食的方法,使2%蛋氨酸组、4%蛋氨酸组及6%蛋氨酸组大鼠在不同剂量高蛋氨酸饮食喂饲12周后,血浆中Hcy水平均处于不同程度高水平状态(均>15 μmol/L),因此,可以视为较理想、可靠的高同型半胱氨酸血症动物模型。
周宪梁等[8]的研究发现,Hcy能够促进平滑肌细胞cyclin D1的mRNA表达增加,通过细胞周期调控蛋白诱导平滑肌细胞进入分裂期,促进平滑肌细胞增殖,这与本研究的结果相似。本研究中,2%、4%及6%蛋氨酸组大鼠颈总动脉中PCNA表达较对照组明显增多,提示Hcy对血管平滑肌细胞具有明显的增殖效应。同时还发现,随着Hcy水平升高,PCNA的表达也相应增多,说明Hcy并呈浓度依赖性刺激平滑肌细胞增殖。
血管平滑肌细胞的凋亡及异常增殖是动脉粥样硬化形成的重要病理特征及主要发病过程。Caspase家族蛋白是一组半胱氨酸天冬氨酸蛋白酶,参与多种凋亡途径介导的细胞凋亡[9-11]。Caspase-12蛋白定位于细胞内质网外膜,是介导内质网应激反应凋亡的关键酶,参与内质网应激反应特有的凋亡途径[12-13]。有研究发现,Caspase-12过表达参与动脉粥样硬化、糖尿病肾病、肝纤维化等多种疾病的发病过程[14-15]。本研究中,Caspase-12蛋白在各实验组中均有表达,2%、4%及6%蛋氨酸组中Caspase-12蛋白表达水平较对照组明显升高。此外,Western blot结果发现,2%、4%及6%蛋氨酸组中Caspase-12蛋白表达水平较对照组明显升高,并且与Hcy呈浓度依赖性。以上实验从细胞水平及分子水平均证明了Caspase-12蛋白表达升高与血浆Hcy水平升高有关,并且与Hcy呈浓度依赖性。目前国内外亦有研究发现,各种原因诱发的短时间的内质网应激反应具有维持细胞稳态,促使细胞生存的作用[16]。过强的内质网应激反应超过自身调节能力,会引起细胞功能紊乱,最终导致细胞凋亡及异常增殖[17]。本研究结果提示长时间高浓度的Hcy刺激可能造成Caspase-12蛋白表达增加,破坏细胞稳态,导致血管平滑肌细胞凋亡及异常增殖。
综上所述,本实验提示Caspase-12蛋白可能参与了HHcy引起的动脉粥样硬化,Hcy可能激活细胞内质网应激反应,造成Caspase-12蛋白表达增加,进一步激活下游Caspase凋亡蛋白酶级联反应,启动平滑肌细胞凋亡,持续长时间的内质网应激反应最终造成细胞功能紊乱,加速细胞凋亡,使血管平滑肌细胞异常增殖,最终参与并促进动脉粥样硬化的发生发展。Caspase-12蛋白参与的内质网应激反应是Hcy导致动脉粥样硬化可能的机制之一。
【参考文献】
[1]中国高血压防治指南修订委员会. 中国高血压防治指南2010 [J]. 中国医学前沿杂志(电子版), 2011, 3(5): 42-93.
[2]王拥军, 刘力生, 饶克勤, 等. 我国脑卒中预防策略思考:同时控制高血压和高同型半胱氨酸水平[J]. 中华医学杂志,2008, 88(47): 3316-3318.
[3]李烨, 宁清秀, 郭红阳, 等. 同型半胱氨酸与冠心病合并2型糖尿病患者心功能的相关性分析[J]. 中华保健医学杂志, 2013, 15(1): 34-36.
[4]李萍, 裴颖皓, 宫剑滨. 高同型半胱氨酸血症对原发性高血压患者左室重构的影响[J]. 东南国防医药, 2014, 16(3): 253-256.
[5]Zhong J, Wang J, Wang X, et a1. Significance of CAVI, hs-CRP and homocysteine in subclinical arteriosclerosis among a healthy population in China [J].Clin Invest Med, 2013, 36 (2): 81-86.
[6]Schaffer A., Verdoia M, Cassetti E, et al. Relationship between homocysteine and coronary artery disease. Results from a large prospective cohort study[J]. Thromb Res, 2014, 134(2): 288-293.
[7]吴平, 全亚萍, 陈顺中. 2型糖尿病患者脑梗死与同型半胱氨酸的相关性研究[J]. 东南国防医药, 2013, 15(6): 559-591.
[8]周宪梁, 惠汝太, 刘力生, 等. 同型半胱氨酸对大鼠主动脉平滑肌细胞增殖及[J]. 中国分子心脏病学杂志, 2004, 4(4): 235-237.
[9]De MS, Candelaresi C, Agostinelli L, et al. Endoplasmic reticulum stress induces hepatic stellate cell apoptosis and contributes to fibrosis resolution[J]. Liver Int,2012,32(10):1574-1584.
[10]Liu Y, Wang J, Qi S Y, et al. Reduced endoplasmic reticulum stress might alter the course of heart failure via Caspase-12 and JNK pathways[J]. Can J Cardiol, 2014, 30(3):368-375.
[11]Lee HJ, Lee SH, Park SH, et al. Purification of catalytically active Caspase-12 and its biochemical characterization[J].Arch Biochem Biophys,2010,502(1):68-73.
[12]Xiao YJ, Huang W, Zhang JZ, et al. Increased plasma S-adenosylhomocysteine-accelerated atherosclerosis is associated with epigenetic regulation of endoplasmic reticulum stress in apoE-/-mice[J]. Arterioscler Thromb Vasc Biol, 2015, 35(1): 60-70.
[13]Shohei S, Tsuyoshi C, Koichi K, et al. A deficiency of Herp, an endoplasmic reticulum stress protein, suppresses atherosclerosis in ApoE knockout mice by attenuating inflammatory responses[J]. PLoS One, 2013, 8(10): e75249.
[14]曹延萍, 郝咏梅, 刘青娟, 等. 内质网应激及其特有凋亡途径Caspase-12与糖尿病大鼠肾组织固有细胞凋亡之间的关系[J]. 中国应用生理学杂志, 2011, 27(2): 236-240.
[15]Cameron SM, Anna JB, Mohammad IK, et al. Endoplasmic reticulum stress and glycogen synthase kinase-3β activation in apolipoprotein E-deficient mouse models of accelerated atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2012, 32(1): 82-91.
[16]Tabas I. The role of endoplasmic reticulum stress in the progression of atherosclerosis[J]. Circ Res, 2010, 107(7): 839-850.
[17]Hotamisligils SH. Endoplasmic reticulum stress and atherosclerosis[J]. Nat Med, 2010, 16(4): 396-399.
(本文编辑:齐名;英文编辑:王建东)
Effect ofhyperhomocystinemia on the proliferation of rats common carotid artery vascular smooth muscle cells and expression of Caspase-12
ZHOULei1,FANMao-dan1,SHICheng-yong2
.1.DepartmentofConvalescent,NavalLogisticsBranchofHangzhouSanatorium,NanjingMilitaryCommand,Hangzhou,Zhejiang310002,China;2.DepartmentofCardiology, 117HospitalofPLA,Hangzhou,Zhejiang310013,China
[Abstract]ObjectiveTo test the effect of hyperhomocystinemia on the proliferation of rats carotid artery vascular smooth muscle cells and the expression of Caspase-12. MethodsForty male SD rats were divided into four groups randomly. The common carotid artery were separated after feeding with high methionine foods for three months and taken to HE staining for observing the proliferation of carotid arteries. The expression of proliferating cell nuclear antigen (PCNA) was detected by immunofluorescence staining. The expression of Caspase-12 was tested by immunohistochemistry and Western blot. ResultsDifferent levels of methionine in the diet leaded to varying degrees of proliferation of common carotid artery smooth muscle cells and increased expression of PCNA and Caspase-12 in a dose-dependent manner. ConclusionHyperhomocysteinemia can lead to increased expression of Caspase-12, which aggravates vascular injury through activation of endoplasmic reticulum stress response, promotes smooth muscle cell proliferation and further leads to atherosclerosis.
[Key words]homocysteine; smooth muscle cell; atherosclerosis; Caspase-12
(收稿日期:2015-08-24;修回日期:2015-10-19)
通讯作者:史承勇,E-mail:3177318463@qq.com
[中图分类号]R543
[文献标志码]A
doi:10.3969/j.issn.1672-271X.2016.01.006
