还原氧化石墨烯-硫化铜纳米复合材料的制备及在癌症热疗中的应用
2016-02-17孔祥权容建华
孔祥权, 严 刚, 邝 淼, 容建华
(暨南大学材料科学与工程系, 广州 510632)
还原氧化石墨烯-硫化铜纳米复合材料的制备及在癌症热疗中的应用
孔祥权, 严刚, 邝淼, 容建华
(暨南大学材料科学与工程系, 广州 510632)
摘要通过一步水热法制备了一种具有光热性能的纳米复合材料——还原氧化石墨烯-硫化铜(rGO-CuS), 利用傅里叶变换红外光谱、拉曼光谱、紫外-可见光谱及高分辨透射电子显微镜对所合成纳米复合物的结构和形貌进行了表征, 并通过细胞实验和动物实验考察其癌症热疗效果. 结果表明, 与未复合的氧化石墨烯(GO)和硫化铜相比, rGO-CuS在近红外光区域具有更高效的光热转换效率; rGO-CuS的光热治疗效果明显好于GO和CuS.
关键词氧化石墨烯; 硫化铜; 纳米复合材料; 光热治疗; 癌细胞
传统的癌症治疗手段主要包括手术治疗、化学治疗(简称化疗)和放射治疗(简称放疗). 手术治疗只能针对早期癌细胞尚未转移的患者; 化疗对于癌细胞和正常细胞缺乏选择性杀灭作用; 放疗只能针对未分化的肿瘤, 且辐射具有较大毒副作用. 由于手术治疗通常无法根治已有肿瘤转移的晚期病人, 放疗和化疗对病人的二次伤害又很大[1], 因此, 特异性地杀死肿瘤细胞而不损伤正常的人体细胞是目前肿瘤治疗的难点. 光热治疗(PTT)作为较安全的新型肿瘤治疗方法受到了广泛关注[2,3]. PTT是指利用纳米材料的光热转化效应, 在近红外激光作用下局部加热肿瘤部位, 从而杀死肿瘤细胞的治疗方法. PTT需要具备近红外光和光热材料两大条件. 近红外光被称为人体的光学窗口, 组织穿透性强, 能穿透深层组织, 到达生物体很多部位, 从而可以充分发挥治疗作用; 由于它具有较低的组织吸收率, 所以对正常组织只有较低的杀伤性, 因此近红外光是肿瘤光热治疗最理想的光源. 光热材料对近红外光有高强吸收, 并能将吸收的光能转化成热量释放出来.
能够用于光热治疗的纳米材料主要有碳纳米材料[氧化石墨烯(GO)[4,5]、还原氧化石墨烯(rGO)[6]、碳纳米管[7,8]]、贵金属纳米颗粒(金纳米棒[ 9~11 ]、金纳米壳[12,13]、金纳米笼[14,15]等)、半导体纳米颗粒(硫化铜[3,16]、硒化铜[17]等)以及聚合物纳米颗粒[18]等. 2011年, Tian等[3]发现硫化铜能够在 808 nm 激光的照射下杀死癌细胞. 这种新型的肿瘤热疗材料具有廉价、生物相容性好的特点. 但是由于硫化铜的光热转化效率较低, 需要使用高功率的激光(24 W/cm2)才能有效地升温并杀死细胞, 这样高功率的激光对皮肤和正常细胞都会造成较大伤害. 因此, 提高硫化铜体系的光热转化效率成为该研究领域的一个难点.
本文利用一步水热法制备了兼具良好生物相容性和良好光热转换特性的纳米复合材料——还氧化石墨烯-硫化铜(rGO-CuS), 考察了材料在功率密度为1 W/cm2、波长为980 nm的近红外激光照射下的升温速率和癌症热疗效果.
1实验部分
1.1试剂与仪器
天然石墨粉(325目), 上海碳素厂; 盐酸(质量分数37%)、硫酸(质量分数98%)、高锰酸钾(纯度99%)、亚硝酸钠(纯度99%)、过氧化氢(质量分数30%)和氨水(质量分数28%), 广州化学试剂公司; 聚乙烯吡咯烷酮(PVP, 分析纯,Mw=30000)、硫化钠(纯度98%)、氯化铜(纯度98%)和中性红, 阿拉丁试剂有限公司; 其它试剂均为分析纯. 实验用水为去离子纯水.
Cary5000型紫外-可见光谱仪(UV-Vis, 美国Varian公司); JEM-2100型透射电子显微镜(HRTEM, 日本JEOL公司); RM2000型显微共焦拉曼光谱仪(英国Renishaw公司); Spectrum One 傅里叶变换红外光谱仪(FTIR, 美国 Perkin-Elmer公司); 功率可调 980 nm 激光器(中国科学院半导体研究所); HT-830 型非接触式红外线测温仪(广州市宏诚集业电子科技有限公司); CK X41型荧光显微镜(日本Olympus公司).
1.2硫化铜纳米片的制备
硫化铜纳米片参考文献[3]方法制备. 具体步骤如下: 向10 mL去离子水中加入2 g PVP, 搅拌均匀后, 加入一定量的氯化铜(0.5 mmol/L), 继续搅拌. 将10 mL配制好的硫化钠溶液(1.5 mmol/L)加入到上述溶液中, 搅拌均匀后, 将反应液转移到50 mL不锈钢水热反应釜(内衬为聚四氟乙烯)中, 放入烘箱于180 ℃反应12 h. 待反应液冷却至室温后, 在10000 r/min转速下离心, 洗涤, 以除去多余的表面活性剂, 最后将产品重新分散于去离子水中, 得到绿色的CuS分散液.
1.3rGO-CuS复合材料的制备
氧化石墨烯采用改进的 Hummers法制备[19]. 将制得的GO 超声处理(600 W)2 h, 再离心(转速10000 r/min)去除大片的GO, 获得平面粒径小于500 nm 的单层结构, 浓度约为0.5 mg/mL. 将 2 g PVP 分散到10 mL GO分散液中, 搅拌均匀, 后续操作与CuS的制备过程相同. 最后得到墨绿色的rGO-CuS分散液.
1.4细胞实验
将HeLa细胞分别在含有相同浓度的 GO, CuS 和rGO-CuS 的培养基中培养4 h后, 用磷酸盐缓冲液(PBS)润洗除去未被细胞摄取的纳米材料, 再加入新鲜的培养基继续培养2 h, 使材料能完全进入到细胞内部. 在980 nm激光下照射5 min(功率密度1 W/cm2)后, 用中性红对活细胞进行染色.
1.5动物实验
将大小为1 mm3的移植瘤组织植入20只裸鼠背部皮下, 待肿瘤长至约6 mm3时将裸鼠随机分成5组: 空白对照组、rGO-CuS组、GO+laser组、CuS+laser组和rGO-CuS+laser组, 每组4只. 进行瘤内注射时, 每组瘤内多点注射50 μL相应药液(1 mg/mL). 其中GO+laser组、CuS+laser组和rGO-CuS+laser组用980 nm 激光(功率 1 W/cm2)照射肿瘤部位 5 min. 观察22 d.
2结果与讨论
2.1rGO-CuS纳米复合材料的制备
Scheme 1为rGO-CuS形成过程示意图. 向GO分散液中加入CuCl2后, 由于GO表面带有大量负电荷和含氧活性基团, Cu2+可以通过静电作用吸附到GO表面. 加入Na2S作为硫源, 在180 ℃水热条件下, Cu2+和S2-在GO表面反应生成微小的纳米晶, 随着反应时间的延长, 纳米晶逐渐长大成纳米片. 在制备过程中所加的PVP在整个过程中起到调节、控制颗粒大小和稳定颗粒的作用[3]. 这种基于静电吸附的方法可以使CuS牢固地生长在GO的表面, 最终实现rGO-CuS的合成.

Scheme 1 Schematic illustration of the synthesis of rGO-CuS
2.2rGO-CuS纳米复合材料的结构与形貌表征
图1(A)为利用水热法在不添加GO时制备的CuS纳米片的HRTEM照片. 从图中可以清楚地观察到CuS呈不规则的多边形片状结构, 粒径为20~100 nm, 纳米片的粒径分布较宽且形状各异, 与文献[3,16]中颗粒状的或花瓣状的CuS相同. 图1(B)和(C)分别为在含有GO的反应液中形成的rGO-CuS的TEM和HRTEM照片. 可见, 在含有GO的反应液中, CuS纳米片可以成功生长在石墨烯的表面, 其颗粒大小更均匀, 约40~50 nm, 且多为四边形.
由图1(D)可以明显看出CuS的晶格条纹, CuS晶片的晶面间距为0.190 nm, 对应的是CuS的(110)晶面. 通过CuS纳米的快速傅里叶变换图[FFT, 图1(D)插图]可以观察到清晰的衍射斑点, 进一步证明了CuS 的单晶结构.

Fig.1 TEM images of CuS(A) and rGO-CuS(B), HRTEM images of rGO-CuS at different magnifications(C, D) Inset in (D) shows the FFT pattern of rGO-CuS.
由图2可以看到, rGO-CuS的部分衍射峰与硫化铜标准卡片(JCPDS No.65-3929)一致, 产物的晶格参数为a=b=0.3760 nm,c=1.6200 nm. 部分衍射峰强度不高, 有杂峰, 是由于水热反应时间和PVP浓度的影响所导致. 通过以上分析可以确定已经制备出rGO-CuS复合材料.
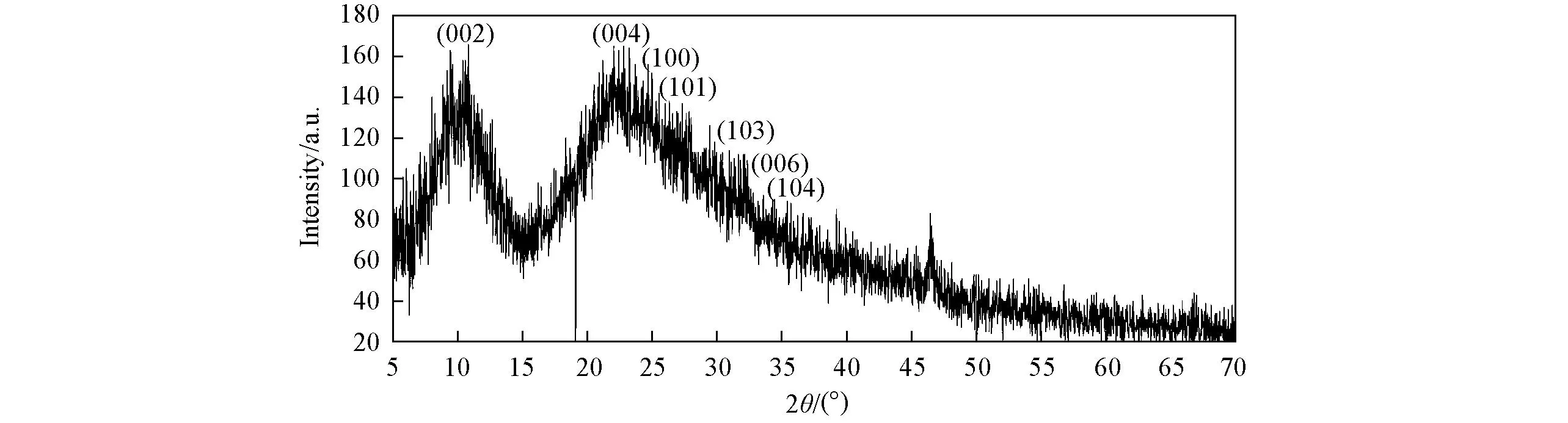
Fig.2 XRD pattern of rGO-CuS nanoparticles
图3(A)中GO与rGO-CuS 的拉曼光谱图都显示出碳材料典型的 D 峰和G峰, 分别位于1350和1600 cm-1. D峰和G峰面积的比值(ID/IG)是反映石墨烯还原程度的重要参数. rGO-CuS的ID/IG值为 1.15, 而未经过水热处理的GO的ID/IG值为0.95, 这说明在水热过程中, GO已经被部分还原成rGO[19]. 相对于GO, rGO在近红外区的吸收得到明显增强, 光热转化的效率也更高, 已被证实能够更高效地杀死肿瘤细胞[6].

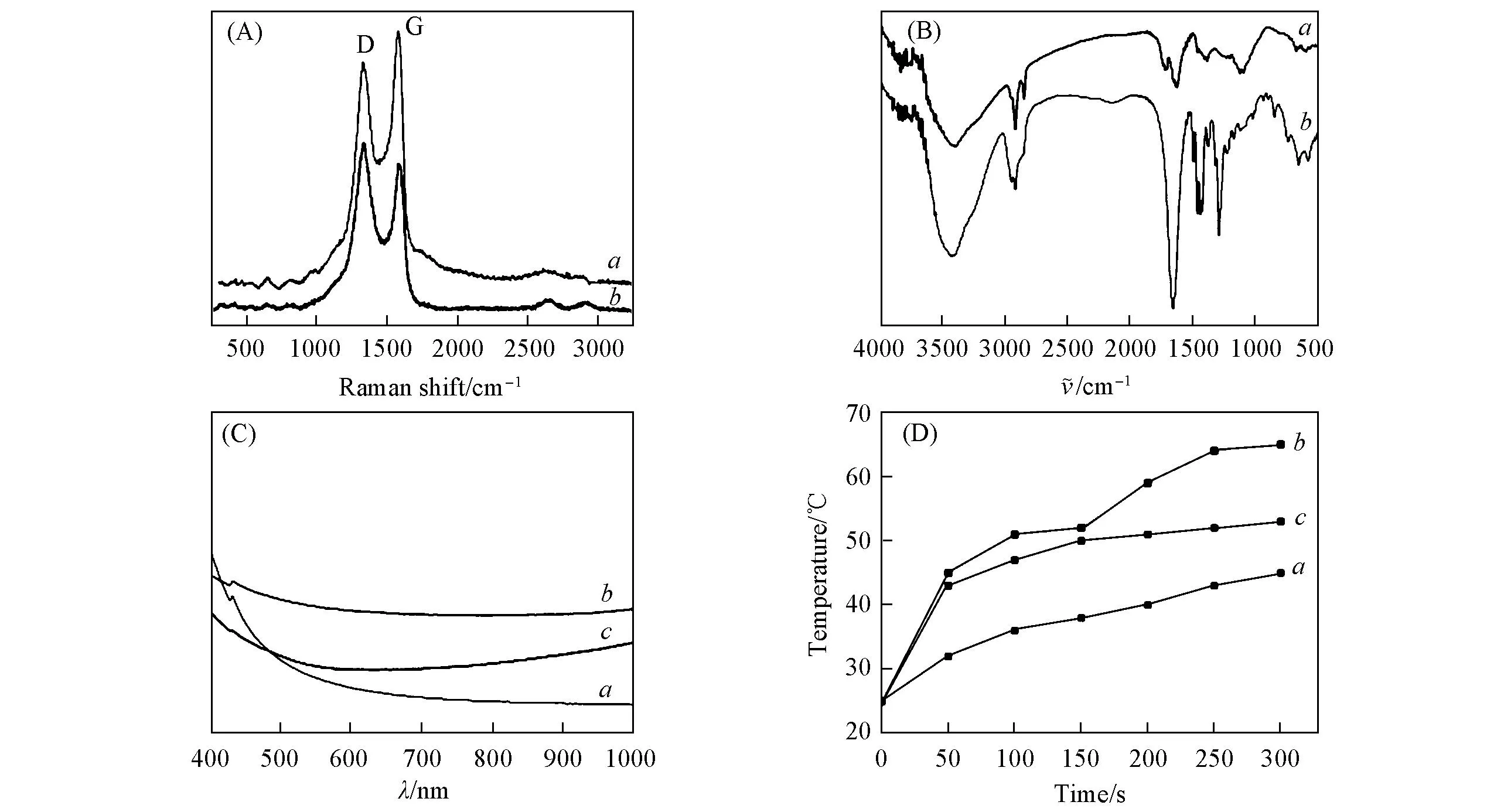
Fig.3 Raman(A), FTIR(B), UV-Vis-NIR(C) spectra and photothermal heating curves(D) of GO(a), rGO-CuS(b) and CuS(c) (D) The samples were dispersed in 200 μL of water respectively with a concentration of 1 mg/mL.
图3(C)是浓度均为1 mg/mL的CuS和rGO-CuS水分散液的紫外-可见-近红外吸收光谱图. 可见, rGO-CuS纳米复合材料在整个光谱区(400~1100 nm)的吸收值都明显高于CuS, 其在980 nm的吸收值是CuS的1.5倍. rGO-CuS 在近红外区的强吸收特性预示其能更有效地将近红外光转换成热量而用于光热治疗.
测试了相同浓度 GO, CuS 和 rGO-CuS 在近红外光照射下的升温速率, 结果如图3(D)所示. 可见, 在功率密度1 W/cm2的980 nm 激光照射下, 5 min后GO水溶液温度升至42 ℃, 相比其它2个样品, 温度上升幅度最低, 这与GO在近红外区的吸收较弱相一致. CuS 的升温效应比较明显, 光照5 min后温度能升至约50 ℃; rGO-CuS的升温效果更明显, 光照5 min后温度能升高到65 ℃. rGO-CuS良好的升温效率是由于其在近红外区光的吸收更高, 可以把更多的光能转化为热能.
2.3细胞毒性分析
为了评估GO, CuS和rGO-CuS作为光热材料的可行性, 采用MC3T3细胞测试了3种材料的细胞毒性. 图4为分别采用浓度为50, 100和200 μg/mL的GO, CuS, rGO-CuS培养基培养后MC3T3细胞存活率的实验结果.
由图4可知, 3种材料对MC3T3细胞均无毒性, 即使浓度高达200 μg/mL的材料与细胞培养后, 细胞的存活率仍高于100%, 符合材料无毒性的标准.
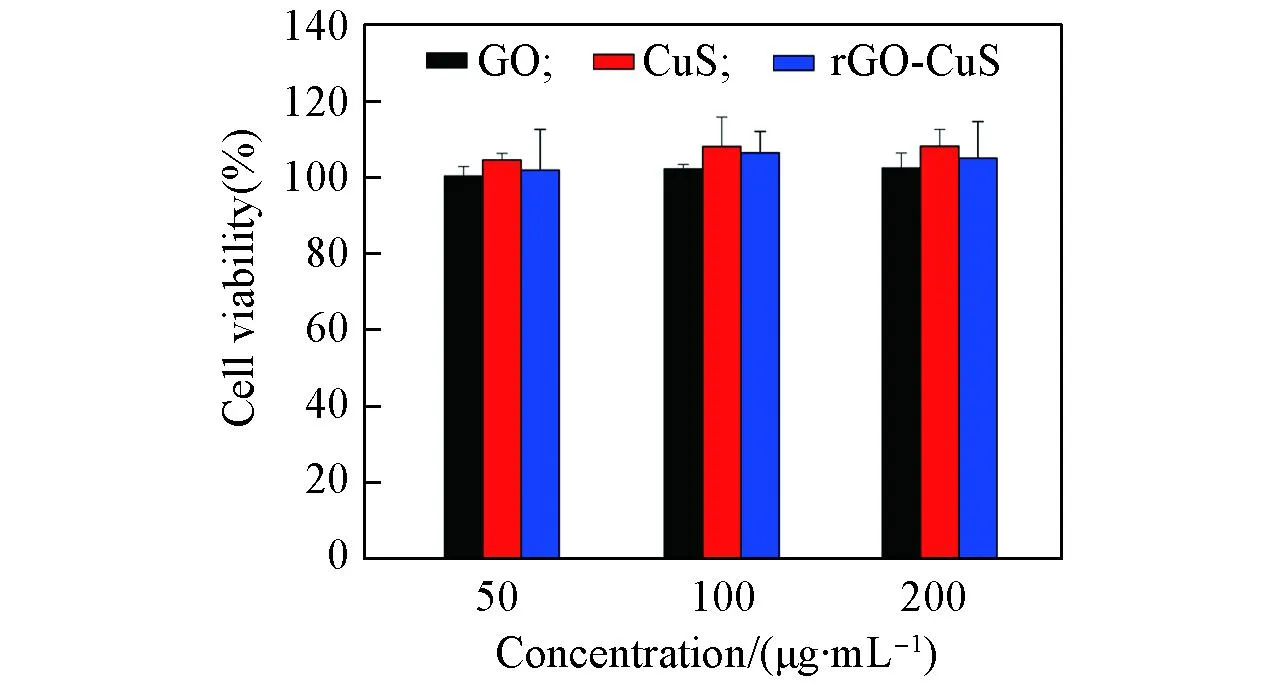
Fig.4 Cytotoxicity evaluation test of MC3T3 cells with different concentrations of GO, CuS and rGO-CuS
2.4纳米复合材料对癌细胞的光热治疗
将HeLa细胞分别在含有GO, CuS 和rGO-CuS 的培养基中培养后, 分别在不采用激光照射和在980 nm激光下照射5 min, 然后用中性红对活细胞进行染色. 如图5(A1)~(D1)和(A2)~(D2)所示, 在无激光照射下, 对照组、GO组、CuS组和rGO-CuS组的细胞都无死亡, 中性红进入活细胞内发出明亮的红色荧光, 说明药物对细胞没有抑制作用.
如图5(A3)~(D3)和(A4)~(D4)所示, 对照组细胞在激光照射下死亡率很低, 中性红进入活细胞内发射出明亮的红色荧光, 并且维持良好的细胞形态. CuS和GO组中细胞出现了部分死亡, CuS组比GO组细胞死亡的数目多, 但仍有细胞存活. rGO-CuS孵育过的HeLa细胞在激光照射下大部分都已经死亡, 细胞的形态也发生了改变, 由贴壁状态良好的纺锤形变成了圆形. 这些实验结果表明, 相对于GO和CuS, rGO-CuS对癌细胞具有更好的光热杀灭效果.

Fig.5 Fluorescence microscope images of HeLa cells staind by neutral red without the irradiation of laser(A1—D1, A2—D2) and after treated by the irradiation of 980 nm laser with the power density of 1 W/cm2 over 5 min(A3—D3, A4—D4) for 100 μg/mL rGO-CuS(A1—A4), 100 μg/mL CuS(B1—B4) and 100 μg/mL GO(C1—C4) and control(D1—D4)(A1—D1), (A3—D3) Dark field; (A2—D2),(A4—D4) bright field.
2.5动物实验测试
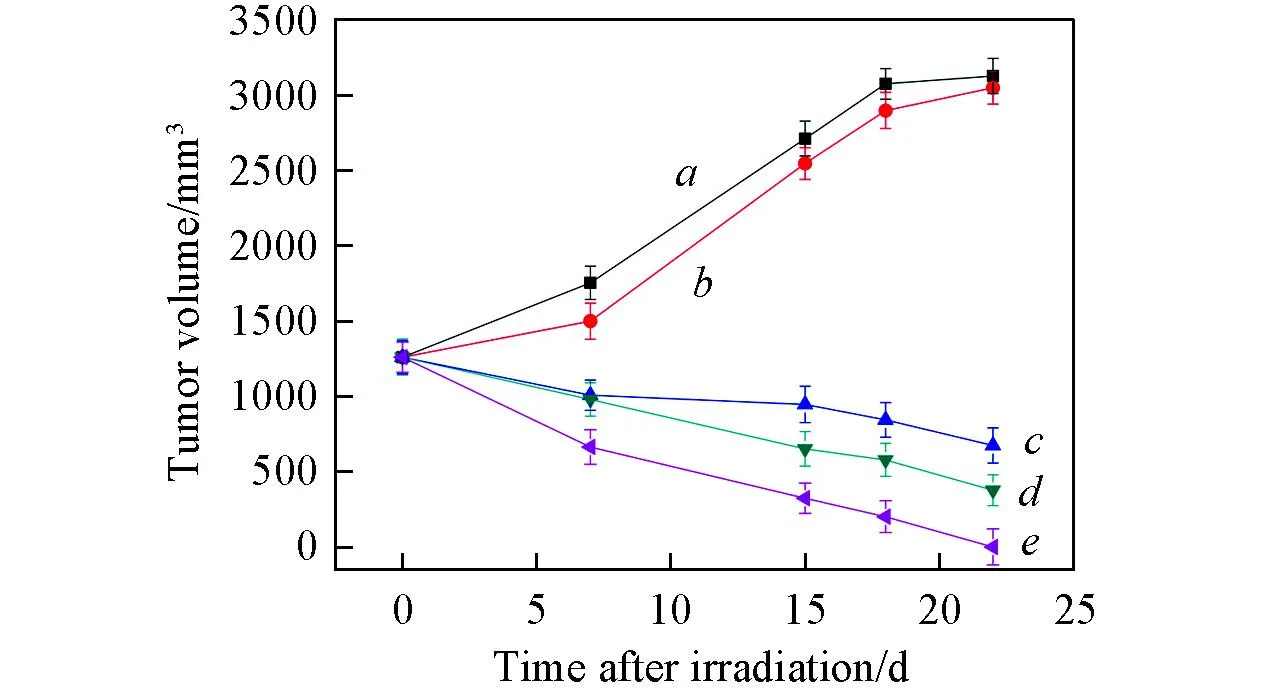
Fig.6 Quantitative measurement of tumor volumes after treatment a. DI water; b. rGO-CuS; c. GO+laser; d. CuS+laser; e. rGO-CuS+laser.
采用在裸鼠皮下种植HeLa宫颈癌肿瘤, 然后向瘤内注射纳米材料的方式评价材料的肿瘤消融效果. 图6为经过光热治疗后小鼠肿瘤体积随时间的变化图. 可见, 激光照射22 d后, 未被激光照射的去离子水空白对照组和rGO-CuS组的肿瘤从最初的1250 mm3增长到3000 mm3; 而激光照射的3组肿瘤体积明显减小, GO+laser组、CuS+laser组和rGO-CuS+laser组的肿瘤体积从最初的1250 mm3分别减小到670, 375和0 mm3. 以上实验结果表明, 经不同条件处理后, rGO-CuS+laser组治疗小鼠肿瘤的效果最好, 表明rGO-CuS是一种更加高效的可用于光热治疗的纳米复合材料.
综上所述, 采用一步水热法制备了还原氧化石墨烯-硫化铜纳米复合材料, 测试了其在功率密度为1 W/cm2的980 nm红外光照射下的升温实验、细胞热疗实验和动物实验. 结果表明, 在相同功率激光的照射下, rGO-CuS杀灭癌细胞的效果要明显好于未复合的 CuS 纳米片和GO, 并且在小鼠肿瘤内注射rGO-CuS并经激光照射后肿瘤体积为0 mm3; 而注射CuS和GO组的肿瘤经激光照射后仍存在, 体积分别为375和670 mm3. 表明rGO-CuS 是一种更加高效的可对癌症进行光热治疗的复合纳米材料.
参考文献
[1]Peer D., Karpm J. M., Hong S., Farokhzad O. C., Margalit R., Langer R.,NatureNanotech., 2007, 2(12), 751—760
[2]Huang X. Q., Tang S. H., Mu X. L., Da Y., Chen G. X., Zhou Z. Y., Ruan F. X., Yang Z. L., Zheng N. F.,NatureNanotech., 2011, 6(1), 28—32
[3]Tian Q. W., Tang M. H., Sun Y. G., Zou Y. J., Chen Z. G., Zhu M. F., Yang S. P., Wang J. L., Wang J. H., Hu J. Q.,Adv.Mater., 2011, 23(31), 3542—3547
[4]Hu S. H., Chen Y. W., Hung W. T., Chen I. W., Chen S. Y.,Adv.Mater., 2012, 24(13), 1748—1754
[5]Zhang W., Guo Z. Y., Huang D. Q., Liu Z. M., Guo X., Zhong H. Q.,Biomaterials, 2011, 32(33), 8555—8561
[6]Robinson J. T., Tabakman S. M., Liang Y. Y., Wang H. L., Casalongue H. S., Vinh D., Dai H. J.,J.Am.Chem.Soc., 2011, 133(17), 6825—6831
[7]Fisher J. W., Sarkar S., Buchanan C. F., Szot C. S., Whitne J., Hatcher H. C., Torti S. V., Rylander C. G., Rylander M. N.,CancerRes., 2010, 70(23), 9855—9864
[8]Ghosh S., Dutta S., Gomes E., Carroll D., Agostino R. D., Olson J. J., Guthold M., Gmeiner W. H.,ACSNano., 2009, 3(9), 2667—2673
[9]El-Sayed I. H., Huang X. H., El-Sayed M. A.,CancerLett., 2006, 239(1), 129—135
[10]Huang X. H., ElSayed M. A., ElSayed I. H., Qian W.,J.Am.Chem.Soc., 2006, 128(6), 2115—2120
[11]Li Z. M., Huang P., Zhang X. J., Lin J., Yang S., Liu B., Gao F., Xi P., Ren Q. S., Cui D. X.,Mol.Pharmaceut., 2009, 7(1), 94—104
[12]Loo C., Lowery A., Halas N., West J., Drezek R.,NanoLett., 2005, 5(4), 709—711
[13]Hirsch L. R., Stafford R. J., Sershen S. R., Rivera B., Price R. E., Hazle J. D., Halas N. J., West J. L.,PNAS, 2003, 100(23), 13549—13554
[14]Gao L., Fei J. B., Zhao J., Li H., Cui Y., Li J. B.,ACSNano., 2012, 6(9), 8030—8040
[15]Cobley C. M., Au L., Chen J. Y., Xia Y. N.,Expert.Opin.DrugDel., 2010, 7(5), 577—587
[16]Li Y. B., Lu W., Huang Q. A., Huang M. A., Li C., Chen W.,Nanomedicine-UK, 2010, 5(8), 1161—1171
[17]Hessel C. M., Pattani V. P., Rasch M., Panthani M. G., Koo B., Tunnell J. W., Korgel B. A.,NanoLett., 2011, 11(6), 2560—2566
[18]Zha Z. B., Yue X. L., Ren Q. S., Dai Z. F.,Adv.Mater., 2013, 25(5), 777—782
[19]Shen J., Hu Y., Li C., Chen Q.,Small, 2009, 5(1), 82—85
[20]Kuila T., Khanra P., Bose S., Kim N. H., Ku B., Moon B., Lee Z. H.,Nanotechnology, 2011, 22(30), 305710
Preparation of Reduced Graphene Oxide-Copper Sulfide Composite as
Efficient Photothermal Agents for Ablation of Cancer†
KONG Xiangquan, YAN Gang, KUANG Miao, RONG Jianhua*
(DepartmentofMaterialScience&Engineering,JinanUniversity,Guangzhou510632,China)
AbstractA novel reduced graphene oxide-copper sulfide nanoplates(rGO-CuS) composite with photothermal property was synthesizedviaone-pot hydrothermal method. Structure and morphology of the as-synthesized rGO-CuS nanocomposite were confirmed by transmission electron microscopy(TEM), UV-Vis-NIR and Raman spectroscopy. The rGO-CuS nanocomposite showed enhanced optical absorbance in near infrared region and higher photothermal conversion efficiency than graphene oxide(GO) and CuS nanoplates. The rGO-CuS nanocomposite was further used to photothermal ablation of cancer cells and cancer tissue under a 980 nm laser irradiation and showed improved performance than CuS nanoplates and GO.
KeywordsGraphene oxide; Copper sulfide; Nanocomposite; Photothermal treatment; Cancer cell
(Ed.: S, Z, M)
† Supported by the National Natural Science Foundation of China(No.21344001).
基金项目:国家自然科学基金(批准号: 21344001)资助.
收稿日期:2015-07-08. 网络出版日期: 2015-12-20.
中图分类号O614.12
文献标志码A
doi:10.7503/cjcu20150526 10.7503/cjcu20150644
联系人简介: 容建华, 女, 博士, 教授, 博士生导师, 主要从事高分子材料和生物医用材料研究. E-mail: trong@jnu.edu.cn
