新型黄芩苷金属离子配合物对Kv1.4和Cav3.2离子通道的影响
2016-02-15陈茂青边平凤
郭 明,樊 君,陈 渊,陈茂青,徐 凯,边平凤
(浙江农林大学1.理学院,2.林业与生物技术学院,浙江临安 311300;3.德清奥丽芙生物科技有限公司,浙江德清 323200;4.浙江大学化学系,浙江杭州 310027)
新型黄芩苷金属离子配合物对Kv1.4和Cav3.2离子通道的影响
郭 明1,樊 君1,陈 渊2,陈茂青3,徐 凯3,边平凤4
(浙江农林大学1.理学院,2.林业与生物技术学院,浙江临安 311300;3.德清奥丽芙生物科技有限公司,浙江德清 323200;4.浙江大学化学系,浙江杭州 310027)
目的 探讨新型黄芩苷(BC)金属离子钴、铜和镍(Co2+,Cu2+和Ni2+)配合物(BMC)对Kv1.4和Cav3.2离子通道的影响。方法 稳定转染法获得分别装载各种离子通道(hERG,Kv1.2,Kv1.3,Kv1.4,Kv1.5,Kv1.6,Kv1.7,Kv1.8,Kir1.1,Kir2.1,KCNQ和Cav3.2)的HEK293细胞或者CHO细胞,应用全细胞膜片钳技术检测BC及BMC(BC-Co,BC-Cu和BC-Ni)对各离子通道的影响。全细胞膜片钳法检测不同浓度BC-Co和BC-Cu对稳态表达Kv1.4和Cav3.2离子通道的细胞上离子通道电流变化的影响。结果 获得了稳定表达各离子通道的CHO细胞或HEK293细胞模型。BMC对各离子通道均有一定影响,尤其对Kv1.4和Cav3.2的影响最为明显。BC-Co,BC-Cu和BC-Ni(10 μmol·L-1)对Kv1.4的抑制率分别为91%,76%和-10%,对Cav3.2的抑制率分别为43%,57%和-14%,表现为金属离子的类效关系。BC-Co对Kv1.4和Cav3.2的IC50分别为1.69和0.81 μmol·L-1;BC-Cu对Kv1.4和Cav3.2的IC50分别为1.66和0.58 μmol·L-1。结论 BC-Cu和BC-Co对Kv1.4和Cav3.2离子通道有浓度依赖性地明显影响。
黄芩苷;黄芩苷金属配合物;离子通道;全细胞膜片钳技术
黄芩苷(baicalin,BC)是传统中药黄芩的主要成分,属于黄酮类化合物,它在清除自由基、抗氧化、抑菌、调节免疫、减轻组织缺血再灌注损伤等方面显示出显著功效[1-2]。BC分子结构中因含有羟基或羰基等基团而与金属离子有较强的螯合作用,其母核的4位羰基上的氧原子具有很强的配位能力,同时BC的空间结构也有利于金属配合物的合成[3]。目前已有关于黄芩苷金属配合物(baicalin metal complexes,BMC)的报道。本课题组也进行了BMC的研究[4],显示BC与金属离子配合后,生物利用度提高,药理活性会有不同程度的提升。目前,黄酮类药物对离子通道的影响及作用机制已有文献报道。如Kelemen等[5]研究发现,绿茶中的黄酮类化合物儿茶素没食子酸盐能抑制hERG(human ether-a-go-go related gene)钾离子通道。Akhlaghi等[6]分析了类黄酮预防心肌缺血再灌注损伤机制与离子通道相关性。Pyle等[7]发现槲皮素能激活囊性纤维化跨膜传导调节蛋白等。BMC在细胞药理及蛋白相互作用方面也有研究,但离子通道方面还未见涉及。因此,探讨BC和BMC对离子通道的作用及影响很有必要,可从不同角度了解其药理作用机制。本研究从生理作用及种类最广泛的钾离子通道和影响药物作用发挥较突出的钙离子通道角度出发,研究本实验室制备的3种新型BMC对离子通道的影响。
1 材料与方法
1.1 主要试剂和仪器
BC,纯度98%,上海金穗生物科技有限公司产品;BMC,本实验室合成[4],BC-Ni,BC-Co及BC-Cu的纯度分别为97.4%,98.3%和95.6%;HEK293细胞和CHO细胞,北京中国细胞系资源库;胎牛血清,美国Gibco公司;LIPofectamineTM2000,美国Invitrogen公司;野生型hERG,Kv1.4,Cav3.2,Kv1.2,Kv1.3,Kv1.5,Kv1.6,Kv1.7,Kv1.8,Kir1.1,Kir2.1和KCNQ基因,获赠于德清奥丽芙生物科技有限公司;HEPES,EGTA和Mg-ATP,美国Sigma公司;高糖DMEM培养基,美国Hyclone公司。HF90型二氧化碳培养箱,中国力康生物医疗科技控股有限公司;Thermo Scientific二级生物安全柜,美国赛飞世尔科技公司;CKX31型倒置显微镜,日本Olympus公司;Patch clamp-505B膜片钳仪,美国MD公司;Digidata 1322A数模转换器、MP-225微操控仪器,美谷分子仪器(上海)有限公司;PC-10微电极拉制仪,日本Narishige公司。
1.2 含各离子通道HEK293或CHO细胞模型
稳定转染人Kv1.2~Kv1.8,hERG或KCNQ的CHO细胞和稳定转染人Kir1.1,Kir2.1或Cav3.2的HEK293细胞,接种于含10%胎牛血清、青霉素100 kU·L-1、链霉素0.1g·L-1和G418 100 mg·L-1的高糖DMEM培养基中,置于37℃,5%CO2的细胞培养箱中培养24~48 h。实验前1 d,将这些细胞重新分布在盖玻片上,用含青霉素100 kU·L-1、链霉素0.1 g·L-1和G418 100 mg·L-1的培养基培养。
1.3 电生理实验
利用全细胞膜片钳技术,通过初筛考察BC及BMC对转染细胞选定离子通道的影响。对于有显著影响的离子通道,再进一步考察电生理参数,分析BMC对其的影响方式及可能的作用机制。
溶液配制:BC及BMC的保存浓度为9 mmol·L-1,溶于二甲亚砜(DMSO)。测试当天再用细胞外液配制成所需浓度(DMSO终浓度始终为0.3%)。hERG离子通道细胞内液〔mmol·L-1:天冬氨酸钾137,EPES 10,Mg-ATP 4,MgCl24,EGTA 10,pH 7.3(KOH滴定)〕;细胞外液〔mmol·L-1:NaCl 136,KCl 8,CaCl22,MgCl22,葡萄糖10;HEPES 20,pH 7.3(NaOH滴定)〕。Kv1.4离子通道细胞内液〔mmol·L-1:天冬氨酸钾盐130,MgCl25,EGTA 5,HEPES 10,Tris-ATP 4,pH 7.2(KOH滴定)〕。细胞外液〔mmol·L-1:NaCl 137,KCl 4,CaCl21.8,MgCl21,HEPES 10,葡萄糖10,pH 7.4(NaOH滴定)〕。其余钾离子通道的细胞内外液与Kv1.4的相同。Cav3.2离子通道细胞内液〔mmol·L-1:CsCl 130,MgCl25,EGTA 5,HEPES 10,Tris-ATP4,pH7.2(KOH滴定)〕。细胞外液〔mmol·L-1:NaCl 137,KCl 4,CaCl21.8,MgCl21,HEPES 10,葡萄糖10,pH 7.4(NaOH滴定)〕。细胞内液分批少量储存于-80℃冰箱,实验当天融化。特别说明除外,所有实验在室温25℃进行。
电生理测试过程:将细胞转移至灌流槽中,用细胞外液进行灌流。电极用PC-10微电极拉制仪拉制。全细胞膜片钳记录,噪声用采样频率的20%进行过滤。每个细胞都以自身为对照,BC和BMC均利用自身重力的灌流系统进行灌流。每个浓度至少测试2组细胞。在电流稳定(或5 min)后,再比较给予BC或BMC前后的电流变化。Kv1.4电流:将细胞钳制在-80 mV,持续500 ms去极化至-20 mV。Cav3.2电流:将细胞钳制在-120 mV,持续50 ms去极化至-30 mV。每个程序每20 s重复1次。待电流稳定后灌流BC或BMC,以稳定后的电流计算抑制率。
1.4 统计学分析
采用Clampex软件包对离子通道记录进行数据和图形转换,Clmpfit 10.2软件用于数据的转换和处理,Origin 8.5用于作图和曲线拟合。通过电流抑制率判断药物对离子通道的影响,抑制率的计算公式如下:抑制率(%)=(1-In/I0)×100%。In为给药后峰电流,I0为给药前峰电流。实验数据均以x±s表示,应用SPSS19.0统计分析软件进行数据统计和方差分析。根据Hill方程计算药物的50%最大抑制浓度(IC50)。
2 结果
2.1 转染细胞的检测
用全细胞膜片钳技术记录稳转细胞表达的通道电流,可以检测到各离子通道的特征通道电流(图1)。

Fig.1 Characteristic current of Kv1.4(A)and Cav3.2(B)detected by whole-cell patch-clamp technique.
2.2 BC和BMC对离子通道影响的初筛结果
由于细胞间的生物差异,电流的基础变化等原因,虽然对膜片钳的条件进行了严格控制,但<10%的差异被认为对离子通道无明显影响。采用全细胞膜片钳技术获得的初筛数据处理后列于表1,从中可见,BC本身对离子通道的作用均<8%,即药理作用与离子通道可能无关。但其金属配合物对不同离子通道有较大的影响,如BC-Co对Kv1.4和Cav3.2的抑制率分别为91%和43%;BC-Cu对Kv1.4和Cav3.2的抑制率分别为76%和57%(图2,图3)。故选择BC-Co和BC-Cu进一步研究其对离子通道Kv1.4和Cav3.2的影响。
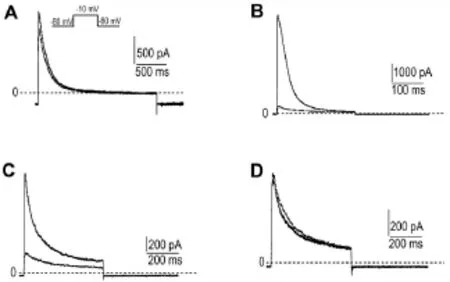
Fig.2 Effect of baicalin and its metal complexes on Kv1.4.Kv1.4 ion channels are stably turned into CHO cells. A,B,C and D:inhibitory rate of BC,BC-Co,BC-Cu,and BCNi on KV1.4 was 8%,91%,76%and-10%(promotional rate),respectively.Solid and dotted line:before and after treat⁃ment with BC and BMC 10 μmol·L-1,respectively.
2.3 BC-Co和BC-Cu对Kv1.4和Cav3.2的影响
以浓度对数为横坐标,抑制率为纵坐标,进行Logistic函数拟合,不同浓度BC-Co和BC-Cu对Kv1.4和Cav3.2的影响见图4。由图4可知,在10 μmol·L-1浓度范围内,BC-Co和BC-Cu对Kv1.4的抑制率随浓度增加而增加;在3 μmol·L-1浓度范围内,BC-Co和BC-Cu对Cav3.2的抑制率随浓度增加而增加,与空白对照组相比差异具有统计学显著性(P<0.01)。当浓度达>10 μmol·L-1时,呈现平台期现象。不同的金属配合物与BC络合后,对不同离子通道电流的阻断作用强度不同,表现为金属离子的类效关系,BC-Co和BC-Cu对Kv1.4的IC50分别为1.69和1.66 μmol·L-1,对Cav3.2的IC50分别为0.81和0.58 μmol·L-1。
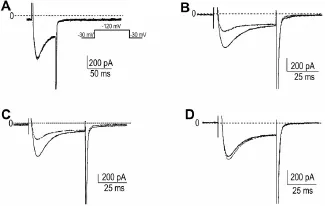
Fig.3 Effect of baicalin and its metal complexes on Cav3.2.Cav3.2 ion channels are stably turned into HEK293 cells.A,B,C and D:inhibitory rate of BC,BC-Co,BC-Cu,and BC-Ni on Cav3.2 was-3%,43%,57%and-14%(promotional ratio),respectively.Solid and dotted line:before and after treat⁃ment with BC and BMC 10 μmol·L-1,respectively.
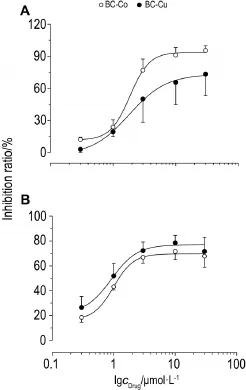
Fig.4 Inhibitory effect of BC-Co and BC-Cu on Kv1.4 and Cav3.2 ion channels at different concentrations detected by whole-cell patch-clamp technique.A:Kv1.4 ion channel.IC50of BC-Co and BC-Cu were 1.69 and 1.66 μmol·L-1,respectively.B:Cav3.2 ion channel.IC50of BC-Co and BC-Cu were 0.81 and 0.58 μmol·L-1,respectively.The nonlinear fitting curve was obtained by Logistic function.x±s,n=4.

Tab.1 Effect of baicalin(BC)and baicalin metal complexes(BMC)on ion channels detected by whole-cell patch-clamp technique
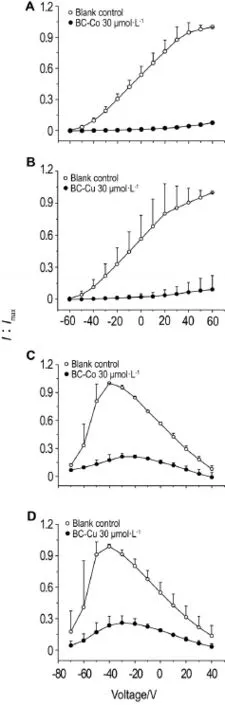
Fig.5I-Vcurves of BC-Co and BC-Cu on Kv1.4 and Cav3.2.A:BC-Co 30 μmol·L-1on Kv1.4;B:BC-Cu 30 μmol·L-1on Kv1.4;C:BC-Co 30 μmol·L-1on Cav3.2;D:BC-Cu 30 μmol·L-1on Cav3.2.x±s,n=4.
从图5的电流-电压曲线可以看出,对于Kv1.4离子通道,以BC-Co或BC-Cu 30 μmol·L-1灌流后,可显著抑制峰电流(P<0.01),随着刺激电压的增加而呈线型增长,具有典型的电压依赖性特征(图5A和B)。对于Cav3.2离子通道,BC-Co或BC-Cu 30 μmol·L-1灌流后,均可显著抑制峰电流(P< 0.01),在刺激电压-40 mV到达峰电流时其抑制率最大(图5C和D)。
3 讨论
离子通道是生命活动的基础,无论动物或植物、单细胞生物或多细胞生物的细胞膜上,都有离子通道的存在[8],它们是细胞膜上控制离子进出的功能蛋白,在细胞生命活动中发挥重要作用,如离子吸收、渗透压调控、电冲动的形成和信号转导等[9-13]。根据离子类型的不同,离子通道可分为K+,Na+,Ca2+和Cl-离子通道。其中K+通道是数量最大、家族最为多样的离子通道,对跨膜电流的产生是必要的,在细胞兴奋性的调节中起着重要作用[14]。Cav3.2是T型Ca2+通道的一种亚型,在心脏中广泛分布,主要影响心率,是心脏起搏的关键离子通道[15]。当离子通道结构变异或调控开关机制出现紊乱时,往往造成比较严重的病症,其中有些是严重的遗传性病症,如癫痫、自闭症、高血压、心脏病、疼痛和癌症等。而许多化合物[16]、金属离子[17]、动物毒素[18]、植物毒素[19]和药物[20]等都可作用于离子通道,影响细胞膜上信号的产生和传导。因此研究离子通道的药理作用是新药开发的热点研究领域,具有非常重要的意义。
BC和BMC有多种药效,BMC含有金属离子,可考虑其对离子通道的影响。BMC作用的非主要靶点属于非靶点靶点(off-target target)或存在潜在的副作用。本工作利用已有的稳转离子通道的细胞株进行筛选,这些靶点包括了hERG等心脏的离子通道,因此也对心脏的药理安全性进行了最初评估。从筛选结果可见,BC-Co和BC-Cu对Kv1.4和Cav3.2离子通道有明显的阻断作用。
综上所述,BMC对K+和Ca2+离子通道有影响,金属离子因其电荷排布的不同有不同的配位能力和配位数,这可能与其活性和作用机制有关,表现为明显的类效关系。从对各K+通道和Cav3.2通道的抑制作用来看,BC及BMC可能通过对离子通道的作用来发挥其药理作用,其与离子通道蛋白的结合方式及空间构效的不同可能是其抑制率不同的主要原因,而结合方式与配合物的离子种类也有很大的关系,但具体是以何种方式结合还有待深入的实验研究。
参考文献:
[1]Wang Q,Wang YT,Pu SP,Zheng YT.Zinc cou⁃pling potentiates anti-HIV-1 activity of baicalin[J].Biochem Biophys Res Commun,2004,324(2):605-610.
[2]Fang Y,Hu DD,Li XJ,Liu YR,Sun ZM,Cao ZQ. Scavenging effects of baicalin and its copper(Ⅱ),zinc(Ⅱ)conplexes on superoxide radical[J].Chin Biochem J(生物化学杂志),1991,7(6):753-756.
[3]Liu YJ,He XY,Liu XH,Zuo H,Li ZB,Wu ZH,et al.Synthesis of baicalin-copper and baicalinaluminium complex and its bioactivity[J].China J Chin Mater Med(中国中药杂志),2012,9(37):1296-1301.
[4]Guo M,Wu ZL,Wang CG,Gao XY.Synthesis and anti-tumor activity of baicalin-metal complex[J].Acta Pharm Sin(药学学报),2014,49(3):337-345.
[5]Kelemen K,Kiesecker C,Zitron E,Bauer A,Scholz E,Bloehs R,et al.Green tea flavonoid epigallocatechin-3-gallate(EGCG)inhibits cardiac hERG Potassium channels[J].Biochem Biophys Res Commun,2007,364(3):429-435.
[6] Akhlaghi M,Bandy B.Mechanisms of flavonoid protection against myocardial ischemia-reperfusion injury[J].J Mol Cell Cardiol,2009,46(3):309-317.
[7]Pyle LC,Fulton JC,Sloane PA,Backer K,Mazur M,Prasain J,et al.Activation of the cystic fibrosis transmembrane conductance regulatorby the flavonoid quercetin potential use as a biomarker of delta F508 cystic fibrosis transmembrane conduc⁃tance regulator rescue[J].Am J Respir Cell Mol Biol,2010,43(5):607-616.
[8]Catterall W,Epstein PN.Ion channels[J].Diabeto⁃logia,1992,35(Suppl 2):S23-S33.
[9]Mahaut-Smith MP.The unique contribution of ion channels to platelet and megakaryocyte function[J].J Thromb Haemost,2012,10(9):1722-1732.
[10]Ko GY,Shi LH,Ko ML.Circadian regulation of ion channels and their functions[J].J Neurochem,2009,110(4):1150-1169.
[11]Boyden PA,Jeck CD.Ion channel function in disease[J].Cardiovasc Res,1995,29(3):312-318.
[12]Terlau H,Stuhmer W.Structure and function of voltage-gated ion channels[J].Naturwissen⁃schaften,1998,85(9):437-444.
[13]Brading AF,Brain KL.Ion channel modulators and urinary tract function[J].Handb Exp Pharmacol,2011,(202):375-393.
[14]Xu XZ,Zhan Y,Ji Q,An HL,Zhuo YZ.K+ion channels and its research progress[J].Mod Phys(现代物理知识),2003,6:19-23.
[15]Wen XJ,Liu HZ,Liang H,Xu SY,Zhang QG,Lai XH,et al.The effects of Cav3.2 on the CaMKⅡexpression in the spinal cord of the rats followed chronic dorsal root ganglia compression[J].Chin J Pain Med(中国疼痛医学杂志),2013,19(3):134-138.
[16]Gohlke BO,Preissner R,Preissner S.Super paina resource on pain-relieving compounds targeting ion channels[J].Nucleic Acids Res,2013,42(Database issue):D1107-D1112.
[17]Elinder F,Arhem P.Metal ion effects on ion channel gating[J].Q Rev Biophys,2003,36(4):373-427.
[18]Kalia J,Milescu M,Salvatierra J, Wagner J,Klint JK,King GF,et al.From foe to friend:using animal toxins to investigate ion channel function[J].J Mol Biol,2015,427(1,SI):158-175.
[19]Ostroumova OS,Gur′nev FA, Takemoto JY,Shchagina LV,Malev VV.Kinetic parameters of single ion channels and stationary conductivities of phytotoxin modified lipid bilayers[J].Tsitologiya,2005,47(4):338-343.
[20]Farre C,Fertig N.New strategies in ion channel screening for drug discovery:are there ways to improve its productivity?[J].Expert Opin Drug Discov,2014,9(10):1103-1107.
Influence of new baicalin-metal complexes on Kv1.4 and Cav3.2 ion channels
GUO Ming1,FAN Jun1,CHEN Yuan2,CHEN Mao-qing3,XU Kai3,BIAN Ping-feng4
(1.School of Science,2.School of Forestry and Bio-technology,Zhejiang Agriculture&Forestry University,Lin′an 311300,China;3.Olive Biological Technology Co.,Ltd.of Deqing County,Deqing 323200,China;4.Department of Chemistry,Zhejiang University,Hangzhou 310027,China)
OBJECTIVE To investigate the effect of new baicalin(BC)metal ions(Co2+,Cu2+,and Ni2+)complexes(BMCs)on ion channels Kv1.4 and Cav3.2.METHODS HEK293 or CHO cells loaded with various ion channels(hERG,Kv1.2,Kv1.3,Kv1.4,Kv1.5,Kv1.6,Kv1.7,Kv1.8,Kir1.1,Kir2.1,KCNQ and Cav3.2)were obtained by stable transfection method.Whole-cell patch-clamp tech⁃nique was used to record current changes of each ion channel induced by BC and BMC in 10 μmoL·L-1. The effect of different concentrations(0.3,1,3,10 and 30 μmoL·L-1)of BC-Co and BC-Cu on Kv1.4 and Cav3.2 current was detected by whole-cell patch-clamp technique.RESULTS A model of HEK293 cells or CHO cells that stably expressed various ion channels was obtained.BMCs(BC-Co,BC-Cu and BC-Ni)had some impact on various ion channels,especially on Kv1.4 and Cav3.2.The inhibitory rate induced by BC-Co,BC-Cu and BC-Ni(10 μmol·L-1)was 91%,76%and-10%,respectively,for Kv1.4;and 43%,57%and-14%,respectively,for Cav3.2.IC50of BC-Co was 1.69 and 0.81 μmoL·L-1for Kv1.4 and Cav3.2.IC50of BC-Cu was 1.66 and 0.58 μmoL·L-1for Kv1.4 and Cav3.2.CONCLUSION BC-Cu and BC-Co concentration-dependently inhibit Kv1.4 and Cav3.2 ion channels.
baicalin;baicalin metal complexes;ion channel;whole-cell patch clamp technique
GUO Ming,E-mail:guoming@zafu.edu.cn,Tel:(0571)63740852
R285.5
A
1000-3002-(2016)09-0935-06
10.3867/j.issn.1000-3002.2016.09.005
Foundation item:The project supported by National Natural Science Foundation of China(20877072);and Scientific Research Development Fund Project of Zhejiang Agriculture&Forestry University(2013FR032)
2015-09-10接受日期:2016-07-17)
(本文编辑:齐春会)
国家自然科学基金(20877072);浙江农林大学科研发展基金(2013FR032)
郭 明,男,博士,教师,从事药物分子相互作用等研究。
郭明,E-mail:guoming@zafu.edu.cn,Tel:(0571)63740852
