氧化条件下没食子酸对猪肉肌原纤维蛋白结构及凝胶特性的影响
2016-02-09张晓星邵俊花李儒仁刘登勇
贾 娜,刘 丹,张晓星,邵俊花,李儒仁,刘登勇
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
氧化条件下没食子酸对猪肉肌原纤维蛋白结构及凝胶特性的影响
贾 娜,刘 丹,张晓星,邵俊花,李儒仁,刘登勇
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
构建肌原纤维蛋白Fenton氧化体系(10 μmol/L FeCl3,100 μmol/L VC和1 mmol/L H2O2),以没食子酸(10、50、100、150 μmol/g蛋白)作为抗氧化剂添加到氧化体系中,通过测定蛋白质表面疏水性、色氨酸荧光强度、凝胶强度、保水性、白度、流变特性及微观结构,研究在氧化条件下,没食子酸的抗氧化效果及其对蛋白质结构和凝胶特性的影响。结果表明,随着没食子酸浓度的增加,蛋白质的表面疏水性逐渐增加,凝胶强度和保水性呈下降趋势,凝胶白度略有上升,其微观结构受到破坏;色氨酸荧光强度随没食子酸浓度的增加而增加,但在150 μmol/g时略有降低;且较高浓度下(50、100、150 μmol/g),蛋白失去典型的流变特征。总的来说,低浓度没食子酸在起到抗氧化作用的同时,对肌原纤维蛋白结构及凝胶特性的影响较小,而较高浓度的没食子酸破坏了蛋白的凝胶结构。
氧化,没食子酸,肌原纤维蛋白,凝胶特性,结构
肌原纤维蛋白是肌肉中含量最高、最重要的蛋白质,约占肌肉蛋白总量的40%~60%,因此,人们通常将其作为优质蛋白质的来源[1]。然而,蛋白质在加工和贮藏过程中容易发生氧化,不仅对蛋白质的结构有所影响,而且还会影响其功能性质。羰基氧化产物的生成、巯基损失以及蛋白质交联都是反映蛋白质氧化的重要指标,氧化最终会导致肉的保水性降低,嫩度变差,并对风味和营养价值产生影响[2]。因此,寻找减少蛋白质氧化的方法是尤为重要的。
近年来,植物多酚以成分天然、抗氧化活性高等优点被添加到食品中,已经成为人们研究的热点[3]。将水果提取物添加到熟猪肉糜中,发现大部分水果提取物具有抑制蛋白羰基氧化产物生成的作用[4]。添加茶多酚对鱼肉中的酶和微生物有一定的抑制作用,延缓了蛋白质的降解速度,降低其降解程度[5]。然而,酚类化合物既有促氧化又有抑制氧化的效果,主要取决于酚的种类、浓度及氧化体系等,如儿茶素、金雀异黄酮、槲皮素、芦丁、没食子酸和绿原酸在高浓度下均表现为促氧化作用[6]。此外,最近研究发现,将酚类化合物添加到肉制品中也会对其功能特性产生影响。将儿茶素、咖啡酸等氧化后添加到鲫鱼鱼糜中,可以提高鲫鱼鱼糜的凝胶强度和持水力[7]。不同浓度的绿茶提取物对肉乳状液的影响不同,低浓度的绿茶提取物可以保护肉蛋白结构及其氧化稳定性,而高浓度的绿茶提取物导致肉乳状液的持水力和结构稳定性有所降低[8]。
Fenton氧化体系可以形成大量的自由基,且自由基诱导蛋白质氧化是最常见的氧化反应[6]。没食子酸又名五倍子酸等,化学名为3,4,5-三羟基苯甲酸,具有较强的抗氧化效果。因此,本文选取肌原纤维蛋白Fenton反应体系,以没食子酸为抗氧化剂,通过测定蛋白质表面疏水性、色氨酸荧光强度、凝胶强度、保水性、白度、流变特性及微观结构,来研究氧化条件下没食子酸的抗氧化效果及其对肌原纤维蛋白结构和凝胶特性的影响,从而为其在肉制品中的应用提供一定的参考依据。
1 材料与方法
1.1 材料与仪器
新鲜猪背最长肌 购于当地超市;没食子酸 购买于sigma化学公司(美国);氯化镁、磷酸二氢钠、磷酸氢二钠、氯化钠、乙二胺四乙酸二钠、氢氧化钠、酒石酸钾钠、氯仿、叔丁醇等试剂 均为国产分析纯。
Allegra 64R冷冻离心机 美国Beckman公司;FE20 pH计 梅特勒-托利仪器(上海)有限公司;T25数显型均质机 德国IKA集团;UV-2550紫外-可见光分光光度计 日本Shimadzu公司;TA-XT2i质构仪 英国Stable Micro Systems公司;Discovery DHR-1流变仪 美国TA公司;JB/7534电子天平 梅特勒-托列多仪器上海有限公司;HHS电热恒温水浴锅 山西省文水医疗器械厂;S-4800场发射扫描电镜 日本日立公司;970CRT荧光分光光度计 上海精密科学仪器有限公司;CR-400色彩色差计 科盛行(杭州)仪器有限公司。
1.2 实验方法
1.2.1 肌原纤维蛋白提取方法 猪肉肌原纤维蛋白提取按照Park[9]的方法进行并适当修改。方法如下:称取猪肉样品,加入4倍体积的冰提取液,匀浆60 s,4 ℃下3500 r/min冷冻离心15 min,去上清液重复匀浆离心两次,得到粗纤维蛋白,然后加入4倍体积的冰洗液,匀浆60 s,在3500 r/min冷冻离心15 min,去上清液重复匀浆离心一次,得到粗纤维蛋白,再加4倍体积冰洗液,匀浆60 s后用4层纱布过滤,并用0.1 mol/L HCl调pH为6.0,随后3500 r/min冷冻离心15 min,得到的沉淀置于密闭的瓶中4 ℃保存备用。提取出的蛋白质其浓度用双缩脲法测定[10],并利用牛血清蛋白作为标准蛋白,标准曲线如图1所示,蛋白提取率为6.7%。

图1 蛋白质标准曲线Fig.1 Standard curve of protein
1.2.2 氧化体系的构建 参照Xiong[11]等的方法并适当修改。提取的肌原纤维蛋白溶解于pH6.0 10 mmol/L磷酸缓冲溶液(含0.6 mol/L NaCl),随后添加4个不同浓度的没食子酸(10、50、100、150 μmol/g蛋白),并向其中添加羟自由基氧化体系(10 μmol/L FeCl3,100 μmol/L VC和1 mmol/L H2O2),使蛋白最终浓度为40 mg/mL。对照组为未氧化的肌原纤维蛋白以及氧化后未加没食子酸的肌原纤维蛋白。蛋白样品均在4 ℃下反应12 h。
1.2.3 表面疏水性的测定 参照Chelh[12]的方法,将肌纤维蛋白溶于20 mmol磷酸缓冲溶液(pH7.0),制备浓度为5 mg/mL的蛋白质溶液,取1 mL蛋白溶液加入200 μL的1 mg/mL溴酚蓝(BPB),充分混合,然后在6000 r/min的条件下离心15 min,取上清液稀释10倍,在595 nm波长处测定吸光值,以未加蛋白溶液的磷酸盐缓冲溶液作为对照组。表面疏水性可用以下公式表示:
1.2.4 色氨酸的测定 参照李学鹏等[13]的方法并适当修改。准确量取0.5 mL 5 mg/mL 蛋白液,用pH7.0 50 mmol/L 磷酸盐缓冲液稀释至0.1 mg/mL,磁力搅拌2 h 后在4 ℃ 10000×g条件下离心30 min。采用荧光分光光度计,在激发波长295 nm 条件下得到250~400 nm之间的发射光谱(灵敏度为3)。
1.2.5 热诱导凝胶的制备 将配制好的蛋白质溶液装入密闭的玻璃瓶中(25 mm×40 mm,Dia.×L),每组3个平行,放入恒温水浴锅内72 ℃下保持20 min,制备好的凝胶在室温下放置1 h后,放入2~4 ℃的冰箱中备用。在进行凝胶特性分析之前要从冰箱中取出放在室温下(25~27 ℃)30 min。
1.2.6 凝胶强度的测定 肌原纤维蛋白凝胶质构特性的测定采用TA-XT plus型质构分析仪。质构分析仪采用的参数如下:测定模式选择下压距离,测试前速度为5 mm/s,测试速度为2 mm/s,测试后速度为2 mm/s,下压距离为凝胶高度的4 mm,引发力为5 g,探头型号选择P/0.5。将待测样品置于测定平台上固定好,在室温下进行测定,每组样品进行三次平行实验,取平均值。
1.2.7 凝胶保水性的测定 采用Salvador[14]的方法测定凝胶保水性,并做适当修改。准确称取离心管的质量,记为m0,取一定质量凝胶(5~8 g)放入离心管底部,准确称取此时离心管的质量,记为m1。在4 ℃下3000 r/min离心10 min,离心后小心用中性滤纸吸干离心管中凝胶析出的水分,再次准确称取离心管质量,记为m2。每组样品进行三次平行实验,取平均值。计算公式如下:
1.2.8 凝胶白度的测定 凝胶白度采用CR-400色差计进行测定。测量前取出样品,室温下放置30 min。采用L*,a*,b*,表示肌原纤维蛋白凝胶的颜色和光泽。所有样品做三次平行后取平均值,按Park[15]的方法计算。公式如下:
1.2.9 动态流变学测定 用Discovery DHR-1流变仪测定样品的动态学特性。首先将制备好的蛋白质溶液均匀涂布于测试平台,赶走气泡。测试参数为:频率0.1 Hz,应变力为2%,上下夹缝为1 mm,起始温度30 ℃,升温速率为1 ℃/min,终止温度80 ℃。测定过程中,平板外蛋白与空气接触,使用保护盖进行密封。每组3个重复。测定指标为流变的弹性模量G′。
1.2.10 微观结构 将肌原纤维蛋白凝胶样品切成2 mm×5 mm的小条,用2.5%的戊二醛(pH6.8)浸泡,过夜固定。用0.1 mol/L pH6.8的磷酸缓冲液洗3次,每次为10 min。随后分别使用50%,70%,80%,90%的乙醇脱水,每次为10 min,再用100%的乙醇进行脱水,每次10 min,共3次。最后,采用氯仿进行脱脂1 h,再用100%乙醇∶叔丁醇=1∶1以及叔丁醇各进行一次置换,每次为15 min。样品进行冷冻干燥。凝胶样品紧贴在扫描电镜样品台上并且将样品表面喷金,处理好样品后,放入扫描电镜样品盒中待检,加速电压为3.0 kV,放大倍数选择100000倍,进行结果观察。
1.3 统计分析
每个实验重复三次,结果表示为平均值±标准差(X±SD)。数据统计分析采用Spss 19.0软件中的Linear Models程序进行处理,差异显著性(p<0.05)分析采用LSD程序。作图使用Sigmaplot 12.0软件。
2 结果与分析
2.1 没食子酸对表面疏水性的影响
蛋白质表面疏水性的变化情况可以用来衡量蛋白质分子空间结构的变化。由图2可知,与未加氧化剂的蛋白相比,氧化后蛋白表面疏水性略有增加,但差异不显著(p>0.05)。胡忠良等[16]发现随着氧化剂浓度的增加,表面疏水性增大,说明氧化后更多蛋白质的疏水氨基酸残基暴露在分子表面,导致蛋白构象发生变化。Li等[17]也研究发现分子间聚集或交联可以减弱其表面疏水性,而表面疏水性增强则可能是由于蛋白质变性发生解折叠。当添加不同浓度的没食子酸后,蛋白质表面疏水性随着没食子酸浓度的增加而增加。其中添加10 μmol/g没食子酸时,表面疏水性显著低于两个对照组(p<0.05),可能是由于没食子酸与蛋白发生疏水相互作用,从而降低了溴酚蓝与疏水基团结合的几率[18]。在添加其他三个浓度时(50、100、150 μmol/g),表面疏水性均高于两个对照组,且浓度为150 μmol/g时差异显著(p<0.05),说明这三个浓度下,没食子酸导致蛋白质的结构展开,埋藏在蛋白质分子内部的疏水性氨基酸残基暴露[19],使得溴酚蓝与蛋白质的疏水性氨基酸残基的结合量增加,从而表面疏水性增加。有研究表明,在肌原纤维蛋白中添加不同浓度的绿原酸,表面疏水性持续增加,特别是高浓度的绿原酸作用效果更明显,这与本实验结果一致,说明其促进了蛋白质结构展开[11]。

图2 没食子酸对肌原纤维蛋白表面疏水性的影响Fig.2 Effect of gallic acid on surface hydrophobicity of myofibrillar protein
2.2 没食子酸对色氨酸荧光强度的影响
色氨酸是一种必需氨基酸,与其它氨基酸相比含量较少[6],但对于微环境非常敏感,可以反映蛋白质三级结构的变化。因此,有必要研究没食子酸对肌原纤维蛋白色氨酸的影响。由图3可以看出,与未氧化的肌原纤维蛋白相比,氧化后肌原纤维蛋白的荧光强度降低。通常氧化引起的蛋白质荧光强度下降的原因有两方面:一是蛋白质氧化使其分子聚集,导致荧光氨基酸残基包埋;二是蛋白质侧链氨基酸中的荧光氨基酸受到氧化猝灭的影响[20]。随着没食子酸浓度(10、50、100 μmol/g)的增加,荧光强度增加,可能是由于适量浓度的没食子酸具有抗氧化作用,对色氨酸起到了一定的保护作用,且浓度越高,效果越好。150 μmol/g时,荧光强度略有降低,但仍高于加氧化剂的对照组,可能是由于过多的没食子酸存在,使其在色氨酸残基周围起到屏障作用[21],从而荧光强度有所降低。此外,溶剂分子对色氨酸荧光具有淬灭作用,如Zhang[22]等研究超声处理对花生蛋白色氨酸的影响时发现,超声导致蛋白质结构破坏,更多的发色团暴露于溶剂中,荧光强度降低。而本研究中表面疏水性的结果证实,色氨酸浓度为150 μmol/g时,表面疏水性最大,蛋白结构充分展开,因此色氨酸能够暴露于极性溶剂中,从而使得荧光强度降低。而没食子酸浓度为50、100 μmol/g时,表面疏水性虽然增加,但荧光强度没有降低,说明没食子酸对色氨酸的保护而引起的荧光强度增加程度大于蛋白结构展开引起的荧光强度降低程度。

图3 没食子酸对肌原纤维蛋白色氨酸荧光强度的影响Fig.3 Effect of gallic acid on tryptophan fluorescence intensity of myofibrillar protein
2.3 没食子酸对凝胶强度和保水性的影响
肌原纤维蛋白的凝胶强度可以反映蛋白形成凝胶的能力。从图4a可以看出,未氧化组的凝胶强度高于氧化组(p<0.05),说明加入自由基后,氧化导致蛋白质原有的结构发生变化,凝胶网络结构较弱,形成凝胶的能力降低。而添加没食子酸后,其凝胶强度随着浓度的增加而降低,与氧化组相比,10 μmol/g时差异不显著(p>0.05),50、100、150 μmol/g时,显著低于两个对照组(p<0.05),可能是由于没食子酸氧化形成醌类物质,与蛋白巯基反应生成巯基-醌加合物,阻止了蛋白质之间生成稳定的二硫键,从而使蛋白凝胶网络结构松散,凝胶强度降低,并对其持水力产生影响[23]。Yan等[24]研究发现,没食子酸使鳕鱼凝胶的凝胶强度降低,可能是足够的多酚分子覆盖在蛋白质表面引起的,这与本实验结果一致。
保水性是蛋白质重要的功能特性之一,它决定着肉及肉制品的品质,并对肉及肉制品的加工工艺的合理性起作用[25]。由图4b可知,两个对照中,加氧化剂的蛋白与未加氧化剂的相比,保水性显著降低(p<0.05),说明氧化破坏了蛋白质中C=O和N-H基团与水分子之间的结合能力,并且氧化后凝胶网络孔隙增多,使蛋白质的水合作用有所降低,从而凝胶保水性显著降低[26]。同时,随着没食子酸浓度的增加,其凝胶保水性呈现下降趋势,并且与两个对照组相比都是显著降低(p<0.05),说明添加没食子酸后,并没有对凝胶的保水性起到改善作用,反而添加量越多,保水性越低,这与本实验凝胶强度的结果一致。
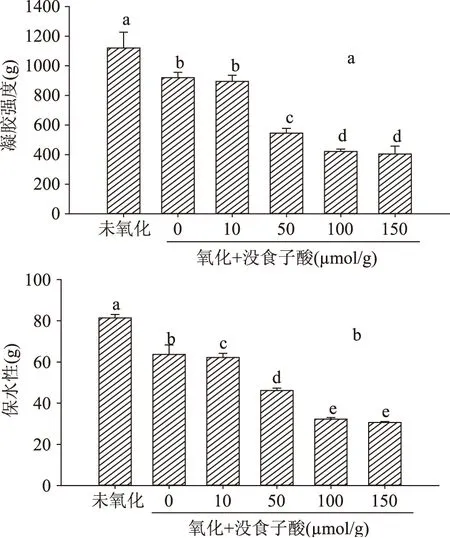
图4 没食子酸对肌原纤维蛋白凝胶强度和保水性的影响Fig.4 Effect of gallic acid on strength and water-holding capacity of myofibrillar protein gel
2.4 没食子酸对凝胶白度的影响
凝胶白度值的变化通常反映蛋白结构的变化,表现为白度值变化越大,蛋白结构变化越大[27]。由图5可知,与未氧化的蛋白相比,氧化蛋白的凝胶白度值升高,且差异显著(p<0.05)。添加没食子酸后,随着浓度的增加,凝胶的白度值逐渐增加,浓度为10、50 μmol/g时,略高于未氧化肌原纤维蛋白的白度值,低于未添加没食子酸氧化肌原纤维蛋白的白度值,浓度为100、150 μmol/g时,高于未氧化和氧化肌原纤维蛋白的白度值。在较低浓度(10、50 μmol/g)下,可能是因为Fe3+的螯合以及没食子酸氧化生成的醌类化合物使凝胶白度有所降低[19]。吕宏宇和许晓曦[28]研究发现氧化酚类化合物(阿魏酸、鞣酸和儿茶素)使鱼糜凝胶白度下降。而较高浓度(100、150 μmol/g)下,白度值增加可能是由于较高浓度破坏了蛋白质的结构,从而导致其白度值增加。

图5 没食子酸对肌原纤维蛋白白度的影响Fig.5 Effect of gallic acids on whiteness of myofibrillar protein gel
2.5 没食子酸对流变性质的影响
蛋白质的凝胶及其流变性质是食品形成独特的质构、感官和风味的决定性因素。从图6可以看出,两个对照组的肌原纤维蛋白在加热到39 ℃后弹性模量(G′)开始增加,并且在45 ℃时出现第一个峰,这是由于蛋白质发生聚合,弹性凝胶网络形成,随后45~50 ℃时蛋白质变性,G′降低,是由于一些已经形成的凝胶网络结构受到破坏[29]。当温度在50 ℃后是凝胶加强阶段,G′升高直至平稳,在此阶段通常形成不可逆的凝胶。没食子酸浓度为10 μmol/g,仍能呈现与对照组相同的流变曲线形状,并且G′最终高于对照组,说明低浓度下仍能形成较好的凝胶结构。当没食子酸浓度为50、100、150 μmol/g,温度为39~45 ℃时,G′较为平缓,失去第一个峰,当温度达到45 ℃后,G′才开始迅速上升,说明中高浓度的没食子酸降低了蛋白质形成凝胶的能力,在较高温度下才开始形成凝胶。温度达到50 ℃后,较高浓度的没食子酸(50、100、150 μmol/g)与两个对照组及10 μmol/g没食子酸组相比,G′较高,说明最终也形成了较完整的凝胶结构。

图6 没食子酸对肌原纤维蛋白流变特性的影响Fig.6 Effect of gallic acids on rheological properties of myofibrillar protein
损耗模量(G″)一般用来描述凝胶体系的粘度性能。两个对照组的G″的峰值变化趋势与G′相似,加热到45 ℃,达到一个最大值,即出现第一个峰值,从45 ℃到50 ℃,G″急剧下降,50 ℃后又开始增加,直到80 ℃。整个加热过程中,G′始终高于G″,尤其是当温度大于50 ℃时,这表明形成了一个更具弹性的蛋白凝胶。在10 μmol/g时,G″值与对照组相比略微升高,然而当添加50、100、150 μmol/g没食子酸时,G″值几乎失去了典型的“几”字形状,在45 ℃时的峰值消失,可能是由于蛋白质过度聚集导致结构发生变化,并且随着温度的增加,G″值先上升后降低。
2.6 没食子酸对微观结构的影响
通常,微观结构的变化也会影响凝胶的持水性和弹性,因此在一定程度上可以说明其凝胶特性的变化。如图7可知,与未添加氧化剂的肌原纤维蛋白相比,添加氧化剂的肌原纤维蛋白凝胶网络结构有较大的空隙,李银[30]等研究了羟自由基对肉类肌原纤维蛋白的氧化作用,发现肌原纤维蛋白样品形成多孔不规则且空隙较大的网络结构,说明氧化导致蛋白凝胶微观结构受到破坏。当添加没食子酸后,随着其浓度的增加,肌原纤维蛋白的微观结构有不同程度的变化。浓度为10 μmol/g时,能够使蛋白形成有序的结构。李明清[31]研究发现菊粉添加到肌原纤维蛋白中可使肌原纤维蛋白凝胶致密、胶束之间的孔径变小。当没食子酸浓度从50 μmol/g增加到150 μmol/g时,微观结构表现为多孔并且粗糙,这与凝胶强度和保水性的结果相一致,由于凝胶空隙较大,从而导致保水性也降低。特别是当浓度为150 μmol/g时,凝胶网络结构松散,凝聚空间不规则,蛋白胶束聚集,分布不均,蛋白网络结构较差。由此可以看出,较高浓度的没食子酸对蛋白质的凝胶结构有不利的影响,可能是较高浓度没食子酸具有促氧化作用,且对蛋白结构产生破坏,因此没有提高凝胶形成的能力。

图7 没食子酸对肌原纤维蛋白微观结构的影响Fig.7 Effect of gallic acids on microstructure of myofibrillar protein gel注:A、B、C、D、E、F分别为未氧化、氧化+没食子酸(0、10、50、100和150 μmol/g)处理组。
3 结论
在氧化体系中,不同浓度的没食子酸对猪肉肌原纤维蛋白的影响有所不同。其中较低浓度的没食子酸可以降低肌原纤维蛋白的表面疏水性并维持其流变学性质和微观结构,随着没食子酸浓度的增加,蛋白质的凝胶强度和保水性呈下降趋势,凝胶白度略有上升,色氨酸荧光强度随没食子酸浓度的增加而增加,但在150 μmol/g时略有降低。今后还需要进一步研究多酚与蛋白质间的相互作用力以及不同种类的多酚和氧化体系如何影响蛋白质的结构及功能特性。
[1]孔保华,韩建春.肉品科学与技术[M].北京:中国轻工业出版社,2011:91-98.
[2]Lund M N,Heinonen M,Baron C P,et al. Protein oxidation in muscle foods:A review[J]. Molecular nutrition & food research,2011,55(1):83-95.
[3]Frankel E N,Meyer A S. The problems of using one-dimensional methods to evaluate multifunctional food and biological antioxidants[J]. Journal of the Science of Food and Agriculture,2000,80(13):1925-1941.
[4]Ganhão R,Morcuende D,Estévez M. Protein oxidation in emulsified cooked burger patties with added fruit extracts:Influence on colour and texture deterioration during chill storage[J]. Meat science,2010,85(3):402-409.
[5]刘泽宇,刘焱,罗灿,等. 茶多酚对草鱼鱼肉蛋白质流变学特性的影响[J]. 现代食品科技,2015(6):009.
[6]Utrera M,Estévez M. Analysis of tryptophan oxidation by fluorescence spectroscopy:Effect of metal-catalyzed oxidation and selected phenolic compounds[J]. Food Chemistry,2012,135(1):88-93.
[7]吕宏宇,许晓曦. 氧化酚类化合物对鲫鱼鱼糜凝胶特性影响的研究[J]. 食品工业科技,2011(5):149-152.
[8]Jongberg S,Terkelsen L S,Miklos R,et al. Green tea extract impairs meat emulsion properties by disturbing protein disulfide cross-linking[J]. Meat science,2015,100:2-9.
[9]Park D,Xiong Y L,Alderton A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food chemistry,2007,101(3):1239-1246.
[10]张龙翔,张庭芳,李令媛,等.生物化学实验方法和技术[M].2版.北京:高等教育出版社,1997:136-137.
[11]Cao Y,Xiong Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food chemistry,2015,180:235-243.
[12]Chelh I,Gatellier P,Santé-Lhoutellier V. Technical note:A simplified procedure for myofibril hydrophobicity determination[J]. Meat science,2006,74(4):681-683.
[13]李学鹏,周凯,王金厢,等. 羟自由基对六线鱼肌原纤维蛋白的氧化规律[J]. 中国食品学报,2014(6):19-27.
[14]Salvador P,Toldra M,Saguer E,et al. Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J]. Food Hydrocolloids,2009,23(7):1654-1659.
[15]Park J A E W. Functional protein additives in surimi gels[J]. Journal of Food Science,1994,59(3):525-527.
[16]胡忠良,邹玉峰,林玉海,等. 氧化程度对肌原纤维蛋白热凝胶及理化特性的影响[J]. 食品科学,2013,34(17):19-23.
[17]LI-Chan E,Nakai S,Wood D F. Relationship between functional(fat binding,emulsifying)and physicochemical properties of muscle proteins. Effects of heating,freezing,pH and species[J]. Journal of Food Science,1985,50(4):1034-1040.
[18]胡爱军,卢秀丽,郑捷,等. 不同频率超声对鲢鱼肌原纤维蛋白结构的影响[J]. 现代食品科技,2014,30(3):23-27.
[19]孔保华,孙妍,熊幼翎.抗氧化剂对羟自由基引起的乳清分离蛋白氧化抑制效果的研究[J].食品科学,2010(3):5-10.
[20]吴伟. 蛋白质氧化对大豆蛋白结构和凝胶性质的影响[D]. 无锡:江南大学,2010.
[21]Kang J,Liu Y,Xie M X,et al. Interactions of human serum albumin with chlorogenic acid and ferulic acid[J]. Biochimica et Biophysica Acta(BBA)-General Subjects,2004,1674(2):205-214.
[22]Zhang Q T,Tu Z C,Xiao H,et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing,2014,92(1):30-37.
[23]Jongberg S,Terkelsen L S,Miklos R,et al. Green tea extract impairs meat emulsion properties by disturbing protein disulfide cross-linking[J]. Meat science,2015,100:2-9.
[24]Yan M,Li B,Zhao X,et al. Physicochemical properties of gelatin gels from walleye pollock(Theragra chalcogramma)skin cross-linked by gallic acid and rutin[J]. Food Hydrocolloids,2011,25(5):907-914.
[25]陈洪生,孔保华,刁静静,等. 氧化引起的肌肉蛋白质功能性变化及其控制技术的研究进展[J]. 食品科学,2015,11:045.
[26]李明清,孔保华,王宇,等.菊粉对鲤鱼肌原纤维蛋白凝胶特性的影响[J].食品工业科技,2010(10):105-108.
[27]陈洪生,孔保华,王宇. 蛋清蛋白对猪肉肌原纤维蛋白功能性的影响[J]. 中国食品学报,2014(5):80-84.
[28]吕宏宇,许晓曦. 氧化酚类化合物对鲫鱼鱼糜凝胶特性影响的研究[J]. 食品工业科技,2011(5):149-152.
[29]Wu M,Xiong Y L,Chen J,et al. Rheological and microstructural properties of porcine myofibrillar protein-lipid emulsion composite gels[J]. Journal of food science,2009,74(4):E207-E217.
[30]李银,李侠,张春晖,等. 羟自由基导致肉类肌原纤维蛋白氧化和凝胶性降低[J]. 农业工程学报,2013,29(12):286-292.
[31]李明清. 鲤鱼肌原纤维蛋白功能特性的研究[D]. 哈尔滨:东北农业大学,2010.
Effect of gallic acid on constructure and gel properties of pork myofibrillar protein under oxidation conditions
JIA Na,LIU Dan,ZHANG Xiao-xing,SHAO Jun-hua,LI Ru-ren,LIU Deng-yong
(College of Food Science and Technology,Bohai University;Food Safety Key Lab of Liaoning Province; National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products;Jinzhou 121013,China)
Fenton oxidation system(10 μmol/L FeCl3,100 μmol/L VCand 1 mmol/L H2O2)of myofibrillar protein was established and gallic acid(10,50,100,150 μmol/g)was added as antioxidant. The surface hydrophobicity,tryptophan intensity,gel strength,water-holding capacity,whiteness,rheological properties and microstructure of myofibrillar protein were investigated to illuminate the antioxidant effect of gallic acid and its effect on protein structure and gel properties. With the increase of gallic acid concentration,surface hydrophobicity was increased gradually,gel strength and water-holding capacity were decreased,whiteness of gel was increased slightly and microstructure was destroyed. Tryptophan fluorescence intensity was increased with the increasing of gallic acid concentration,but showed slightly lower at 150 μmol/g. At higher concentrations(50,100,150 μmol/g),the typical characteristics of rheological properties were lost. In conclusion,low concentrations of gallic acid showed antioxidant activity and had slight effect on the structure and gel properties,but high levels of gallic acid had damage effect on the protein gel properties.
oxidation;gallic acid;myofibrillar proteins;gel properties;structure
2016-06-23
贾娜(1982-),女,博士,副教授,研究方向:肉品加工及质量控制,E-mail:jiana_2010@163.com。
国家自然科学青年基金(31301509)。
TS251
A
1002-0306(2016)23-0061-06
10.13386/j.issn1002-0306.2016.23.003
