青虾幼虾发育时期性腺发育组织学研究
2016-02-07金舒博张颖关海红傅洪拓蒋速飞熊贻伟乔慧张文宜龚永生吴滟
金舒博,张颖,关海红,傅洪拓,蒋速飞,熊贻伟,乔慧,张文宜,龚永生,吴滟
(1.南京农业大学无锡渔业学院,江苏 无锡 214081;2.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业与种质资源利用重点实验室,江苏 无锡 214081;3.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
青虾幼虾发育时期性腺发育组织学研究
金舒博1,2,张颖3,关海红3,傅洪拓1,2,蒋速飞2,熊贻伟2,乔慧2,张文宜2,龚永生2,吴滟2
(1.南京农业大学无锡渔业学院,江苏 无锡 214081;2.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业与种质资源利用重点实验室,江苏 无锡 214081;3.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
采用组织切片及类固醇激素含量测定等方法,研究青虾Macrobrachium nipponense幼虾发育第1~31d的精巢、卵巢及促雄腺发育的起始时间、发育过程及成熟时间。结果表明:青虾幼虾发育到第10d(PL10)时促雄腺呈索状结构开始发育,随后经历增殖期(PL10)、合成期(PL13)和分泌期(PL19)3个发育阶段发育成熟,形成完整的促雄腺。青虾精巢和卵巢均在幼虾发育第13d(PL13)开始发育,精巢形成不规则排列的精原细胞,而卵巢生殖上皮开始分化为椭圆或多边形的卵原细胞。精巢经精原细胞期(PL13)、精母细胞期(PL16)、精细胞期(PL19)和精子期(PL22)4个发育阶段成熟,此时成熟的精巢生精小管内充满成熟的精子。卵巢经卵原细胞期(PL13)、初级卵母细胞期(PL16)、次级卵母细胞期(PL16)和卵子期(PL19)4个时期发育成熟,此时卵巢充满成熟卵子。从PL1到PL22,睾酮分泌量逐渐增加,维持在稳定水平至PL25后逐渐下降;从PL1到PL19,17β-雌二醇的分泌量逐渐增加,维持在稳定水平至PL25后逐渐下降。本研究显示:促雄腺与精巢发育过程均持续10d,但促雄腺早于精巢3d开始发育和成熟,这可为性别和生殖相关基因的筛选及性别调控机制的研究提供参考。
青虾;组织学观察;类固醇激素测定;性腺发育;性早熟
青虾Macrobrachium nipponense(日本沼虾)是我国重要的淡水经济虾类,养殖范围广泛。青虾的雌雄个体生长差异显著,雄性个体的生长速度明显快于雌性,同龄雄虾的大小约为雌虾的2~2.5倍[1]。青虾全雄群体养殖具有巨大的经济价值。
促雄腺(androgenic gland)又称为促雄性腺,与性别分化、雄性发育及维持有关,在甲壳类性别调控中发挥关键作用[2],可促使甲壳动物向雄性方向发育[3]。在性别分化的早期,植入促雄腺或注射促雄腺提取物可导致雌性甲壳动物出现雄性第二性征而雄性化[4];性别已经分化的个体,人为摘除或植入促雄腺可使性逆转,改变生理性别。围绕促雄腺开展的研究已成为近些年来甲壳动物性别决定相关研究的重点。目前已研究了青虾[5]、凡纳滨对虾Litopenaeus cannamei[6]、锯缘青蟹Scylla serrata[7]、三疣梭子蟹Portunus trituberculatus[8]、中华绒螯蟹Eriocheir sinensis[9]等甲壳动物成体促雄腺的组织学。但尚未开展有关幼虾发育过程中促雄腺的组织学研究,如青虾促雄腺分化的起始时间、发育过程及成熟时间等。
性早熟是青虾养殖过程中的严重问题。在繁殖季节,雌虾卵巢发育周期非常短,新繁育的雌虾性腺成熟早,可以在发育45d后与雄虾交配产卵,导致多代同塘、种质退化、养殖密度增大等问题,严重制约青虾养殖业的可持续发展[10]。因此,开展青虾性腺发育的研究对性腺发育调控至关重要。
本实验采用组织学切片方法研究青虾幼虾发育过程中促雄腺及性腺发育,以确定促雄腺及性腺分化的起始时间、发育过程及成熟时间;测定睾酮和17β-雌二醇的分泌量,探讨类固醇激素分泌对青虾精巢及卵巢发育的影响。
1 材料与方法
1.1 材料
野生健康的抱卵雌虾购于无锡太湖边,体质量为3.78~5.26g,养殖于实验室中,24h充气,水温维持在30℃。日换水量约为总水量的1/2,每天投喂2次,直到受精卵进入幼虾发育期。
1.2 方法
组织学观察:从幼虾发育第1~31d,每隔3d取样一次,每次取8只幼虾固定于Bouin氏固定液中,用于组织学观察。实验虾的体质量见表1。常规石蜡包埋,连续切片,切片厚6μm。Ehrlich氏苏木精与伊红对比染色,Olympus SZX16显微镜下观察。
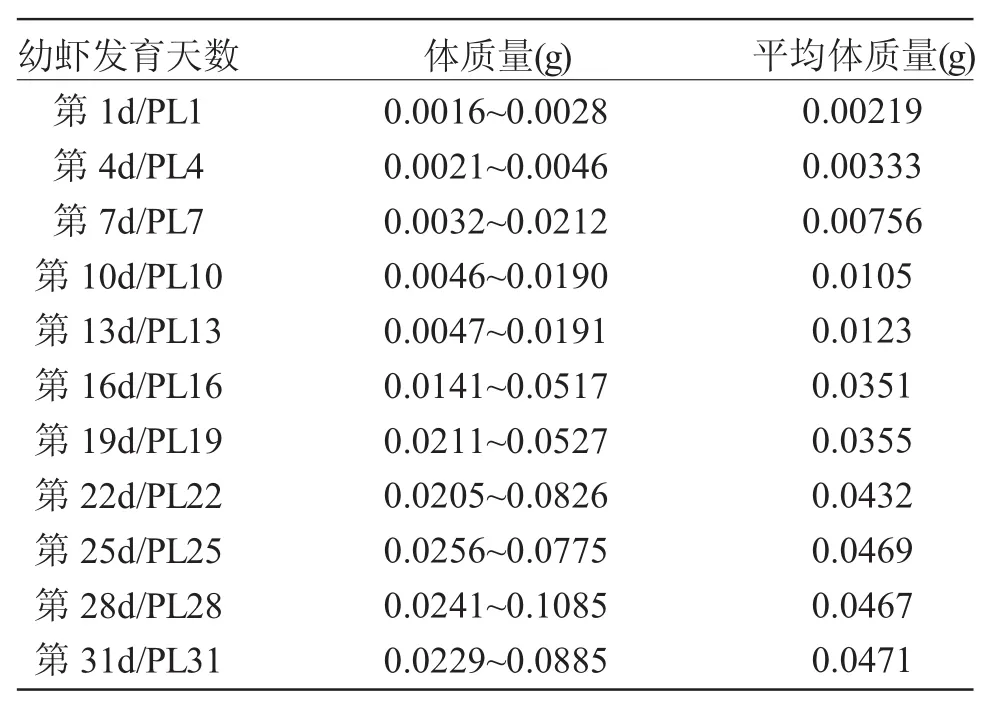
表1 组织学研究中实验虾的体质量Tab.1 The body weight of oriental river prawn(Macrobrachium nipponense)in histological observation
1.3 类固醇激素测定
从幼虾发育第1~31d,每隔3d取样一次,每次取10只用于测定类固醇激素。实验虾的体质量见表2。实验虾取样后立即保存在-20℃环境中。用Beckman Coulter Access 2测定类固醇激素的分泌量。用甲醇提取睾酮及17β-雌二醇,用BECKMAN ACESSⅡT和E2试剂盒分别测定睾酮及17β-雌二醇的分泌量。
2 结果与分析
2.1 促雄腺的组织结构及变化
增殖期:在PL10,促雄腺开始形成而进入增殖期。此期,促雄腺体积较小,成索状结构,形成少量促雄腺细胞。细胞体积小,直径约为5.67~8.69μm。细胞核呈较强的嗜碱性(图1-1)。
合成期:在PL13,促雄腺发育进入合成期。此期,促雄腺腺体及腺细胞均明显增大,腺细胞呈圆形或椭圆形,直径为12.98~17.67μm。腺细胞弱嗜碱性。腺体细胞已成典型的腺泡结构,血窦较为清晰(图1-2)。
分泌期:在PL19,促雄腺发育进入分泌期。此期,促雄腺发育成熟,腺体呈泡状化,含嗜碱性颗粒。腺细胞已不再有完整的细胞结构,核完全固化,体积很小。促雄腺与输精管肌层的连接变得疏松,有从其表面脱落的趋势,输精管中充满成熟的精子(图1-3、图1-4)。
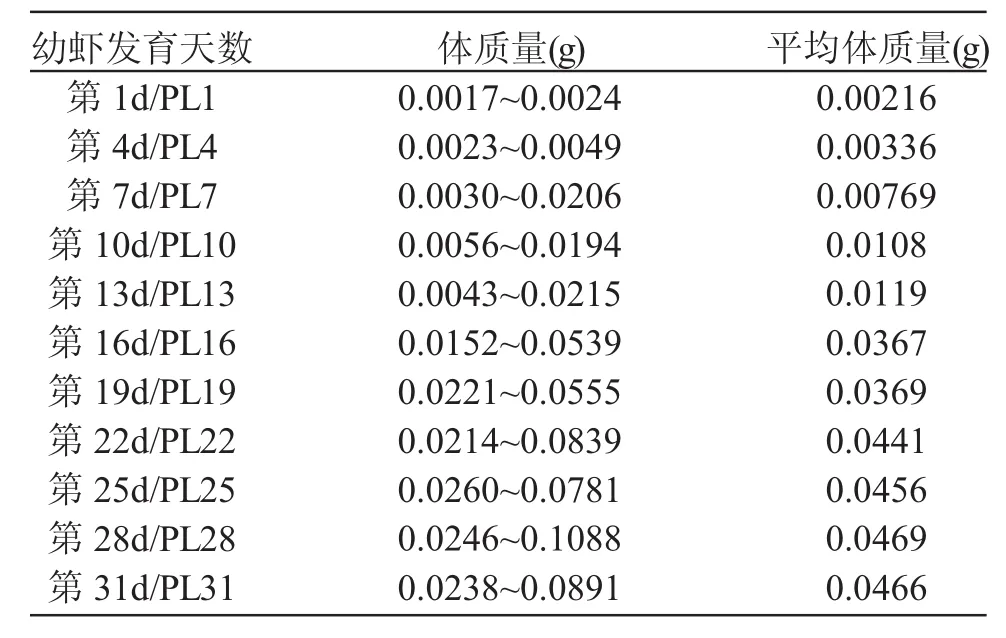
表2 测定类固醇激素含量实验中青虾的体质量Tab.2 The body weight of oriental river prawn(Macrobrachium nipponense)for steroid analysis
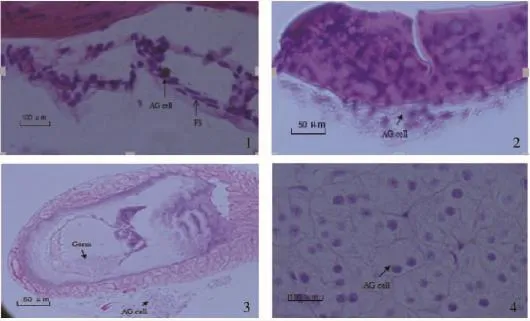
图1 青虾幼虾发育过程中促雄腺的发育Fig.1 The development of androgenic gland in post-larva prawn
2.2 精巢的结构及变化
精原细胞期:在PL13,精巢发育进入精原细胞期。在这一时期,精原细胞开始逐渐形成。精巢体积很小,输精管充满了排列不规则的精原细胞(图2-1)。
精母细胞期:在PL16,精巢发育进入精母细胞期。在这一时期,精巢及输精管体积显著增大。处于这一时期的精巢包含初级精母细胞、次级精母细胞及少量的精原细胞。大多数剩余的精原细胞正处于分化状态(图2-2)。
精细胞期:在PL19,精巢发育进入精细胞期。在这一时期,精巢体积进一步增大,仍可发现一些精母细胞及精原细胞,及少量成熟的精子(图2-3)。生精小管继续变大,营养物质散布在精细胞中。
精子期:在PL22,精巢发育进入精子期。在这一时期,精巢发育成熟,生精小管内充满着成熟的精子,但腔内仍有一定量的精母细胞(图2-4)。
退化期:在PL22,精巢发育进入退化期。此时,精巢发育停止,成熟的精子被排出。精巢进入新的发育周期,残存的精原细胞开始恢复增殖(图2-5)。
2.3 卵巢的组织结构及变化
卵原细胞期:在PL13,卵巢开始发育进入卵原细胞期。此时,生殖上皮分化出的卵原细胞呈椭圆或多边形,细胞最大直径为40.7~101.5μm。细胞核大,约占细胞体积的4/5。核中央有1个大而明显的核仁。细胞质仅在核外一薄层(图3-1)。
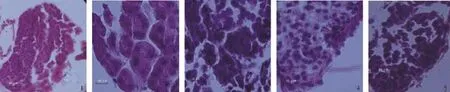
图2 青虾幼虾发育过程中精巢的发育Fig.2 The development of testis in post-larva prawn
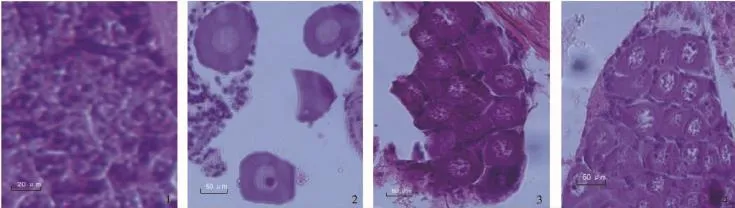
图3 青虾幼虾发育过程中卵巢的发育Fig.3 The development of ovary in post-larva prawn
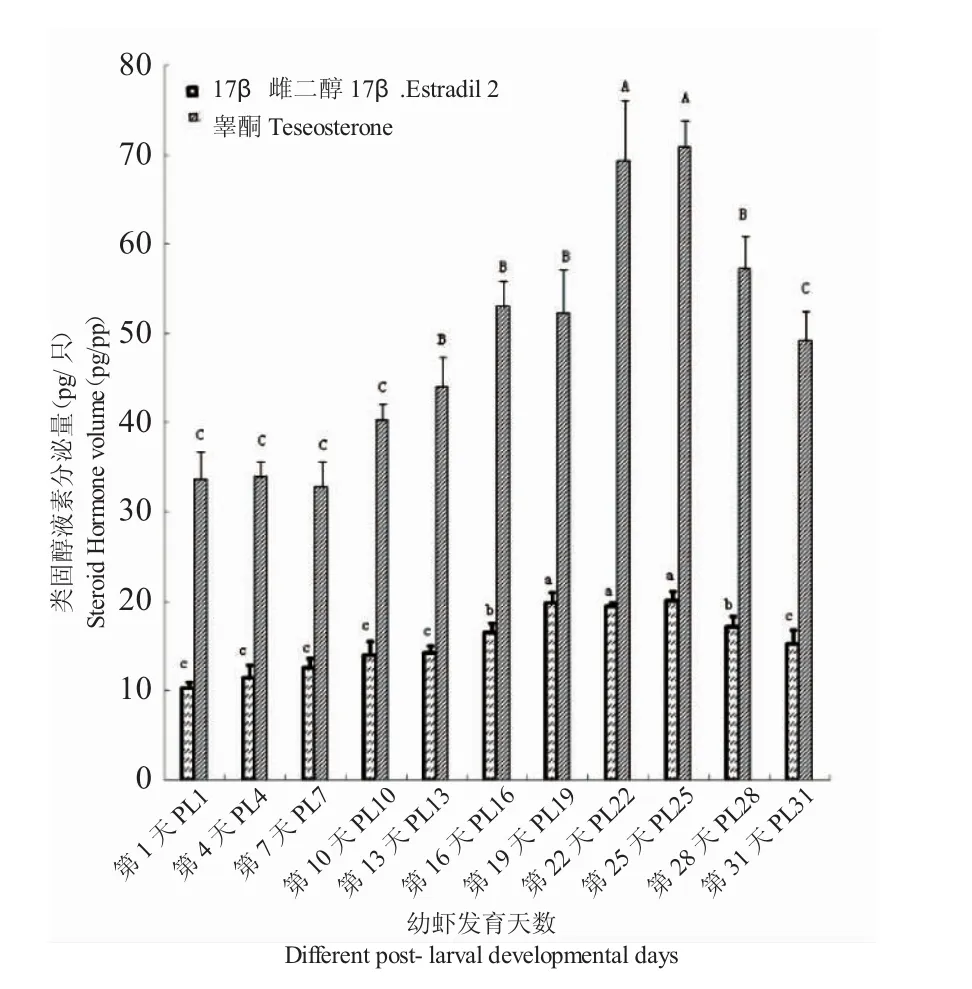
图4 青虾幼虾发育期睾酮及17β-雌二醇的分泌量Fig.4 The contents of testosterone and 17β-estradiol in the post-larva prawn
初级卵母细胞期:在PL16,卵巢发育进入初级卵母细胞期。此时,卵原细胞体积逐渐变大,变为圆形或椭圆形,成初级卵母细胞,最大细胞直径为55.7~129.1μm。核质比例相对减小,无卵黄积累,细胞质区增厚是营养物质开始增长的预兆(图3-2)。
次级卵母细胞期:在PL16,卵巢发育进入次级卵母细胞期。此时,营养物质迅速积累,空泡内外已有卵黄粒积累。卵黄的堆积使得卵细胞体积大幅增加,最大细胞直径可达69.5~164.7μm。细胞核位于细胞中央,圆形,有数个小核仁(图3-3)。
卵子期:在PL19,卵巢发育进入卵子期。卵巢发育成熟并生成卵子。此时营养物进入成熟期。卵黄颗粒在空泡内外先后沉积,充塞了几乎全部细胞,使得卵细胞相互挤压呈多边形,最大直径为409.5~517.3μm。已不见细胞核(图3-4)。
退化期:在PL19,卵巢进入退化期。此时,卵巢中成熟的卵子排出,剩余的卵原细胞回到初级卵母细胞期,并开始恢复生殖功能,卵巢进入新的发育周期。
2.4 睾酮与17β-雌二醇的分泌量
青虾幼虾发育过程中睾酮的分泌量从PL1的33.69pg/尾逐渐增加到PL22的69.27pg/尾,然后维持在稳定水平到PL25,之后开始逐渐下降;17β-雌二醇的分泌量从PL1的10.26pg/尾逐渐增加到PL19的19.77pg/尾,然后维持在稳定水平到PL25,之后开始逐渐下降(图4)。统计学分析结果显示:在性腺发育成熟期,睾酮与17β-雌二醇的分泌量显著高于其他发育阶段(P<0.05)。
3 讨论
3.1 促雄腺发育研究
促雄性腺与性别分化、雄性发育及维持有关,在甲壳类性别调控中发挥着关键作用[2]。根据促雄腺发育的形态变化,可将甲壳动物的促雄腺分为不同的发育阶段,如鲸螯虾Orconectes nais的促雄腺分为4个发育时期[11],长额虾Pandalus platyceros分为6个时期[12],中华绒螯蟹划分为3个时期[13]。根据组织学观察,青虾促雄腺在PL10开始分化,随后经历增殖期(PL10)、合成期(PL13)和分泌期(PL19),在PL19发育成熟,形成完整的促雄腺结构。而在PL10时,性腺原基已发育成熟,可分化为精巢或卵巢。
3.2 精巢和卵巢发育的研究
青虾精巢在PL13开始分化,随后经历精原细胞期(PL13)、精母细胞期(PL16)、精细胞期(PL19)和精子期(PL22)4个发育时期,在PL22发育成熟。促雄腺与精巢发育过程均持续10d,但促雄腺早于精巢3d开始发育和成熟,表明促雄腺的发育可调控精巢发育[5]。溪蟹Potamon koolooense的促雄腺和精巢发育与本文中所述的结果相似,当促雄腺最大时,精巢刚好启动精子发生;当精子发育时,促雄腺逐渐缩小[14]。卵巢也从PL13开始分化,随后经历卵原细胞期(PL13)、初级卵母细胞期(PL16)、次级卵母细胞期(PL16)、卵子期(PL19),在PL19发育成熟。与其他的水产物种相似,青虾精巢和卵巢经历4个发育时期,直至成熟并退化[15-18]。测定睾酮及17β-雌二醇的分泌量已为多种水产动物的性腺发育提供了依据。本实验中,睾酮的分泌量从PL1到PL22逐渐上升,并维持在稳定的分泌水平直到PL25,然后逐渐下降;然而,17β-雌二醇的分泌量从PL1~PL19逐渐上升,并维持在稳定的分泌水平直到PL25,然后逐渐下降。该结果与组织学观察结果一致,证明精巢在PL22发育成熟,而卵巢在PL19发育成熟。类固醇激素在幼虾发育后期分泌量下降表明,精巢和卵巢进入了新的发育周期。该结果说明,近亲繁殖不但发生在新生的雌虾与亲本雄虾之间,还可以发生在新生雄虾与亲本雌虾之间,这严重制约着青虾产业的可持续发展。Zhang等[19]报道,在28℃水温条件下,青虾在PL11可观察到性腺原基,卵巢在PL18开始分化,而精巢在PL20开始分化。该结果显示,温度可显著促进青虾性腺的发育。
组织学观察发现,同一天发育的幼虾的性腺发育状况差异极显著。例如,在PL19实验虾中,体质量为0.0289g的幼虾卵巢仅发育到初级卵母细胞期,而体质量为0.0466g及0.0517g的幼虾卵巢则分别发育到次级卵母细胞期及卵子期。另外在PL22,体质量为0.0254g的幼虾精巢仅发育到精母细胞期,而体质量为0.0756g及0.1117g的幼虾精巢则分别发育到精细胞期及精子期。该结果表明,青虾精巢和卵巢的发育状况与其体长及体质量显著相关。
[1]金舒博,王宁,乔慧,等.青虾高血糖激素基因全长cDNA序列的克隆及表达分析[J].中国水产科学,2013,20(1): 1-11.
[2]Ventura T,Manor R,Aflalo E D,et al.Temporal silencing of an androgenic gland-specific insulin-like gene affecting phenotypical gender differences and spermatogenesis[J]. Endocrinology,2009,150(3):1278-1286.
[3]Ventura T and Sagi A.The insulin-like androgenic gland hormone in crustaceans:from a single gene silencing to a wide array of sexual manipulation-based biotechnologies[J].BiotechnologyAdvances,2012,6:1543-1550.
[4]Suzuki S and Yamasaki K.Sex-reversal of male Armadillidium vulgare(Isopoda Malaeostraea,Crustacea)following andrectomy and partial gonadectomy[J].General and Comparative Endocrinology,1991,83(3):375-378.
[5]吴萍,杨立荣,崇加荣,等.日本沼虾促雄腺的研究[J].水利渔业,2002,22(5):21-23.
[6]赵光凤,李广丽,朱春华.凡纳滨对虾促雄性腺的组织学初步观察[J].广东海洋大学学报,2010,30(6):74-77.
[7]管卫兵,王桂忠,李少菁,等.锯缘青蟹促雄腺和胸腹神经团的直接联系[J].中国水产科学,2005,12(4):397-401.
[8]苏青,朱冬发,杨济芬,等.三疣梭子蟹促雄腺显微和亚显微结构的研究[J].水产科学,2010,29(4):193-197.
[9]肖美南,徐佳念,蔡生力,等.中华绒螯蟹促雄性腺素分离、纯化的初步研究[J].上海海洋大学学报,2010,19(1):28-33.
[10]Qiao H,Xiong Y,Zhang W,et al.Characterization,expression,and function analysis of gonad-inhibiting hormone in oriental river prawn,Macrobrachium nipponense and its induced expression by temperature[J].Comparative Biochemistryand Physiology,Part A,2015,185:1-8.
[11]Carpenter M B and deRoos R.Seasonal morphology and histologyoftheandrogenicglandofthecrayfish,Orconectes nais[J].General Comparative Endocrinology,1970,15(1):143-157.
[12]Hoffman DL.The development ofthe androgenic glands of aprotandricshrimp[J].BiolBull,1969,137(2):286-296.
[13]邱高峰,吴萍,楼允东.中华绒螯蟹促雄腺的结构与功能[J].水产学报,2000,24(2):108-112.
[14]Joshi P C and Khanna S S.Studies on the androgenic gland ofthe freshwater crab,Potamon koolooense(Rathbum)[J].Zmikrosk-anat Forsch Leipzig,1987,101(4): 699-713.
[15]邓道贵,胡艳玲.粗糙沼虾精巢发育的组织学[J].动物学杂志,2002,37(3):62-65.
[16]罗宇良,吴志新,陈孝煊,等.红螯螯虾精巢发育的组织学研究[J].华中农业大学学报,1999,18(1):78-80.
[17]何绪刚,张训蒲,龚世园,等.武湖日本沼虾卵巢发育研究[J].华中农业大学学报,2002,21(2):148-151.
[18]马丹丹,康现江,董丽君,等.中华绒螯蟹精巢发育组织学[J].水产科学,2006,25(6):291-296.
[19]ZhangY P,Sun S M,Fu H T,et al.Characterization ofthe male-specific lethal 3 gene in the oriental river prawn, Macrobrachium nipponense[J].Genetic Molecular Research,2015,14(2):3106-3120.
Histological Observation of Gonadal Development During Post-larva in Oriental River Prawn,Macrobrachium nipponense
JIN Shu-bo1,2,ZHANG Ying3,GUAN Hai-hong3,FU Hong-tuo1,2,JIANG Su-fei2,XIONG Yi-wei2, QIAO Hui2,ZHANG Wen-yi2,GONG Yong-sheng2,WU Yan2
(1.Wuxi Fisheries College,Nanjing Agricultural University,Wuxi 214081,China; 2.Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization,Ministry of Agriculture,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi 214081,China; 3.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
In this study,histological method and steroid hormone detection were used to analyze the beginning period,developmental process and mature period of gonad including testes,ovary,and androgenic gland during post-larvae of oriental river prawn(Macrobrachium nipponense).The histological analysis revealed that the initial development of funicular androgenic gland with a few androgenic gland cells was observed at post-larval stage of 10 days(PL10).The androgenic gland development was divided into 3 developmental stages:proliferating phase at PL10,synthesis phase at PL13 and secretary phase PL19,full maturity at PL19.Both small testes and ovary were found to begin to develop at PL13 when the spermatogonia with irregular arrangement were the first time observed. Oogonia differentiated from germinal epithelia were oval or polygon in shape.The testis development was divided into 4 stages including spermatogonium stage,spermatocyte stage,sperm cell stage and sperm stage and matured at PL22 when the seminiferous tubule of matured testis was filled with mature spermatozoa.The ovary development was divided into 4 stages including oogonia stage,primary oocyte stage,secondary oocyte stage and ovum stage,matured at PL19 when the matured ovary was full of ovum.The 17β-E2 levelwas shown to be gradually increased from 10.26 pg/prawn at PL1 to 19.77 pg/prawn at PL19,constant until PL25,and then the 17β-E2 level was gradually decreased.The level of 17α-T,however,was gradually increased from 33.69 pg/prawn at PL1 to 69.27 pg/prawn at PL22,constant until PL25,and then gradually decreased.Both androgenic gland and gonad were developed in 10 days,3 days earlier in development and maturity of androgenic gland than those in gonad.The findings provide information for the screening of the genes related to sexual differentiation and reproduction and for the mechanism of sex control during the developmental process.
Macrobrachium nipponense;histological observation;steroid hormone detection;gonadal development;sexual precocity
S954.48
A
1005-3832(2016)04-0011-06
2016-05-16
中央级科研院所基本科研业务费(2015JBFM11);国家自然科学基金(31502154).
金舒博(1986-),男,助理研究员,从事水产动物遗传育种研究.E-mail:jinsb@ffrc.cn
傅洪拓(1964-),研究员,博士生导师,从事水产动物遗传育种研究.E-mail:fuht@ffrc.cn
