奥曲肽联合恩替卡韦对乙型肝炎相关晚期肝癌患者的临床疗效观察
2016-01-25马艳丽
马艳丽
奥曲肽联合恩替卡韦对乙型肝炎相关晚期肝癌患者的临床疗效观察
马艳丽
【摘要】目的 观察奥曲肽联合恩替卡韦对乙型肝炎相关晚期肝癌的临床疗效和安全性。方法 选择2012年6月~2014年12月在我院住院的乙型肝炎相关晚期肝癌患者90例,分为奥曲肽联合恩替卡韦治疗组(A组22例),奥曲肽治疗组(B组23例),恩替卡韦治疗组(C组21例)和单纯内科保肝组(D组24例)。随访监测治疗后4、12、24及48W肝功能、AFP、HBV-DNA定量、腹部彩色超声或CT,每4W对患者生活质量包括食欲、体重及乏力等情况进行现场或电话随访,所有患者随访4~48 W。结果 奥曲肽联合恩替卡韦治疗组,奥曲肽治疗组,恩替卡韦治疗组生活质量较常规治疗组改善,生存时间延长,其中奥曲肽联合恩替卡韦治疗组最明显,其次为奥曲肽治疗组与抗病毒治疗组,常规治疗组无改善,P<0.05,差异具有统计学意义。结论 奥曲肽联合恩替卡韦治疗乙型肝炎相关晚期肝癌可提高生活质量、延长生存时间,提高生存率等,且不良反应轻。
【关键词】原发性肝癌,肝炎病毒,乙型,奥曲肽,恩替卡韦
原发性肝癌是我国常见的恶性程度较高的肿瘤之一,就医时大多已是晚期,已无手术机会,且放化疗及免疫治疗效果差。研究表明[1],生长抑素及其类似物可抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,并应用于肿瘤治疗方面。乙型肝炎病毒感染是肝癌发生、发展的重要危险因素,抑制病毒复制,控制炎性活动,改善肝功能,将有助于提高HBV相关性肝癌患者的总体生存率,乙型肝炎相关肝癌的抗病毒治疗日益受到医师的重视[2]。我们应用奥曲肽联合恩替卡韦治疗乙型肝炎相关性晚期肝癌获得较好效果,具体报告如下。
1 临床资料与方法
1.1 临床资料
选取2012年6月~2014年12月在我院住院治疗的乙型肝炎相关晚期肝癌患者90例。年龄41~72岁,男性84例,女性6例,平均年龄(56.8±8.4)岁。入组标准:(1)所有患者诊断均符合《2010年慢性乙型肝炎防治指南及2011年版原发性肝癌诊疗规范的标准》。(2)HBV-DNA阳性。(3)不能进行手术、肝动脉化学治疗栓塞及肝移植治疗的晚期肝癌。(4)预计生存期大于3个月。排除标准:(1)继发的肝肿瘤。(2)合并其他类型慢性肝脏疾病。(3)合并严重心血管疾病、呼吸系统疾病等或其他系统肿瘤。(4)对奥曲肽过敏或有肌注及皮下注射禁忌证。
1.2 分组及治疗方法
按治疗方案将患者随机分为4组:奥曲肽联合恩替卡韦治疗组(A组22例),患者一般治疗基础上应用奥曲肽0.1 mg皮下注射,12 h/次,口服恩替卡韦片,每次0.5 mg,每日1次。奥曲肽治疗组(B 组23例),常规治疗基础上应用奥曲肽。恩替卡韦治疗组(C组21例),常规治疗基础上口服恩替卡韦。单纯内科保肝组(D组24例),采用单纯常规内科治疗。常规治疗包括止痛﹑纠正水电解质紊乱﹑补充能量﹑保肝﹑抗感染、利尿等支持治疗。奥曲肽针剂,为瑞士诺华制药公司提供,应用前使药液达到室温,在两餐之间注射。恩替卡韦片剂为正大天晴公司生产。4组患者在病程、年龄、性别比、肝功能分级、HBV DNA定量、AFP水平等比较,P>0.05,差异不具有统计学意义。
1.3 观察指标
在治疗前所有患者均常规检查肝功能、凝血常规、HBV DNA定量、甲胎蛋白(AFP)、腹部彩色超声或肝CT,在治疗后4、8、12、24 W复查。肝功能、凝血常规、AFP,应用全自动生化仪检测,HBV DNA定量应用荧光PCR扩增仪完成。幷计算患者Child-Pugh评分。每4周对患者生活质量包括食欲、体重(排除腹水影响因素)及乏力等情况进行随访,所有患者随访4~24周。生存期为治疗开始至死亡或失访的时间。
1.4 统计学方法
用SPSS16.0统计学软件进行数据分析,计量资料用(均数士标准差)(±s)表示,采用t检验,计数资料用率表示,采用χ2检验,P<0.05,差异具有统计学意义。
2 结果
2.1 Child-Pugh评分的变化
治疗前对4组患者Child-Pugh评分,P>0.05,差异不具有统计学意义。不同组别Child-Pugh评分随时间延长均逐渐上升,但于治疗12 W及24 W时奥曲肽联合恩替卡韦治疗组、奥曲肽治疗组、恩替卡韦治疗组均低于单纯内科保肝组,且A组与B组、C组比较,P<0.05,差异具有统计学意义,B组和C组比较,P >0.05,差异不具有统计学意义;A组低于D组,P<0.05,差异具有统计学意义。见表1。
2.2 HBV DNA水平的变化
奥曲肽联合恩替卡韦治疗组和恩替卡韦治疗组HBV DNA水平随治疗逐渐降低,且与奥曲肽治疗组、内科保肝组相比较,P <0.05,差异具有统计学意义。而奥曲肽治疗组、单纯内科保肝组HBV DNA水平无明显变化。奥曲肽联合恩替卡韦治疗组、及恩替卡韦组在12 w以后大部分患者HBV DNA转阴,而奥曲肽治疗组、单纯内科保肝组无发生阴转患者。见表2。
2.3 生活质量的影响
观察治疗对乙型肝炎相关原发性肝癌患者的食欲、睡眠、疼痛、体重和乏力状况等,在治疗后每4 w进行评估,连续评定24 w。结果显示:奥曲肽联合恩替卡韦治疗组、奥曲肽治疗组及抗病毒治疗组24 w内患者食欲增加、睡眠改善、疼痛减轻、乏力好转,KPS评分较常规治疗组高,其中奥曲肽联合恩替卡韦治疗组最明显,P<0.05,差异具有统计学意义,生活质量评定采用KPS评分。见表3。
2.4 生存情况影响
观察乙型肝炎相关原发性肝癌患者的中位生存期影响。奥曲肽联合恩替卡韦治疗组10.5个月、奥曲肽治疗组中位生存期7.2个月、恩替卡韦治疗组7.4个月,常规治疗组为4.3个月。奥曲肽联合恩替卡韦治疗组、奥曲肽治疗组及恩替卡韦治疗组24 w生存高于常规治疗组,P<0.05,差异具有统计学意义。观察乙型肝炎相关原发性肝癌患者累积生存率情况,结果显示:奥曲肽联合恩替卡韦治疗组、奥曲肽治疗组、恩替卡韦治疗组与常规治疗组患者24 w生存率分别为81.8%(18例)、69.6%(16例)、71.4%(15例)、45.8%(11例)。奥曲肽联合恩替卡韦治疗组、奥曲肽治疗组及恩替卡韦治疗组24 w生存率高于常规治疗组,P<0.05,差异具有统计学意义。
2.5 不良反应
应用奥曲肽治疗的不良反应轻,主要表现为阵发性恶心、呕吐、腹痛、腹胀、腹泻及皮下注射处疼痛,但较轻,一般不需停药或特殊处理,且均为可逆,停药后消失。
3 讨论
原发性肝癌是我国常见的恶性肿瘤之一,其发生率和病死率居恶性肿瘤的第二位。且逐年上升,对人们的健康造成威胁。原发性肝癌的根治性方法包括手术切除及肝移植,然而,80℅以上的患者病情已到晚期,无法应用上述治疗方法。经肝动脉栓塞化疗或全身化疗是肝癌的二线治疗手段,但整体治疗效果并不理想。因此,寻找新的治疗方案,特别是有利于晚期患者生活质量的姑息治疗方案,及易被大多患者接受的药物成为临床工作者的任务,具有临床意义。生长抑素在抑制肿瘤生长等方面有较显著的作用,生长抑素及其类似物的抗肿瘤机理可分为两条途径,包括生长抑素受体介导途径和非受体介导途径。奥曲肽是人工合成的生长抑素八肽类似物,因具有作用强、半衰期长、作用持久等特点,在临床上应用广泛并获得较好疗效。体外及动物实验提示奥曲肽有较明显的抗肝脏肿瘤作用。王春晖[3]等研究发现奥曲肽可通过抑制DNA合成及介导肿瘤细胞凋亡等抗肿瘤。Schally[4]等通过对部分肝切除鼠的肝脏及皮下移植肝细胞癌研究,提示奥曲肽可使肝细胞癌体积缩小。Jia等[5]对种植了人肝癌细胞系移植瘤的裸鼠研究,发现奥曲肽可抑制肿瘤新血管生成,肿瘤细胞的生长变慢。目前认为奥曲肽作用机制:(1)抑制肝脏肿瘤生长:通过抑制DNA合成及介导肿瘤细胞凋亡以抗肿瘤。(2)可抑制肝脏部分切除后肿瘤细胞的再生,增加肝网状内皮细胞系统的活性,使肝肿瘤生长变慢。(3)可延缓肝脏部分切除对肿瘤的促生长作用。(4)抑制肿瘤血管生成[6-8]。乙型肝炎病毒是原发性肝癌常见的病因之一,高病毒载量是肝癌发生、发展及预后的重要因素。外科手术、局部栓塞化疗、放射治疗等可促使体内乙肝病毒复制活跃,影响疗效。乙肝病毒感染作为贯穿肝癌发生、发展全过程的影响因素,在乙肝相关性肝癌治疗中越来越得到重视。抗病毒治疗对HBV相关性肝癌的治疗是目前的研究热点,Cheng[9]等的研究显示,抗病毒组与对照组的中位生存期分别为12.5个月和6个月,P<0.05,差异有统计学意义。Nan[10]等报道第1年和第2年治疗组的生存率分别为41.9%和7.0%,对照组分别为33.3%和2.0%,P<0.05,差异有统计学意义。Teiji[11]认为抗病毒处理可以延长生存时间。抗病毒治疗通过抑制病毒复制、改善肝功能,延长生存时间[12-15]。原发性肝癌是恶性肿瘤,生存期较短,因此抗病毒药物需起效快,抑制病毒复制,来延缓病情进展。在我国现在上市的抗乙肝病毒药物中,恩替卡韦是作用最强的药物之一,优点是抗病毒强效、快速、耐药发生率低,且安全性好,不良反应少,是专家推荐核苷类似物单药治疗的一线用药。根据以上理论和实践,我们设计了奥曲肽联合恩替卡韦治疗乙型肝炎相关性晚期肝癌的临床研究课题。结果显示奥曲肽联合恩替卡韦治疗组,奥曲肽治疗组,恩替卡韦治疗组生活质量较常规治疗组改善,生存时间延长,其中奥曲肽联合恩替卡韦治疗组最明显,其次为奥曲肽治疗组与抗病毒治疗组,常规治疗组无改善,P<0.05,差异具有统计学意义。所有患者均未出现因使用奥曲肽和恩替卡韦而产生的严重不良反应。奥曲肽联合恩替卡韦治疗乙肝相关晚期肝癌可延长生存期、提高生存质量,是一种安全、不良反应少的治疗方法。但对于奥曲肽联合恩替卡韦治疗的最佳剂量、用药时机、给药途径等问题,我们将进行更多的样本、进一步监测、长期随访研究来证实。
表1 各组不同时期Child-Pugh评分比较(±s)
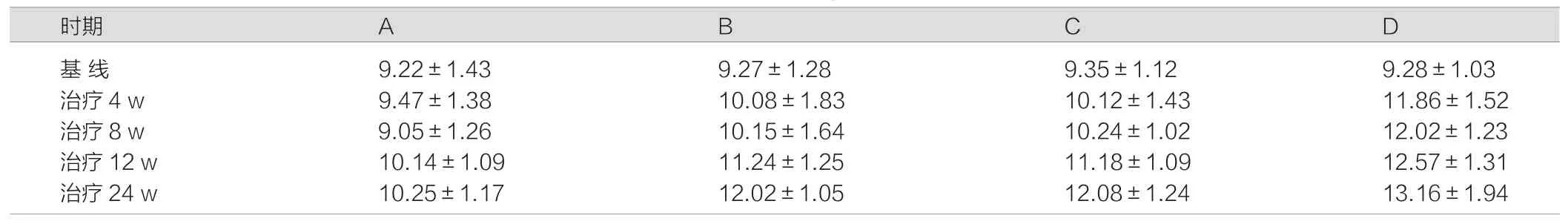
表1 各组不同时期Child-Pugh评分比较(±s)
注:A组:奥曲肽联合恩替卡韦治疗组;B组:奥曲肽治疗组;C组:恩替卡韦治疗组;D组:单纯内科保肝组。
时期 A B C D 基 线 9.22±1.43 9.27±1.28 9.35±1.12 9.28±1.03治疗4 w 9.47±1.38 10.08±1.83 10.12±1.43 11.86±1.52治疗8 w 9.05±1.26 10.15±1.64 10.24±1.02 12.02±1.23治疗12 w 10.14±1.09 11.24±1.25 11.18±1.09 12.57±1.31治疗24 w 10.25±1.17 12.02±1.05 12.08±1.24 13.16±1.94
表2 各组不同时期HBVDNA水平比较±s,log10 IU/ml)

表2 各组不同时期HBVDNA水平比较±s,log10 IU/ml)
注:A组:奥曲肽联合恩替卡韦治疗组;B组:奥曲肽治疗组;C组:恩替卡韦治疗组;D组:单纯内科保肝组。
时期 A B C D基线 4.28±1.47 4.53±1.56 4.47±1.35 4.34±1.49 4 w 3.35±1.25 4.28±1.67 3.28±1.41 4.42±1.38 8 w 2.26±1.35 4.09±1.72 2.46±1.37 4.61±1.53 12 w 2.13±0.14 4.06±1.64 2.18±1.43 4.42±1.49 24 w 2.03±0.03 4.02± 1.38 2.12±0.12 4.70±1.52
表3 各组不同时期KPS评分比较(±s)
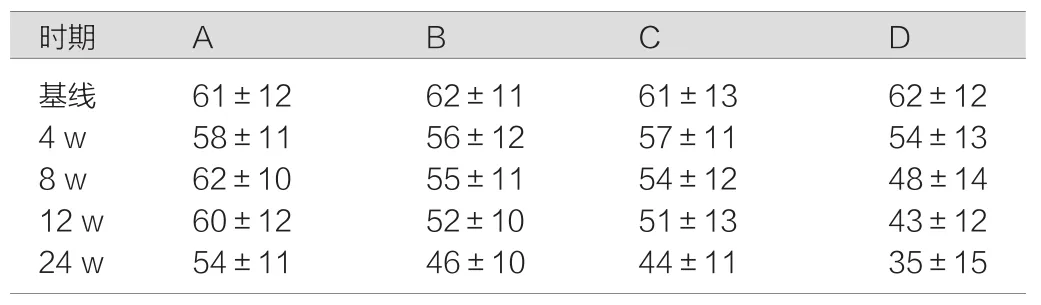
表3 各组不同时期KPS评分比较(±s)
注:A组:奥曲肽联合恩替卡韦治疗组;B组:奥曲肽治疗组;C组:恩替卡韦治疗组;D组:单纯内科保肝组。
时期 A B C D基线 61±12 62±11 61±13 62±12 4 w 58±11 56±12 57±11 54±13 8 w 62±10 55±11 54±12 48±14 12 w 60±12 52±10 51±13 43±12 24 w 54±11 46±10 44±11 35±15
参考文献
[1] 邱婷婷,谢艳. 生长抑素类似物治疗原发性肝细胞肝癌研究进展[J]. 西部医学,2013,25(10):1590-1593.
[2] 中华医学会肝病学会肝癌学组. HBV/HCV相关性肝细胞癌抗病毒治疗专家建议[J]. 中华实验和临床感染病杂志(电子版),2012,6(6):651-655.
[3] 王春晖,唐承薇,汤丽平. 奥曲肽抑制肝癌生长的实验研究[J].中华医学杂志,2001,81(19):1194-1197.
[4] Schally AV. Ontological applications of somatostasion analogues[J]. Cancer Rcs,1988,48(24):6977-6985.
[5] Jia WD,Xu GL,Xu RN,et al.Octreotide acts as an antitumorangiogenesis compound and suppresses tumor growth in nudemice bearing human hepatocellular carcinoma xenografts[J]. Cancer Res Clin Oncol,2003,129(6):327-334.
[6] 霍立,刘海林,王磊. 奥曲肽对人肝癌细胞生长增殖、甲胎蛋白合成及细胞凋亡的作用[J]. 中华消化杂志,2002,22(6):331-334.
[7] Diaconu CC, Szathmari M , Keri G, et al. Apoptosis is inducedin both drug-s ensitive and multidrug-resistant hepatoma cells bysomatostatin analogue TT-232[J]. BrJ Cancer,1999,80(8):1197-1203.
[8] Dimitroulopoulos D, Xinopoulos D, Tsamakidis K, et al. The role of sandostatin LAR in treating patients with advanced hepatocellular cancer[J]. Hepato-gastroenterology,2002,49(47):1245-1250.
[9] Cheng Shuqun, Ding Guanghui, Shi Jie, et al. Role of Antivirus Therapy in Treatment of Hepatocellular Carcinoma with Chronic Hepatitis B Infection[J]. The Chinese-German Journal of Clinical,2005(4):330-333.
[10] Li N, Lai EC, Shi J, et al. A Comparative study of antiviraltherapy after resection of hepatocellular carcinoma in the immune-active phase of hepatitis B virus infection[J]. Surgical Oncol,2010,17(1):179-185.
[11] Teiji Kuzuya, Yoshiak Katano, Takashi Kumada, et al. Efficacyof antiviral therapy with lamivudine after initial Treatment forhepatitis B virus-related hepatocellular carcinoma[J]. Journal of Gastroenterology and Hepatology,2007(22):1929-1935.
[12] 藏允红,丁明权,何登明. HBV-DNA阳性的中晚期肝癌预后因素分析及抗病毒治疗对生存期的影响[J]. 临床肝胆病杂志,2011,27(6):632-634.
[13] 郭宏华,晁阳,李岩,等. 抗病毒治疗对乙型肝炎相关原发性肝癌患者生活质量及预后的影响[J]. 肝脏,2012,17(2):83-86.
[14] 张健,蔺淑梅,杨雪亮,等. 肝功能失代偿期的乙型肝炎相关肝癌抗病毒治疗的生存分析[J]. 中华实验和临床感染病杂志(电子版),2014,8(2):13-16.
[15] 冯红萍,姜雪强,刘彦威,等. 乙型肝炎相关原发性肝癌35例抗病毒治疗临床观察[J]. 中华临床医师杂志(电子版),2013,7 (15):172-175.
作者单位:274000山东省菏泽市立医院消化内科
Clinical Curative Observation Effect of Octreotide Combine With Entecavir on Hepatitis B Virus-related Advanced Hepatocellular Liver Cancer
MA Yanli Heze City Municipal Hospital Department of Gastroenterology, Heze 274000, China
[Abstract]Objective Observation the clinical efficacy and safety of OCT combinewith ETV on patients with hepatitis B virus-related advanced hepatocellular carcinoma. Methods Selected 90 patients with hepatitis B virusrelated advanced hepatocellular carcinoma hospitalized from June 2012 to December 2014 in our hospital, were randomly divided into the OCT combined with ETV group ( group A, n=22 ), OCT group ( group B, n=23 ), ETV group ( group C, n=21) and pure medical liver protection group ( group D, n=24). Liver function, AFP, HBV-DNA, abdominal color ultrasound or CT were quantified at 4, 12, 24, 48 weeks. The patient's appetite, weight and lack of power were followed up by on-site or telephone. All patients were followed up from 4 weeks to 48 weeks. Results Compared with the routine treatment group, quality of life and survival time of patients in OCT combined with ETV group, OCT group and ETV group improved. Among them, those of patients in OCT combined with ETV group were the most obvious, followed with OCT group and ETV group. Routine treatment group showed no improvement, P<0.05, had difference statistically significance. Conclusion OCT combined with ETV with less adverse reaction can improve the quality of life and survival rate and prolong the survival time to patients with hepatitis B virus-related advanced hepatocellular carcinoma.
[Key words]Primary hepatic carcinoma, Hepatitis B, Octreotide, Entecavir.
doi:10.3969/j.issn.1674-9308.2015.23.112
【文章编号】1674-9308(2015)23-0153-03
【文献标识码】B
【中图分类号】R512.6+2
