毕赤酵母高密度发酵产β—甘露聚糖酶的工艺优化
2016-01-08张晓龙肖静王瑞明
张晓龙+肖静+王瑞明
摘要:以表达β-甘露聚糖酶的毕赤酵母工程菌为研究对象,采用摇瓶发酵确定碳源、接种量、温度、pH基础条件,通过30 L发酵罐高密度发酵,探究菌体浓度、甲醇浓度、甲醇补料方式、溶氧量等条件对目的蛋白产量的影响,并通过正交试验优化发酵工艺条件。结果表明,最佳产酶条件为接种量10%,初始葡萄糖质量浓度30 g/L,诱导温度28 ℃,pH 5.0,溶氧量10%~20%。在此发酵条件下,最终细胞干重135 g/L,目的蛋白表达量5.04 g/L,最高酶活力29 600 U/mL,较优化前提高24倍,已满足工业化要求。
关键词: β-甘露聚糖酶; 巴斯德毕赤酵母; 高密度培养; 发酵优化
中图分类号:Q815 文献标识码:A 文章编号:0439-8114(2015)23-5978-06
DOI:10.14088/j.cnki.issn0439-8114.2015.23.047
Optimization Technology of β-Mannanase Fermented by Pichia pastoris
ZHANG Xiao-long,XIAO Jing,WANG Rui-ming
(Institute of Biological Engineering of Qilu University of Technology, Shandong Province Key Laboratory of Microbial Engineering,
Jinan 250353,China)
Abstract:The fermentation conditions of genetically engineered Pichia pastoris for β-Mannanase were studied. Basic conditions of the carbon source, immunization rates, temperature, pH were optimized in shake-flask. The tests in 30 L fermenter was applied to study the effects of DCW,methanol concentration and DO on enzyme production. Through the orthogonal design to optimize the fermentation conditions. The results indicated that the optimum conditions were as follows:10% inoculum size,30 g/L initial glucose concentration, 10%~20% DO,pH 5.0 at 28 ℃. The dry cell weight was 135 g/L,the target protein concentration could reach to 5.04 g/L. And the β-Mannanase activity got to be 29 600 U/mL,which was 24 times of that the results in the shake flask under these conditions.
Key words:β-Mannanase;Pichia pastoris;high cell density culture;fermentation optimization
β-甘露聚糖酶(β-1,4-D-mannan mannohydrolase,EC 3.2.1.78)是β-1,4甘露聚糖甘露糖苷水解酶的简称,属于半纤维素酶类,广泛应用于食品、饲料、医药、纺织印染等方面[1],在饲用酶制剂应用方面尤其重要[2],添加β-甘露聚糖酶可以降解饲料中含有的β-甘露聚糖,有助于消除甘露聚糖对机体胰岛素分泌和胰岛素样生长因子(IGF)生成的抑制作用,提高葡萄糖吸收速率,促进碳水化合物代谢过程,提高日粮能量利用率,是一种良好的饲料添加剂,也是抗生素的理想代替品[3]。
毕赤酵母(Pichia pastoris)表达系统既具有原核表达系统易于培养、繁殖快速、表达量高的优点,又具有真核表达系统外源蛋白翻译后再加工修饰等特点,目前已有超过500种外源蛋白在毕赤酵母中获得成功表达。山东省微生物重点实验室成功构建一株表达枯草芽孢杆菌β-甘露聚糖酶基因毕赤酵母工程菌,在前期工作的基础上,本试验通过优化毕赤酵母工程发酵最适pH、温度、碳源浓度、接种量等基础条件,以及选取在大规模工业化生产中的重要因素甲醇补料方式、甲醇浓度、菌体浓度、DO值等,进行毕赤酵母高密度培养表达β-甘露聚糖酶的工艺优化,获得较为成熟的工艺,使酶活力达到工业化生产要求。
1 材料与方法
1.1 菌种
β-甘露聚糖酶毕赤酵母工程菌:山东省微生物重点实验室构建、保存[4]。
1.2 仪器设备
30 L发酵罐为上海国强生化装备有限责任公司生产,配备温度、溶氧、pH电极、压缩空气、氨气、冷却水以及蒸汽系统。
1.3 培养基
种子培养基(YPD):20 g/L葡萄糖、20 g/L蛋白胨、10 g/L酵母提取物。
发酵基础培养基:2.5%葡萄糖、5 g/L KH2PO4、3 g/L CaSO4、15 g/L K2SO4、15 g/L MgSO4、35 g/L NH4H2PO4、4.2 g/L KOH、12 g/L微量元素。endprint
分批补料培养基:50%甘油(W/V,g/mL)(含12 g/L微量元素溶液,g/mL)。
诱导剂:100%甲醇(含12 mL/L微量元素溶液)。
补料培养基:200 g NH4H2PO4、20 g CaSO4、100 g K2SO4、100 g MgSO4,定容至2 L。
微量元素溶液:参照Invitrogen表达手册。
1.4 毕赤酵母表达β-甘露聚糖酶基础条件优化
1)在基础培养基中分别添加1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%的葡萄糖或1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%的甘油作为碳源,单独灭菌后混匀,调节pH 5.0,30 ℃、240 r/min培养24~30 h,初始碳源耗尽后,补充1 mL 50%甘油,甘油耗尽后饥饿培养0.5 h,每24 h补充100%甲醇0.4 mL,每24 h取发酵液测定酶活力,以确定最适碳源种类以及最适添加比例。
2)分别接种2%、4%、6%、8%、10%、12%、14%YPD培养液(OD600 nm≈8.0)于发酵基础培养基中,其他条件不变,测定酶活力确定最佳接种量。
3)诱导温度梯度为26、28、30、32 ℃,其他条件不变,测定酶活力确定最佳接种量。
4)诱导pH梯度为4.5、5.0、5.5、6.0,其他条件不变,测定酶活力确定最佳接种量。
1.5 发酵罐高密度发酵β-甘露聚糖酶工艺优化
1.5.1 发酵罐常规控制工艺 种子制备:YPD液体培养基于30 ℃、240 r/min培养至OD600 nm≈8.0时,按0.5%接入30 L种子罐中,30 ℃、400 r/min培养至OD600 nm≈8.0时,按8%接种量接入30 L发酵罐基础培养基中。细胞增殖阶段:pH 5.5、温度30 ℃、罐压0.1 MPa、通气量1 m3/h、转速400~600 r/min。诱导表达阶段:pH 5.0、温度28 ℃、罐压0.12 MPa、通气量2.0~ 4.5 m3/h、转速600~800 r/min,采用连续补料方式添加甲醇,测定培养基中N、P含量剩余30%时,添加补料培养基。
1.5.2 不同诱导前菌体浓度对赤酵母产β-甘露聚糖酶酶活力的影响 基础培养基中葡萄糖耗尽后,通过控制流加甘油时间提高菌体浓度,使诱导前菌体浓度分别达到80、100、140、180 g/L,其他条件不变,发酵180 h,测定酶活力确定最佳诱导前菌体浓度。
1.5.3 甲醇浓度对毕赤酵母产β-甘露聚糖酶酶活力的影响 初始添加甲醇速度1 mL/L·h,之后每小时增加1个单位,直至达到8 mL/L·h,之后控制甲醇流加速度,中后期使甲醇浓度分别达到为0.5、1.0 g/L,其他条件不变,发酵180 h,测定酶活力确定最佳甲醇浓度。
1.5.4 溶氧量(DO)对毕赤酵母产β-甘露聚糖酶酶活力的影响 甲醇诱导阶段,通过调节罐压及通气量,控制溶氧量在10%~20%、20%~30%、30%~40%,其他条件不变,发酵180 h,测定酶活力确定最佳溶氧量。
1.5.5 补料方式对毕赤酵母产β-甘露聚糖酶酶活力的影响 毕赤酵母工业化大规模发酵时,甲醇补料方式基本分为分批式补料、连续式补料等[5],据此确定以下3种甲醇添加方案进行诱导表达:①分批式补料,每次补入1%甲醇,待甲醇消耗完后继续补料;②分批-连续式补料,诱导初期加入0.5%甲醇,甲醇消耗完后,继续补加0.5%甲醇,10 h后控制流速为8 ~12 mL/(L·h);③连续式补料,诱导初期补料速度为1 mL/(L·h),每小时提升一个单位,10 h后控制流加速度为8~12 mL/(L·h)。
1.5.6 正交试验 为进一步研究各因素间的相互关系,根据以上试验结果,选取接种量、碳源浓度、溶氧量、诱导前湿重对发酵影响较大的因素,进行四因素三水平正交试验,按正交L9(34)安排试验(表1),各因素最佳值的确定以各水平平均值K最高为准。
1.5.7 批量发酵 在正交试验优化条件下,采用4套30 L上海国强发酵罐设备进行连续30批发酵,测定β-甘露聚糖酶酶活。
1.6 测定方法
1.6.1 β-甘露聚糖酶酶活测定方法 采用DNS法测定酶活,酶活单位定义为在37 ℃、pH 5.5的条件下,每分钟从浓度3 mg/mL的甘露聚糖溶液降解释放1 μmol还原糖所需的酶量为一个酶活单位。
1.6.2 发酵参数测定方法 采用高碘酸钠氧化法测定甘油残留浓度[6],气相色谱测定分析甲醇浓度[7],甲醛滴定法测定氨基氮含量,钼酸铵-米吐尔法测定磷含量,数据分析参照文献[8]。
1.6.3 细胞质量浓度测定方法 取适量发酵液经80 ℃烘干至恒重,测定细胞干质量,再除以所取发酵液体积即为细胞质量浓度[9],根据测量数值绘制线性回归曲线,细胞干重与OD600 nm的关系为DCW=0.226OD600 nm+0.017(R2=0.989 2)。
1.6.4 菌体浓度(WCW)测定方法 取发酵液,经10 000 r/min离心5 min,去上清液,计算菌体浓度(g/L)。
1.6.5 发酵液中总蛋白与目的蛋白含量测定 采用考马斯亮蓝染色法测定发酵液中总蛋白含量[10],使用BIO-PRINT凝胶成像与分析系统,根据发酵液中总蛋白含量计算目的蛋白含量。endprint
2 结果与分析
2.1 毕赤酵母产酶基础条件分析
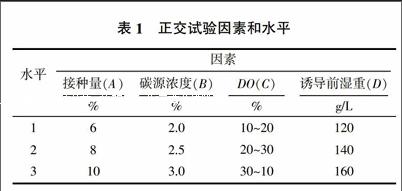
甘油浓度为1.5%与葡萄糖浓度为2.5%时,毕赤酵母产β-甘露聚糖酶酶活达到最高(图1a),分别为1 032、998 U/mL,酶活力差距较小,鉴于工业级葡萄糖单价3 000~4 000元/t,甘油单价5 000~ 7 000元/t,在大规模工业生产中,宜选用葡萄糖作为初始碳源;不同pH对毕赤酵母产β-甘露聚糖酶酶活影响较大(图1b),在pH 5.0时酶活最高,达到1 230 U/mL;接种量不仅影响菌体增殖速度,而且一定程度上影响了发酵培养基的营养成分,当接种量为8%时,酶活达到最高1 100 U/mL(图1c);在不同温度下进行诱导发酵,28 ℃时,β-甘露聚糖酶酶活最高,当温度为32 ℃时,酶活力明显降低(图1d)。
2.2 发酵罐高密度发酵优化
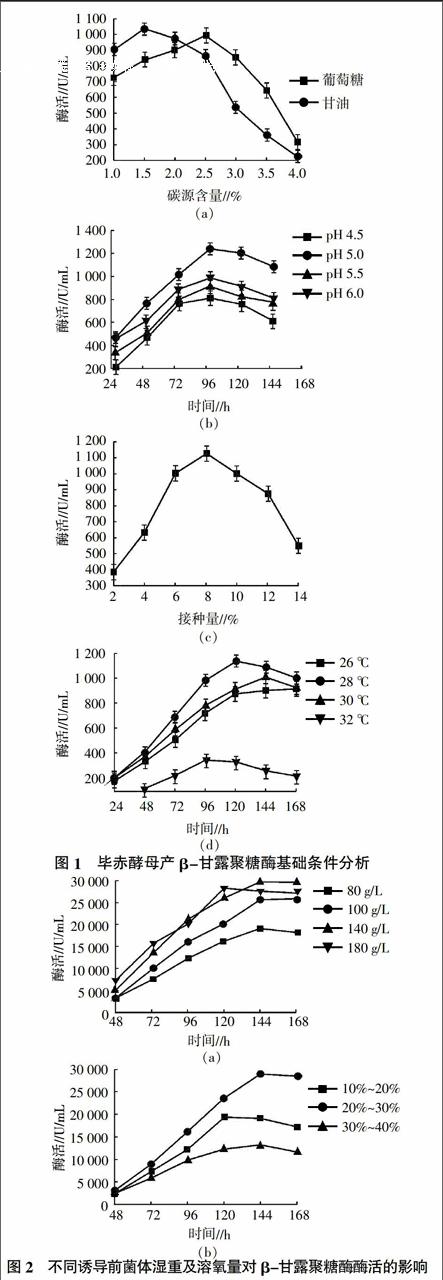
2.2.1 诱导前菌体浓度、溶氧量对β-甘露聚糖酶酶活的影响 提高菌体浓度是提高外源蛋白表达量的有效手段,但通过试验验证(图2a),当诱导前菌体浓度为140 g/L发酵144 h时,β-甘露聚糖酶酶活最高,达到29 500 U/mL,过高的诱导前菌体浓度一定程度上抑制了酶蛋白的高效表达;通过测定不同溶氧条件下酶活(图2b),发现当发酵罐通气量控制在20%~30%、发酵144 h时,β-甘露聚糖酶表达量最高,达到29 000 U/mL。
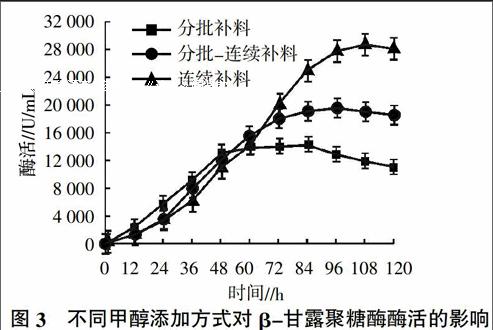
2.2.2 甲醇补料方式对β-甘露聚糖酶酶活的影响 结果表明(图3),采用连续补料的方式可以使毕赤酵母更好地适应甲醇,延长最佳表达周期,最高酶活达到29 000 U/mL,而采用分批补料的方式,受甲醇浓度过高影响,毕赤酵母前期未能适应碳源变化,导致48 h后外源蛋白停止表达,诱导期明显缩短,采用分批-连续补料的方式,连续补料方式有助于酶蛋白表达,但前期变换碳源过渡不佳,导致发酵后期酶活不高,因此采用连续补料的方式进行毕赤酵母产β-甘露聚糖酶诱导表达。
2.2.3 发酵罐中不同甲醇浓度对β-甘露聚糖酶酶活的影响 21 h进入甲醇诱导期(图4),甲醇浓度为约1.0 g/L时,菌体增殖速度与酶蛋白表达速度均明显加快,但发酵后期高甲醇浓度下细胞大量衰亡,导致菌体浓度下降,同时菌体破裂造成酶蛋白降解[11],发酵后期酶活损失严重;酶活方面,低甲醇浓度时在144 h酶活最高,达到29 600 U/mL,高甲醇浓度下在120 h达到最高酶活28 000 U/mL,虽然高甲醇组酶活较前者低,但其发酵周期缩短约24 h;无机盐方面,随着菌体不断增殖,高甲醇浓度下氮、磷消耗同样较快,当诱导阶段进入80 h左右时,仅通过调节pH进入的氨气不足以弥补氮消耗,因此在N、P剩余30%时添加补料培养基,后续60 h诱导阶段氮、磷消耗仍然较快,表明之前补充氮源、磷源十分必要,以保持培养基中离子浓度稳定性以及稳定的渗透压。甲醇浓度在0.5 g/L时酶蛋白表达量较高,因此,诱导时选择添加0.5 g/L甲醇。
2.2.4 发酵条件正交优化 正交试验经重复验证后得到最佳发酵条件:接种量为10%、碳源浓度为3.0%、DO控制在10%~20%、诱导前湿重为140 g/L(表2),按极值差R值大小决定因素的主次顺序为:DO、碳源浓度、接种量、诱导前湿重。
2.2.5 最优发酵工艺下参数分析 表3为正交试验最优发酵工艺下毕赤酵母产β-甘露聚糖酶发酵参数,21 h开始甲醇诱导,150 h酶活达到最高29 600 U/mL,细胞干重、目的蛋白含量、比酶活分别为127.3 g/L、5.32 g/L、2 740.74 U/mg,目的蛋白生成比速率(qp)、细胞对甲醇得率(Yx /s)、目的蛋白对细胞得率(Yp /s)分别为0.201 mg/g·h、0.158 g/g、5.96 mg/g;比酶活随诱导时间不断升高,在酶蛋白高表达期达到最高值,150 h之后酶活力和比酶活等均呈下降趋势,此时毕赤酵母不断表达外源蛋白以及蛋白降解综合作用的表观结果,因此发酵应控制在150 h。
2.2.6 摇瓶发酵与发酵罐高密度发酵蛋白电泳 结果(图5)表明,在约37 kDa处有明显的目的条带,摇瓶发酵时,发酵上清液中杂蛋白很少,但在发酵罐高密度发酵过程中,随着酶蛋白表达量的不断提高,杂蛋白含量相对增加,147 h前,蛋白含量随时间延长不断增加,之后由于细胞衰亡,上清液中的酶蛋白被部分降解,在227 h时,蛋白含量已经降解50%以上。
2.2.7 批量发酵结果 在正交试验最优工艺条件下,采用4套30 L上海国强发酵罐设备进行连续30批发酵,得到酵母细胞干重均达120~160 g/L,达到高密度发酵目的,并且β-甘露聚糖酶蛋白的表达量达到5.1 g/L,酶活力达到29 600 U/mL。
3 小结与讨论
温度不但影响毕赤酵母发酵液溶氧量、基质的分解吸收速率,还会影响发酵产物的活性及生物合成方向[12],是影响细胞生长和目的蛋白产率及稳定性的一个重要因素,最佳诱导温度是各种因素综合表现的结果[13]。不同外源基因对温度要求不同,在本试验中,温度升高有利于提高酶蛋白表达速率,诱导温度为28 ℃时,酶活最高,达到1 150 U/mL,温度继续升高时,酶活单位时间增加较快,但发酵后期酶活衰减严重,这是因为温度升高,表达速度过快不利于外源蛋白的正确折叠和有效地向胞外分泌[14],当温度为32 ℃时,外源蛋白表达严重受阻。
在毕赤酵母高密度发酵过程中,溶氧作为重要参数,不同溶氧水平,甲醇代谢速率和代谢产物相差较大[15]。低溶氧水平下,酵母因溶氧不足,呼吸向无氧代谢途径漂移[16,17],导致甲醇利用减慢,最终生成乙醇、乙酸等副产物,进一步抑制酵母生长,同时也抑制醇氧化酶AOX活性,降低外源蛋白表达量,而溶氧过高时,会促进胞内活性氧(ROS)的积累,对细胞造成损伤,影响表达系统的稳定性[18],合适的溶氧值有助于外源蛋白的高效表达[19]。本试验发现较低的溶氧更利于β-甘露聚糖酶的表达,这与发酵工艺中较低的甲醇浓度有关,作为毕赤酵母Mut+型,对甲醇需求较大,且易受甲醇浓度影响[20],在诱导期,甲醇作为惟一碳源,被酵母增殖与目的蛋白诱导表达竞争消耗,此时过低的甲醇浓度会导致诱导不足而降低酶蛋白表达量,浓度过高又抑制菌体增殖,导致发酵失败[21]。王帅坤等[22]在较高的甲醇以及较高的溶氧量下获得最优发酵条件,但本试验甲醇浓度在0.5 g/L时酶蛋白表达量较高,此时只需10%~20%较低的溶氧量就可满足酶蛋白的高效表达,进一步降低了供氧设备成本。endprint
高密度发酵时基因工程是提高外源蛋白表达量的重要策略之一。目前,一般认为酵母细胞密度为100~200 g/L(DCW)即为高密度发酵,本试验中采用4套30 L上海国强发酵罐设备进行连续30批发酵,细胞干重均达120~160 g/L,达到高密度发酵目的,并且β-甘露聚糖酶蛋白的表达量达到5.1 g/L,酶活达到29 600 U/mL,远高于目前相关报道,如Chen等[23]将硫色曲霉的甘露聚糖酶基因序列优化在毕赤酵母中进行分泌表达,发酵酶活为1 100 U/mL,乔宇等[24]克隆一株枯草芽孢杆菌中的甘露聚糖酶基因至毕赤酵母中,在5 L发酵罐中进行高密度发酵,酶活为1 102 U/mL,马威等[25]将枯草芽孢杆菌中的甘露聚糖酶基因克隆到毕赤酵母中,10 L发酵罐高密度发酵活为2 100 U/mL,张娟等[26]克隆黑曲霉中甘露聚糖酶基因到毕赤酵母中,进行5 L液体发酵,酶活为11 785 U/mL。
本试验获得毕赤酵母产β-甘露聚糖酶最佳发酵工艺,初始葡萄糖质量浓度为30 g/L,诱导前菌体湿重140 g/L(DCW约27 g/L),诱导温度为28 ℃,pH 5.0,诱导期溶氧量控制在10%~20%,甲醇流加方式采用前10 h为适应期,后续采用溶氧恒定法,控制甲醇流速在8~12 mL/(L·h)。最终细胞干重为135 g/L,胞外总蛋白含量达到10.9 g/L(目的蛋白5.1 g/L),酶活最高为29 600 U/mL,是摇瓶培养最高酶活力的24倍,通过本试验优化产酶条件及高密度发酵工艺研究,使得毕赤酵母表达β-甘露聚糖酶工程菌酶活力得到极大提高,已满足工业化生产要求。
参考文献:
[1] BENECH R O,LI X M,PATTON D,et al. Recombinant expression,characterization,and pulp prebleaching property of a Phanerochaetr chrysosporium endo-β-1,4-mannanase[J].Enzyme and Microbial Technology,2007,41(6-7):740-747.
[2] 黄小文,刘雪山,徐凤芹,等.甘露聚糖酶对小猪生产性能的影响[J].饲料工业,2003,24(1):15-27.
[3] 辛总秀.β-甘露聚糖酶在家禽饲料中应用的研究进展[J].畜牧与饲料料学,2011,32(5):28-30.
[4] 唐卫华,王瑞明,肖 静,等.β-甘露聚糖酶基因在毕赤酵母中的高效表达[J].生物技术,2013,23(2):18-22.
[5] CEREGHINO J L,CREGG J M. Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J]. FEMS Microbiol Rev,2000,24(1):45-66.
[6] 王剑锋,修志龙,范圣第.甘油转化生产1,3-丙二醇发酵液中甘油含量的测定[J].工业微生物,2001,31(2):33-35.
[7] DENG B B,FENG H Q,XUE C,et al. GC rapid analysis of methanol and ethanol during high cell density culture of recombinant methylotrophic yeast[J].Ind Microbiol,2001,31(2):26-29.
[8] 戚以政,夏 杰.生物反应工程[M].北京:化工出版社,2004.
[9] JAHIC M,GUSTAVSSON M,JANSEN A K,et al. Analysis and control of proteolysis of a fusion protein in Pichia pastoris fed-batch processes[J]. Biotechnol,2003,102(1):45-53.
[10] 萨姆布鲁克J, 弗里奇EF, 曼尼阿蒂斯J. 分子克隆实验指南[M]第二版.金冬雁,黎孟枫,译.北京:科学出版社,1998.
[11] SINHA J,PLANTZ B A,INAN M,et al. Causes of proteolytic degradation of secreted recombinant proteins produced in methylotrophic yeast Pichia pastoris: Case study with recombinant ovine interferon[J]. Biotechnol Bioeng,2005,89(1):102-112.
[12] 薛 雁,徐 梅,薛百忠,等.毕赤酵母表达巴曲酶发酵条件的优化研究[J].蛇志,2009,21(2):94-97.
[13] MATTANOVICH D,GASSER B,HOHENBLUM H,et al. Stress in recombinant protein producing yeasts[J]. Journal of Biotechnology,2004, 113(2):121-135.
[14] 孙战胜,陈劲春.重组人血清蛋白在毕赤酵母表达中的降解控制[J].北京化工大学学报,2004,31(4):9-11.
[15] CUNHA A E,CLEMENTE J J,GOMES R,et al. Methanol induction optimization for scFv antibody fragment production in Pichia pastoris[J].Biotechnol Bioeng, 2004,86(4):458-467.endprint
[16] KHATRI N K, HOFFMANN F. Impact of methanol concentration on secreted protein production in oxygen-limited cultures of recombinant Pichia pastoris[J].Biotechnol Bioeng,2006, 93(5):871-879.
[17] INAN M,MEAGHER M M. The effect of ethanol and acetate on protein expression in Pichia pastoris[J]. J Biosci Bioeng,2001,92(4):337-341.
[18] MARK D T,IAN W D,GABRIEL G P. Complex cellular responses to reactive oxygen species[J]. Trends Cell Biol,2005, 15(6):319-326.
[19] TRENTMANN O,KHATRI N K,HOFFMANN F. Reduced oxygen supply increase process stability and product yield with recombinant Pichia pastoris[J]. Biotechnol Prog,2004,20(6):1766-1975.
[20] 周祥山,范卫民,张元兴.不同甲醇流加策略对重组毕赤酵母高密度发酵生产水蛭素的影响[J].生物工程学报,2002,18(3):348-351.
[21] MACAULEY-PATRICK S,FAZENDA M L,MCNEIL B,et al. Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22(2):249-270.
[22] 王帅坤,郝杰清,王振伟,等.毕赤酵母表达重组葡萄糖氧化酶的发酵条件[J].生物技术通报,2013,14(9):136-141.
[23] CHEN X L,QIAO J Y,YU H F,et al. Overexpression of an optimized Aspergillus sulphureus β-mannanase gene in Pichia pastoris[J]. Biologia, 2009, 64(2):235-238.
[24] 乔 宇,陈小兵,丁宏标,等.甘露聚糖酶基因在毕赤酵母中表达及酶学性质研究[J].中国生物工程杂志,2006,26(7):52-56.
[25] 马 威,沈志娜,陈轶群,等.枯草芽孢杆菌β-甘露聚糖酶在毕赤酵母中的分泌表达[J].生物技术通讯,2010,21(2):171-174.
[26] 张 娟,罗长财.耐酸性黑曲霉β-甘露聚糖酶的克隆及其在毕赤酵母中的表达分析[J].生物技术通讯,2011,22(2):184-187.endprint
