瞬时受体电位阳离子通道蛋白6高表达对转化生长因子—β1诱导体外培养小鼠肾足细胞损伤的作用
2016-01-05黄海庭林栩尤燕舞汤春荣古贤君黄美英覃幼玲谭军华黄非凡
黄海庭++林栩++尤燕舞++汤春荣++古贤君++黄美英++覃幼玲++谭军华++黄非凡


【摘要】目的探讨瞬时受体电位阳离子通道蛋白6(TRPC6)高表达对转化生长因子β1 (TGFβ1)干预下体外培养小鼠肾足细胞nephrin、desmin、caspase9表达及细胞凋亡的影响。
方法用脂质体Lip2000将针对小鼠TRPC6的基因真核表达载体pEX3TRPC6转染体外培养的小鼠足细胞,48小时后Western blot检测转染后TRPC6蛋白表达变化。将足细胞分为4组:正常对照组,TGFβ1干预组,TGFβ1+pEX3NC组(空载体组),TGFβ1+pEX3TRPC6组(TRPC6高表达组),干预48小时后用western blot和real time PCR 检测caspase9、desmin、nephrin蛋白和mRNA表达水平,用流式细胞术检测各组细胞凋亡率,DAPI染色观察凋亡细胞核形态学变化。
结果转染48 小时后TRPC6高表达组TRPC6蛋白水平较正常对照组明显升高(P<0.01),空载体组TRPC6蛋白表达水平无明显变化;TGFβ1干预48小时后caspase9、desmin蛋白和mRNA表达水平显著升高(P<0.05),nephrin蛋白和mRNA表达水平明显下降(P<0.01),使TRPC6高表达后上述变化更明显(P<0.05);TGFβ1干预后足细胞凋亡增多并出现典型凋亡细胞核形态学改变,TGFβ1干预组足细胞凋亡率为(12.30±0.81)%,TRPC6高表达组凋亡率为(21.26±1.16)%,组间比较差异有统计学意义(P<0.01),空载体组细胞凋亡率与TGFβ1干预组比较无明显差异。
结论TRPC6在 TGFβ1诱导足细胞损伤中发挥重要作用,其机制之一可能通过线粒体凋亡途径诱导足细胞凋亡,减少nephrin表达,增加desmin表达来实现。
【关键词】足细胞;转化生长因子β1;凋亡;结蛋白;nephrin;caspase9
中图分类号:R692文献标识码:ADOI:10.3969/j.issn.10031383.2016.04.003
瞬时受体电位阳离子通道蛋白6(TRPC6)是新近发现的联系足细胞裂孔隔膜与细胞骨架的重要分子,通过对人类多种获得性蛋白尿性肾小球疾病的研究则表明TRPC6表达升高是足细胞损伤的重要因素[1],但TRPC6在足细胞损伤中的具体机制目前尚未完全明确。转化生长因子β1 (TGFβ1)具有诱导足细胞损伤的作用,有研究表明TRPC6可能是TGFβ1下游作用因子之一[2~3],但TRPC6是否参与TGFβ1诱导足细胞的损伤过程,目前尚未检索到相关研究。本研究通过基因过表达技术,诱导足细胞TRPC6高表达,观察TRPC6高表达对TGFβ1诱导的足细胞凋亡及nephrin、desmin、caspase9表达的影响,以期为足细胞损伤的防治提供新靶点。
1材料与方法
1.1实验细胞和试剂
肾小球足细胞株(MPC5)购于上海复旦大学细胞中心,RPMI1640培养液、胎牛血清[海克隆生物化学制品(北京)有限公司],重组人TGFβ1(ProSpecTany)、BCA蛋白定量试剂盒(碧云天生物工程研究所)、RNA提取试剂盒(爱思进 AxyPrep)、SuperQuickRT MasterMix(北京康为世纪生物科技有限公司)、UltraSYBR MixturePCR(北京康为世纪生物科技有限公司)、TRPC6、nephrin、desmin、GAPDH一抗及HRP标记的二抗(美国Abcam),DAPI溶液(北京索莱宝),pEX3NC、pEX3TRPC6质粒(上海吉玛公司),FITC标记山羊抗兔IgG(北京中杉金桥),Lipofeetamine2000(Invitrogen公司)。
1.2足细胞培养
肾小球足细胞培养参照文献[4],并稍做修改,细胞在含10%胎牛血清的RPMI1640培养液中,在5% CO2、37℃培养箱中传代培养。
1.3细胞转染及分组
实验前一天,接种1×104细胞至24孔板中,加入500 μL含血清培养液,5%CO2、37℃培养箱培养至65%融合。分别将pEX3NC、 pEX3TRPC6与脂质体Lipofeetamine2000混合(1∶4),室温静置30分钟后加入24孔板,以无血清的1640培养液孵育6小时后改用含10%FBS的RPMI1640培养基继续培养。24及48小时后通过倒置荧光显微镜观察足细胞中GFP的表达,测定转染效率(转染细胞率=荧光蛋白表达细胞数/总细胞数×100%);48小时后应用Western blot检测TRPC6蛋白的表达。将细胞分为4组:正常对照组,TGFβ1干预组,TGFβ1干预+pEX3NC,TGFβ1干预+pEX3TRPC6组。在后3组细胞中加入TGFβ1,使其终浓度为12 ng/ml,干预48小时后收集各组细胞分别进行检测,实验重复3次。
1.4real time RTPCR检测caspase9、nephrin、desmin mRNA表达
模型建立后按 RNA提取试剂盒提取各组细胞总RNA。用紫外分光光度计测 RNA 的浓度并用电泳测得RNA的完整性和降解情况。按反转录试剂盒要求加入相应的试剂,放入PTC200仪进行反转录得到cDNA。引物均由上海生物工程公司生产,引物序列见表1。反应总体系20 μL,反应条件:95℃预变性10 min,95℃变性15 s,61.7℃延伸58 s,循环40次。同时设熔解曲线55℃~95℃ 10 s共81个循环。每个样品均设3个复孔,同时设空白对照和阴性对照,每个样本重复3次,取其平均值为样本Ct值。目标基因相对于内参基因进行相对定量,采用2△△CT法进行mRNA相对表达量的比较。PCR扩增产物经2%琼脂糖凝胶电泳检测基因特异性。

去除24孔板中的培养液,每孔细胞中加入50 μL IP(IP使用前与PMSF混匀,使PMSF终浓度为1 mmol/L)充分裂解细胞,用枪头上下吹打细胞10~20次后收集细胞至1.5 ml离心管中,14 000 g离心5 min,取上清液至200 μL离心管中得细胞总蛋白质,用BCA蛋白定量试剂盒测定总蛋白浓度。将提取的总蛋白溶于5%SDS,100℃,5分钟热变性。每孔加50 μg总蛋白进行SDSPAGE凝胶电泳,300 mA恒流转至PVDF膜2.5 h。3%BSA室温封闭1小时,加入按适当比例稀释的一抗(兔抗TRPC6多克隆抗体,稀释度1∶300;兔抗caspase9,稀释度1∶300;兔抗nephrin,稀释度1∶200;兔抗desmin,稀释度1∶500;兔抗GAPDH,稀释度1∶500),4℃冰箱摇床孵育过夜。TBST洗膜3次,10 min/次,加入羊抗兔多克隆二抗,稀释度1∶5000,室温孵育1小时,TBST洗膜3次,20 min/次,ECL化学发光试剂盒显色,曝光、显影、定影,扫描条带,利用ImageJ软件分析蛋白条带灰度值,以目的蛋白条带与GAPDH蛋白条带的灰度值的比值表示其相对含量,每组实验重复3次,取其平均值。
1.6流式细胞术检测细胞凋亡率
各组细胞先用预冷的PBS洗2次,然后用胰酶消化,1.5 ml离心管收集各组细胞,800 g离心5 min分钟,去上清,用1 ml PBS重悬细胞,再次离心去上清,重复两次以去除胰酶中的ETDA。最后将细胞重悬于150 μL结合缓冲液中,调整细胞浓度为1×106/ml,分别加入2.5 μL Annexin V和0.5 μL 100 μg/ml的PI溶液,室温避光孵育15 min。上机检测前补加200 μL结合液,轻轻混匀。立即将染色细胞进行流式分析,每组实验重复3次,取其平均值。
1.7DAPI荧光染色观察足细胞凋亡的核形态学变化
各组细胞干预72 h后,取10 μg 1 mg/ml的DAPI水溶液加到1 ml PBS中,配制成10 μg/ml的DAPI溶液,每孔细胞加入50 μL的10 μg/ml DAPI溶液,在37℃培养箱中培养细胞15 min,然后置于荧光显微镜360 nm激发波长下观察,取图。
1.8统计学方法
采用SPSS 17.0软件进行分析,计量资料先进行正态分布和方差齐性检验,符合正态分布及方差齐性,以均数±标准差(±s)表示,多组间比较采用方差分析,进一步两两比较采用q检验(NewmanKeuls法),检验水准:α=0.05。
2结果
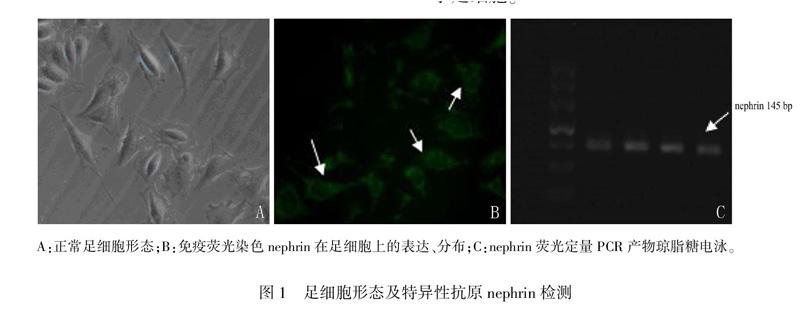
2.1足细胞形态学观察及特异性抗原nephrin检测
正常足细胞呈多边形或梭形,细胞轮廓清晰,自细胞体伸出少量树枝样突起(图1A)。间接免疫细胞化学染色:nephrin分布于胞膜、核周及细胞质(图1B)。real time RTPCR产物行琼脂糖凝胶电泳,结果显示该细胞系表达nephrin(图1C),nephrin是足细胞特异性分子,因此可以认为实验用细胞系来源于足细胞。
A:正常足细胞形态;B:免疫荧光染色nephrin在足细胞上的表达、分布;C:nephrin荧光定量PCR产物琼脂糖电泳。
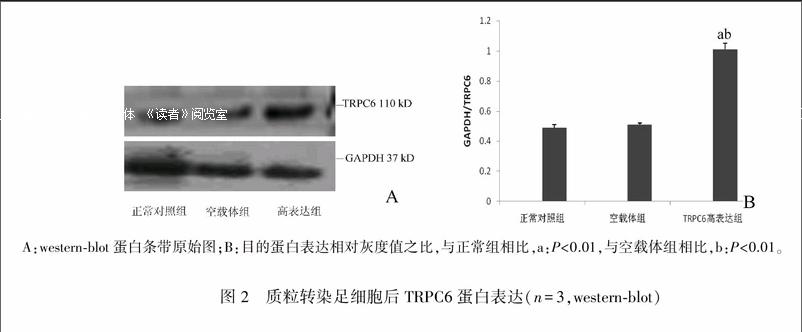
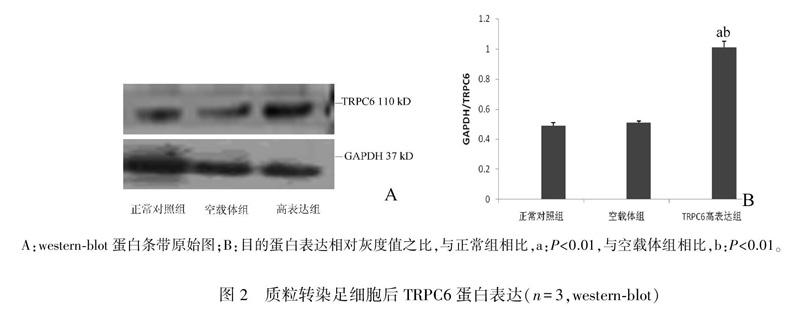
2.2TRPC6转染效率
将pEX3NC、pEX3TRPC6转染足细胞48小时后,Westernblot 结果显示,转染pEX3TRPC6(高表达组)TRPC6蛋白明显升高(P<0.05),传染pEX3NC(空载体组)对TRPC6蛋白表达无明显影响(P>0.05)。正常对照组、空载体组、高表达组TRPC6/GAPDH蛋白灰度值之比分别为(0.49±0.02)、(0.50±0.001)、(1.01±0.04)。见图2A、B。
A:westernblot蛋白条带原始图;B:目的蛋白表达相对灰度值之比,与正常组相比,a:P<0.01,与空载体组相比,b:P<0.01。
2.3TRPC6高表达对TGFβ1干预下足细胞nephrin、caspase9、desmin mRNA表达的影响
TGFβ1干预48小时后足细胞nephrin mRNA表达水平明显降低(P<0.05),caspase9、desmin mRNA表达水平明显升高(P<0.05),TGFβ1干预+转染pEX3TRPC6(TRPC6高表达) 组上述变化更加明显 (P<0.05)。TGFβ1干预+转染pEX3NC (空载体)组与TGFβ1干预组nephrin、caspase9、desmin mRNA表达水平无明显差异。见表2。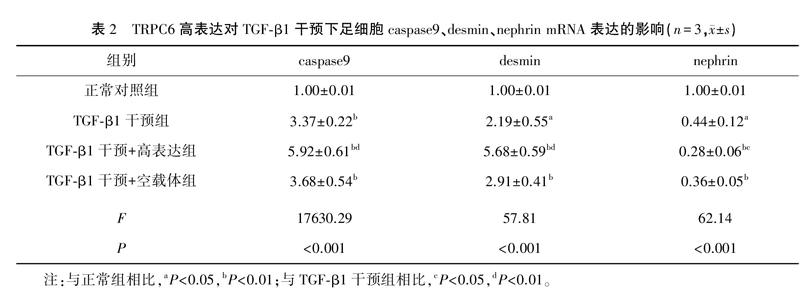
2.4TRPC6高表达对TGFβ1干预下足细胞nephrin、caspase9、desmin 蛋白表达的影响
TGFβ1刺激48小时后足细胞nephrin 蛋白表达水平明显降低(P<0.05),caspase9、desmin 蛋白表达水平明显升高(P<0.01),TGFβ1干预+转染pEX3TRPC6(TRPC6高表达组)上述变化更加明显 (P<0.05)。TGFβ1干预+转染pEX3NC(空载体组)与TGFβ1干预组nephrin、caspase9、desmin 蛋白表达水平无明显差异。见图3。
2.5DAPI染色结果
细胞核形态学改变是细胞凋亡的重要鉴别依据。在荧光显微镜下(图4A),可观察到正常足细胞的染色质疏松,荧光强度相对较弱,细胞核大小一致,形态规则(图4A); 细胞发生凋亡时染色质浓缩,荧光强度增强,一些细胞核碎裂,呈现大小不一的荧光斑块,即“凋亡小体”(图4B); 各组细胞经DAPI染色后均可见典型细胞凋亡的细胞核形态学改变,但各组细胞凋亡细胞数明显不一(图4C~F)。
A:western blot 蛋白条带原始;B:目的蛋白表达相对灰度值之比:与正常组相比,a:P<0.01;与TGFβ1干预组相比,b:P<0.01。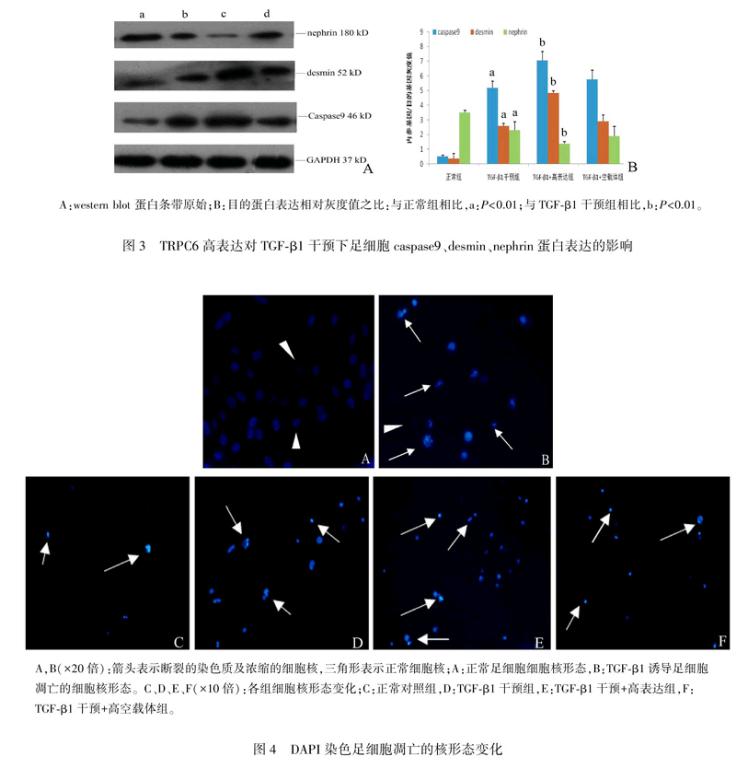
A,B(×20倍):箭头表示断裂的染色质及浓缩的细胞核,三角形表示正常细胞核;A:正常足细胞细胞核形态,B:TGFβ1诱导足细胞凋亡的细胞核形态。C、D、E、F(×10倍):各组细胞核形态变化;C:正常对照组,D:TGFβ1干预组,E:TGFβ1干预+高表达组,F:TGFβ1干预+高空载体组。
2.6TRPC6高表达对TGFβ1诱导下足细胞凋亡的影响
流式细胞术结果显示正常对照组足细胞凋亡率为(1.34±0.15)%,应用TGFβ1处理48 小时后凋亡率明显升高,其凋亡率为(12.30±0.81)%,与对照组相比差异有统计学意义(P<0.01),而TGFβ1干预+TRPC6高表达组凋亡率为(21.26±1.16)%,明显高于TGFβ1干预组(P<0.01),转染空载体组细胞凋亡率为(13.20±1.25)%,与TGFβ1干预组相比差异无统计学意义(P>0.05)。见图5A~D、表3。
A:正常组;B:TGFβ1干预组;C:TGFβ1干预+高表达组;D:TGFβ1干预 + 空载体组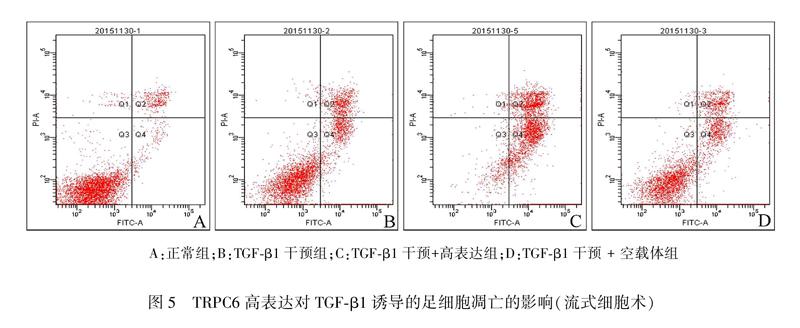

3讨论
瞬时受体电位阳离子通道蛋白6(transient receptor potential channel6,TRPC6)作为瞬时受体电位超家族中的一员,是一种非选择性的阳离子通道。TRPC6是2005年Winn研究小组通过对家族性遗传性局灶节段性肾小球硬化症研究所发现,随后免疫共沉淀技术显示TRPC6和podocin、nephrin共表达,且与这些蛋白之间有相互作用,TRPC6参与构成裂孔隔膜信号复合体[5], TRPC6的发现将足细胞裂孔隔膜蛋白与离子通道联系起来,拓宽了足细胞分子网络,为复杂肾脏疾病的研究提供新的思路。但目前对于TRPC6的研究尚处于起步阶段,具体作用机制尚未完全阐明。
TRPC6基因突变可以导致常染色体显性遗传性局灶节段性肾小球硬化,在高糖[6]、血管紧张素Ⅱ诱导[7]、链脲佐菌素诱导[8]的足细胞损伤过程中,TRPC6高表达可通过诱导细胞内钙离子内流增加,引起足细胞骨架分布紊乱、裂孔隔膜蛋白表达异常。在糖尿病肾病[9]、膜性肾病[10]等多种人类获得性蛋白尿性肾小球疾病中其表达量与蛋白尿程度呈正比。TGFβ1是公认的致肾脏纤维化细胞因子,具有诱导足细胞损伤的作用,但在此过程中TRPC6是否参与其中目前尚无研究。鉴于此,本研究通过转染TRPC6真核表达载体至足细胞使其高表达TRPC6,观察TRPC6高表达对TGFβ1干预下足细胞损伤的影响。通过实验我们发现,在TGFβ1作用下,nephrin表达明显下降,desmin表达明显增多,基因诱导 TRPC6高表达后nephrin下降更加明显,desmin表达升高更加明显,这表明TRPC6高表达能促进TGFβ1诱导的足细胞损伤过程,与上述研究结果相似。
足细胞丢失是导致肾小球硬化的关键因素,而凋亡则是导致足细胞丢失的重要原因之一,深入探讨足细胞凋亡机制对延缓肾小球硬化进程具有重要意义。TGFβ1是一种多功能细胞因子,参与细胞增殖分化、凋亡、血管形成、细胞外基质形成等多种生物学事件[11]。在TGF损伤足细胞的多种机制中,促凋亡是其重要的环节,但TRPC6与TGF诱导足细胞凋亡的关系目前国内外尚未检索到相关报道。因此,本研究中我们首先通过DAPI染色观察足细胞核形态学改变。结果发现,各组细胞经DAPI染色后均可见典型细胞凋亡的细胞核形态学改变,TRPC6高表达后细胞凋亡数目明显增多。由此可初步判断TRPC6高表达参与TGF诱导的足细胞凋亡过程。为使实验结果更有说服力,我们又通过流式细胞检测各组细胞的凋亡率。结果显示,TGFβ1作用48小时后足细胞凋亡率由(1.34±0.15)%增高至(1230±0.81)%,而使TRPC6高表达后凋亡率升高至(21.26±1.16)%,转染空载体组细胞凋亡率较TGFβ1干预组无明显差异。上述实验结果说明TRPC6高表达参与了TGFβ1诱导的足细胞凋亡过程。
既往研究发现,线粒体凋亡途径在TGFβ1诱导的足细胞凋亡中发挥重要作用。Das等[12]通过体外构建TGFβ1诱导条件永生化小鼠足细胞损伤模型,发现TGFβ1通过SmadERK1/2mTORC1轴提高Nox4的表达,进而使ROS产生增多、线粒体功能障碍,最终导致足细胞凋亡。半胱氨酸蛋白酶家族(caspase) 是一类凋亡特异性蛋白酶,在细胞凋亡过程中处于中心地位,其中caspase9是线粒体介导的内源凋亡途径中首先被激活的因子[13]。为了进一步研究TRPC6在TGFβ1诱导的足细胞凋亡中的可能作用机制,本实验观察了TRPC6高表达对TGFβ1干预下足细胞caspase9表达的影响。结果发现TGFβ1作用48小时后足细胞caspase9表达水平明显上调,说明线粒体介导的内源性凋亡途径确实参与了TGFβ1诱导的足细胞凋亡过程,而当使TRPC6高表达后caspase9在基因及蛋白水平均明显升高,这说明TRPC6至少部分通过调节线粒体介导的内源性凋亡途径caspase9的表达进而增加TGFβ1诱导的足细胞凋亡。
综上所述,我们的研究表明TRPC6是TGF诱导足细胞损伤过程中的重要分子,通过加深TGFβ1诱导的足细胞凋亡程度,减少nephrin表达,增加desmin表达可能是其作用机制之一。阻断病理状况下TRPC6的高表达或许是治疗蛋白尿性肾脏疾病的新策略,我们将在后续试验中进一步探讨。
参考文献
[1]SzabóT,Ambrus L,Zákány N,et al.Regulation of TRPC6 ion channels in podocytes Implications for focal segmental glomerulosclerosis and acquired forms of proteinuric diseases[J].Acta Physiol Hung,2015,102(3):241251.
[2]姚兴梅.晚期糖基化终末产物对肾小球系膜细胞瞬时受体电位阳离子通道蛋白 6(TRPC6)表达的影响[D].苏州:苏州大学,2010.
[3]Graham S,Yuan JP,Ma R.Canonical transient receptor potential channels in diabetes[J].Exp Biol Med (Maywood),2012,237(2):111118.
[4]雷凤英.全反式维甲酸对体外培养阿霉素致肾小球足细胞损伤的作用及其分子机制[D].南宁:广西医科大学,2014.
[5]Winn MP,Conlon PJ,Lynn KL,et al.A mutation in the TRPC6 cation channel causes familial focal segmental glomerulosclerosis[J].Science,2005,308(5729):18011804.
[6]Sonneveld R,van der Vlag J,Baltissen MP,et al.Glucose specifically regulates TRPC6 expression in the podocyte in an AngIIdependent manner[J].Am J Pathol,2014,184(6):17151726.
[7]Zhang H,Ding J,Fan Q,et al.TRPC6 upregulation in Ang IIinduced podocyte apoptosis might result from ERK activation and NFkappaB translocation[J].Exp Biol Med (Maywood),2009,234(9):10291036.
[8]Zhang X,Song Z,Guo Y,et al.The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZinduced diabetic rats[J].Mol Cell Biochem,2015,399(12):155165.
[9]Ma R,Liu L,Jiang W,et al.FK506 ameliorates podocyte injury in type 2 diabetic nephropathy by downregulating TRPC6 and NFAT expression[J].Int J Clin Exp Pathol,2015,8(11):1406314074.
[10]Hofstra JM,Coenen MJ,Schijvenaars MM,et al.TRPC6 single nucleotide polymorphisms and progression of idiopathic membranous nephropathy[J].PLoS One, 2014,9(7):e102065.
[11]Meng XM,Tang PM,Li J,et al.TGFβ/Smad signaling in renal fibrosis[J].Front Physiol,2015(6):82.
[12]Das R,Xu S,Nguyen TT,et al.Transforming Growth Factor β1induced Apoptosis in Podocytes via the Extracellular Signalregulated KinaseMammalian Target of Rapamycin Complex 1NADPH Oxidase 4 Axis[J].J Biol Chem,2015,290(52):3083030842.
[13]Brentnall M,RodriguezMenocal L,De Guevara RL,et al.Caspase9,caspase3 and caspase7 have distinct roles during intrinsic apoptosis[J].BMC Cell Biol,2013(14):32.
(收稿日期:2016-04-24修回日期:2016-08-06)
(编辑:梁明佩)
黄海庭 林栩 尤燕舞 汤春荣 古贤君 黄美英 覃幼玲 谭军华 黄非凡

【摘要】目的探讨瞬时受体电位阳离子通道蛋白6(TRPC6)高表达对转化生长因子β1 (TGFβ1)干预下体外培养小鼠肾足细胞nephrin、desmin、caspase9表达及细胞凋亡的影响。
方法用脂质体Lip2000将针对小鼠TRPC6的基因真核表达载体pEX3TRPC6转染体外培养的小鼠足细胞,48小时后Western blot检测转染后TRPC6蛋白表达变化。将足细胞分为4组:正常对照组,TGFβ1干预组,TGFβ1+pEX3NC组(空载体组),TGFβ1+pEX3TRPC6组(TRPC6高表达组),干预48小时后用western blot和real time PCR 检测caspase9、desmin、nephrin蛋白和mRNA表达水平,用流式细胞术检测各组细胞凋亡率,DAPI染色观察凋亡细胞核形态学变化。
结果转染48 小时后TRPC6高表达组TRPC6蛋白水平较正常对照组明显升高(P<0.01),空载体组TRPC6蛋白表达水平无明显变化;TGFβ1干预48小时后caspase9、desmin蛋白和mRNA表达水平显著升高(P<0.05),nephrin蛋白和mRNA表达水平明显下降(P<0.01),使TRPC6高表达后上述变化更明显(P<0.05);TGFβ1干预后足细胞凋亡增多并出现典型凋亡细胞核形态学改变,TGFβ1干预组足细胞凋亡率为(12.30±0.81)%,TRPC6高表达组凋亡率为(21.26±1.16)%,组间比较差异有统计学意义(P<0.01),空载体组细胞凋亡率与TGFβ1干预组比较无明显差异。
结论TRPC6在 TGFβ1诱导足细胞损伤中发挥重要作用,其机制之一可能通过线粒体凋亡途径诱导足细胞凋亡,减少nephrin表达,增加desmin表达来实现。
【关键词】足细胞;转化生长因子β1;凋亡;结蛋白;nephrin;caspase9
中图分类号:R692文献标识码:ADOI:10.3969/j.issn.10031383.2016.04.003
瞬时受体电位阳离子通道蛋白6(TRPC6)是新近发现的联系足细胞裂孔隔膜与细胞骨架的重要分子,通过对人类多种获得性蛋白尿性肾小球疾病的研究则表明TRPC6表达升高是足细胞损伤的重要因素[1],但TRPC6在足细胞损伤中的具体机制目前尚未完全明确。转化生长因子β1 (TGFβ1)具有诱导足细胞损伤的作用,有研究表明TRPC6可能是TGFβ1下游作用因子之一[2~3],但TRPC6是否参与TGFβ1诱导足细胞的损伤过程,目前尚未检索到相关研究。本研究通过基因过表达技术,诱导足细胞TRPC6高表达,观察TRPC6高表达对TGFβ1诱导的足细胞凋亡及nephrin、desmin、caspase9表达的影响,以期为足细胞损伤的防治提供新靶点。
1材料与方法
1.1实验细胞和试剂
肾小球足细胞株(MPC5)购于上海复旦大学细胞中心,RPMI1640培养液、胎牛血清[海克隆生物化学制品(北京)有限公司],重组人TGFβ1(ProSpecTany)、BCA蛋白定量试剂盒(碧云天生物工程研究所)、RNA提取试剂盒(爱思进 AxyPrep)、SuperQuickRT MasterMix(北京康为世纪生物科技有限公司)、UltraSYBR MixturePCR(北京康为世纪生物科技有限公司)、TRPC6、nephrin、desmin、GAPDH一抗及HRP标记的二抗(美国Abcam),DAPI溶液(北京索莱宝),pEX3NC、pEX3TRPC6质粒(上海吉玛公司),FITC标记山羊抗兔IgG(北京中杉金桥),Lipofeetamine2000(Invitrogen公司)。
1.2足细胞培养
肾小球足细胞培养参照文献[4],并稍做修改,细胞在含10%胎牛血清的RPMI1640培养液中,在5% CO2、37℃培养箱中传代培养。
1.3细胞转染及分组
实验前一天,接种1×104细胞至24孔板中,加入500 μL含血清培养液,5%CO2、37℃培养箱培养至65%融合。分别将pEX3NC、 pEX3TRPC6与脂质体Lipofeetamine2000混合(1∶4),室温静置30分钟后加入24孔板,以无血清的1640培养液孵育6小时后改用含10%FBS的RPMI1640培养基继续培养。24及48小时后通过倒置荧光显微镜观察足细胞中GFP的表达,测定转染效率(转染细胞率=荧光蛋白表达细胞数/总细胞数×100%);48小时后应用Western blot检测TRPC6蛋白的表达。将细胞分为4组:正常对照组,TGFβ1干预组,TGFβ1干预+pEX3NC,TGFβ1干预+pEX3TRPC6组。在后3组细胞中加入TGFβ1,使其终浓度为12 ng/ml,干预48小时后收集各组细胞分别进行检测,实验重复3次。
1.4real time RTPCR检测caspase9、nephrin、desmin mRNA表达
模型建立后按 RNA提取试剂盒提取各组细胞总RNA。用紫外分光光度计测 RNA 的浓度并用电泳测得RNA的完整性和降解情况。按反转录试剂盒要求加入相应的试剂,放入PTC200仪进行反转录得到cDNA。引物均由上海生物工程公司生产,引物序列见表1。反应总体系20 μL,反应条件:95℃预变性10 min,95℃变性15 s,61.7℃延伸58 s,循环40次。同时设熔解曲线55℃~95℃ 10 s共81个循环。每个样品均设3个复孔,同时设空白对照和阴性对照,每个样本重复3次,取其平均值为样本Ct值。目标基因相对于内参基因进行相对定量,采用2△△CT法进行mRNA相对表达量的比较。PCR扩增产物经2%琼脂糖凝胶电泳检测基因特异性。

去除24孔板中的培养液,每孔细胞中加入50 μL IP(IP使用前与PMSF混匀,使PMSF终浓度为1 mmol/L)充分裂解细胞,用枪头上下吹打细胞10~20次后收集细胞至1.5 ml离心管中,14 000 g离心5 min,取上清液至200 μL离心管中得细胞总蛋白质,用BCA蛋白定量试剂盒测定总蛋白浓度。将提取的总蛋白溶于5%SDS,100℃,5分钟热变性。每孔加50 μg总蛋白进行SDSPAGE凝胶电泳,300 mA恒流转至PVDF膜2.5 h。3%BSA室温封闭1小时,加入按适当比例稀释的一抗(兔抗TRPC6多克隆抗体,稀释度1∶300;兔抗caspase9,稀释度1∶300;兔抗nephrin,稀释度1∶200;兔抗desmin,稀释度1∶500;兔抗GAPDH,稀释度1∶500),4℃冰箱摇床孵育过夜。TBST洗膜3次,10 min/次,加入羊抗兔多克隆二抗,稀释度1∶5000,室温孵育1小时,TBST洗膜3次,20 min/次,ECL化学发光试剂盒显色,曝光、显影、定影,扫描条带,利用ImageJ软件分析蛋白条带灰度值,以目的蛋白条带与GAPDH蛋白条带的灰度值的比值表示其相对含量,每组实验重复3次,取其平均值。
1.6流式细胞术检测细胞凋亡率
各组细胞先用预冷的PBS洗2次,然后用胰酶消化,1.5 ml离心管收集各组细胞,800 g离心5 min分钟,去上清,用1 ml PBS重悬细胞,再次离心去上清,重复两次以去除胰酶中的ETDA。最后将细胞重悬于150 μL结合缓冲液中,调整细胞浓度为1×106/ml,分别加入2.5 μL Annexin V和0.5 μL 100 μg/ml的PI溶液,室温避光孵育15 min。上机检测前补加200 μL结合液,轻轻混匀。立即将染色细胞进行流式分析,每组实验重复3次,取其平均值。
1.7DAPI荧光染色观察足细胞凋亡的核形态学变化
各组细胞干预72 h后,取10 μg 1 mg/ml的DAPI水溶液加到1 ml PBS中,配制成10 μg/ml的DAPI溶液,每孔细胞加入50 μL的10 μg/ml DAPI溶液,在37℃培养箱中培养细胞15 min,然后置于荧光显微镜360 nm激发波长下观察,取图。
1.8统计学方法
采用SPSS 17.0软件进行分析,计量资料先进行正态分布和方差齐性检验,符合正态分布及方差齐性,以均数±标准差(±s)表示,多组间比较采用方差分析,进一步两两比较采用q检验(NewmanKeuls法),检验水准:α=0.05。
2结果
2.1足细胞形态学观察及特异性抗原nephrin检测
正常足细胞呈多边形或梭形,细胞轮廓清晰,自细胞体伸出少量树枝样突起(图1A)。间接免疫细胞化学染色:nephrin分布于胞膜、核周及细胞质(图1B)。real time RTPCR产物行琼脂糖凝胶电泳,结果显示该细胞系表达nephrin(图1C),nephrin是足细胞特异性分子,因此可以认为实验用细胞系来源于足细胞。
A:正常足细胞形态;B:免疫荧光染色nephrin在足细胞上的表达、分布;C:nephrin荧光定量PCR产物琼脂糖电泳。
2.2TRPC6转染效率
将pEX3NC、pEX3TRPC6转染足细胞48小时后,Westernblot 结果显示,转染pEX3TRPC6(高表达组)TRPC6蛋白明显升高(P<0.05),传染pEX3NC(空载体组)对TRPC6蛋白表达无明显影响(P>0.05)。正常对照组、空载体组、高表达组TRPC6/GAPDH蛋白灰度值之比分别为(0.49±0.02)、(0.50±0.001)、(1.01±0.04)。见图2A、B。
A:westernblot蛋白条带原始图;B:目的蛋白表达相对灰度值之比,与正常组相比,a:P<0.01,与空载体组相比,b:P<0.01。
2.3TRPC6高表达对TGFβ1干预下足细胞nephrin、caspase9、desmin mRNA表达的影响
TGFβ1干预48小时后足细胞nephrin mRNA表达水平明显降低(P<0.05),caspase9、desmin mRNA表达水平明显升高(P<0.05),TGFβ1干预+转染pEX3TRPC6(TRPC6高表达) 组上述变化更加明显 (P<0.05)。TGFβ1干预+转染pEX3NC (空载体)组与TGFβ1干预组nephrin、caspase9、desmin mRNA表达水平无明显差异。见表2。
2.4TRPC6高表达对TGFβ1干预下足细胞nephrin、caspase9、desmin 蛋白表达的影响
TGFβ1刺激48小时后足细胞nephrin 蛋白表达水平明显降低(P<0.05),caspase9、desmin 蛋白表达水平明显升高(P<0.01),TGFβ1干预+转染pEX3TRPC6(TRPC6高表达组)上述变化更加明显 (P<0.05)。TGFβ1干预+转染pEX3NC(空载体组)与TGFβ1干预组nephrin、caspase9、desmin 蛋白表达水平无明显差异。见图3。
2.5DAPI染色结果
细胞核形态学改变是细胞凋亡的重要鉴别依据。在荧光显微镜下(图4A),可观察到正常足细胞的染色质疏松,荧光强度相对较弱,细胞核大小一致,形态规则(图4A); 细胞发生凋亡时染色质浓缩,荧光强度增强,一些细胞核碎裂,呈现大小不一的荧光斑块,即“凋亡小体”(图4B); 各组细胞经DAPI染色后均可见典型细胞凋亡的细胞核形态学改变,但各组细胞凋亡细胞数明显不一(图4C~F)。
A:western blot 蛋白条带原始;B:目的蛋白表达相对灰度值之比:与正常组相比,a:P<0.01;与TGFβ1干预组相比,b:P<0.01。
A,B(×20倍):箭头表示断裂的染色质及浓缩的细胞核,三角形表示正常细胞核;A:正常足细胞细胞核形态,B:TGFβ1诱导足细胞凋亡的细胞核形态。C、D、E、F(×10倍):各组细胞核形态变化;C:正常对照组,D:TGFβ1干预组,E:TGFβ1干预+高表达组,F:TGFβ1干预+高空载体组。
2.6TRPC6高表达对TGFβ1诱导下足细胞凋亡的影响
流式细胞术结果显示正常对照组足细胞凋亡率为(1.34±0.15)%,应用TGFβ1处理48 小时后凋亡率明显升高,其凋亡率为(12.30±0.81)%,与对照组相比差异有统计学意义(P<0.01),而TGFβ1干预+TRPC6高表达组凋亡率为(21.26±1.16)%,明显高于TGFβ1干预组(P<0.01),转染空载体组细胞凋亡率为(13.20±1.25)%,与TGFβ1干预组相比差异无统计学意义(P>0.05)。见图5A~D、表3。
A:正常组;B:TGFβ1干预组;C:TGFβ1干预+高表达组;D:TGFβ1干预 + 空载体组

3讨论
瞬时受体电位阳离子通道蛋白6(transient receptor potential channel6,TRPC6)作为瞬时受体电位超家族中的一员,是一种非选择性的阳离子通道。TRPC6是2005年Winn研究小组通过对家族性遗传性局灶节段性肾小球硬化症研究所发现,随后免疫共沉淀技术显示TRPC6和podocin、nephrin共表达,且与这些蛋白之间有相互作用,TRPC6参与构成裂孔隔膜信号复合体[5], TRPC6的发现将足细胞裂孔隔膜蛋白与离子通道联系起来,拓宽了足细胞分子网络,为复杂肾脏疾病的研究提供新的思路。但目前对于TRPC6的研究尚处于起步阶段,具体作用机制尚未完全阐明。
TRPC6基因突变可以导致常染色体显性遗传性局灶节段性肾小球硬化,在高糖[6]、血管紧张素Ⅱ诱导[7]、链脲佐菌素诱导[8]的足细胞损伤过程中,TRPC6高表达可通过诱导细胞内钙离子内流增加,引起足细胞骨架分布紊乱、裂孔隔膜蛋白表达异常。在糖尿病肾病[9]、膜性肾病[10]等多种人类获得性蛋白尿性肾小球疾病中其表达量与蛋白尿程度呈正比。TGFβ1是公认的致肾脏纤维化细胞因子,具有诱导足细胞损伤的作用,但在此过程中TRPC6是否参与其中目前尚无研究。鉴于此,本研究通过转染TRPC6真核表达载体至足细胞使其高表达TRPC6,观察TRPC6高表达对TGFβ1干预下足细胞损伤的影响。通过实验我们发现,在TGFβ1作用下,nephrin表达明显下降,desmin表达明显增多,基因诱导 TRPC6高表达后nephrin下降更加明显,desmin表达升高更加明显,这表明TRPC6高表达能促进TGFβ1诱导的足细胞损伤过程,与上述研究结果相似。
足细胞丢失是导致肾小球硬化的关键因素,而凋亡则是导致足细胞丢失的重要原因之一,深入探讨足细胞凋亡机制对延缓肾小球硬化进程具有重要意义。TGFβ1是一种多功能细胞因子,参与细胞增殖分化、凋亡、血管形成、细胞外基质形成等多种生物学事件[11]。在TGF损伤足细胞的多种机制中,促凋亡是其重要的环节,但TRPC6与TGF诱导足细胞凋亡的关系目前国内外尚未检索到相关报道。因此,本研究中我们首先通过DAPI染色观察足细胞核形态学改变。结果发现,各组细胞经DAPI染色后均可见典型细胞凋亡的细胞核形态学改变,TRPC6高表达后细胞凋亡数目明显增多。由此可初步判断TRPC6高表达参与TGF诱导的足细胞凋亡过程。为使实验结果更有说服力,我们又通过流式细胞检测各组细胞的凋亡率。结果显示,TGFβ1作用48小时后足细胞凋亡率由(1.34±0.15)%增高至(1230±0.81)%,而使TRPC6高表达后凋亡率升高至(21.26±1.16)%,转染空载体组细胞凋亡率较TGFβ1干预组无明显差异。上述实验结果说明TRPC6高表达参与了TGFβ1诱导的足细胞凋亡过程。
既往研究发现,线粒体凋亡途径在TGFβ1诱导的足细胞凋亡中发挥重要作用。Das等[12]通过体外构建TGFβ1诱导条件永生化小鼠足细胞损伤模型,发现TGFβ1通过SmadERK1/2mTORC1轴提高Nox4的表达,进而使ROS产生增多、线粒体功能障碍,最终导致足细胞凋亡。半胱氨酸蛋白酶家族(caspase) 是一类凋亡特异性蛋白酶,在细胞凋亡过程中处于中心地位,其中caspase9是线粒体介导的内源凋亡途径中首先被激活的因子[13]。为了进一步研究TRPC6在TGFβ1诱导的足细胞凋亡中的可能作用机制,本实验观察了TRPC6高表达对TGFβ1干预下足细胞caspase9表达的影响。结果发现TGFβ1作用48小时后足细胞caspase9表达水平明显上调,说明线粒体介导的内源性凋亡途径确实参与了TGFβ1诱导的足细胞凋亡过程,而当使TRPC6高表达后caspase9在基因及蛋白水平均明显升高,这说明TRPC6至少部分通过调节线粒体介导的内源性凋亡途径caspase9的表达进而增加TGFβ1诱导的足细胞凋亡。
综上所述,我们的研究表明TRPC6是TGF诱导足细胞损伤过程中的重要分子,通过加深TGFβ1诱导的足细胞凋亡程度,减少nephrin表达,增加desmin表达可能是其作用机制之一。阻断病理状况下TRPC6的高表达或许是治疗蛋白尿性肾脏疾病的新策略,我们将在后续试验中进一步探讨。
参考文献
[1]SzabóT,Ambrus L,Zákány N,et al.Regulation of TRPC6 ion channels in podocytes Implications for focal segmental glomerulosclerosis and acquired forms of proteinuric diseases[J].Acta Physiol Hung,2015,102(3):241251.
[2]姚兴梅.晚期糖基化终末产物对肾小球系膜细胞瞬时受体电位阳离子通道蛋白 6(TRPC6)表达的影响[D].苏州:苏州大学,2010.
[3]Graham S,Yuan JP,Ma R.Canonical transient receptor potential channels in diabetes[J].Exp Biol Med (Maywood),2012,237(2):111118.
[4]雷凤英.全反式维甲酸对体外培养阿霉素致肾小球足细胞损伤的作用及其分子机制[D].南宁:广西医科大学,2014.
[5]Winn MP,Conlon PJ,Lynn KL,et al.A mutation in the TRPC6 cation channel causes familial focal segmental glomerulosclerosis[J].Science,2005,308(5729):18011804.
[6]Sonneveld R,van der Vlag J,Baltissen MP,et al.Glucose specifically regulates TRPC6 expression in the podocyte in an AngIIdependent manner[J].Am J Pathol,2014,184(6):17151726.
[7]Zhang H,Ding J,Fan Q,et al.TRPC6 upregulation in Ang IIinduced podocyte apoptosis might result from ERK activation and NFkappaB translocation[J].Exp Biol Med (Maywood),2009,234(9):10291036.
[8]Zhang X,Song Z,Guo Y,et al.The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZinduced diabetic rats[J].Mol Cell Biochem,2015,399(12):155165.
[9]Ma R,Liu L,Jiang W,et al.FK506 ameliorates podocyte injury in type 2 diabetic nephropathy by downregulating TRPC6 and NFAT expression[J].Int J Clin Exp Pathol,2015,8(11):1406314074.
[10]Hofstra JM,Coenen MJ,Schijvenaars MM,et al.TRPC6 single nucleotide polymorphisms and progression of idiopathic membranous nephropathy[J].PLoS One, 2014,9(7):e102065.
[11]Meng XM,Tang PM,Li J,et al.TGFβ/Smad signaling in renal fibrosis[J].Front Physiol,2015(6):82.
[12]Das R,Xu S,Nguyen TT,et al.Transforming Growth Factor β1induced Apoptosis in Podocytes via the Extracellular Signalregulated KinaseMammalian Target of Rapamycin Complex 1NADPH Oxidase 4 Axis[J].J Biol Chem,2015,290(52):3083030842.
[13]Brentnall M,RodriguezMenocal L,De Guevara RL,et al.Caspase9,caspase3 and caspase7 have distinct roles during intrinsic apoptosis[J].BMC Cell Biol,2013(14):32.
(收稿日期:2016-04-24修回日期:2016-08-06)
(编辑:梁明佩)
