克罗诺杆菌的生物膜检测和药敏性分析
2015-12-26陈雅蘅周帼萍杨祖顺
张 翼,陈雅蘅,周帼萍,*,杨祖顺
(1.武汉轻工大学生物与制药工程学院,湖北 武汉 430023;2.云南省疾病预防控制中心,云南 昆明 650022)
克罗诺杆菌的生物膜检测和药敏性分析
张 翼1,陈雅蘅1,周帼萍1,*,杨祖顺2
(1.武汉轻工大学生物与制药工程学院,湖北 武汉 430023;2.云南省疾病预防控制中心,云南 昆明 650022)
目的:了解38 株主要来源于我国婴幼儿食品克罗诺杆菌分离株的生物膜形成能力和药敏性。方法:首先用fusA序列分析,对43 株克罗诺杆菌进行准确鉴定;采用半定量黏附实验(结晶紫染色法)测定分离株的生物膜形成能力,并选用八大类11 种抗生素测定其抗生素敏感性。结果:鉴定出34 株阪崎克罗诺杆菌、7 株丙二酸盐克罗诺杆菌和2 株都柏林克罗诺杆菌。这些克罗诺杆菌分离株均有一定生物膜成膜能力,其中丙二酸盐克罗诺杆菌的成膜能力较强;菌株普遍对四环素和万古霉素耐药性较高,共有14 个耐药谱;四环素的耐药性与生物膜形成能力有显著相关性。结论:实验结果表明克罗诺杆菌的成膜性和耐药性都较强,对相关食品企业的消杀措施和临床治疗提出了挑战。
克罗诺杆菌;鉴定;生物膜;抗生素敏感性
克罗诺杆菌原名阪崎肠杆菌,耐高温、酸和干燥,对环境有比较强的抵抗力,广泛分布在食品和环境中[1]。联合国粮食及农业组织和世界卫生组织(Food and Agriculture Organization of the United Nations/World Health Organization,FAO/WHO)于2004年在日内瓦召开的有关联席会议中指出奶粉中的克罗诺杆菌等是导致婴幼儿感染、疾病以及死亡的主要原因,特别是早产儿、出生体质量较低或免疫力低下的婴幼儿,能引起严重的婴幼儿败血症、脑膜炎、坏死性小肠结肠炎,神经系统后遗症等疾病,甚至导致婴幼儿死亡[2-4]。克罗诺杆菌对危重患者、老人等免疫力低下人群的感染也会引发较严重的后果[5]。
2007年Iversen[6-7]、Joseph[8]、Brady[9]等根据表型和基因型特征将阪崎肠杆菌成立为肠杆菌科中的一个新属——克罗诺属,目前该属共有10 个种:阪崎克罗诺杆菌、苏黎世克罗诺杆菌、丙二酸盐克罗诺杆菌、莫金斯克罗诺杆菌、都柏林克罗诺杆菌、康帝蒙提克罗诺杆菌、尤尼沃斯克罗诺杆菌、C. zurichensis、C. helveticus、C. pulveris。阪崎肠杆菌的常规鉴定和分类主要依据生理生化性质[10],但已发现生化分型与基因组测序和MLST分子分型结果有偏差,已不再适用于鉴别该属下种的划分。国际标准等依据生理生化鉴定方法与国际最新分类体系出现了偏离,这不仅是分类学的问题,也涉及到阪崎肠杆菌的安全性评价。因为目前发现只有阪崎克罗诺杆菌、苏黎世克罗诺杆菌和丙二酸盐克罗诺杆菌对人类有感染力,尤其值得重视的是阪崎克罗诺杆菌与婴幼儿脑膜炎密切相关[11-12]。
生物膜是细菌为了适应环境和维持自身生命而发生的形态学变化,具有抵抗机体免疫系统的能力[13],并增强了细菌对外界环境的抵抗力[14]。生物膜对于食品工业卫生有重大影响,因为食物包装材料及设备加工表面形成的生物膜可能导致常规清洁、消毒、杀菌方法失效,进而造成长期持续性污染,为食品企业带来风险隐患[15]。了解食源性致病菌的生物膜产生能力对食品企业分析潜在的污染源头,并消除污染隐患有所助益。
由于滥用抗生素等因素,近年来克罗诺杆菌等细菌的耐药性不断增加[16],细菌的耐药性给临床治疗带来诸多困难,对人类健康造成威胁[17],研究微生物的耐药性和耐药机制,加强对细菌的耐药检测,合理地选用抗菌药物以减少细菌耐药性发生,对于控制和治疗由该食源性微生物引起的感染具有重要意义[18]。
本研究对从食品中分离的38 株克罗诺杆菌及5 株标准株,按照最新分类体系鉴定到种后,分析其生物膜形成能力及其对抗生素的敏感性,以期为研究克罗诺杆菌及治疗由其引起的感染提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
对34 株来自我国婴幼儿食品的分离株、4 株食品原料分离株、2 株标准株(中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)和美国菌种保藏中心(American Type Culture Collection,ATCC))、3 株丹麦实验室提供的菌株共计43 株克罗诺杆菌进行分析。菌株的分离和初步鉴定依据GB 4789.40—2010《食品安全国家标准 食品微生物学检验 阪崎肠杆菌检验》。蜡样芽孢杆菌ATCC 14579及ATCC 10987分别作为生物膜形成能力检测方法实验中的阳性和阴性对照株,大肠杆菌ATCC 29522则为药敏标准中质控菌株。
1.1.2 试剂
LB培养基、水解酪蛋白培养基、药敏试纸 北京天坛药物生物技术开发公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂2×Taq PCR Master Mix 北京艾德莱生物科技有限公司。
1.2 仪器与设备
恒温培养箱 上海精宏实验设备有限公司;YM50AI全自动灭菌锅 上海三申医疗器械有限公司;A-5082 DNA Expert酶标仪 瑞士Tectan公司;96孔酶标板 美国康宁公司。
1.3 方法
1.3.1 fusA序列分析
对数据库网站(http://pubmlst.org/cronobacter/)所列克罗诺杆菌的7 对管家基因中的fusA进行PCR扩增,PCR反应产物由苏州金唯智生物科技有限公司进行测序,对测序结果进行编辑和核对后提交给MLST数据库,获得编号ID和等位基因型,并用Splitstree4软件进行聚类分析。
1.3.2 生物膜检测[19]
采用结晶紫染色法进行半定量分析:每个96 孔板上均有蜡样芽孢杆菌ATCC14579及ATCC10987这2 个标准对照组和1 个空白培养基组,每个菌株设3 个重复。具体实验方法如下:LB平板30 ℃、24 h活化菌株;新96 孔平板每孔加200 μL的无菌LB培养液;接种:30 ℃培养72 h;弃菌液:1×磷酸盐缓冲液(phosphate buffered saline,PBS)清洗、室温干燥,加200 μL的结晶紫染色20 min,弃染液,1×PBS清洗3 次,室温干燥;加160 μL的丙酮-乙醇溶液(20∶80,V/V)溶解,测595 nm波长处的光密度值(OD595nm)。
1.3.3 药敏实验方法[20]
美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的抗微生物药物敏感性实验操作方法和判断标准,也是国内临床细菌检验遵循的标准,故采取CLSI 2005版中K-B纸片扩散法进行,以ATCC25922大肠杆菌做质控。按推荐的肠杆菌药敏实验抗生素选择原则,结合临床用药和研究需要,共选择了八大类11 种抗生素,结果见表1。
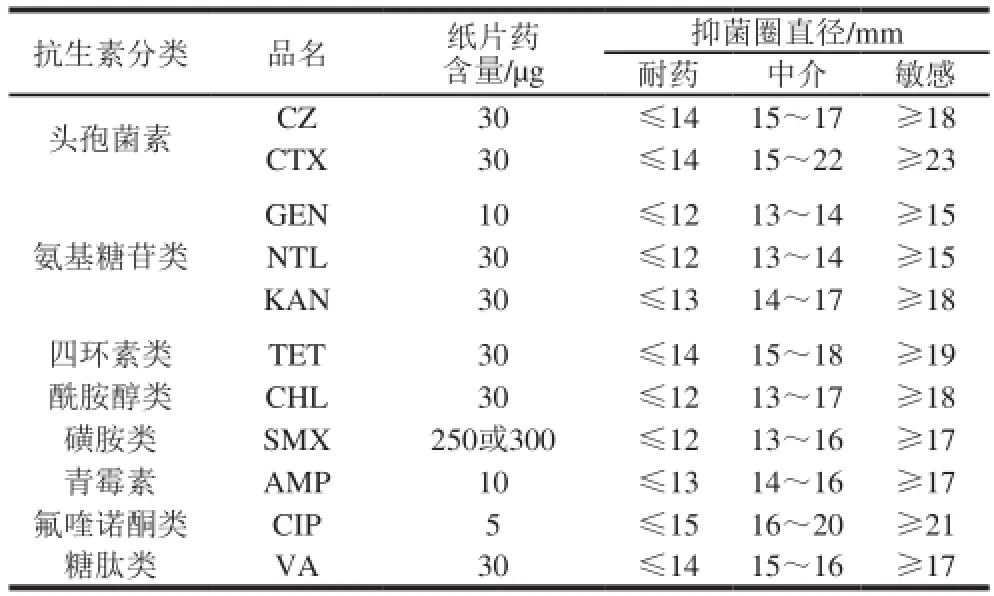
表1 药敏实验中所选用的抗生素Table 1 Antibiotics used in the susceptibility testing
1.3.4 数据分析
使用软件SPSS19.0统计分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 fusA序列分析
截至2014年11月23日在克罗诺杆菌MLST数据库中收集了自1950年以来全球超过38 个国家1 078 个菌株共329 个ST型的信息。采用Splitstree4分析数据库中7 个管家基因的序列,发现fusA基因是进化最稳定的基因,但其序列多样性又可准确区分最新分类系统中的该属下10 个种(图1),所以选用fusA基因序列分析做菌种鉴定。提交fusA基因序列给数据库获得等位基因型和菌株编号见表1,再依据图1鉴定到种。该鉴定结果和ropB序列分析及MLST分型结果一致(待发表),说明其结果可信。
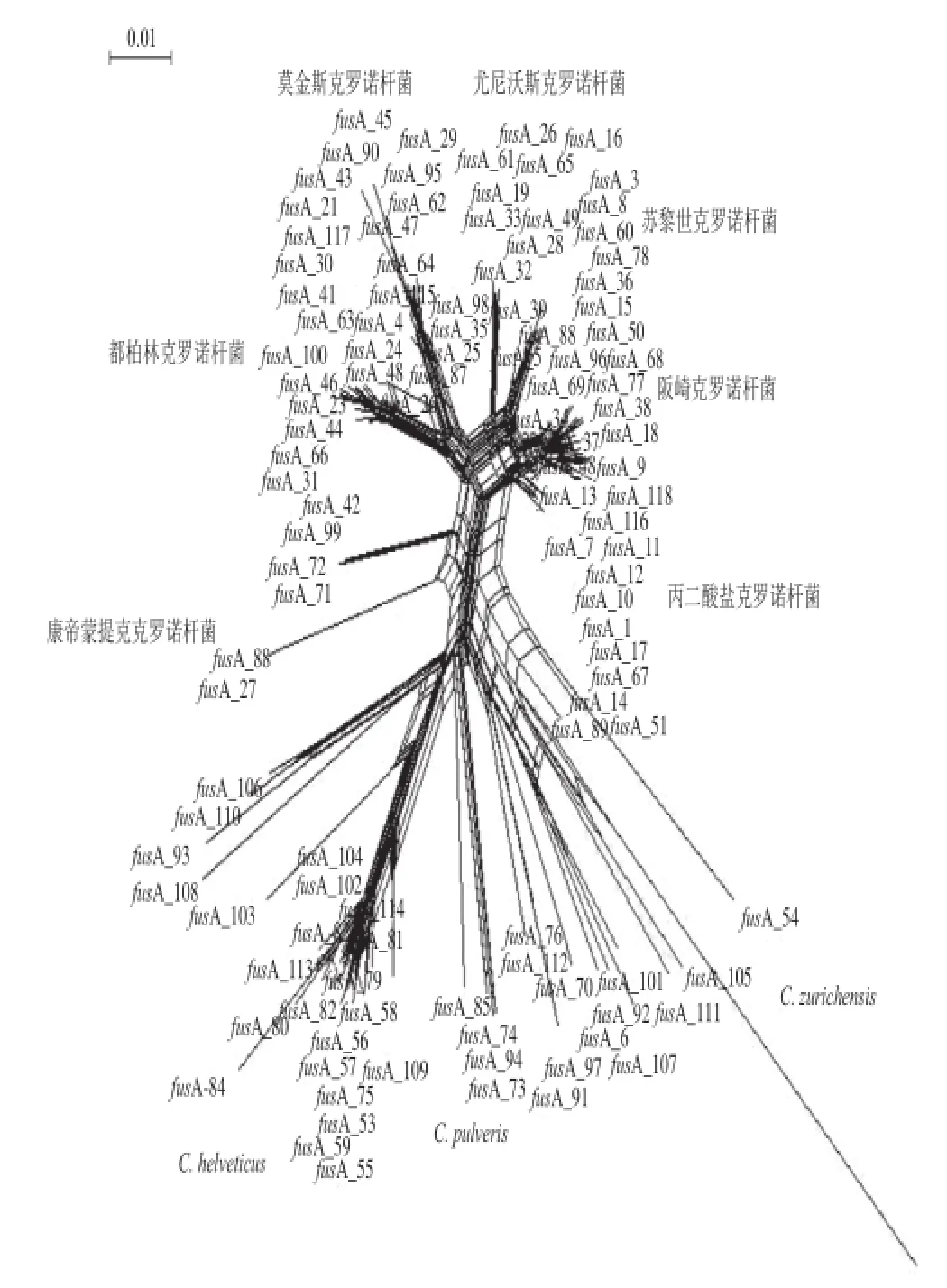
A管家基因的Splitstree4分析Fig.1 Splitstree4 analysis of fusA housekeeping gene in MLST database图1 MLST数据库中fus
其中,中国工业微生物菌种保藏中心的标准株CICC21544登记的是阪崎肠杆菌,根据fusA序列分析结果鉴定为丙二酸盐克罗诺杆菌(图1)。
2.2 生物膜形成能力
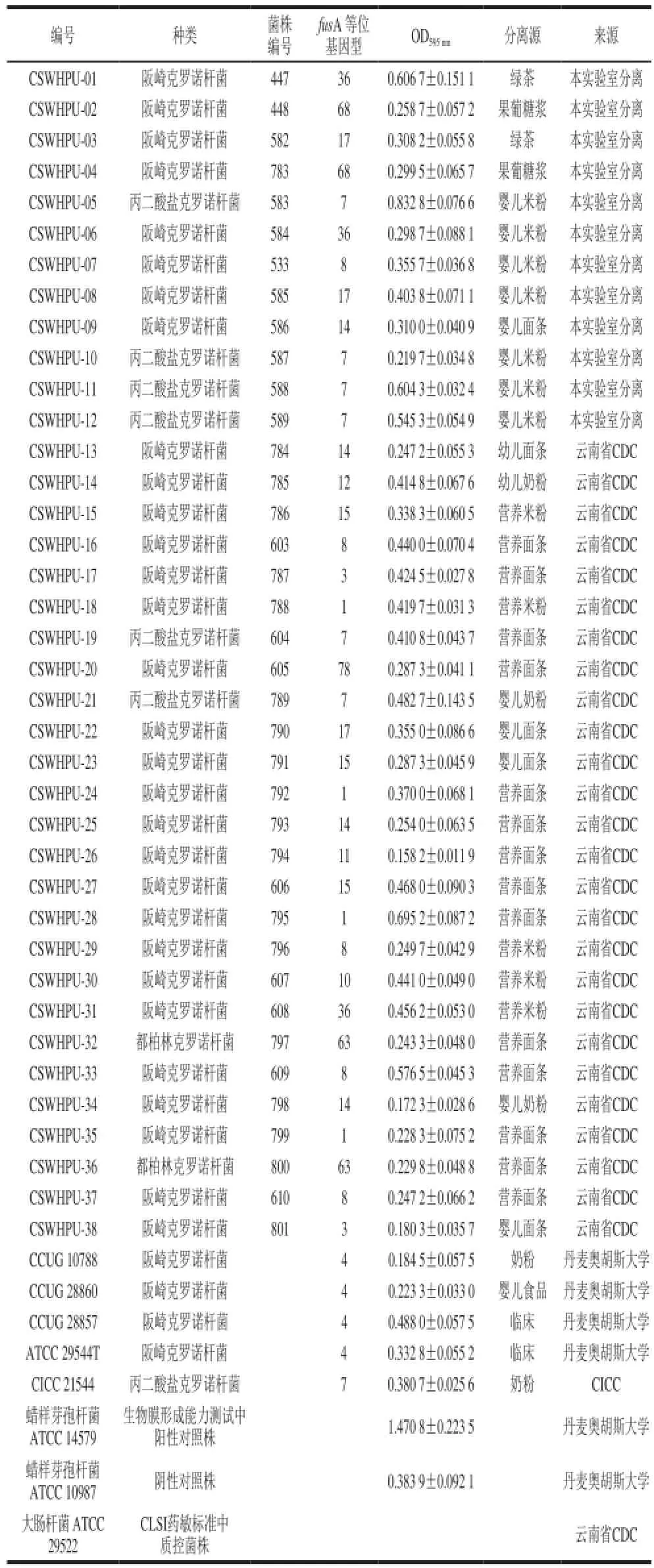
表2 克罗诺杆菌分离株信息Table 2 Profile of Cronobacter isolates
由表2可知,蜡样芽孢杆菌ATCC14579是生物膜形成能力较强的菌株(均值1.470 8±0.223 5),蜡样芽孢杆菌ATCC10987是生物膜形成能力较弱的菌株(均值0.383 9±0.092 1),将其分别作为阳性和阴性对照监测生物膜检测方法的稳定性和可比性。将43 株菌株按照克罗诺属中不同种之间进行生物膜形成能力的比较,结果见图2。阪崎克罗诺杆菌的成膜能力较弱,而丙二酸盐克罗诺杆菌的成膜能力较强,差异具有统计学意义(P<0.05)。
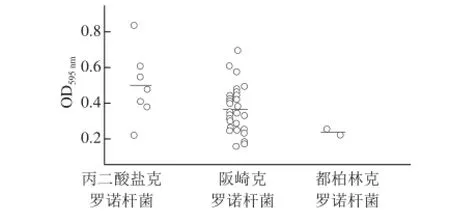
图2 克罗诺杆菌分离株的3 个种之间生物膜形成能力比较Fig.2 Comparison of biofilm-forming capability among three Cronobacter species
2.3 药敏实验结果
2.3.1 药敏实验检验结果
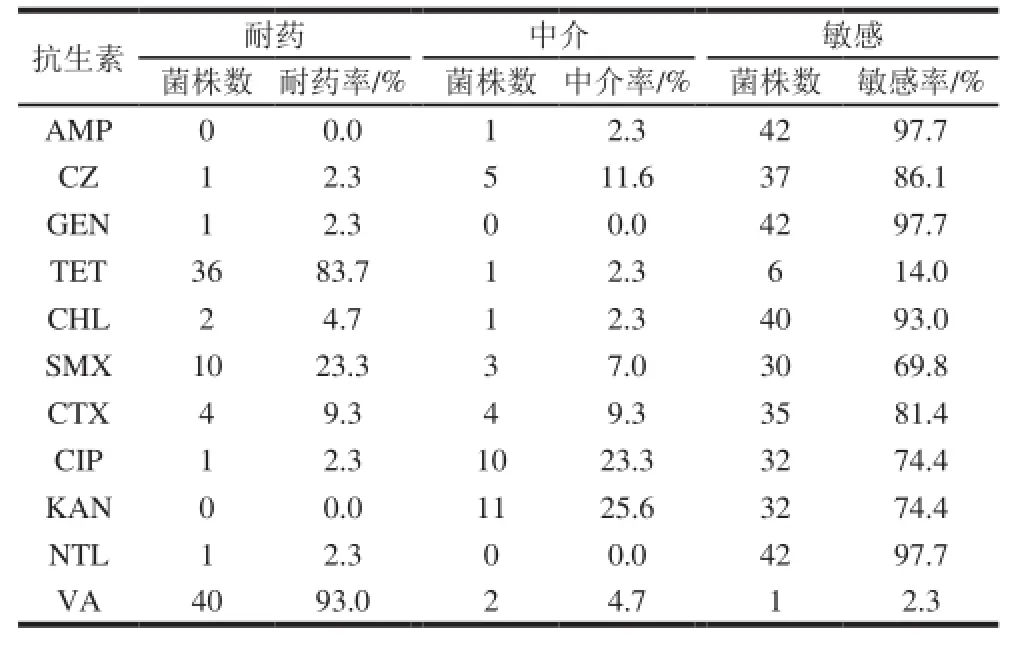
表3 药敏实验结果Table 3 Results of antibiotic susceptibility testing
由表3可知,43 株克罗诺杆菌对万古霉素和四环素耐药性较高,分别为93.0%和83.7%;而对氨苄西林、庆大霉素、奈替米星最为敏感;对头孢菌素类抗生素头孢唑啉和头孢噻肟的敏感率比较相似。药敏结果与相关文献报道较为一致[21]。
值得注意的是文献普遍认为克罗诺杆菌对万古霉素抗性可达100%,而本实验结果中43 株中并非都对万古霉素有抗性,如果参照肠球菌(G+)标准来看,仅有93%菌株对万古霉素有耐药性,而非100%抗性。
2.3.2 菌株的耐药谱分析
由表4可知,43 株克罗诺杆菌至少对一种抗生素有抗性,一共有14 个耐药谱,耐两种以上抗生素的菌株有38 株,耐3 种以上抗生素的多重耐药菌株有12 株。最常见的两种耐药谱依次是TET-VA(51.2%),TET-SMX-VA(11.6%),多重耐药菌株最多可同时对5 种抗生素耐药(TET-CHL-SMX-CTX-VA)。说明克罗诺杆菌的耐药性问题比较严重,但尚未发现对临床时针对克罗诺杆菌常用的氨苄青霉素-氨基糖苷类抗生素如:AMP-GEN/NTL/KAN的双重耐药型菌株,也就是说临床目前使用的抗生素组合依然有效。
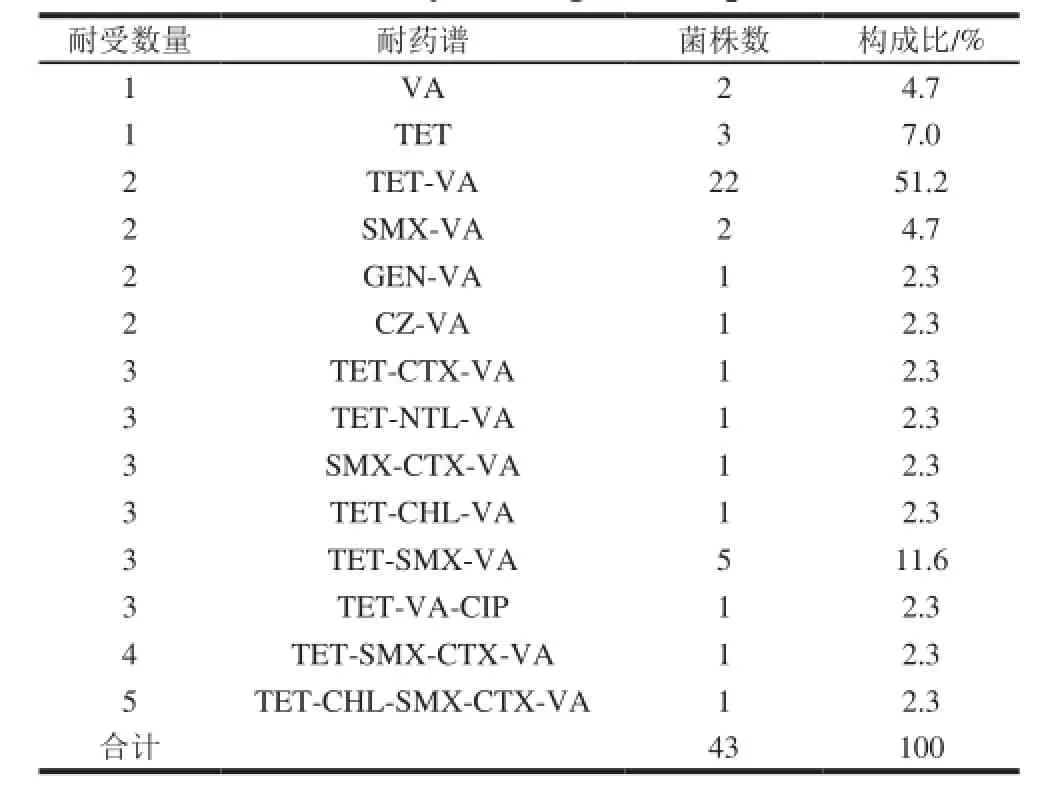
表4 分离株的耐药谱分析Table 4 Analysis of drug resistant spectrum
2.3.3 3 种克罗诺杆菌对不同抗生素的敏感率比较

表53 种克罗诺杆菌对抗生素的敏感率Table 5 Comparison of antibiotic susceptibility among three Cronobacter species %
由表5可知,有7 株丙二酸盐克罗诺杆菌均对氨苄西林、庆大霉素、氯霉素、卡那霉素和奈替米星敏感;但阪崎克罗诺杆菌对临床常用药氨苄西林(97.1%)、庆大霉素(97.1%)、卡那霉素(70.6%)和奈替米星(97.1%)敏感率均不足100%;不同种的菌株间对四环素的敏感率差别显著。
2.3.4 生物膜形成能力与耐药性的相关性
本实验对分离株生物膜形成能力和药敏实验结果抑菌圈直径大小进行相关性分析,四环素耐药性与生物膜形成能力有显著相关性(相关系数-0.364,P<0.05),其他抗生素的抗药性和生物膜形成能力的数据相关性不大。
2.3.5 武汉分离株和云南CDC分离株耐药率比较
武汉(武汉轻工大学生化楼605实验室)分离株和云南(云南CDC)分离株耐药率比较如图3,可见云南分离株在头孢唑林、庆大霉素、氯霉素、磺胺的耐药率上高于武汉分离株;而武汉株在四环素和奈替米星的耐药率高于云南株。各个地区对不同抗生素的耐药率显示出差异,尤其是以磺胺抗性差异显著。
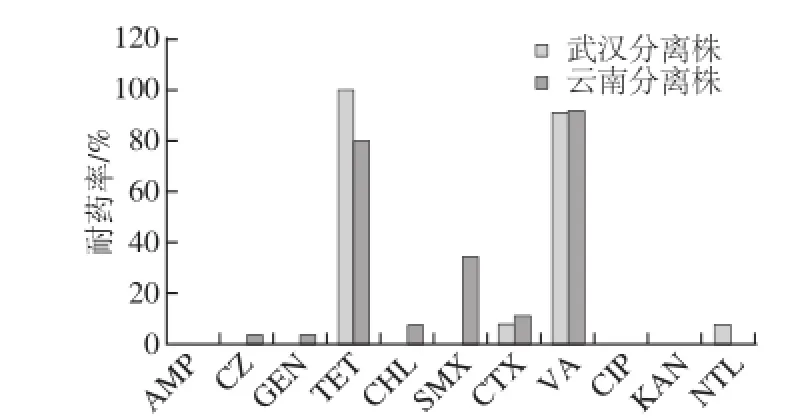
图3 武汉分离株和云南分离株耐药率比较Fig.3 Comparison of drug resistance rate of isolates from Wuhan and Yunnan
3 讨 论
本实验中43 株菌株分别鉴定为34 株阪崎克罗诺杆菌、7 株丙二酸盐克罗诺杆菌和2 株都柏林克罗诺杆菌。除2 株标准株及1 株临床株外均为食品分离株(其中36 株菌株来自婴幼儿食品),其中有32 株阪崎克罗诺杆菌(78.9%),6 株丙二酸盐克罗诺杆菌(15.8%)和2 株都柏林克罗诺杆菌(5.3%)。值得关注的是:在克罗诺杆菌10 个种中,对婴幼儿具有高毒力的阪崎克罗诺杆菌占显著优势,对成人具有感染力的丙二酸盐克罗诺杆菌所占比例次之,另一个对人类有感染力的苏黎世克罗诺杆菌则未检出。说明这些食品,尤其是婴幼儿食品中克罗诺杆菌的危害不可小视。
克罗诺杆菌对四环素、氨基糖苷类抗生素、多种β-内酰胺类抗生素、氯霉素和喹诺酮敏感,所以临床治疗其感染多选用氨苄青霉素-庆大霉素或氨苄青霉素-链霉素[22],但是已经发现一些氨苄青霉素或庆大霉素抗性菌株出现,这是因为它们获得了某些转座子,或产生β-内酰胺酶的能力和多重耐药基因簇。本实验分离到的38 株分离株中未发现对这2 种抗生素组合的双重耐药谱。
特别值得注意的是很多文献认为克罗诺杆菌对万古霉素抗性可达100%[1,23],所以在GB 4789.40—2010中所用的富集培养基中含10 μg/mL的万古霉素。依据GB 4789.40—2010进行前期分离和初步鉴定,也就是说本实验中分离株至少能耐受10 μg/mL的万古霉素,但是药敏实验中用了30 μg/mL的万古霉素,有1 株敏感菌,2 株中介菌。周显凤等[16]也曾发现1 株婴幼儿配方奶粉的阪崎肠杆菌分离株对30 μg/mL的万古霉素敏感。这促使本课题组考虑有没有更敏感的菌株存在;目前采用的选择型培养基有可能导致万古霉素敏感菌株漏检。
2012年Lee等[24]分析了353 份来自韩国的食品中分离到的66 株克罗诺杆菌,并进行了生物膜和耐药性实验:其中占显著优势的阪崎克罗诺杆菌有58 株(87.9%),剩下的分别为2 株莫金斯克罗诺杆菌和6 株都柏林克罗诺杆菌。Lee等[24]研究的韩国株和本实验分离株(武汉株、云南株、丹麦奥胡斯大学的5 个标准株,下同)均对氯霉素和氨苄青霉素高度敏感,但是在四环素和氨基糖苷类抗生素的敏感率差异非常显著。韩国分离株对四环素敏感率达98.2%,而本实验分离株仅为14.0%;本实验中选用了氨基糖苷类抗生素中的庆大霉素、奈替米星和卡那霉素,敏感率分别为97.7%、97.7%和74.4%;而韩国选用了链霉素,敏感率仅为12.0%,中介率高达75.9%。即使是我国不同地区,比如武汉地区分离株和云南地区分离株对11 种抗生素的敏感性也有一定差异。反映出不同国家、地区在食品行业的上游比如:农业、畜牧养殖业抗生素的施用种类和环境中残留浓度有显著差异。
菌株的生物膜形成能力测试实验容易受到多种因素的影响干扰,需要标准株参照。本实验和Lee等[24]都采用了克罗诺杆菌ATCC29544T作为标准株,且两者测定的数值有可比性((0.33±0.06)/(0.29±0.02))。Lee等[24]以OD600nm>1.0为能力强,0.5<OD600nm<1.0为中等,OD600nm<0.5为弱,发现13.8%的阪崎克罗诺杆菌生物膜形成能力强,19.0%为中等;而2 株莫金斯克罗诺杆菌和6 株都柏林克罗诺生物膜形成能力弱。同样标准,本实验中的34 株阪崎克罗诺杆菌仅有2 株为中等,其余生物膜形成能力都为弱;反而是7 株丙二酸盐克罗诺杆菌有3 株达到中等,2 株都柏林克罗诺杆菌最弱(0.23~0.24)。
[1] 裴晓燕, 郭云昌, 徐进, 等. 婴幼儿配方粉中阪崎肠杆菌分离株的药敏分析[J]. 卫生研究, 2007, 36(1): 63-65.
[2] 裴晓燕, 刘秀梅. 阪崎肠杆菌的生物学性状与健康危害[J]. 中国食品卫生杂志, 2004, 16(6): 550-555.
[3] 王宇, 卢雁. 婴儿配方奶粉中条件致病菌的检出及检测方法的建立[J].中国奶牛, 2010(4): 51-53.
[4] 吴清平, 董晓晖, 张菊梅, 等. 阪崎肠杆菌分类与致病机制[J]. 微生物学报, 2010, 50(7): 841-846.
[5] 陈卓, 任立松, 马龙, 等. 阪崎肠杆菌新疆分离株的药敏分析[J]. 现代预防医学, 2011, 38(17): 3539-3541.
[6] IVERSEN C, LEHNER A, MULLANE N, et al. The taxonomy of Enterobacter sakazakii: proposal of a new genus Cronobacter gen. nov. and descriptions of Cronobacter sakazakii comb. nov. Cronobacter sakazakii subsp. sakazakii, comb. nov., Cronobactersakazakii subsp. malonaticus subsp. nov., Cronobacter turicensis sp. nov., Cronobacter muytjensii sp. nov., Cronobacter dublinensis sp. nov. and Cronobacter genomospecies 1[J]. BMC Evolutionary Biology, 2007, 7: 64-74.
[7] IVERSEN C, MULLANE N, MCCARDELL B, et al. Cronobacter gen. nov. , a new genus to accommodate the biogroups of Enterobacter sakazakii, and proposal of Cronobacter sakazakii gen. nov., comb. nov., Cronobacter malonaticus sp. nov., Cronobacter turicensis sp. nov., Cronobacter muytjensii sp. nov., Cronobacter dublinensis sp. nov., Cronobacter genomospecies I, and of three subspecies, Cronobacter dublinensis subsp. Dublinensis subsp. nov., Cronobacter dublinensis subsp. lausannensis subsp. nov. and Cronobacter dublinensis subsp. lactaridi subsp. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58: 1442 -1447.
[8] JOSEPH S, CETINKAYA E, DRAHOVSKA H, et al. Cronobacter condimenti sp. nov., isolated from spiced meat and Cronobacter universalis sp. nov., a novel species designation for Cronobacter sp. genomospecies 1, recovered from a leg infection, waterand food ingredients[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62: 1277-1283.
[9] BRADY C, CLEENWERCK I, VENTER S, et al. Taxonomic evaluation of the genus Enterobacter based on multilocus sequence analysis (MLSA): proposal to reclassify E. nimipressuralis and E. amnigenus into Lelliottia gen. nov. as Lelliottia nimipressuralis comb. nov. and Lelliottia amnigena comb. nov., respectively, E. gergoviae and E. pyrinus into Pluralibacter gen. nov. as Pluralibacter gergoviae comb. nov. and Pluralibacter pyrinus comb. nov., respectively, E. cowanii, E. radicincitans, E. oryzae and E. arachidis into Kosakonia gen. nov. as Kosakonia cowanii comb. nov., Kosakonia radicincitans comb. nov., Kosakonia oryzae comb. nov. and Kosakonia arachidis comb. nov., respectively, and E. turicensis, E. helveticus and E. pulveris into Cronobacter as Cronobacter zurichensis nom. nov., Cronobacter helveticus comb. nov. and Cronobacter pulveris comb. nov., respectively, and emended description of the genera Enterobacter and Cronobacter[J]. Systematic and Applied Microbiology, 2013, 36(5): 309-319.
[10] 赵贵明,袁飞,陈颖, 等. 奶粉中阪崎肠杆菌分离鉴别方法研究[J].中国公共卫生, 2006, 22(2): 207-208.
[11] JOSEPH S, FORSYTHE S J. Predominance of Cronobacter sakazakii sequence type 4 in neonatal infections[J]. Emerging Infectious Diseases, 2011, 17(9): 1713-1715.
[12] JOSEPH S, FORSYTHE S J. Insights into the emergent bacterial pathogen Cronobacter spp., generated by multilocus sequence typing and analysis[J]. Frontiers in Microbiology, 2012, 3: 397. doi: http:// dx.doi.org/10.3389/fmicb.2012.00397.
[13] 丁进亚, 黄前川, 曹军皓. 细菌生物膜的防治进展[J]. 医学综述, 2011, 17(3): 452-454.
[14] 崔彦超, 侯振江. 国内细菌生物膜耐药性研究进展[J]. 检验医学教育, 2012, 19(2): 41-43.
[15] HARTMANN I, CARRANZA P, LEHNER A, et al. Genes involved in Cronobacter sakazakii biofilm formation[J]. Applied and Environmental Microbiology, 2010, 76: 2251-2261.
[16] 周显凤, 高建新, 龙慧, 等. 婴幼儿配方奶粉中肺炎克雷伯菌与阪崎肠杆菌分离株的药敏分析[J]. 现代预防医学, 2012, 39(6): 1511-1513.
[17] 何旭瑛. 细菌耐药性产生的机制与最新研究进展[J]. 临床和实验医学杂志, 2009, 8(11): 117-118.
[18] 张丽芳. 细菌的耐药性[J]. 河北化工, 2011, 34(8): 40-41; 43.
[19] AUGER S, KRIN E, AYMERICH S, et al. Autoinducer 2 affects biofilm formation by Bacillus cereus[J]. Applied and Environmental Microbiology, 2006, 72: 937-941.
[20] Clinical and Laboratory Standards Institute, NCCLS. Performance standards for antimicrobial susceptibility testing; Fifteenth informational supplement. CLSI/NCCLS document M100-S15[S]. USA: NCCLS, 2005.
[21] 崔晶花, 杨小蓉, 杜小莉, 等. 60株克罗诺杆菌的药敏分析[J]. 疾病监测, 2012, 27(5): 409-411.
[22] DRUDy D, MULLANE N R, QUINN T, et al. Enterobacter sakazakii: an emerging pathogen in powdered infant formula[J]. Clinical Infectious Diseases, 2006, 42(7): 996-1002.
[23] 李秀娟, 李丽婕, 田会方, 等. 食品及环境分离的阪崎肠杆菌药敏分析[J]. 中国卫生检验杂志, 2010(4): 678-680.
[24] LEE y D, PARK J h, ChANG h I. Detection, antibiotic susceptibility and biofilm formation of Cronobacter spp. from various foods in Korea[J]. Food Control, 2012, 24(1/2): 225-230.
Biofilm Detection and Antibiotic Sensitivity Analysis of Cronobacter
ZHANG Yi1, CHEN Yaheng1, ZHOU Guoping1,*, YANG Zushun2
(1. School of Biological and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. Center for Disease Control and Prevention of Yunnan Province, Kunming 650022, China)
Cronobacter isolates including 5 standard strains and 38 isolates from infant foods were studied for biofil-formating capability and antibiotic sensitivity. The fusA sequence analysis was used to identify the species of these isolates. Then the isolates were tested for biofilm-forming capability by crystal violet staining. And 11 antibiotics belonging to 8 categories were selected to test their antibiotic sensitivity. Totally 34 C. sakazakii, seven C. malonaticus and two C. dublinensis strains were identified. All these isolates were able to form biofilm. C. malonaticus showed stronger biofilm-forming capability. The resistance to tetracycline and vancomycin was higher. Totally 14 antibiotic resistance homologies were identified. The resistance to tetracycline correlated with biofilm-forming capability. All the Cronobacter isolates investigated showed biofilm-forming capability and antibiotic resistance to some extent, which pose a challenge the disinfection and sterilization methods used in food industries and clinical therapy.
Cronobacter; identification; biofilm; antibiotic susceptibility
Q939.97
A
1002-6630(2015)21-0129-06
10.7506/spkx1002-6630-201521025
2014-11-30
中国-丹麦政府间科技合作项目([2010]329);湖北省教育厅科学研究计划资助项目(Q20111703);
武汉轻工大学研究生创新基金项目(2013cx020)
张翼(1991—),女,硕士研究生,研究方向为食源性微生物检测与分析。E-mail:757631504@qq.com
*通信作者:周帼萍(1971—),女,副教授,博士,研究方向为微生物发酵与食品安全。E-mail:wjczgp@163.com
