梨叶多酚提取的正交试验优化及其成分测定
2015-12-21郑迎春曹玉芬田路明董星光常耀军
郑迎春,曹玉芬*,李 静,田路明,董星光,张 莹,齐 丹,常耀军
(中国农业科学院果树研究所,农业部果品质量安全风险评估实验室(兴城),辽宁 兴城 125100)
梨叶多酚提取的正交试验优化及其成分测定
郑迎春,曹玉芬*,李 静,田路明,董星光,张 莹,齐 丹,常耀军
(中国农业科学院果树研究所,农业部果品质量安全风险评估实验室(兴城),辽宁 兴城 125100)
以早酥梨成熟叶片为研究对象,考察超声时间、料液比、溶剂种类3 个因素对梨叶多酚提取效果的影响,以优化梨叶片多酚提取工艺,并采用超高效液相色谱-光电二极管阵列技术,测定梨叶片多酚物质组成和含量。结果表明:梨叶片中熊果苷最佳提取条件是:采用70%甲醇溶液提取溶剂、超声(超声功率500 W)辅助提取2 次、每次超声时间30 min、料液比1∶150 (g/mL);梨叶片中咖啡酰奎宁酸类和黄酮醇类的最佳提取条件均是:超声(超声功率500 W)辅助提取2 次、每次超声时间25 min、采用70%甲醇溶液提取溶剂、料液比1∶125 (g/mL)。在优化的提取条件下,梨叶中共检测出10 种多酚物质,其中熊果苷含量最高为7.934~36.854 mg/g,被检测出的多酚物质总含量高达17.852~61.149 mg/g,因此梨叶片可作为开发化妆品、保健品和药品的优质天然材料。
早酥梨叶;超高效液相色谱;多酚;提取;成分
植物多酚物质是植物体内广泛存在的一类重要次生代谢产物。在临床方面应用广泛,主要表现在抗氧化、抗衰老[1]、抗癌、抗肿瘤[2]、抗炎、抗病毒[3]、抗心血管疾病[4]、预防糖尿病[5]、抗抑郁、保护神经[6]、提高免疫力[7]等方面。在生物学功能方面,其可以调节植物生长[8]、提高植物抗逆性[9-10]等。
梨是我国种植面积和产量仅次于苹果和柑橘的第三大水果。李时珍《本草纲目》中记载:“梨品甚多,俱为上品,可治百病。润肺凉心,消痰降火,解疮毒酒毒”。梨果、叶等器官均可入药[11],梨的保健价值与其所含多酚物质密切相关。对梨属植物中多酚物质研究相对较少,一般是对梨果实(尤其是梨皮)测定。果肉主要多酚物质有18 种[12-13];梨皮多酚物质种类和含量相对较丰富,Lin等[14]检测出53 种主要多酚物质(34 种类黄酮和19 种羟甲基肉桂酸);然而对梨叶中多酚物质研究相对甚少,一般针对梨叶中含量较高的熊果苷和绿原酸等几种多酚物质的分析,而且研究对象主要是西洋梨叶片[9-10,15],对东方梨叶片多酚物质提取方法及组成和含量的研究报道更为罕见。早酥梨广泛分布在我国的黑龙江、河北、甘肃、陕西和四川等地,其地域适应性广,因此本实验以早酥梨成熟叶片为原料,通过优化提取条件,采用超高效液相色谱-光电二极管(ultra performance liquid chromatography coupled with photodiode array detector,UPLC-PDA)技术定量和定性分析梨叶片中多酚物质,以期为梨叶片进一步研究提供技术参考,为梨叶片保健功能的开发利用提供依据,为梨属植物抗逆性研究积累数据。
1 材料与方法
1.1 材料与试剂
早酥梨成熟叶片(2013年7月25日采集)、早三花、南果梨、库尔勒香梨和华酥的成熟叶片(2014年9月10日采集)均来自“国家果树种质兴城梨、苹果圃”,经干燥粉粹在-20 ℃冰箱保存备用。
熊果苷、没食子酸、原儿茶酸、新绿原酸、原花青素B1、DL-儿茶素、绿原酸、隐绿原酸、咖啡酸、原花青素B2、丁香酸、表儿茶素、原花青素C1、杨藓素、p-香豆酸、槲皮素-阿拉伯-葡糖苷、反式阿魏酸、芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷、木犀草-7-O-葡糖苷、异绿原酸B、莰菲醇-3-O-芸香糖苷、槲皮素-阿拉伯糖苷、异绿原酸A、水仙苷、异鼠李素-3-O-半乳糖苷、异鼠李素-3-O-葡糖苷、根皮苷、白藜芦醇、肉桂酸、二水槲皮素、根皮素、芹菜素、山奈黄酮醇(纯度均不小于98%) 美国Sigma公司;甲醇、乙醇、乙腈、甲酸等均为色谱纯。
1.2 仪器与设备
Acquity H-class UPLC仪、Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm)、Oasis HBL 6 CC(200 mg)固相萃取小柱 美国Waters公司;0.22 μm滤膜 天津津腾实验设备有限公司;DFT-50手提式中药粉碎机 温岭市林大机械有限公司;CF16RXⅡ立式大容量高速离心机 日本日立公司;R-210旋转蒸发仪 瑞士Buchi公司;Mill-Q Direct8水纯化系统 美国Millipore公司;SK-12TC超声波清洗器 上海科导超声仪器有限公司。
1.3 方法
1.3.1 梨叶片多酚物质提取工艺流程
梨叶片→105 ℃杀青(抽真空)15 min→65 ℃干燥至恒质量→研磨(200目)→称样(重复3 次)→加23 mL溶剂→室温超声(超声功率为500 W[16],下同)提取→离心(10 000 r/min)5 min→取上清液→加23 mL溶剂→室温超声提取→离心(10 000 r/min)5 min→定容至50 mL(称为粗提液)→取5 mL粗提液→35 ℃旋蒸近干→过已用甲醇和水活化好的固相萃取小柱→用5 mL水洗固相萃取小柱2 次(除去叶绿素、糖和强极性化合物[17])→用5 mL甲醇洗固相萃取小柱2次收集溶液→将收集液于35 ℃旋蒸近干→用甲醇定容至5 mL→过0.22 μm滤膜→UPLC测定。
1.3.2 梨叶片多酚含量的测定
采用福林酚(Folin-Ciocalteu)法[18]对粗提液进行测定,以没食子酸为基准物质,计算梨叶多酚含量。回归方程为y=0.012x-0.016 1,R2=0.993 3。
1.3.3 梨叶片多酚提取量的计算
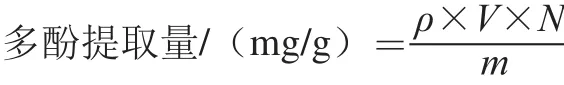
式中:ρ为上样液中多酚质量浓度/(mg/mL);V为粗提液体积/mL;N为稀释倍数;m为梨叶片干质量/g。
1.3.4 梨叶片多酚提取的单因素试验
选取超声时间、料液比和溶剂种类为影响因素,进行单因素试验,均设置3 次重复。
1.3.4.1 超声时间对梨叶片多酚提取量的影响
采用不同的超声时间15、30、60、90 min(第1次超声结束后,离心取上清液,加适量提取剂立即进行第2次超声,此处为每次超声时间),固定料液比1∶150(g/mL)、提取溶剂60%甲醇溶液,研究超声时间对梨叶片多酚提取量的影响。
1.3.4.2 料液比对梨叶片多酚提取量的影响
采用不同的料液比1∶50、1∶100、1∶150、1∶200、1∶250(g/mL),固定超声时间为1.3.4.1节确定的超声时间,提取溶剂为60%甲醇溶液,研究料液比对梨叶片多酚提取量的影响。
1.3.4.3 溶剂种类对梨叶片多酚提取量的影响
采用20%、40%、60%、80%、100%(均为体积分数)乙醇、甲醇溶液为提取剂,固定料液比为1.3.4.2节确定的料液比,超声时间为1.3.4.1节确定的超声时间,研究提取溶剂种类对梨叶片多酚提取量的影响。
1.3.5 梨叶片多酚提取的正交试验
在单因素试验基础上,通过正交试验设计L16(45)利用UPLC技术对梨叶片多酚物质提取条件进一步优化,设置3 个因素超声时间、料液比和溶剂种类(存在两个空白列),每个因素设4 个水平,重复3 次,具体实施方案见表1。

表1 正交试验设计因素及水平Table1 Factors and levels used in orthogonal array design
1.3.6 梨叶片多酚物质的UPLC-PDA检测
利用UPLC-PDA技术,采用Acquity UPLC HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱,以0.5%甲酸溶液和乙腈分别为流动相A和B[16],在200~400 nm波长处进行光谱扫描,获取280、320 nm和360 nm波长处的色谱图,柱温为40 ℃,样品温度为10 ℃,流速为0.4 mL/min,梯度洗脱条件为:0~1 min,0~5% B;1~6 min,5%~15% B;6~16 min,15%~40% B;16~18 min,40%~50% B;18~19 min,50%~100% B;19~20 min,100% B;20~21 min,100%~0 B;21~30 min,0 B。对早酥、早三花、南果梨、库尔勒香梨和华酥梨成熟叶片多酚物质进行检测。
2 结果与分析
2.1 单因素试验结果
2.1.1 超声时间对梨叶片多酚提取量的影响
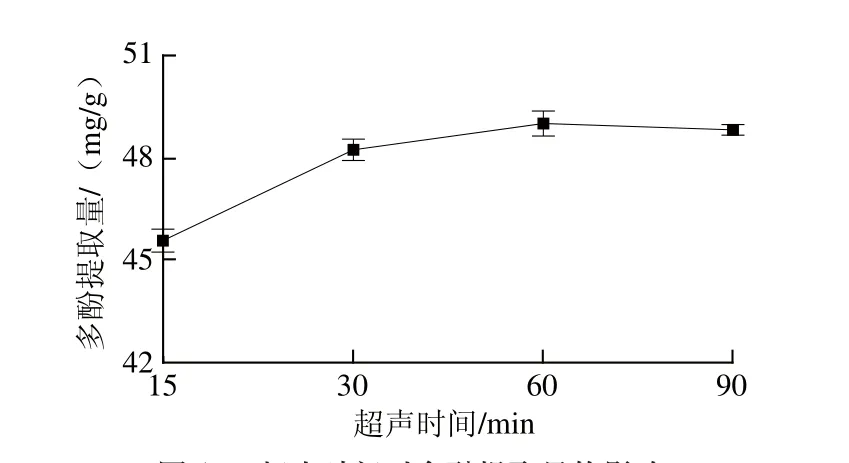
图1 超声时间对多酚提取量的影响Fig.1 Effect of ultrasonication time on the extraction rate of polyphenols
如图1所示,在15~60 min超声时间范围内,多酚提取量随超声时间延长而呈增长趋势,60~90 min超声时间范围内,多酚提取量反而有所下降。是由于开始随着超声时间延长,多酚物质充分溶解,继续延长超声时间,超声清洗器内温度升高使其发生降解、氧化等反应[19]。超声时间在30~60 min范围内时,多酚提取量增长趋于平缓,因此选取最佳超声时间为30 min。
2.1.2 料液比对梨叶片多酚提取量的影响
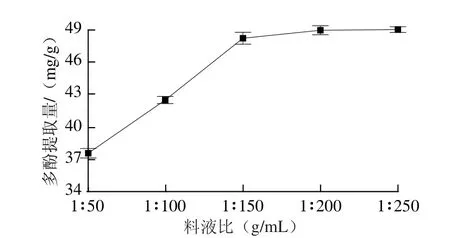
图2 料液比对多酚提取量的影响Fig.2 Effect of leaf to solvent ratio on the extraction rate of polyphenols
如图2所示,随着溶剂用量增大,多酚提取量逐渐增加,当达到1∶150(g/mL)后,多酚提取量增加幅度很小,提取溶剂用量过大,增加提取成本,从提取效果和经济综合考虑,最佳料液比为1∶150 (g/mL)。
2.1.3 溶剂种类对梨叶片多酚提取量的影响
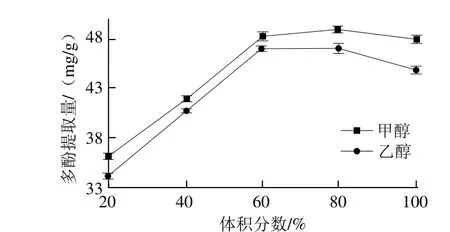
图3 溶剂种类对多酚提取量的影响Fig.3 Effect of solvents on the extraction rate of polyphenols
如图3所示,甲醇、乙醇体积分数小于60%时,多酚提取量均随着溶剂体积分数增大而增加;甲醇在60%~80%范围内时,多酚提取量增长趋于平缓,当甲醇体积分数高于80%时,多酚提取量有所下降,而乙醇体积分数高于60%时,多酚提取量开始下降。可能是由于溶剂体积分数低时,水比例高,水断裂氢键的作用力不足以破坏多酚在植物体内和其他物质形成的氢键或疏水键,使多酚提取量低;当溶剂体积分数过高时,溶出较多醇溶性杂质、色素和亲脂性较强的成分,该物质与多酚物质竞争相同的溶剂分子[20],也会导致多酚提取量降低。从提取效果、旋蒸速率(过固相萃取小柱前需旋蒸,甲醇沸点低,旋蒸速率快)和UPLC分离[17]综合考虑,应选择60%甲醇溶液为提取剂;但从提取效果、溶剂毒性和经济成本综合考虑,应选择60%乙醇溶液为提取剂。为综合考察两种溶剂的提取效果,正交试验设计选取60%、70%的甲醇、乙醇溶液进一步研究。
2.2 梨叶片多酚物质提取条件的正交试验优化
经测定熊果苷、咖啡酰奎宁酸类(新绿原酸、绿原酸、隐绿原酸、异绿原酸A)和黄酮醇类(槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷、芦丁、木犀草-7-O-葡糖苷)是早酥梨叶中含量较多的3 类多酚物质,所以正交试验设计分熊果苷、咖啡酰奎宁酸类和黄酮醇类3 部分来研究梨叶多酚物质的最佳提取条件(表2)。
表2结果表明,梨叶多酚物质种类不同受各提取因素的影响程度有所不同。熊果苷提取量最重要因素是溶剂种类,而其他两部分最重要因素是超声时间,对3 部分影响最小因素均是料液比。甲醇比乙醇对于熊果苷提取效果好,而甲醇对咖啡酰奎宁酸类和黄酮醇类的提取效果没有明显提高,但70%甲醇溶液对3 部分的提取效果均最好。提取熊果苷相比咖啡酰奎宁酸类和黄酮醇类需要超声时间更长,分别是30 min和25 min。
梨叶片中熊果苷最佳提取条件为采用70%甲醇溶液提取溶剂、超声辅助提取2次、每次超声30 min、料液比1∶150 (g/mL),利用该条件提取梨叶熊果苷含量为39.031 mg/g;咖啡酰奎宁酸类和黄酮醇类最佳提取条件均为:超声辅助提取2次、每次超声25 min、采用70%甲醇溶液提取溶剂、料液比1∶125(g/mL),利用该条件提取梨叶咖啡酰奎宁酸类和黄酮醇类含量分别为19.651 mg/g和3.740 mg/g。
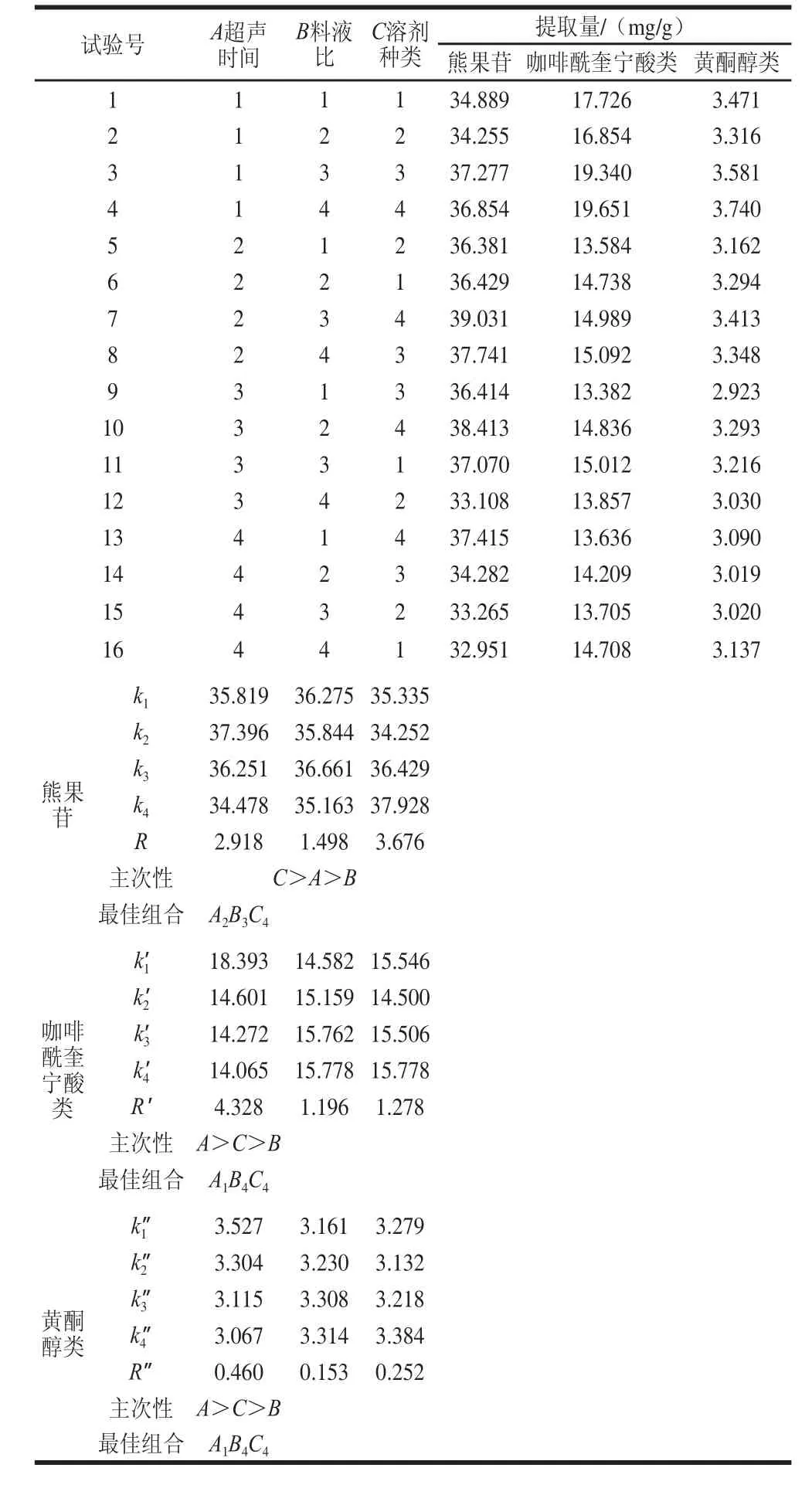
表2 正交试验设计L16(45)提取优化结果Table2 Orthogonal array design L16(45) with experimental results
2.3 梨叶片多酚物质的UPLC-PDA检测结果
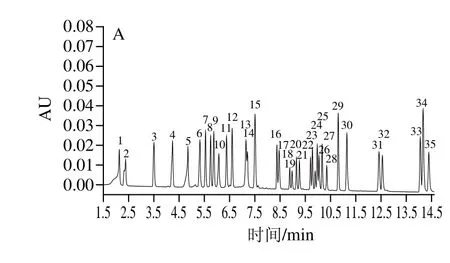
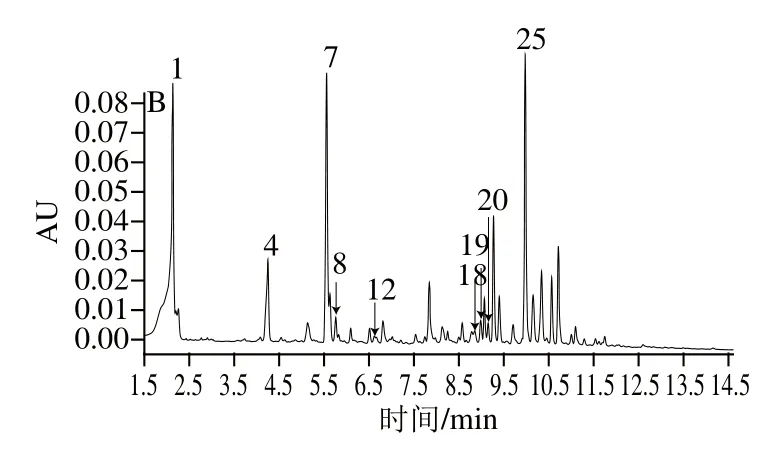
图4 在280 nm波长处的多酚物质色谱图Fig.4 Chromatograms of pear leaf polyphenols at 280 nm
采用与咖啡酰奎宁酸类和黄酮醇类相一致的提取条件(因咖啡酰奎宁酸类和黄酮醇类包含8种多酚物质),按1.3.1节处理5 种梨叶样品并进行UPLC检测。利用UPLC技术将35 种多酚标准物质进行分离(图4A),梨叶中检测出10 种多酚物质(图4B):熊果苷、新绿原酸、绿原酸、隐绿原酸、表儿茶素、芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷、木犀草-7-O-葡糖苷、异绿原酸A,其干质量含量见表3。梨叶片中被检测出的多酚物质总含量为17.852~61.149 mg/g,其中熊果苷含量最多,为7.934~36.854 mg/g。
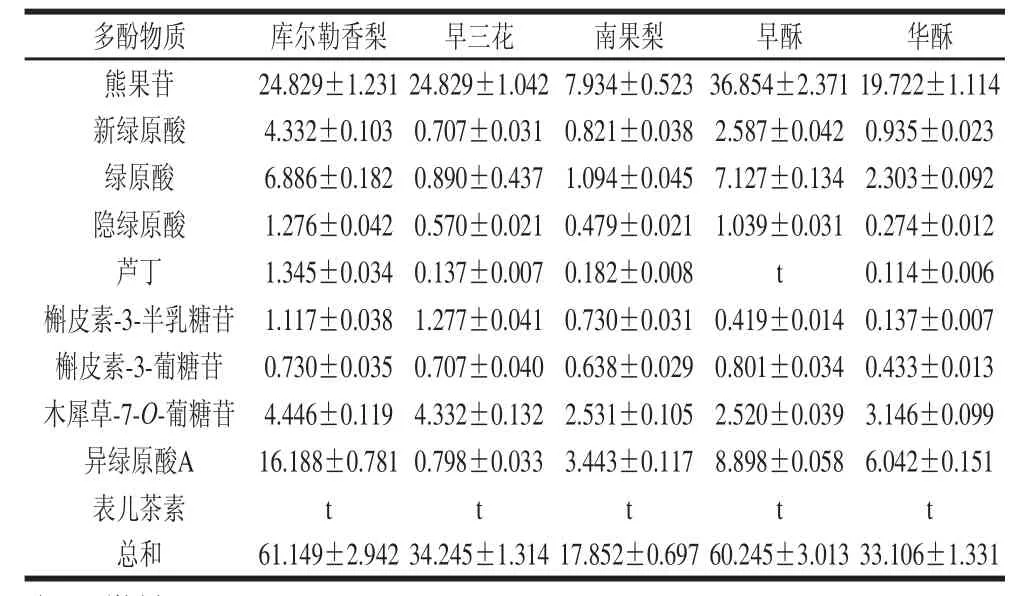
表3 梨叶片多酚物质组成与含量Table3 Contents of polyphenols present in pear leavesmg/g
3 结 论
通过对早酥梨叶不同种类的多酚物质(熊果苷、咖啡酰奎宁酸类和黄酮醇类)的提取方法优化,结果表明,影响熊果苷提取效果的关键因素为溶剂种类,而影响咖啡酰奎宁酸类和黄酮醇类提取效果的关键因素为超声时间,表明多酚物质种类不同受提取因素的影响程度不同,因此应根据研究的梨叶多酚物质的种类,选择合适的提取条件:梨叶熊果苷最佳提取条件为采用70%甲醇溶液提取溶剂、超声辅助提取2次、每次超声30 min、料液比1∶150(g/mL);梨叶咖啡酰奎宁酸类和黄酮醇类最佳提取条件均为超声辅助提取2次、每次超声25 min、采用70%甲醇溶液提取溶剂、料液比1∶125(g/mL)。提取条件的优化为梨叶的进一步研究提供了技术参考。利用UPLC检测出梨叶片中10 种多酚物质,其中熊果苷含量最高。熊果苷具有美白、祛斑、护法、利尿、抗感染的功效[21-23],因此梨叶片可作为开发化妆品、保健品和药品的优质天然材料。
[1] 谢棒祥, 张敏红. 生物类黄酮的生理功能及其应用研究进展[J]. 动物营养学报, 2003, 15(2): 11-15.
[2] CASSIDY C E, SETZER W N. Cancer-relevant biochemical targets of cytotoxic Lonchocarpus fl avonoids: a molecular docking analysis[J]. Journal of Molecular Modeling, 2010, 16(2): 311-315.
[3] 刘金霞, 邓淑华, 杨贺松. 黄芩茎叶总黄酮的抗炎作用机制的研究[J].中国药理学通报, 2002, 18(6): 713-714.
[4] CASSIDY A, RIMM E B, O’REILLY E J, et al. Dietary fl avonoids and risk of stroke in women[J]. Stroke, 2012, 43(4): 946-951.
[5] COSKUN O, KANTER M, KORKMAZ A. Quercetin, a flavonoid an-tioxidant, prevents and protects strepto-zotocin-induced oxidative stress and beta-cell damage in rat pancreas[J]. Pharmaceutical Research, 2004, 51(2): 117-123.
[6] PAULKE A, NÖLDNER M, SCHUBERT Z M. John’s wort flavonoids and their metabolites show anti-depressant activity and accumulate in brain after multiple oral doses[J]. Die Pharmazie, 2008, 63(4): 296-302.
[7] CORVAZIER E, MACLOUF J. Interference of some fl avonoids and non-steroidal anti-inflammatory drugs with oxidative metabolism of arachidonic acid by human platelets and neutrophils[J]. Biochimica et Biophysica Acta, 1985, 835(2): 315-321.
[8] JAEOBS M, RUBERY P H. Naturally occurring auxin transport regulators[J]. Science, 1988, 241: 346-349.
[9] CARLO A, GUGLIELMO C, DIETER T. Composition of phenolic compounds in pear leaves as affected by genetics, ontogenesis and the environment[J]. Scientia Horticulturae, 2006, 109(2): 130-137.
[10] YASEMIN G, ADALET M, RUHINAZ G. Leaf phenolic content of pear cultivars resistant or susceptible to fire blight[J]. Scientia Horticulturae, 2005, 105(2): 213-221.
[11] 董忠义, 晓彤. 梨的药用功效[J]. 绿化与生活, 1994, 4(2): 15-16.
[12] SCHIEBER A, KELLER P, CARLE R. Determination of phenolic acids and flavonoids of apple and pear by high-performance liquid chromatography[J]. Journal of Chromatography A, 2001, 910(2): 265-273.
[13] SALTA J, MARTINS A, SANTOS R G, et al. Phenolic composition and antioxidant activity of Rocha pear and other pear cultivars: a comparative study[J]. Journal of Functional Foods, 2010, 2(2): 153-157.
[14] LIN L Z, HARNLY J M. Phenolic compounds and chromatographic profilesof pear skins (Pyrus spp.)[J]. Journal of Agricultural and Food Chemistry, 2008, 56(19): 9094-9101.
[15] MATEJA C, FRANCI S, METKA H. Bending affects phenolic content of William pear leaves[J]. Acta Agriculturae Scandinavica, Section B-Plant Soil Science, 2007, 57(2): 187-192.
[16] 王临宾. 超声波辅助提取苹果叶多酚及其体外抗氧化性研究[D]. 杨凌: 西北农林科技大学, 2010.
[17] SHA Chen, WU Benhong, FANG Jinbao, et al. Analysis of fl avonoids from lotus (Nelumbo nucifera) leaves using high performance liquid chromatography/photodiode array detector tandem electrospray ionization mass spectrometry and an extraction method optimized by orthogonal design[J]. Journal of Chromatography A, 2012, 12(27): 145-153.
[18] 李静, 聂继云, 李海飞, 等. Folin-酚法测定水果及其制品中总多酚含量的条件[J]. 果树学报, 2008, 25(1): 126-131.
[19] JORGE L, GARDEN T, DERMIS W. Effect of chemical modifi cation of algae carboxyl groups on metal ion binding[J]. Environment Science and Technology, 1990, 24(9): 1372-1378.
[20] MOON J, CHOI I. Development of natural meat-like fl avor based on Maillard reaction products[J]. Korean Journal for Food Science of Animal Resources, 2011, 31(1): 129-138.
[21] 高瑞英, 傅中, 慕丹, 等. 超声乳化法构建化妆品用熊果苷/透明质酸-己二酸二酰肼交联载药微球[J]. 时珍国医国药, 2010, 21(8): 1962-1965.
[22] 房军, 杜顺晶, 金银龙. 熊果苷在化妆品中应用的研究进展[J]. 卫生研究, 2009, 38(1): 111-113.
[23] 王慧琛, 王丽琴. 熊果苷的应用及检测研究进展[J]. 天津药学, 2012, 24(4): 71-74.
Optimization of Extraction of Pear Leaf Polyphenols by Orthogonal Array Design and Polyphenol Composition Analysis
ZHENG Yingchun, CAO Yufen*, LI Jing, TIAN Luming, DONG Xingguang, ZHANG Ying, QI Dan, CHANG Yaojun
(Research Institute of Pomology, Chinese Academy of Agricultural Sciences, Laboratory of Quality and Safety Risk Assessment for Fruit (Xingcheng), Ministry of Agriculture, Xingcheng 125100, China)
The ultrasonic-assisted extraction of polyphenols from mature leaves of Zaosu pear was optimized by investigating the effects of ultrasonic time, solid-to-solvent ratio and solvent type on extraction effi ciency. The components and contents of pear leaf polyphenols were determined by ultra performance liquid chromatography (UPLC) coupled with photodiode array detector (PDA). The results showed that the optimal conditions for arbutin extraction from pear leaves were found to be 30 min extraction carried out twice using 70% aqueous ethanol as the extraction solvent with a solid-to-solvent ratio of 1:150 (g/mL) at an ultrasonic power of 500 W, while the optimal conditions for the extraction of both caffeoylquinic acid and fl avonols were identical to those for arbutin except for an extraction time of 25 min and a solid-to-solvent ratio of 1:125 (g/mL). Ten polyphenols were detected in pear leaves under the optimized conditions with total contents ranging from 17.852 to 61.149 mg/g, and the contents of arbutin were 7.934-36.854 mg/g. Therefore, pear leaves can be used as an excellent natural material for developing cosmetics, health products and medicines.
Zaosu pear leaf; ultra performance liquid chromatography (UPLC); polyphenols; extraction; components
S661.2
A
1002-6630(2015)20-0032-05
10.7506/spkx1002-6630-201520006
2015-02-13
国家现代农业(梨)产业技术体系建设专项(CARS-29-01)
郑迎春(1986—),女,硕士,研究方向为果 树种质资源。E-mail:zhengyingchunaiyy@163.com
*通信作者:曹玉芬(1965—),女,研究员,博士,研究方向为果树种质资源。E-mail:yfcaas@263.net
