野生仙人掌多糖提取工艺优化及抗氧化活性研究
2015-12-20李莉梅何春梅周鲜娇曾富华
李 恒,李莉梅,何春梅,朱 苗,周鲜娇,曾富华,*
(1.岭南师范学院生命科学与技术学院,广东湛江524048;2.广东高校边缘热带特色植物工程技术开发中心,广东湛江524048)
野生仙人掌多糖提取工艺优化及抗氧化活性研究
李恒1,李莉梅2,何春梅1,朱苗1,周鲜娇1,曾富华1,*
(1.岭南师范学院生命科学与技术学院,广东湛江524048;2.广东高校边缘热带特色植物工程技术开发中心,广东湛江524048)
优化热水浸提法提取野生仙人掌多糖(Opuntia dillenii Haw.polysaccharides,ODPs)的工艺。在单因素实验的基础上,利用Box-Behnken实验和响应面分析法,研究提取温度、提取时间以及液料比对ODPs提取结果的影响;通过回归分析模拟得到二次多项式回归方程的预测模型;最后测定不同提取温度下ODPs蛋白质含量及DPPH自由基清除率。结果显示,最佳提取工艺为提取温度93℃,液料比62∶1,提取时间3.5h,由模型预测得率达到25.14%,验证实验结果为25.05%,与预测值较接近,表明模型具有较好预测性。提取温度、液料比、提取时间对野生仙人掌多糖得率的影响具有统计学意义(p<0.001)。提取温度为95℃时,多糖含量、DPPH自由基清除率都最高,但多糖中蛋白质含量也最高。说明响应面优化得到的提取工艺有利于提高ODPs得率,95℃的提取温度有利于增加多糖的抗氧化活性。
野生仙人掌,多糖,提取,响应面,抗氧化
野生仙人掌是仙人掌科、仙人掌属的一种植物,主要分布在热带亚热带地区,在我国南方的分布也很广。它与墨西哥仙人掌一样,具有较高的营养价值[1-2],并且具有降胆固醇、降血糖、调节免疫功能等作用[3-7]。但是,目前它的利用率却远比墨西哥仙人掌低,资源浪费严重。从野生仙人掌中分离所得的野生仙人掌多糖(Opuntia dillenii Haw.polysaccharides,ODPs)是仙人掌重要有效成分之一,本研究小组前期的研究及国外的研究已发现ODPs具有降血糖[8]、降血脂[9-11]、抗癌、调节免疫[12]、抗氧化[13]、促伤口愈合及护肝等药理作用[14-16]。因此,本研究从资源开发以及节约能源的角度出发,进一步优化ODPs的提取条件,旨在提高得率的同时降低能源的消耗。
响应面优化法是一种实验条件寻优的方法,近年来广泛用于各种活性物质提取条件的优化[17-18],是降低开发成本、优化加工条件、提高产品产量的一种有效方法。相对于正交实验,它可以连续的对实验的各个水平进行分析,而正交实验只能对孤立的实验点进行分析。因此,本文采用Box-Behnken实验设计和响应面分析法优化ODPs的提取条件,并初步探索提取温度对ODPs清除DPPH自由基活性的影响,以获得抗氧化活性及得率均较高的工艺条件,促进野生仙人掌的利用。
1 材料与方法
1.1材料与仪器
新鲜野生仙人掌采自湛江东海岛附近,经本院陈燕副教授鉴定为Opuntia dillenii Haw.;考马斯亮蓝G250、阿拉伯糖FLUKA BioChemika公司;苯酚、浓硫酸、氯仿、正丁醇国产分析纯。
CR22E高速冷冻离心机日本日立公司;FreeZone 4.5L冻干机美国Labconco公司;TU-1800S型紫外可见分光光度计北京普析通用仪器有限责任公司;LABOROTA 4003-control型旋转蒸发仪德国Heidolph公司。
1.2实验方法
1.2.1野生仙人掌多糖(ODPs)水提工艺新鲜仙人掌除刺,洗净,切碎至黄豆颗粒大小,用80%食用酒精浸泡至绿色明显褪去,残渣烘干,粉碎过60目筛得仙人掌干粉。准确称取仙人掌干粉,热水浸提,8000r/min离心15min,合并上清液,减压浓缩至原体积1/4。用95%乙醇醇沉,8000r/m离心20min,得白色沉淀冻干即得ODPs。
1.2.2标准曲线的制作多糖含量以总糖计,按文献[19]用苯酚-硫酸法测定,以葡萄糖质量浓度(X)为横坐标、吸光度(A)为纵坐标,得标准曲线回归方程为A=0.02X-0.007(R2=0.9999)。
蛋白质含量按参考文献[20]测定。以蛋白质质量浓度(X)为横坐标、吸光度(A)为纵坐标,得标准曲线回归方程为A=0.008x+0.0123(R2=0.9991)
1.2.3指标的计算
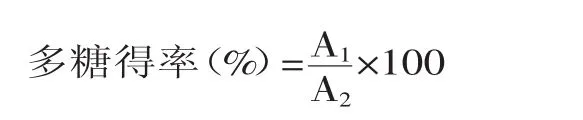
式中:A1为热水浸提所得ODPs的质量(g);A2为仙人掌干粉的质量(g)。

式中:Y为通过标准曲线计算所得的葡萄糖质量浓度(mg/mL);V为样品溶液总体积(mL);B为样品总质量(g);D为样品稀释倍数。

式中:E为通过标准曲线计算所得的蛋白质质量浓度(mg/mL);V为样品溶液总体积(mL);M为样品总质量(g);R为样品稀释倍数。
1.3单因素实验
设定提取温度95℃、液料比为60∶1(水与仙人掌干粉质量比),提取时间为3h,固定其中两个条件,分别考察温度(60、70、80、90、95、100℃)、液料比(40∶1、50∶1、60∶1、70∶1、80∶1)、提取时间(1.5、2.0、2.5、3.0、3.5、4.0h)对ODPs含量的影响。
1.4响应面法优化提取工艺
根据单因素实验的结果以及Box-Behnken中心组合实验设计原理,进行提取温度、液料比、提取时间三因素三水平的响应面分析,以ODPs得率为响应面值,采用Design Expert软件进行多元回归拟合,实验因素水平编码设计见表1。

表1 Box-Behnken设计因素与水平表Table.1 Factors and levels for Box-Behnken experimental design
1.5提取温度对ODPs清除DPPH自由基活性的影响
设定液料比为60∶1,提取时间为3h,考察温度(60、70、80、90、95、100℃)对ODPs蛋白质含量以及DPPH清除率的影响。

图1 提取温度对ODPs含量的影响Fig.1 Effect of temperature on the polysaccharides content of crude extracts
2 结果与分析
2.1单因素实验结果
2.1.1提取温度对ODPs含量的影响如图1所示,当提取温度升高时,多糖含量呈现上升趋势。尤其是60~70℃和90~95℃,上升的幅度较大。而水平70~90℃,上升幅度较平缓,结果差异不大。当温度上升至100℃时,多糖含量反而下降。所以,选择80、90、100℃三个水平进行响应面分析。一般认为,温度上升更有利于植物细胞的破碎,多糖溶出量增加。但是,实验过程中发现,温度达到100℃时,提取液变得非常粘稠,表明多糖的组成发生了变化。可能过高的温度容易导致多糖糖苷键断裂而变性失活。
2.1.2液料比对ODPs含量的影响如图2所示,液料比为60∶1时,多糖含量最高。在液料比达到60∶1之前,随着提取溶剂用量的增加,多糖含量增加。但是,当溶剂的量超过物料的60倍时,所得多糖的含量反而下降。提示60倍的溶剂已经可以将ODPs充分溶解,再增加溶剂用量对多糖含量影响不大。因此,选择液料比为50∶1、60∶1、70∶1三个水平进行响应面分析。

图2 液料比对ODPs含量的影响Fig.2 Effect of liquid-to-material ratio on the polysaccharides content of crude extracts
2.1.3时间对ODPs含量的影响延长浸提时间有利于多糖的充分溶出。如图3所示,随着提取时间的延长,所得多糖含量上升。而且,在1.5~2.0h和3.0~4.0h时,所得多糖含量上升幅度较大;而在2.0~3.0h范围,则没有明显的上升。从节约成本的角度考虑,选择2.0、3.0、4.0h三水平进行响应面分析。

图3 提取时间对ODPs含量的影响Fig.3 Effect of extraction time on the polysaccharides content of crude extracts
2.2响应面结果方差分析
通过Design-Expert v.8.0.6软件计算获得提取温度(A)、提取时间(B)和液料比(C)三种因素与多糖得率的二次多项回归方程,如下所示,
ODPs得率=23.98+2.57A+2.73B+2.33C+0.81AB-0.56AC-2.45BC-4.64A2-3.02B2-3.45C2

表2 响应面实验设计及结果Table.2 Box-Behnken experimental design matrix with experimental and predicted values on the yield of ODPs

表3 回归方程系数显著性检验Table.3 Regression coefficients and their statistical significance
通过该方程可以计算实验的预测值。可以用决定系数R2来评价回归方程的优劣,R值越接近于1,说明则实验值与预测值的相关性越好[21],本研究结果中相关系数模型的决定系数R2为0.9827,表明仙人掌多糖得率的实验值与预测值之间具有很好的一致性,模型预测性越好。调整后相关系数(Adj R2)为0.9704,则说明该模型能解释97.04%响应值的变化,有约总变异的2.96%不能由此回归模型来解释。模型的信噪比(Adeq precision)达到22.777(>4),说明方程的拟合度很高,即该模型可用于预测。如方差分析结果所示,模型具有显著的统计学意义(p<0.0001),而且,失拟项在α=0.05水平上不显著(p>0.05),表明该方程对实验拟合情况好,实验误差小。CV值较低(6.21%),表明实验精确度较高,重复性好。

表4 二次模型的方差分析统计Table.4 Analysis of variance for the fitted quadratic regression model
表3显示,一次项提取温度(A)、提取时间(B)和液料比(C),交互项提取时间与液料比(BC),三种因素的二次项(A2、B2、C2)对ODPs得率都具有显著的影响。比较各组F值,各因素对ODPs得率影响的大小顺序依次为:液料比>提取温度>提取时间。

图4 各两因素交互作用对多糖得率影响的响应面图Fig.4 Response surface pilots showing the interaction effect of the optimization parameters on the yield of ODPs
2.3响应面图分析
将模型中的某一因素固定在零水平作响应面图可获得另外两个因素的交互作用图。图形的响应曲面及其等高线图的形状可以反映交互效应的强弱(如图4所示)。响应面图的抛物面开口向下,且具有极大值点,说明所选因素水平里包括了最优组合[22]。等高线为椭圆形表示两因素交互作用显著,而圆形则说明交互作用不显著。如图4(c)所示,料液比与提取时间直接的交互作用对ODPs的影响显著,此外,两者的曲面图较陡峭,说明随着料液比与提取时间的增加,ODPs的得率增加,但到了极值之后,两因素的增加反而会使得率下降。响应面图分析结果与单因素分析,以及模型方差分析结果具有一致性。
软件分析所得最佳提取条件为,提取温度93.04℃、提取时间3.43h、液料比61.6∶1(mL/g),在此条件下,ODPs的理论得率可达到25.14%。考虑实际的操作性,就将提取工艺修正为:提取温度93℃、提取时间3.5h、水料比62∶1mL/g。
2.4验证实验
为了检验模型的准确性,在修正的优化条件(提取温度93℃、提取时间3.5h、水料比62∶1mL/g)下进行了3次提取实验,所得ODPs分别为25.09%、25.01%、25.04%,平均值为25.05%,与模型预测值25.14%较接近,表明该模型能较好的预测实际的提取情况。

图5 提取温度对ODPs清除DPPH自由基活性的影响Fig.5 Effect of temperature on the scavenging of ODPs for DPPH·
2.5提取温度对ODPs清除DPPH自由基活性及蛋白质含量的影响
有研究[23]显示,高温提取的香菇多糖,虽然在提取前3h,DPPH·清除率下降,但之后抗氧化活性增强,而且超过新鲜香菇的清除能力,分析原因可能为加热过程中生成了具有抗氧化活性的美拉德反应产物。孙世利[24]的研究则显示,60~70℃提取的茶多糖抗氧化性最强。这些研究提示温度可能会改变多糖的抗氧化活性。于是本文研究了不同提取温度下ODPs的DPPH·抗氧化活性。结果如图5所示,随着多糖浓度的增加,ODPs对DPPH·的清除能力增加,ODPs具有一定的抗氧化性。对比从60~100℃之间的几个温度水平,高温的两个水平(95、100℃)所得ODPs的DPPH·清除能力较高,而温度较低的几个水平(60、70、80、90℃)所得的ODPs的DPPH·清除率相对较低。而且,随着多糖浓度的增加,抗氧化性的差别越明显。当ODPs浓度为6.4mg/mL时,对不同温度提取的ODPs对DPPH·的清除率作单因素方差分析,结果显示,它们对DPPH·的清除率具有显著性差异(p<0.05)。结合图1、图5及图6可以发现,在所设置的温度范围内,95℃条件下的ODPs的DPPH·清除率最高、ODPs含量最高,蛋白质含量也最高,且与较低的提取温度(60、70、80、90℃)相比,均具有统计学意义(p<0.05)。提示本实验优化条件所得的ODPs不仅可以提高得率及纯度,还增加了其抗氧化能力。

图6 提取温度对ODPs蛋白质含量的影响Fig.6 Effect of temperature on the protein content of crude extracts
3 结论
通过响应面实验设计使ODPs得率增加,验证实验结果达到25.04%,与预测值较接近,说明模型优化成功。修正后最佳提取条件为温度93℃,液料比62∶1(mL/g),时间3.5h。响应面结果分析提示提取时间对多糖得率影响最大,其次是提取温度和液料比。提取温度不仅显著影响ODPs得率,还影响其抗氧化活性,95℃下提取所得的ODPs含量、DPPH·清除能力都最强,但多糖中蛋白质含量也最高。说明通过提取工艺的优化,尤其是提取温度的控制,可以获得较高的多糖得率及较强的活性。
[1]Hichem A,Najla H,Zouhour B,et al.Protective effect of Opuntia ficus indica f.inermis prickly pear juice upon ethanolinduced damages in rat erythrocytes[J].Alcohol,2012,46(3):235-243.
[2]Jae H K,Hyun J L,Hyun S L,et al.Physical and sensory characteristics of fibre-enriched sponge cakes made with Opuntia humifusa[J].LWT-Food Sci Technol,2012,47(2):478-484.
[3]Matsuhiro B,Lillo L E,Sáenz C,et al.Chemical characterization of the mucilage from fruits of Opuntia ficus indica[J].Carbohyd Polym,2006,63:263-267.
[4]Sohail E,Khaleeq A,Robina T,et al.A novel link between angiogenesis and natural products:Anti-angiogenic effects of Opuntia dillenii[J].Cent Eur J Biol,2014,9(3):298-308.
[5]Madjdoub H,Roudesli S,Picton,L,et al.Prickly pear nopals pectin from Opuntia ficus-indica physico-chemical study in dilute and semi-dilute solutions in dilute and semidilute solutions [J].Carbohyd Polym,2001,46:69-79.
[6]Betty M,Luis E L,Carmen S,et al.Chemical characterization of the mucilage from fruits of Opuntia ficus indica[J].Carbohyd Polym,2006,63:263-267.
[7]Cai W R,Gu X H,Tang J.Extraction,purification,and characterization of the polysaccharides from Opuntia milpa alta [J].Carbohyd Polym,2008,71:403-410.
[8]Zhao L Y,Lan Q J,Huang Z C,et al.Antidiabetic effect of a newly identified component of Opuntia dillenii polysaccharides [J].Phytomedicine,2011,18:661-668.
[9]Zhao L Y,Lan Q J,Huang Z C,et al.Hypolipidemic effects and mechanisms of the main component of Opuntia dillenii Haw. polysaccharides in high-fat emulsion-induced hyperlipidemic rats[J].Food Chem,2012,134(2):964-971.
[10]黄卫,曾富华,杨小舟.仙人掌多糖对高脂血症大鼠血脂的影响[J].中医研究,2008,21(6):13-16.
[11]杨小舟,黄卫,曾富华,等.仙人掌多糖对高脂血症大鼠体内抗氧化作用的研究[J].时珍国医国药,2009,20(10):2440-2442.
[12]Schepetkin I A,Xie G,Kirpotina L N,et al.Macrophage immunomodulatory activity of polysaccharidesisolatedfrom Opuntia polyacantha[J].Int Immunopharmacology,2008,8(10):1455-1466.
[13]Huang X,Li Q,Li HG.Neuroprotective and antioxidative effect of cactus polysaccharides in vivo and in vitro[J].Cell Mol Neurobiol,2009,29(8):1211-1221
[14]Zhao M M,Yang N,Yang B,et al.Structural characterization of water-soluble polysaccharides from Opuntia monacantha cladodes in relation to their anti-glycated activities[J].Food Chem,2007,105:1480-1486.
[15]Zhao LY,Huang W,Yuan QX,et al.Hypolipidaemic effects and mechanisms of the main component of Opuntia dillenii Haw. polysaccharides in high-fat emulsion-induced hyperlipidaemic rats[J].Food Chem,2012,134(2),964-971.
[16]Yang Q,Chen H,Zhou X,et al.Optimum extraction of polysaccharides from Opuntia dillenii and evaluation of its antioxidant activities[J].Carbohydr Polym,2013,97(2):736-742.
[17]张剑光,徐彦,刘圆,等.响应面设计法优化川贝母茎和叶中总生物碱的提取工艺[J].食品科学,2013,34(10):11-15.
[18]Nedim T,Esra Y.Ultrasound-assisted extraction of d-pinitol from carob pods using response surface methodology[J].Ultrason Sonochem,2014,21(2):860-865.
[19]王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4):276-279.
[20]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1-2):248-254.
[21]周芳,赵鑫,宫婕,等.响应面法优化超声辅助提取红皮云杉多酚工艺[J].食品工业科技,2014,35(1):210-213.
[22]吴萍萍,赖曼萍,尹艳艳,等.响应面法优化山稔叶总黄酮提取工艺的研究[J].食品工业科技,2014,35(4):223-228.
[23]郝瑞芳,刘翼翔,方茹,等.温度对香菇糖和蛋白质提取、含量及抗氧化性的影响[J].食品工业科技,2009,30(6):125-129.
[24]孙世利,赖兆祥,庞式,等.提取温度对金萱绿茶多糖体外抗氧化活性的影响[J].广东农业科学,2011(1):123-125.
Optimization of extraction conditions of Opuntia dillenii Haw. polysaccharides by response surface analysis and their antioxidant activity study
LI Heng1,LI Li-mei2,HE Chun-mei1,ZHU Miao1,ZHOU Xian-jiao1,ZENG Fu-hua1,*
(1.College of Life Science and Technology,Lingnan Normal University,Zhanjiang 524048,China;2.University Engineering&Technology Development Center of Fringe Tropical Characteristic Plant in Guangdong,Zhanjiang 524048,China)
This study examined the extraction conditions of Opuntia dillenii Haw.Polysaccharides(ODPs)with a series of methods.Firstly,based on the single-factor tests,response surface methodology was used to investigate the effect of three parameters(liquid-materal ratio,extraction time,exraction temperature)on the ODPs yields. Secondly,a second-order polynomial regression model was established using a Box-Behnken experimental design.Finally,the DPPH·scavenging and protein content of ODPs was measured.Consequently,the exraction temperature,liquid-material ratio,extraction time were the major factor affecting the exraction rate of ODPs with a very low p-values(p<0.001).The polysaccharides and protein content of ODPs and the DPPH·scavenging of ODPs were the highest under the 95℃ extraction temperature.The optimal conditions exhibited a liquidmateral ratio 62∶1,extraction time 3.5h and exraction temperature 93℃.Under these conditions,the actual extraction rate of ODPs was 25.05%,while the predicted value was 25.14%.In conclusion,the conditions optimization by the response surface method were better for enhanced the extraction rate,and the exraction temperature of 95℃was better for the antioxidant activity of ODPs.
Opuntia dillenii Haw.;polysaccharides;extraction;response surface methodology;antioxidant activity
TS255.1
B
1002-0306(2015)04-0210-05
10.13386/j.issn1002-0306.2015.04.037
2014-06-18
李恒(1980-),女,硕士,讲师,研究方向:天然产物研究与开发。
曾富华(1952-),男,博士,教授,研究方向:天然产物研究与开发。
国家星火计划(2013GA780085,2013GA780082,2012GA780016);广东省科技计划项目(2013B010404047);湛江市科技攻关计划项目(2014A01012,2014A02012,2012C030304)。
