凝集生长毛乳头细胞膜联蛋白A2的表达特性研究
2015-11-07夏汝山孙慧陶诗沁曹蕾杨莉佳
夏汝山 孙慧 陶诗沁 曹蕾 杨莉佳
凝集生长毛乳头细胞膜联蛋白A2的表达特性研究
夏汝山 孙慧 陶诗沁 曹蕾 杨莉佳
目的 探讨膜联蛋白A2在毛乳头细胞(DPC)凝集生长中的表达特点。方法 反转录PCR和Western印迹方法分别在基因和蛋白水平研究膜联蛋白A2在DPC凝集和非凝集生长状态下的表达特点。结果 在DPC凝集性生长状态下,膜联蛋白A2 mRNA表达水平显著高于非凝集生长状态,差异有统计学意义(0.50±0.15比0.35±0.19,t=8.26,P<0.05)。在蛋白质水平,膜联蛋白A2表现为相对分子质量为40 000的膜联蛋白A2异构体和分子质量为36 000的膜联蛋白A2两种形式,前者在凝集与非凝集生长的DPC均高表达,后者在凝集生长的DPC表达,在非凝集生长的DPC则不表达。结论 膜联蛋白A2可能与DPC的凝集生长密切相关。
毛囊;膜联蛋白A2;细胞生长过程;逆转录聚合酶链反应;印迹法,蛋白质;毛乳头细胞
毛囊发育和周期循环主要依赖毛囊上皮与毛乳头的相互作用[1],毛乳头发挥重要作用。凝集生长的毛乳头细胞(dermal papilla cells,DPC)分泌大量蛋白样因子,共同调节其他毛乳头细胞、外根鞘细胞、内皮细胞和角质形成细胞的增殖[2]。为了探索调控DPC生长的分子机制,我们运用蛋白质组学技术分析凝集与非凝集生长的DPC的蛋白表达差异,并初步确定膜联蛋白(annexin)A2在凝集生长的DPC中特异性高表达[3]。膜联蛋白属于保守的钙离子调节磷脂结合蛋白家族,广泛参与细胞一系列生物学进程,但膜联蛋白A2在毛囊周期和DPC生长中的作用尚未见报道。为了分析质谱鉴定结果,我们研究膜联蛋白A2在基因和蛋白水平的表达,探索其在DPC凝集生长中的表达特点。
材料与方法
一、材料
1.主要试剂及仪器:DMEM培养基为美国Hyclone公司产品;胰蛋白酶为美国Sigma公司产品。兔抗人膜联蛋白A2多克隆抗体为美国Genex Bioscience公司产品;辣根过氧化物酶(HRP)标记山羊抗兔IgG(H+L)和3,3-二氨基联苯胺(DAB)为北京中山生物技术有限公司产品。
2.标本:所需毛乳头来自门诊头皮活检术后残留的含毛发皮损。本研究经无锡市第二人民医院伦理委员会批准,患者均签署知情同意书。
二、方法
1.双向电泳及图像分析:毛乳头的分离和培养均参照本课题组成熟的技术方法[4]。150 μg总蛋白与重水化液{8 mol/L尿素,2%3-[(3-胆酰胺基丙基)二甲基铵基]-1-丙磺酸盐(CHAPS),60 mmol/L二硫苏糖醇(DTT)和0.5%固相pH梯度(IPG)缓冲液,pH 3~10}混合,总体积250 μl,吸入IPG胶槽,置于IPGphor等电聚焦仪电极板上,重水化和等电聚焦在20℃自动进行,总电压时间积40 000 V·h。等电聚焦后于平衡液中平衡2次。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)在SE600电泳仪中进行。电泳结束后,用质谱兼容的银染法染色,超纯水脱色至背景清楚;用Gel Doc 2000成像系统对凝胶进行扫描,图像经PDQuest分析软件进行处理并比较差异蛋白质点。
2.肽质量指纹谱(PMF)鉴定目的蛋白:选取目的蛋白点,从凝胶上准确切割后用水清洗,用含50%乙腈和25 mmol/L NH4HCO3溶液浸泡至蓝色褪尽;真空离心干燥至完全脱水,加入0.01 g/L胰酶溶液,待酶液完全吸收后补充25 mmol/L NH4HCO3,37℃保温15 h;加5%三氟乙酸于40℃保温1 h,吸出上清;加入2.5%三氟乙酸,50%乙腈于30℃保温1 h,吸出上清;上清液冷冻干燥。制备好的样品置于质谱仪上进行分析,获得的肽质量指纹图谱(PMF)直接经Mascot软件和NCBInr数据库检索。
3.反转录(RT)-PCR检测膜联蛋白A2在基因水平的表达:按Trizol试剂说明书,提取DPC总RNA。取2 μg总RNA,按SuperscriptⅡ反转录试剂盒说明书反转录为cDNA,反应条件为:65℃变性5 min,50℃反转录50 min。PCR扩增膜联蛋白A2基因,上游引物:5′-TGAAGTCAGCCTTATCTGGC-3′,下游引物:5′-ATTGACCAAGATGCTCGG-3′,扩增片段长度为329 bp;β肌动蛋白为内参照,上游引物:5′-CGGG ACCTGACTGACTACCTC-3′,下游引物:5′-CAAGAAAGGGTGTA ACGCAAC-3′,扩增片段长度为618 bp。PCR反应条件为:95℃预变性3 min,95℃变性30 s,56℃退火30 s,72℃延伸45 s,35个循环,PCR产物经15 g/L琼脂糖凝胶电泳。实验重复3次,结果经凝胶成像系统结合MultiGauge V3.1进行光密度分析,根据灰度值分析mRNA表达差异。
4.Western印迹检测膜联蛋白A2在蛋白水平的表达:①蛋白质样品制备:毛乳头细胞团内加入20 mmol/L Tris缓冲液,涡旋器上振荡约10 min后,冰浴超声裂解至混悬液清亮透明,12 000×g离心40 min,留取上清,Bradford法测定蛋白质浓度;②常规蛋白电泳:按每孔上样量50 μg进行SDS-PAGE电泳,稳压冰浴电转至硝酸纤维素膜上,5%脱脂牛奶封闭2 h,兔抗人膜联蛋白A2多克隆抗体(1∶500)孵育4℃过夜,加入HRP标记的山羊抗兔IgG(1∶5 000)室温孵育1 h,DAB显色;③双向电泳:将150 μg总蛋白与重水化液混合,总体积250 μl吸入IPG胶槽,置于IPGphor等电聚焦仪电极板上,重水化和等电聚焦在20℃自动进行,总电压时间积40 000 V·h。等电聚焦后于平衡液中平衡2次;SDS-PAGE在SE600电泳仪中进行。Western印迹过程同②,不同之处在于显色采用化学发光法。实验重复3次。
5.统计学分析:应用SPSS 13.0统计软件进行统计学处理,所有数据均采用±s表示,两样本均数比较采用t检验,P<0.05认为差异有统计学意义。
结果
一、双向电泳和质谱鉴定结果
本研究建立了重复性较好、分辨率较高的双向凝胶电泳考马斯亮蓝染色图谱(图1)。在凝集生长和非凝集生长的DPC胞质总蛋白中分别检测到(608±39)个和(595±31)个蛋白点,各点清晰独立。我们选择凝集生长DPC特异表达的20个蛋白点进行鉴定;通过基质辅助激光解吸/电离飞行时间(MALDI-TOF)质谱仪,15个蛋白点获得较好的PMF图谱,经Mascot软件和NCBInr数据库检索,与15种蛋白质相匹配,相对分子质量36 631,序列覆盖51%。

图1 毛乳头细胞(DPC)的双向电泳模式 1A:凝集生长毛乳头细胞;1B:非凝集生长毛乳头细胞。二者大多匹配,差异点主要集中在相对低分子质量蛋白质,在此区域凝集生长毛乳头细胞的蛋白点数高于非凝集生长毛乳头细胞
二、RT-PCR结果
为了验证双向电泳的研究结果,本研究通过RT-PCR技术在mRNA水平验证膜联蛋白A2的表达特点。凝集生长和非凝集生长DPC总RNA反转录为cDNA,以β肌动蛋白作为内参照,分别扩增凝集生长和非凝集生长条件下DPC中膜联蛋白A2的表达特点,电泳结果经Quatity one软件分析,可见膜联蛋白A2在DPC凝集和非凝集状态下的PCR产物差异有统计学意义(图2,0.50±0.15比0.35±0.19,t=8.26,P<0.05)。
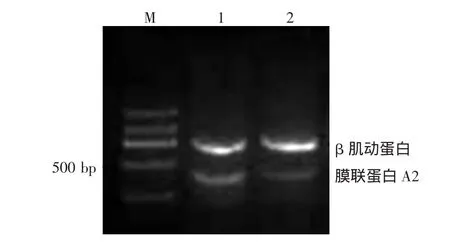
图2 凝集和非凝集生长毛乳头细胞(DPC)中膜联蛋白A2的反转录PCR结果 M:标准参照物;1:凝集生长DPC;2:非凝集生长DPC
三、Western印迹结果
1.常规SDS-PAGE电泳:见图3。凝集生长的DPC总蛋白常规SDS-PAGE后有2条反应条带(条带1和2),而非凝集生长的DPC则仅有1条反应条带(条带1)。条带1对应相对分子质量约40 000,而条带2对应相对分子质量约36 000。

图3 毛乳头细胞(DPC)常规电泳的Western印迹结果 M:标准参照物;1:凝集生长DPC;2:非凝集生长DPC
2.双向电泳:为排除假阳性结果,将毛乳头细胞总蛋白进行双向电泳分离并进行免疫印迹检测,结果(图4)发现凝集生长的DPC出现2个蛋白点(蛋白点1和2),而非凝集生长的DPC则出现1个蛋白点(蛋白点1),蛋白点1是二者共有蛋白点,与常规电泳结果一致。

图4 毛乳头细胞(DPC)双向电泳的Western印迹结果 4A:凝集生长DPC(蛋白点A和B);4B:非凝集生长DPC(蛋白点A)
讨论
膜联蛋白属于保守的钙离子调节磷脂结合蛋白家族,annexin蛋白有2个主要的结构域,即核心结构域和相互作用结构域。人类表达12种annexin,其中膜联蛋白A2是研究最广泛的,尤其是在哺乳动物生物学和人类疾病方面[5]。相对分子质量为36 000的膜联蛋白A2蛋白可产生于内皮细胞、单核细胞、巨噬细胞、树突细胞、上皮细胞和肿瘤细胞等。人类膜联蛋白A2是ANXA2基因产物,该基因位于15号染色体(15q21)。
膜联蛋白A2是一种多功能蛋白质,参与一系列生物学进程,在细胞外分泌、细胞内吞、离子通道导电和链接细胞骨架到细胞膜中发挥重要作用[6]。目前的研究主要涉及膜联蛋白A2与肿瘤的相关性,大量证据显示,膜联蛋白A2蛋白在人类很多肿瘤都有高表达,如肺癌[7]。Meta分析显示,膜联蛋白A2的过表达可能与恶性肿瘤患者较差的预后有关[8],可能是膜联蛋白A2在细胞核聚集破坏了着丝点功能,从而导致染色体不稳定,而染色体不稳定与肿瘤发生有关[9]。但膜联蛋白A2在DPC和毛囊周期调控中的作用尚未见报道,该蛋白在DPC凝集生长中发挥何种作用值得探讨。
为了追踪膜联蛋白A2在相关领域的研究进展,我们以DPC为特化的成纤维细胞为切入点进行检索,研究发现膜联蛋白A2基因在瘢痕疙瘩成纤维细胞高表达[10]。也有结果相反的报道,Kim等[11]发现膜联蛋白A2在瘢痕疙瘩组织中表达下调,提示膜联蛋白A2可能通过抑制瘢痕疙瘩成纤维细胞的增殖而参与瘢痕形成。在本研究中,我们发现膜联蛋白A2存在分子质量不同的2种异构体,膜联蛋白A2异构体(相对分子质量40 000)在凝集与非凝集生长的DPC均高表达,而经典的膜联蛋白A2蛋白(相对分子质量36 000)在凝集生长的DPC表达,在非凝集生长的DPC则不表达,表明膜联蛋白A2可能在DPC的凝集生长中发挥重要作用,但其作用机制尚不明确。
[1]Woo WM,Atwood SX,Zhen HH,et al.Rapid genetic analysis of epithelial-mesenchymal signaling during hair regeneration[J/OL].J Vis Exp,2013,28(72):e4344[2014-10-28].http://www.jove.com/ pdf/4344/jove-protocol-4344-rapid-genetic-analysis-epithelialmesenchymal-signaling-during-hair.
[2]McElwee K,Hoffmann R.Growth factors in early hair follicle morphogenesis[J].Eur J Dermatol,2000,10(5):341-350.
[3]Rushan X,Fei H,Zhirong M,et al.Identification of proteins involved in aggregation ofhuman dermalpapillacellsby proteomics[J].J Dermatol Sci,2007,48(3):189-197.
[4]夏汝山,顾静,陶诗沁,等.凝集生长毛乳头细胞分泌性蛋白组的初步分析[J].中华皮肤科杂志,2014,47(10):699-702.
[5]Hedhli N,Falcone DJ,Huang B,et al.The annexin A2/S100A10 system in health and disease:emerging paradigms[J/OL].J Biomed Biotechnol,2012,2012:406273[2014-060-30].http://www.ncbi. nlm.nih.gov/pmc/articles/PMC3496855/
[6]Bharadwaj A,Bydoun M,Holloway R,et al.Annexin A2 heterotetramer:structure and function[J].Int J Mol Sci,2013,14(3): 6259-6305.
[7]Yang J,Yang F,Nie J,et al.Evaluation of Annexin A2 as a novel diagnostic serum biomarker for lung cancer[J].Cancer Biomark, 2015,15(2):211-217.
[8]Liu X,Ma D,Jing X,et al.Overexpression of ANXA2 predicts adverse outcomes of patients with malignant tumors:a systematic review and meta-analysis[J].Med Oncol,2015,32(1):392.
[9]Kazami T,Nie H,Satoh M,et al.Nuclear accumulation of annexin A2 contributes to chromosomal instability by coilin-mediated centromere damage[J/OL].Oncogene,2014.doi:10.1038/onc. 2014.345[2014-11-26].http://www.researchgate.net/publication/ 267453466_Nuclear_accumulation_of_annexin_A2_is_involved_ in_chromosomal_instability_by_coilinmediated_centromere_damage.
[10]Satish L,Lyons-Weiler J,Hebda PA,et al.Gene expression patterns in isolated keloid fibroblasts[J].Wound Repair Regen, 2006,14(4):463-470.
[11]Kim SH,Jung SH,Chung H,et al.Annexin A2 participates in human skin keloid formation by inhibiting fibroblast proliferation[J].Arch Dermatol Res,2014,306(4):347-357.
Expression characteristics of annexin A2 in dermal papilla cells with aggregative behavior
Xia Rushan,Sun Hui, Tao Shiqin,Cao Lei,Yang Lijia.Department of Dermatology,Wuxi No.2 People′s Hospital,Wuxi 214002,Jiangsu,China Corresponding author:Yang Lijia,Email:yanglijia726@163.com
ObjectiveTo analyze the expression characteristics of annexin A2 in dermal papilla cells(DPCs)with aggregative behavior.MethodsReverse transcriptase-polymerase chain reaction(RT-PCR)and Western blot were performed to measure themRNA andprotein expressions of annexin A2 respectively in DPCs with or without aggregative behavior.ResultsThe mRNA expression level of annexin A2 was significantly higher in DPCs with aggregative behavior than in those without aggregative behavior(0.50±0.15 vs.0.35±0.19,t=8.26,P<0.05).Western blot showed that annexin A2 had two isoforms,including one isoform with a relative molecular mass of 40 000 and the other one with a relative molecular mass of 36 000.The annexin A2 isoform with a relative molecular mass of 40 000 was highly expressed in both DPCs with aggregative behavior and those without aggregative behavior,while the other isoform was only expressed in DPCs with aggregative behavior.ConclusionAnnexin A2 may be closely related to the aggregative growth of DPCs.
Hair follicle;Annexin A2;Cell growth processes;Reverse transcriptase polymerase chain reaction; Blotting,Western;Dermal papilla cells
10.3760/cma.j.issn.0412-4030.2015.10.013
南京医科大学重点项目(NJMU233);无锡市卫生局面上项目(ML201202)
214002江苏,无锡市第二人民医院皮肤科
杨莉佳,Email:yanglijia726@163.com
2014-12-31)
(本文编辑:尚淑贤)
