纳米金光热作用对ICR小鼠皮肤光老化保护作用的初步研究
2015-11-07刘亚乐葛芹李张军耿松梅肖生祥姚翠萍张镇西曾维惠
刘亚乐 葛芹 李张军 耿松梅 肖生祥 姚翠萍 张镇西 曾维惠
纳米金光热作用对ICR小鼠皮肤光老化保护作用的初步研究
刘亚乐 葛芹 李张军 耿松梅 肖生祥 姚翠萍 张镇西 曾维惠
目的 探讨纳米金光热作用对雌性ICR小鼠皮肤光老化的保护作用及其可能机制。方法 32只健康雌性ICR小鼠随机分成正常组、模型组、红光组、纳米金组,每组8只。正常组小鼠不予任何干预,另3组每次照射前背部脱毛,面积约16 cm2。每次照射紫外线前,模型组暂不予以特殊处理。红光组小鼠给予红光照射,纳米金组小鼠先涂抹纳米金球溶液,用黑色塑料薄膜封包30 min后再照射红光。经上述处理后,将模型组、红光组、纳米金组小鼠分笼放入灯箱中进行紫外线照射。实验结束后,肉眼及皮肤镜观察皮肤外观变化;取小鼠背部皮肤,组织切片HE染色和Masson染色观察皮肤组织结构和胶原纤维的改变。ImageJ图像分析软件计算胶原纤维面积。DCFH-DA探针检测皮肤细胞内活性氧簇(ROS)含量。ELISA检测皮肤组织中基质金属蛋白酶13(MMP-13)的含量。采用单因素方差分析进行组间差异分析,并用LSD-t检验进行两两多重比较。用简单线性回归分析ROS变化与MMP-13表达量之间的相关性。结果 与正常组比较,紫外线照射后,模型组小鼠皮肤出现皮屑、褐黄、粗糙肥厚、深皱纹、缺乏弹性等光老化特征;皮肤镜下小鼠皮肤粗糙,毛细血管断裂出血,结痂,褐色斑点。组织切片显示,模型组小鼠表皮厚度[(81.32±7.09)μm]和真皮厚度[(352.75±40.08)μm]均较正常组[表皮(38.42±13.64)μm,真皮(188.50±27.83)μm]明显增加(P<0.05),胶原纤维面积减少(分别为31.94%± 8.56%和48.63%±11.32%,P<0.05),异常弹性物质增多;模型组ROS含量(5 124 152.80±754 119.22)DCF荧光强度/mg蛋白和MMP-13表达(3 895.42±136.06)g/L均较正常组(分别为3 502 085.29±135 089.06)DCF荧光强度/mg蛋白和(2 414.73±105.96)g/L明显增高(P<0.05)。与模型组比较,纳米金组皮肤外观及组织学特点均明显改善,小鼠皮肤厚度明显变薄,表皮(48.70±13.35)μm,真皮(253.74±36.28)μm(P<0.05),且其表皮厚度恢复正常(P>0.05),胶原纤维面积(41.54%±12.10%)增加(P<0.05);纳米金组ROS含量(3 516 963.35± 67 436.36)DCF荧光强度/mg蛋白和MMP-13表达(2 558.25±102.72)g/L均较模型组明显降低(P<0.05),且恢复至正常水平。用简单线性回归分析显示,ROS的产生量与MMP-13的表达量呈正相关(r=0.864,P= 0.018)。结论 纳米金的光热作用对小鼠光老化有一定的保护作用,其机制可能与其减少ICR小鼠皮肤组织中ROS产生,从而减少下游MMP-13表达有关。
皮肤衰老;紫外线;活性氧;基质金属蛋白酶13;动物实验;金属纳米粒子;纳米金
皮肤光老化是皮肤长期、反复暴露于紫外线所产生的皮肤早老征象。纳米金是非常好的光热转换颗粒,不同粒径、不同形态的纳米金能高效地吸收可见光或近红外光,并迅速转换为热能[1],适用于医学靶向清除人体病变组织。同时纳米金还具有表面吸附特性,能稳定又迅速地吸附生物大分子,且不改变其性状[2],非常适用于医学探针进行细胞表面和细胞内生物大分子的定位。目前,纳米金的光热作用广泛应用于癌症治疗[3-4],但在光老化的预防方面尚未见报道。由于纳米金球的尺寸小、易合成[1],我们就纳米金球的光热作用在光老化的保护方面进行实验研究,并初步探讨其可能的机制。
材料与方法
一、试剂和仪器
雌性封闭群ICR小鼠,6~8周龄,体质量18~22 g,由西安交通大学医学部实验动物中心提供,实验动物合格证号0014410,饲养于清洁级动物饲养室内,温度(25±10)℃,普通饲料和水喂养。40 W紫外线灯管,包括中波紫外线(UVB)管4支、长波紫外线(UVA)管2支(北京誉朗诺科技有限公司),UVA和UVB辐射计(上海希格玛高技术有限公司),Carnation-88C一体式高能窄谱光子治疗仪(红光模式,中心波长630 nm,深圳普门科技有限公司),VICTO X5多功能酶标仪(美国PerkinElmer公司);氯金酸(AuCl3·HCl·4H2O)(上海精细化工研究所),支链聚乙烯亚胺(BPEI)(德国Sigma-Aldrich公司),活性氧簇(ROS)试剂盒(南京建成生物工程研究所),RIPA裂解液(西安赫特生物科技有限公司),BCA试剂盒(西安晶彩生物科技有限公司),小鼠基质金属蛋白酶13(matrix metalloproteinase 13,MMP-13)ELISA试剂盒(武汉伊莱瑞特生物科技有限公司)。
二、方法
1.阳离子纳米金球的合成:由于皮肤在生理条件下带负电[5],18 nm纳米金具有无毒、不易转位的特性[6],故制备18 nm粒径的阳离子纳米金球,采用BPEI还原法[7]制备。取3 ml 1%(m/v)的HAuCl4与2.5 g BPEI氯金酸,用超纯水定容至50 ml,待溶液混匀后,转移至烧杯中,调节恒温磁力搅拌加热器至80℃,将烧杯至于恒温磁力搅拌加热器上搅拌溶解,可观察到颜色由淡黄色-无色-淡红色-深红色,颜色不再变化时,停止搅拌;将烧瓶中的溶液转移至棕色容量瓶中定容至50 ml;用超速离心机100 000×g离心20 min,离心2次,弃上清液,加超纯水10 ml,用超纯水10倍稀释,4℃冷藏备用。透射电镜(TEM,H-7650透射式电子显微镜)观察制备纳米金颗粒的形态,紫外分光光度计测量纳米金的吸收峰。
2.动物分组及处理:实验开始前,小鼠适应性喂养1周。32只雌性ICR小鼠随机分成正常组、模型组、红光组、纳米金组,每组8只。正常组小鼠不予任何干预,另3组每次照光前用电推剪给小鼠背部脱毛,脱毛面积约16 cm2。每次照射紫外线前,模型组暂不予以特殊处理。红光组小鼠给予红光照射(0.8 W/cm2,30 min,该参数为预实验所定),纳米金组小鼠先涂抹纳米金球溶液,用黑色塑料薄膜封包30 min后再照射红光(0.8 W/cm2,30 min)。经上述处理后,将模型组、红光组、纳米金组小鼠分笼放入灯箱中进行紫外线照射。
3.紫外线照射:40 W紫外灯管(UVB 4支、UVA 2支)并列装于木箱制成灯箱[8],小鼠背部距灯源30 cm。用UVA和UVB辐射计测得的吸光度分别为1 mW/cm2和0.15 mW/cm2,测量小鼠背部皮肤最小红斑量(minimal erythema dose,MED)。每次照射前灯管预热15 min,每周一、三、五照射,第1周照射量为1 MED,以后每周增加1 MED至第4周,然后维持4 MED直至实验结束,共照射14周[9]。
4.取材:最后一次照射结束24 h后,用5%硫化钠溶液给小鼠背部脱毛。脱毛24 h后腹腔注射水合氯醛(250 mg/kg)麻醉,拍照,德国DELTA20皮肤镜(×10)观察,继而处死。立即取下背部脱毛处全层皮肤。一部分放入4%甲醛溶液中固定过夜,制作病理组织切片,HE染色并用显微镜测量真、表皮厚度,Masson染色(用胺本蓝,而不是亮绿)观察胶原变化和ImageJ图像分析软件计算胶原纤维面积。胶原纤维面积=测量区真皮胶原染色面积/测量区真皮面积(真表皮连接至皮下脂肪层上缘)×100%[10]。一部分皮肤去除皮下脂肪,在冰冻的生理氯化钠溶液中漂洗,冷冻于-80℃备用。
5.皮肤组织匀浆的制备及ROS测定:采用DCFH-DA探针测量皮肤ROS含量。将皮肤用滤纸拭干,称重放入小烧杯中,加入100 mmol/L冷磷酸盐缓冲液(磷酸盐缓冲液的总量是皮肤组织块重量的20倍),尽快剪碎后移入玻璃匀浆器制成匀浆,1 000×g离心10 min后取上清液,依据试剂说明书测定ROS的产生量。采用VICTO X5多功能酶标仪检测荧光强度,酶标仪激发波长为485 nm,发射波长为525 nm。结果表示为荧光强度/mg蛋白。
6.组织蛋白提取及MMP-13检测:将组织用干净的剪刀尽量剪碎,置于陶瓷研钵中,加适量液氮研碎组织后再加入组织蛋白裂解液(150~200 μl/ 20 mg),反复碾压尽量碾碎组织(整个过程在冰上进行),裂解1~2 min后移至1.5 ml离心管中,4℃离心机中12 400×g离心5 min;离心完成后取上清分装于0.5 ml离心管中,-80℃保存。BCA定量试剂盒检测蛋白含量后ELISA检测组织中MMP-13含量。
7.统计学处理:所有数据均用SPSS18.0统计分析软件处理,数据用±s表示,各组间的差异用单因素方差分析进行检验,并用LSD-t检验作两两多重比较,P<0.05为差异有统计学意义。用简单线性回归分析ROS变化与MMP-13表达量之间的相关性。
结果
一、纳米金的形态及特征
TEM下观察所制备的阳离子纳米金颗粒粒径大小均匀,直径约18 nm。紫外可见光吸光度的结果显示,其吸收峰出现在约530 nm处[11]。见图1,2。

图1 BPEI还原法制备的纳米金透射电镜图(×20万,标尺:20 μm)和紫外-可见光吸光谱图(右) 透射电镜图可见纳米金球颗粒粒径大小接近均匀,颗粒不团聚,直径18 nm
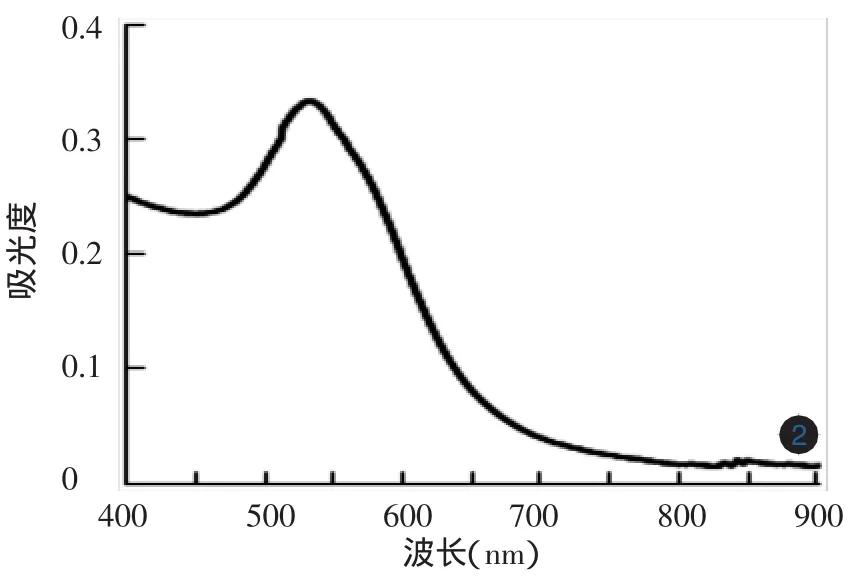
图2 BPEI还原法制备的纳米金紫外-可见光吸光谱 纳米金球吸收峰值在530 nm处
二、临床和皮肤镜观察
肉眼观察,正常组小鼠皮肤光滑,颜色红润,有弹性;模型组小鼠皮肤出现皮屑、褐黄、粗糙肥厚、深皱纹、缺乏弹性等光老化特征;红光组小鼠皮肤中度粗糙,尾侧皮肤有鳞屑,中度皮革样外观;纳米金组小鼠皮肤外观,除隐约可见的褐色斑外,大体接近正常组。皮肤镜下:正常组小鼠皮肤颜色红润,血管清晰可见,而模型组小鼠皮肤粗糙,毛细血管断裂出血、结痂,褐色斑点;红光组小鼠皮肤改变以散在鳞屑、轻度褐色斑及毛细血管扩张为主;纳米金组小鼠皮肤可见散在、不规则褐色斑片,皮肤纹理稍清晰,明显较模型组及红光组的老化现象轻。见图3。
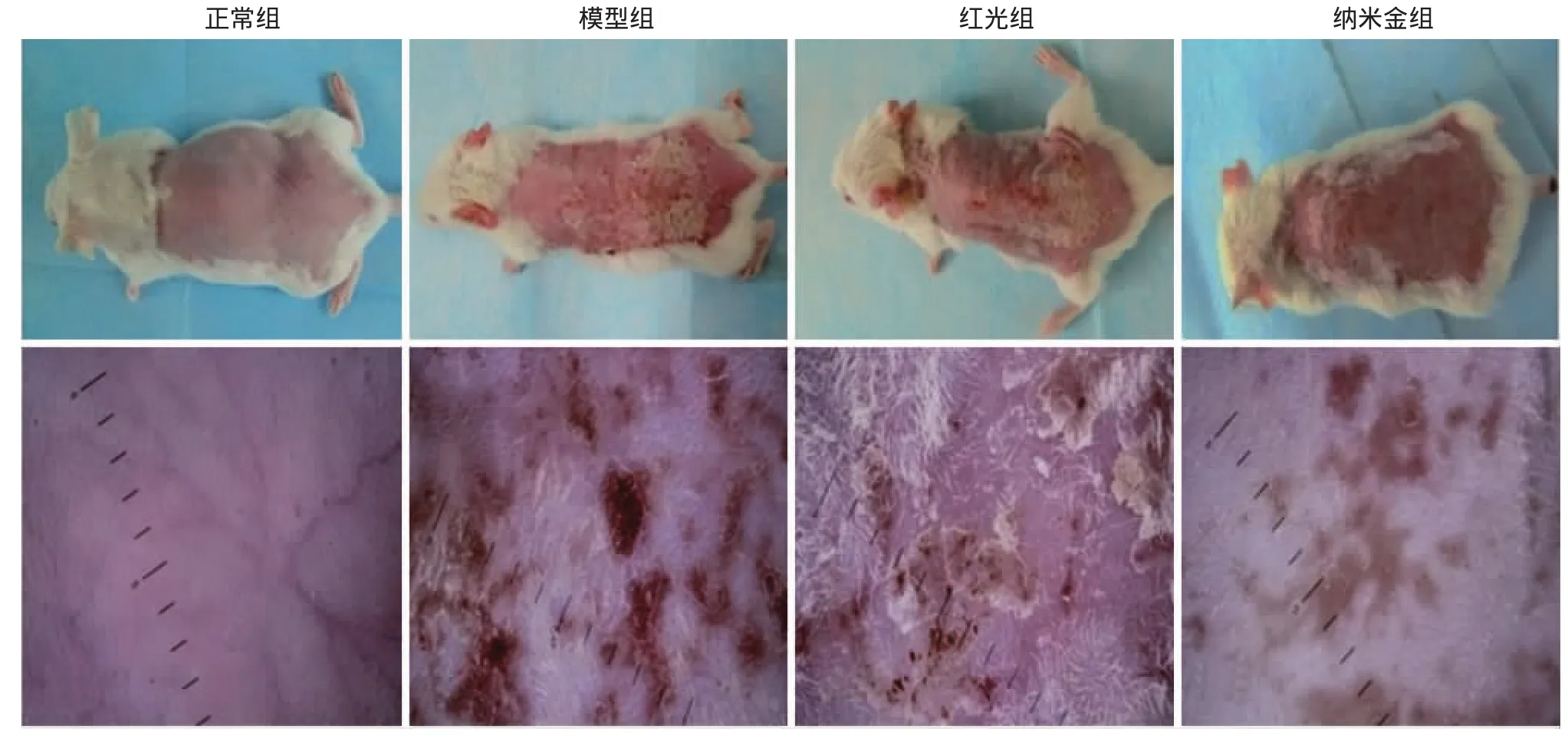
图3 4组不同处理小鼠背部皮肤的临床和皮肤镜观察结果 肉眼观察:正常组小鼠皮肤光滑,颜色红润,有弹性;模型组小鼠皮肤粗糙、大面积鳞屑、结痂,皮革样外观;红光组小鼠中等程度粗糙,尾侧皮肤有鳞屑,中等程度皮革样外观;纳米金组小鼠皮肤可见散在褐色斑点,皮肤颜色和质地接近正常。皮肤镜下观察(×10):正常组小鼠皮肤光滑,颜色红润,血管支清晰;模型对照组小鼠皮肤大量褐色斑片、结痂,血管支难以辨认;红光组小鼠皮肤鳞屑、散在褐色斑点及出血点;纳米金组小鼠皮肤以褐色斑片为主,无明显鳞屑、出血和结痂
三、组织切片HE染色及胶原纤维Masson染色
HE染色显微镜观察可见,正常组表皮连续,结构完整,皮肤较薄,层次分明,Masson染色真皮层可见规律分布的胶原纤维束,长轴与皮面平行;模型组表皮增厚,角化过度伴角化不全,表皮及真皮层明显增厚,胶原纤维减少、断裂、卷曲,排列紊乱,分布不均。纳米金组皮肤基本接近正常,而红光组组织学改变介于两者之间。见图4。

图4 4组不同处理小鼠背部皮肤组织HE染色(×40)和胶原纤维Masson染色(×100)结果 HE染色,正常组小鼠皮肤组织结构清晰、层次分明,真表皮较薄;模型组小鼠表皮角化过度,真表皮厚度明显增加;红光组小鼠皮肤较薄,真表皮连接处变平;纳米金组小鼠皮肤轻度角化,真表皮厚度较薄。Masson染色,正常组胶原丰富,排列整齐,无增粗或断裂;模型组小鼠胶原明显减少,排列紊乱;红光组小鼠胶原稍增多,但仍较粗、断裂、卷曲;纳米金组小鼠皮肤胶原纤维增加,排列渐趋规整
表1 4组小鼠表皮和真皮的厚度及真皮胶原纤维面积/真皮面积百分比的变化(±s)

表1 4组小鼠表皮和真皮的厚度及真皮胶原纤维面积/真皮面积百分比的变化(±s)
注:a:与模型组比较,P<0.05;b:与正常组比较,P<0.05
组别 只数 表皮厚度(μm) 真皮厚度(μm) 真皮胶原纤维面积(%)正常组 8 38.42±13.64a 188.50±27.83a 48.63±11.32a模型组 8 81.32±7.09b 352.75±40.08b 31.94±8.56b红光组 8 53.47±8.37ab 304.87±47.55ab 38.89±6.81b纳米金组 8 48.70±13.35a 253.74±36.28ab 41.54±12.10a F值 22.207 26.629 3.380 P值 <0.001 <0.001 0.035
ImageJ图像分析软件分析皮肤结构显示(表1),与正常组相比,模型组真表皮厚度均明显增加(P<0.05),真皮胶原纤维面积减少(P<0.05);纳米金组较模型组真表皮厚度均明显降低(P<0.05),且其表皮厚度恢复正常(P>0.05),纳米金组真皮胶原纤维面积较模型组增加(P<0.05)。红光组的真表皮厚度均高于正常组,又低于模型组(P<0.05),其真皮胶原纤维面积低于正常组(P<0.05),但与模型组没有差异(P>0.05)。
四、ROS含量测定
正常组、模型组、红光组、纳米金组皮肤组织中ROS含量分别为(3 502 085.29±135 089.06)、(5124152.80±754119.22)、(4078230.66±157934.42)和(3 516 963.36±67 436.36)DCF荧光强度/mg蛋白,经单因素方差分析,4组间ROS表达量差异有统计学意义(F=19.511,P<0.001)。与正常组相比,模型组ROS含量明显增多(P<0.05);与模型组相比,纳米金组含量降低(P<0.05),且恢复至正常水平;而红光组ROS含量介于正常组与模型组之间(P<0.05)。
五、ELISA检测皮肤组织中MMP-13含量
正常组、模型组、红光组、纳米金组皮肤组织中MMP-13含量分别为(2 414.73±105.96)、(3 895.42± 136.06)、(2 925.17±71.27)和(2 558.25±102.72)g/L,经单因素方差分析,4组间MMP-13表达量差异有统计学意义(F=37.337,P=0.000)。与正常组比较,模型组皮肤组织中MMP-13含量明显增多(P<0.05);与模型组相比,纳米金组含量降低(P<0.05),且恢复至正常水平;而红光组MMP-13水平介于正常组与模型组之间(P<0.05)。
六、ROS的产生量与MMP-13表达水平之间的关系
用简单线性回归分析ROS与MMP-13表达之间的关系,结果表明,两者之间呈正相关(r=0.864,P=0.018)。
讨论
纳米金的光热特性基于其表面等离子体共振,当纳米金颗粒受到一定强度的光照时,可强烈地吸收光,并将光能转化为热能,传递给周围环境,产生局部光热作用,造成局部细胞温度升高,实现对细胞的杀伤。同时纳米金还具有良好的热传导性和光热效应。已有研究证实,纳米金对细胞有热杀伤作用[3-4]。我们利用纳米金光热作用干预小鼠皮肤后再进行紫外线照射,发现在皮肤镜下,小鼠皮肤色素斑、毛细血管扩张及皮革样外观明显改善。组织切片上真、表皮厚度未见明显增加,胶原纤维面积及分布接近正常组,显示皮肤未出现明显光老化表现。
本研究提示,小鼠皮肤在经过纳米金的光热作用后,一定程度上可预防皮肤出现严重的光老化。为初步探讨其可能机制,我们检测了与光老化密切相关的ROS和MMP的变化。由于小鼠和人MMP表达的差异性,人类皮肤光老化胶原的降解以MMP-1为主,小鼠以MMP-13为主[12],因此,本课题选择检测MMP-13在小鼠皮肤组织中的变化。我们的结果显示,相比正常组,模型对照组小鼠皮肤中ROS、MMP-13表达均明显升高(P<0.05),而真皮中胶原纤维面积减少(P<0.05);纳米金光热作用干预后皮肤中ROS、MMP-13表达明显降低(P<0.05),而真皮中胶原纤维面积明显增加(P<0.05)。而红光组改变介于两者之间,提示红光在光老化预防方面亦有一定作用。
我们的研究初步提示,纳米金光热作用预防光老化的机制是减少光老化过程中发挥主要作用的ROS的产生,避免ROS作用于其下游分子,如MMP-13等,达到预防光老化的作用。我们将纳米金的光热作用用于光老化保护方面的研究,为光老化的预防提供了新方法。
[1]Kennedy LC,Bickford LR,Lewinski NA,et al.A new era for cancer treatment:gold-nanoparticle-mediated thermal therapies[J].Small, 2011,7(2):169-183.
[2]Giljohann DA,Seferos DS,Daniel WL,et al.Gold nanoparticles for biology and medicine[J].Angew Chem Int Ed Engl,2010,49(19): 3280-3294.
[3]El-Sayed IH,Huang X,El-Sayed MA.Selective laser photothermal therapy of epithelial carcinoma using anti-EGFR antibody conjugated gold nanoparticles[J].Cancer Lett,2006,239(1):129-135.
[4]Yezhelyev MV,Gao X,Xing Y,et al.Emerging use of nanoparticles in diagnosis and treatment of breast cancer[J].Lancet Oncol,2006, 7(8):657-667.
[5]Burnette RR,Ongpipattanakul B.Characterization of the permselective properties of excised human skin during iontophoresis[J]. J Pharm Sci,1987,76(10):765-773.
[6]Semmler-Behnke M,Kreyling WG,Lipka J,et al.Biodistribution of 1.4-and 18-nm gold particles in rats[J].Small,2008,4(12): 2108-2111.
[7]Sun X,Dong S,Wang E.One-step preparation of highly concentrated well-stable gold colloids by direct mix of polyelectrolyte and HAuCl4 aqueous solutions at room temperature[J].J Colloid Interface Sci,2005,288(1):301-303.
[8]易清玲,曾维惠,刘彦婷,等.黑木耳多糖对ICR小鼠皮肤光老化的保护作用[J].中国美容医学,2012,5(21):759-761.
[9]Fan J,Zhuang Y,Li B.Effects of collagen and collagen hydrolysate from jellyfish umbrella on histological and immunity changes of mice photoaging[J].Nutrients,2013,5(1):223-233.
[10]Park JY,Jang YH,Kim YS,et al.Ultrastructural changes in photorejuvenation induced by photodynamic therapy in a photoaged mouse model[J].Eur J Dermatol,2013,23(4):471-477.
[11]Arockiya Aarthi Rajathi F,Arumugam R,Saravanan S,et al. Phytofabrication of gold nanoparticles assisted by leaves of Suaeda monoica and its free radical scavenging property[J].J Photochem Photobiol B,2014,135:75-80.
[12]Balbín M,Fueyo A,Knäuper V,et al.Identification and enzymatic characterization of two diverging murine counterparts of human interstitial collagenase(MMP-1)expressed at sites of embryo implantation[J].J Biol Chem,2001,276(13):10253-10262.
Gold nanoparticles protect against skin photoaging through photothermal effects in ICR mice:a preliminary study
Liu Yale*,Ge Qin,Li Zhangjun,Geng Songmei,Xiao Shengxiang,Yao Cuiping,Zhang Zhenxi,Zeng Weihui.*Department of Dermatology,Second Affiliated Hospital of Xi′an Jiaotong University,Xi′an 710004,China
< class="emphasis_italic">Corresponding author:Zeng Weihui,Email:zengwh88@163.com
Zeng Weihui,Email:zengwh88@163.com
ObjectiveTo investigate the protective effect of gold nanoparticles against skin photoaging through photothermal effects in female ICR mice,and to explore its possible mechanisms.MethodsA total of 32 healthy female ICR mice were randomly and equally divided into four groups:normal control group receiving no treatment,model group receiving ultraviolet radiation alone,red laser group irradiated with red laser followed by ultraviolet radiation,gold nanoparticle group pretreated with gold nanoparticle solution under occlusion with a black plastic film for 30 minutes followed by red laser and ultraviolet radiation.Ultraviolet radiation was conducted thrice a week for 14 weeks,and the hairs in an area sized about 16 cm2on the back of mice were shaved before each radiation in the model group,red laser group and gold nanoparticle group.At the end of experiment,the skin appearance of mice was observed by naked eyes and dermoscopy.Then,all the mice were sacrificed and skin samples were resected from the tested areas on the back. Haematoxylin-eosin(HE)and Masson′s staining was performed to observe the changes of skin structure and collagen fibers,and the image analysis software ImageJ was used to calculate the area fraction(AA%)occupied by collagen fibers.The DCFH-DA probe was utilized to determine the level of reactive oxygen species(ROS),and enzyme-linked immunosorbent assay(ELISA)was performed to measure the expression of matrix metalloproteinase-13(MMP-13)in skin samples.Statistical analysis was carried out by one-way analysis of variance(ANOVA)for intergroup comparisons followed by the least significant difference(LSD)-ttest for multiple pair-wise comparisons.The simple linear regression analysis was performed to assess the relationship between ROS levels and MMP-13 expression.Results After ultraviolet radiation,a series of characteristic photoaging changes were observed in the skin of mice in the model group,such as squamation,brown-yellowish discoloration,coarsening,thickening,appearance of deep wrinkles and lack of flexibility. Dermoscopy also showed skin coarseness,crusting and brown spots with breakage of and hemorrhage from capillaries in the model group.Compared with the normal control group,the model group showed significant increases in epidermal thickness(81.32±7.09 vs.38.42±13.64 μm,P<0.05),dermal thickness(352.75±40.08 vs.188.50±27.83 μm,P<0.05),ROS levels(5 124 152.80±754 119.22 vs.3 502 085.29±135 089.06 fluorescence intensity of DCF per milligram of protein,P<0.05)and MMP-13 expression(3 895.42±136.06 vs.2 414.73±105.96 g/L,P<0.05),but a significant decrease in the area fraction occupied by collagen fibers(31.94%±8.56%vs.48.63%±11.32%,P<0.05)with an elevation in abnormal elastic materials.Both skin appearance and histological changes improved obviously in the gold nanoparticle group compared with the model group.The skin was significantly thinner in the gold nanoparticle group(epidermal thickness:48.70±13.35 μm;dermal thickness:253.74±36.28 μm,P<0.05)than in the model group. Moreover,the gold nanoparticle group showed a significant elevation in the area fraction occupied by collagen fibers(41.54%±12.10%,P<0.05),but a significant reduction in ROS levels(3 516 963.35±67 436.36 fluorescence intensity of DCF per milligram of protein,P<0.05)and MMP-13 expression levels(2558.25±102.72 g/L,P<0.05)compared with the model group.There were no significant differences between the gold nanoparticle group and normal control group in epidermal thickness,ROS levels or MMP-13 expression(allP>0.05).The simple linear regression analysis showed that ROS levels were positively correlated with MMP-13 expression(r=0.864,P=0.018).Conclusion The photothermal effects of gold nanoparticles can protect ICR mice from skin photoaging to a certain degree,likely by downregulating the generation of ROS and expression of the downstream factor MMP-13.
Skin aging;Ultraviolet rays;Reactive oxygen species;Matrix metalloproteinase 13;Animal experimentation;Metal nanoparticles;Gold nanoparticle
10.3760/cma.j.issn.0412-4030.2015.10.012
国家自然科学基金(81172590);高等学校博士学科点专项科研基金(20130201110068);西安交通大学学科综合交叉项目(xjj20100201)
710004西安交通大学医学院第二附属医院皮肤科(刘亚乐、葛芹、李张军、耿松梅、肖生祥、曾维惠);西安交通大学生命科学与工程学院(姚翠萍、张镇西)
曾维惠,Email:zengwh88@163.com
2014-12-02)
(本文编辑:周良佳 颜艳)
