食源性致病菌MALDI-TOF MS检测方法的建立与应用
2015-11-04周千渝张延国黄成才谢景丽高青珍中国农业科学院蔬菜花卉研究所农业部蔬菜品质监督检验测试中心北京0008岛津企业管理中国有限公司分析仪器事业部北京0000
周千渝,张延国,黄成才,谢景丽,高青珍,刘 肃,*(.中国农业科学院蔬菜花卉研究所,农业部蔬菜品质监督检验测试中心,北京0008;.岛津企业管理(中国)有限公司,分析仪器事业部,北京0000)
食源性致病菌MALDI-TOF MS检测方法的建立与应用
周千渝1,张延国1,黄成才2,谢景丽1,高青珍1,刘肃1,*
(1.中国农业科学院蔬菜花卉研究所,农业部蔬菜品质监督检验测试中心,北京100081;2.岛津企业管理(中国)有限公司,分析仪器事业部,北京100020)
建立用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)快速检测并鉴定从鲜食蔬菜中分离到的5种食源性致病菌的方法。以标准菌株为模式菌,考察基质溶液配比、菌株培养条件、溶剂处理方法、点样方法及比例等条件对鉴定结果的影响,确定最优方法,并考察方法的稳定性、重复性和检测限。分别用所建立的方法和16S rRNA基因测序法对7株标准菌株和93株分离株进行分析,比较两者鉴定结果的一致性。结果表明,所建立的方法稳定性良好,检测限为106~109cfu/mL,菌株鉴定结果与基因测序鉴定结果具有较高一致性(83%在种水平鉴定一致,94%在属水平鉴定一致)。MALDI-TOF MS法可用于食源性致病菌的准确、快速、低成本、高通量的检测及鉴定。
MALDI-TOF MS,食源性致病菌,检测,鉴定
食源性致病菌导致的食品安全问题越来越受到关注。资料显示,2006年到2010年,我国共收到食源性疾病暴发事件报告2023起,累计发病62920人,死亡967人,其中微生物引起的食源性疾病暴发事件数和患者数最多,分别占40.09%和61.92%[1]。存在于食品介质上的潜在致病菌包括沙门氏菌、大肠杆菌、单核细胞增生李斯特菌、金黄色葡萄球菌、蜡样芽胞杆菌等,这些污染若未得到及时监测和有效控制,则对人体存在极大潜在危害[2]。微生物快速检测技术的应用将为食源性致病菌监测提供重要的技术支撑。
食源性致病菌检测技术主要包括基于微生物形态学、生理生化反应的传统方法,分子生物学方法以及免疫学方法。传统方法操作复杂,检测周期长;分子生物学和免疫学方法检测结果灵敏,快速高效,但是实验操作也相对复杂,成本较高。在实际应用中上述方法不能完全满足细菌准确、快速、高通量检测的需要[3-4]。质谱技术的发展为食源性致病菌的快速检测提供了新思路,基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)具体原理是细菌样品与基质(小分子有机酸)溶液形成的共晶体在激光照射下发生电荷转移使得样品分子电离,不同质荷比(m/z)的离子在电场作用下加速飞过飞行管道,根据到达飞行时间检测器(TOF)时所用的时间不同而被分离和检测,所测得的蛋白质及多肽质量指纹图谱与标准数据库比对,即可得到鉴定结果[5]。目前,此技术已被应用于多种临床病原菌的快速鉴定[6]。在我国,MALDI-TOF MS技术在食品安全领域的研究尚处于起步阶段,已有的研究表明此技术应用于食源性致病菌鉴定和分型方面是可行的。另外,MALDI-TOF MS技术在真菌毒素检测、菌株功能蛋白分析、食品过敏源检测、真伪辨别、产地溯源、细菌耐药性研究等方面也具有潜在应用价值[7-9]。
基质溶液配比、菌株培养时间及培养基、溶剂处理方法、点样方法及比例等是影响谱图质量的主要因素[10-12],本文以几种标准菌株为模式菌,考察了以上几个因素对实验结果的影响,研究了样品处理及质谱分析的最佳方法,并通过分析实际分离到的菌株对此方法的准确性和稳定性进行验证,以期建立一种适用于食源性致病菌的快速检测方法。
1 材料与方法
1.1材料与仪器
甲酸(FA)、乙腈(ACN)、三氟乙酸(TFA)、无水乙醇、α-氰-4-羟基肉桂酸(CHCA) 色谱纯,Sigma公司;营养琼脂(NA)、平板计数琼脂(PCA)、脑心浸液琼脂培养基(BHI)、改良山梨醇麦康凯(CT-SMAC)琼脂、Baird-Parke(BP)琼脂、PALCAM琼脂、HE琼脂、XLD琼脂、亚硫酸铋(BS)琼脂、沙门氏菌显色培养基青岛海博生物技术有限公司;脑心浸液肉汤(BHIB) 美国Oxid公司;7株标准菌株:出血性大肠杆菌O157∶H7(Escherichia coli O157∶H7,CICC 21530)、大肠埃希氏菌(Escherichia coli,ATCC 8739)、肠炎沙门氏菌(Salmonella enteritidis,CICC 21482)、鼠伤寒沙门氏菌2株(Salmonella enterica subsp.enterica serovar Typhimurium,ATCC 14028、ATCC 49416)、金黄色葡萄球菌(Staphylococcus aureus,CICC 23656)、单核细胞增生李斯特菌(Listeria monocytogenes,CICC 21633);93株蔬菜中分离到的野生菌株均为本实验室保存。
AXIMA Performance基质辅助激光解吸电离飞行时间质谱仪岛津公司;DHP-420型电热恒温培养箱佳美仪器有限公司;WH-2型微型涡旋混合仪上海泸西分析仪器厂;TGL-16B型高速台式离心机安亭科学仪器厂;D-1型高压蒸汽灭菌锅湖北永大换热设备有限公司。
1.2实验方法
1.2.1基质溶液的选择10 mg的α-氰-4-羟基肉桂酸溶解于1 mL的超纯水、乙腈、三氟乙酸的混合溶液(三者的体积比分别为19∶20∶1和49.9∶50∶0.1)中制成基质饱和溶液1和溶液2。以出血性大肠杆菌CICC 21530和金黄色葡萄球菌CICC 23656为模式菌,考察不同基质溶液对质谱结果的影响。两株细菌分别接种于BHI培养基,37℃培养24 h后,无菌操作分别挑取适量菌落(5~10 mg)加入含300 μL超纯水的1.5 mL的无菌离心管中,仔细混匀后再加900 μL无水乙醇,再次混匀灭活,12000 r/min高速离心2 min后弃去上清。灭活后的菌体沉淀中先后加入50 μL的70%甲酸和50 μL乙腈,充分悬浮,混匀,以12000 r/min离心2 min提取蛋白,上清液备用。制备的上清液样品和两种基质溶液以1∶1的体积比覆盖法点样,同一细菌样品不同基质溶液分别重复点12个孔进行质谱分析。
1.2.2培养条件的选择以金黄色葡萄球菌CICC 23656和沙门氏菌ATCC 14028标准菌株为模式菌,分别考察不同培养基及培养时间对质谱结果的影响。将金黄色葡萄球菌标准菌株接种于NA、BHI、PCA三种非选择性培养基上,将沙门氏菌标准菌株接种于BHI、BS、XLD、HE、沙门显色培养基上,将上述培养基于37℃恒温培养箱培养24、48、72 h培养后,以1.2.1所述方法灭活并提取蛋白后点样进行质谱分析,使用上述基质溶液1点样。同一培养条件平行处理三次,每个处理平行点样三次。
1.2.3蛋白提取方法的选择以大肠杆菌ATCC 8739为模式菌,标准菌株接种于BHI培养基于37℃培养24 h后,挑取适量菌落用1.2.1所述方法灭活后,考察以下六种蛋白提取方法(见表1)对结果的影响。灭活菌体沉淀分别按照表1步骤处理后,仔细混匀样品,以12000 r/min离心2 min,留取上清液备用。每种方法平行处理3个样品,每个样品平行点样三次。

表1 蛋白提取方法Table 1 Protein extraction method
1.2.4点样及MALDI-TOF MS分析以出血性大肠杆菌CICC 21530为模式菌考察以下不同点样方法及点样比例对质谱结果的影响。覆盖法:移取经上述方法处理后的上清液点至靶板,室温自然干燥后覆盖CHCA基质溶液,自然干燥后上机分析,上清液样品及基质溶液点样量分别为1 μL+1 μL、0.5 μL+1 μL、1 μL+0.5 μL;夹心法:先在靶板上点0.5 μL基质溶液,干燥后覆盖1 μL样品,自然晾干再覆盖0.5 μL基质溶液;混合干滴法:点靶前样品和基质溶液等量混合,取1 μL混合液立即点样,干燥后上机分析。每种点样方法及比例重复点样6次,分析鉴定结果一致性。
质谱仪器参数如下:线性操作模式,阳离子模式,检测范围:2000~20000 Da;激光点击数:每图谱100;激光频率:50 Hz;离子源加速电压:20 kV。每次实验前都要在采集数据的质量范围内用大肠杆菌标准菌株样品进行仪器校准,以保证所获得的离子质量数误差小于±7。
1.2.5检测限实验以大肠杆菌CICC 21530和沙门氏菌CICC 21482各一株为模式菌,考察方法的检测限。两株菌株分别接种于10 mL的BHIB中于37℃培养24 h后,分别用0.85%无菌生理盐水以1∶10的比例梯度稀释9次。每个稀释度的菌液各取1 mL,离心弃上清,沉淀菌体用1.2.1的方法处理并以覆盖法1 μL+ 1 μL点样分析。每个稀释度的样品重复处理三次,每个处理重复点样三次,通过分析不同稀释度样品的鉴定结果的准确性来考察仪器检测限。同时各取两者的三个最高稀释倍数的菌液1 mL用于PCA平板计数,每个稀释度重复计数三次。
1.2.6稳定性实验以大肠杆菌CICC 21530和金黄色葡萄球菌CICC 23656作为模式菌,三个不同时间分别以同样的方法处理后进行质谱分析,每个菌株3个平行处理,每个处理重复点样4次,考察同一批次及不同批次处理后鉴定结果的稳定性。
1.3数据处理
用Shimadzu Biotech launchpad 2.9软件对采集到的图谱进行分析比较。采集结果导入到SARMIS数据库中,与标准图谱比对,经软件计算给出相应的得分和鉴定结果。得分在90%~99.9%,结果以绿色标出,表示鉴定结果可信;得分在85%~89.9%,结果以黄色标出,表示鉴定结果可信度较高;得分在70%~85%,结果以白色标出,表示可能的菌属或者菌种鉴定;得分70%以下不给出鉴定结果。若以红色标出,表示不可信的鉴定结果或者样品有杂菌污染。重复处理及点样的样品,以平均鉴定得分及其变异系数(C.V)考察鉴定结果的可信度和稳定性。
2 结果与讨论
2.1基质溶液的选择
用基质溶液1和基质溶液2以相同方法点样分析的所有样品都得到准确鉴定结果,但用基质溶液1的平均得分稍高。对于大肠杆菌和金黄色葡萄球菌,用基质溶液1点样鉴定平均得分分别为99.9%、99.9%,用基质溶液2点样鉴定平均得分为94.7%、95.0%。
图1是大肠杆菌用两个溶液点样分析后得到的质谱图,看出A的特征峰峰形更好,而B的基线噪音较明显,部分特征峰的位置有偏离,可能是因为基质溶液中的三氟乙酸可以影响样品和基质的共结晶过程[13],从而影响数据的采集。使用两者久置(室温或者4℃保存一个月)的基质溶液实验时,这一趋势更明显。因此,基质溶液选择超纯水、乙腈、三氟乙酸(体积比19∶20∶1)的CHCA饱和溶液,每次实验前重新配制。
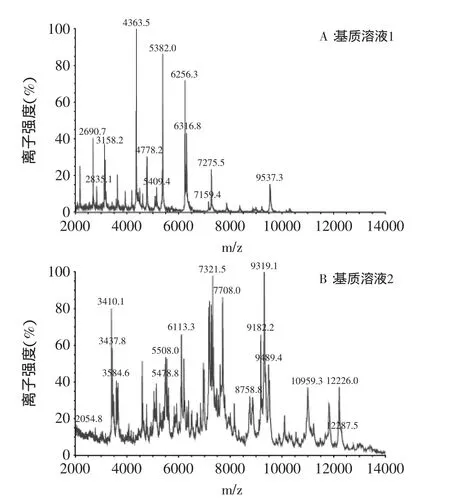
图1 大肠杆菌用不同配比的基质溶液点样得到的质谱图Fig.1 The spectra of E.coli strains using
2.2培养条件的选择
不同条件培养金黄色葡萄球菌CICC 23656,鉴定得分见表2。48、72 h培养的个别样品鉴定得分较低,可能是因为细菌长时间培养产生了代谢物会对结果有所影响,本实验后续菌株培养时间均为24 h。实际上,细菌只要经过培养在琼脂平板上形成可方便挑取的菌落即可,一般过夜培养就可达到要求;用NA、PCA、BHI培养金黄色葡萄球菌24 h后,鉴定平均得分均在95%以上,质谱图无明显差异,说明三种非选择性培养基对质谱结果影响不大,但是从几组鉴定得分的变异系数看出,BHI培养基24 h培养时变异系数最小,结果稳定性更好。

表2 金黄色葡萄球菌经不同培养条件培养后的鉴定得分(%)Table 2 Identification scores of Staphylococcus aureus in different cultivation conditions(%)
沙门氏菌ATCC 14028经BHI、BS、XLD、HE、沙门氏菌显色培养基分别培养24 h并处理后得到的质谱图不同特征峰的峰强度稍有差异,但质谱数据导入数据库通过与标准图谱比对,软件计算后,都得到准确鉴定。表3是9个平行样品的鉴定得分,可看出平均鉴定得分均大于95%,且除了沙门显色培养基外,其他鉴定得分的变异系数均小于5%,说明非选择性培养基对鉴定结果几乎无影响。本实验统一选择37℃,BHI培养24 h为后续研究菌株的培养条件。

表3 沙门氏菌经不同培养基培养后的鉴定得分(%)Table 3 Identification scores of Salmonella enteritidis on different culture medium(%)
2.3蛋白提取方法的选择
六种方法处理大肠杆菌ATCC 8739,得到的谱图见图2。看出方法5处理后特征峰数量有所减少,其他图谱之间各峰强度稍有差异,可能是因为不同提取方法对非特征峰的出峰有影响,但所有样品都得到准确鉴定,平均鉴定得分均在95%以上,变异系数均小于3%。说明处理方法对特征峰数量及强度影响不大,这与相关文献的报道不太一致[14]。实验最终确定用报道较多的70%甲酸和乙腈处理菌株,即为文中提到的方法1。
2.4点样方法及点样比例的选择
不同点样方法及比例点样的大肠杆菌所得谱图见图3。覆盖法点样,前两者特征峰数量及强度较一致,平均鉴定得分均大于98%,变异系数小于1%,但样品与基质以覆盖法1 μL+0.5 μL点样时,特征峰数量有所减少。夹心法及混合干滴法点样得到的图谱基线噪音较大,特征峰数量明显减少,平均得分分别为90.8%、89.9%,得分变异系数分别为4%、9%。证明点样方法对实验结果有较大影响。本实验后续研究最终选择覆盖法1 μL+1 μL点样。

图2 不同处理方法处理大肠杆菌得到的质谱图Fig.2 The spectra of E.coli of different pre-treatment
2.5方法的检测限
根据最高稀释倍数的菌液计数结果推算出各个稀释度的菌浓度。表4为检测限实验结果,菌浓度在105cfu/mL以下的稀释菌液,灭活离心后菌体沉淀几乎观察不到,按照处理步骤加溶剂提取蛋白并点样分析,无法得到鉴定结果。因此确定此方法检测限为106~109cfu/mL,这个检测限满足一般检测需求。

图3 不同点样方法及点样比例得到的金黄色葡萄球菌质谱图Fig.3 The spectra of Staphylococcus aureus by different sample/matrix proportion and sample deposition method

表4 检测限实验结果Table 4 Results of the detection limit
2.6方法的稳定性
同一批次的大肠杆菌CICC 21530和金黄色葡萄球菌CICC 23656样品不同重复之间鉴定结果高度一致,平均得分均大于95%,变异系数均小于5%;三个不同批次之间,相同菌株的鉴定结果一致,平均得分均大于97%,变异系数均小于5%,且质谱图无明显差异,证明此方法稳定性和重复性良好。
2.7与16S rRNA基因测序结果的对比
7株标准菌株,56株根据食品微生物检验标准GB 4789的方法[15]从鲜食蔬菜中分离到的食源性致病菌(包括大肠杆菌、金黄色葡萄球菌、沙门氏菌、单增李斯特菌、蜡样芽胞杆菌),以及37株分离过程中得到的菌株(包括铜绿假单胞菌、奇异变形杆菌等涉及食物中毒报道案例的条件致病菌,或按照传统方法在检验过程中以假阳性出现的非常见的野生菌株)。以上共100株菌株分别同时用MALDI-TOF MS法和16S rRNA基因测序法分析,前者有91株鉴定到种水平,5株细菌无鉴定结果。后者92株菌株鉴定到种水平,1株测序结果BLAST比对后无法得到确认。表5是两方法的鉴定结果对比,其中83株菌株在种水平上两方法鉴定一致,94株在属水平上鉴定一致。MALDI-TOF MS法分析的56株常见食源性致病菌除一株沙门氏菌和一株李斯特菌只鉴定到属水平外,其他的都在种水平上与测序结果鉴定结果相符。此结果说明MALDI-TOF MS方法的可靠性良好。
3 结论与讨论
本文建立的菌株处理方法如下:取适量(5~10 mg)新鲜培养的菌株到300 μL超纯水中混匀,再加入900 μL无水乙醇充分混匀灭活,12000 r/min高速离心2 min后弃去上清,沉淀中先后加入50 μL 70%甲酸和等量乙腈,仔细混匀后,12000 r/min高速离心2 min,上清液以覆盖法1 μL+1 μL点样分析,基质溶液选择体积比为19∶20∶1的超纯水、乙腈、三氟乙酸三者的混合溶液的CHCA饱和液。另外,文中提到的其他处理方法的适用性及稳定性有待进一步研究。
MALDI-TOF MS具有操作简单,快速(每个样品2~3 min可完成鉴定),成本低(与传统方法比较,可降低20%~30%的检测成本),容易实现大通量检测等优点[16],可作为一种主要或辅助方法应用于食源性致病菌监测系统。因为大部分导致食源性疾病的致病菌为未知微生物,用传统方法很难实现全面的监测,而MALDI-TOF MS常应用于一些用传统方法难鉴定或者鉴定周期长的微生物的快速鉴定[17-18],这一点的意义重大。此法也可用于细菌的全细胞分析,即不需要经过溶剂处理,纯菌落或菌液可直接点样,这样可明显提高检测效率,有文献报道了其应用于多种临床菌株的全细胞分析[19]。因此,尝试不同样品前处理方式,进一步简化处理步骤,还有数据库的完善及补充都是今后研究的重点。另外,虽然MALDITOF MS可实现菌株的快速鉴定,但其要求必须得到纯菌落或者纯菌液,依然依赖于基础增菌及分离培养阶段(一般需要1~3 d),所以此法结合快速复合增菌的研究有助于检测效率的进一步提高。

表5 MALDI-TOF MS法和16S rRNA基因测序法分析100株细菌的结果比较Table 5 The results of the MALDI-TOF MS method and 16S rRNA gene sequence analysis for 100 strains
[1]庞璐,张哲,徐进.2006-2010年我国食源性疾病暴发简介[J].中国食品卫生杂志,2011,63(6):560-563.
[2]James M Jay,Martin J Loessner,David A Golden.Modern Food Microbiology[M].Springer Science Business Media,Inc, 2005:519-542.[3]栗建永,赵琢,贾晓川,等.食源性致病菌检测分析技术的研究进展[J].食品研究与开发,2013,34(18):110-115.
[4]龚艳清,郭书林,陈信忠,等.基质辅助激光解析电离飞行时间质谱在动物病原菌检测中的应用[J].中国动物检疫,2012,29(2):22-25.
[5]Martin Welker.Proteomics for routineidentificationof microorganisms[J].Proteomics,2011,11:3143-3153.
[6]Antony Croxatto,Guy Prod hom,Gilbert Greub.Applications ofMALDI-TOFmassspectrometryinclinicaldiagnostic microbiology[J].Federation of European Microbiological Societies,2012,36(2):380-407.
[7]郑秋月,战晓微,徐杨,等.食源性致病菌沙门氏菌MALDITOF MS溯源分析[J].食品科技,2013,38(12):315-320.
[8]Analía Lima,Rosario Durán,Gustavo Enrique Schujman,et al.Serine/threonine protein kinase PrkA of the human pathogen Listeria monocytogenes:Biochemical characterization and identification of interacting partners through proteomic approaches[J].Journal of Proteomics,2011,74(9):1720-1734.[9]Maria Fiorella Mazzeo,Beatrice De Giulio,Giulia Guerriero,et al.Safety Assessment of Fresh and Processed Seafood Products by MALDI-TOF Mass Fingerprinting[J].Food and Bioprocess Technology,2011,4(6):907-918.
[10]OndrejˇSedo,Aleˇs Voraˇ,Zbynˇek Zdrahal.Optimization of massspectralfeaturesinMALDI-TOFMSprofilingof Acinetobacter species[J].Systematic and Applied Microbiology,2011,34(1):30-34.
[11]HU Wei,FU Qiang,ZHOU Jie,et al.Optimization of conditions for determination of protein molecular weight using matrixassistedlaserdesorption/ionizationtime-of-flightmass spectrometry[J].Journal of Southern Agriculture,2012,43(1):14-17.
[12]吕佳,卢行安,刘淑艳.MALDI-TOF MS技术鉴定食源性致病菌的影响因素[J].分析仪器,2011(2):12-17.
[13]石磊,季怡萍,邢俊鹏.蛋白质分子量测定过程中的酸效应[J].分析化学,2002,30(8):938-941.
[14]陈秀金,尹红红,匡华.沙门氏菌MALDI-TOF-MS蛋白质指纹图谱分析方法的研究[J].食品与生物技术学报,2012,31(11):1189-1197.
[15]中华人民共和国卫生部.中华人民共和国国家标准GB 4789.1-2010/4789.4-2010/4789.10-2010/4789.30-2010/ 4789.36-2008[S].中国标准出版社,第1版(2010年5月1日).
[16]Marché Loff,Louise Mare,Michele de Kwaadsteniet.3MTMMolecularDetectionsystemversusMALDI-TOFmass spectrometry and molecular techniques for the identification of Escherichia coli O157∶H7,Salmonella spp.&Listeria spp[J]. Journal of Microbiological Methods,2014,101:33-43.
[17]A C M Veloo,G W Welling,J E Degener.The identification of anaerobic bacteria using MALDI-TOF MS[J].Anaerobe,2011,17(4):211-212.
[18]Valeria Gaia,Simona Casati,Mauro Tonolla.Rapid identification of Legionella spp.by MALDI-TOF MS based protein mass fingerprinting[J].Systematic and Applied Microbiology,2011,34(1):40-44.
[19]Jamal W,Saleem R,Rotimi VO.Rapid identification of pathogens directly from blood culture bottles by Bruker matrixassisted laser desorption laser ionization-time of flight mass spectrometry versus routine methods[J].Diagnostic Microbiology and Infectious Disease,2013,76(4):404-408.
Matrix-assisted laser desorption ionization-time of flight mass spectrometry for the identification and detection of foodborne pathogens
ZHOU Qian-yu1,ZHANG Yan-guo1,HUANG Cheng-cai2,XIE Jing-li1,GAO Qing-zhen1,LIU Su1,*
(1.Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Supervision and Testing Center for Vegetable Quality,Ministry of Agriculture,Beijing 100081,China;2.Shimadzu(China)Co.,Ltd.,Analytical Instruments Dept,Beijing 100020,China)
A method based on matrix-assisted laser desorption ionization-time of flight mass spectrometry(MALDI-TOF MS)was developed for rapid discrimination of 5 species of foodborne pathogens which isolated from fresh vegetables.Standard strains were used in the study to investigate factors affecting the identification results,such as the selection of matrix solution,cultivation conditions,solvent treatment method,and the sample deposition method.After determined the optimal protocol,the stability and repeatability of the method were evaluated.Then bacteria strains separated from fresh vegetables were identified by this protocol.The 16S rRNA gene sequence analysis for 93 wild strains and 7 standard strains was used as a reference to evaluate the credibility of MALDI-TOF MS method.The MALDI-TOF MS method showed good stability with appropriate detection limit(106~109cfu/mL)for rapid detection of those strains and high consistency with the 16S rRNA gene sequence analysis(83%consistency at the species level and 94%consistency at the genus level).It was showed that MALDI-TOF MS could be used as an accurate,quick,cost-effective and high throughput method in the identification of foodborne pathogens.
MALDI-TOF MS;foodborne pathogens;detection;identification
TS207.4
A
1002-0306(2015)18-0059-07
10.13386/j.issn1002-0306.2015.18.003
2014-12-05
周千渝(1991-),女,在读硕士研究生,研究方向:食品加工与安全,E-mail:qyzhou1991@163.com。
刘肃(1955-),男,硕士,研究员,研究方向:农产品质量和安全检测技术,E-mail:liusu@mail.caas.net.cn。
2014年国家蔬菜产品质量安全风险评估项目(GJFP2014001)。
