不同盐质量浓度四川泡菜腐败前后微生物的分析比较研究
2015-10-29蒋云露杨建涛车振明
王 猛,蒋云露,杨建涛,常 伟,车振明,陈 功,饶 瑜,*
(1.西华大学生物工程学院,四川 成都 610039;2.通威三文鱼研究所,四川 都江堰 611800;3.四川省食品发酵工业研究设计院,四川 温江 611130)
不同盐质量浓度四川泡菜腐败前后微生物的分析比较研究
王猛1,蒋云露1,杨建涛1,常伟2,车振明1,陈功3,饶瑜1,*
(1.西华大学生物工程学院,四川 成都 610039;2.通威三文鱼研究所,四川 都江堰 611800;3.四川省食品发酵工业研究设计院,四川 温江 611130)
研究不同盐质量浓度四川泡菜正常发酵后与发生腐败后盐卤中微生物的数量、分布及变化。利用不同的选择培养基对3 个盐质量浓度四川泡菜腐败前后盐卤中的微生物进行分离纯化,得到168 株菌株,并经16S rDNA和18S rDNA分子生物学鉴定其种属。结果表明:在不同盐质量浓度泡菜正常发酵过程中,以植物乳杆菌和戊糖乳杆菌为主的乳酸菌主导了泡菜发酵过程。泡菜腐败时,不同盐质量浓度泡菜中的腐败微生物以芽孢杆菌和酵母为主,其中枯草芽孢杆菌和塔克斯假丝酵母在不同盐质量浓度泡菜腐败时均占一定比例;40 g/L盐质量浓度泡菜盐卤以甲级营养型芽孢杆菌、地衣芽孢杆菌、库德里阿兹威毕赤酵母和热带念珠酵母为主,60 g/L盐质量浓度泡菜盐卤以短小芽孢杆菌、克鲁维毕赤酵母和热带念珠酵母为主,80 g/L盐质量浓度泡菜盐卤以奇异变形杆菌、解淀粉芽孢杆菌、白地霉、地衣芽孢杆菌、库德里阿兹威毕赤酵母以及克鲁维毕赤酵母为主。腐败泡菜盐卤表层的膜璞由细菌和真菌共同形成,且盐质量浓度越低,细菌所占的比例越高。
四川泡菜;盐质量浓度;正常发酵;腐败;优势菌群
泡菜是一类以各种新鲜蔬菜为原料,在一定盐浓度溶液中经乳酸菌自然发酵得到的一种蔬菜制品。四川泡菜历史悠久,以味道咸酸、口感脆生、色泽鲜亮、香味扑鼻而著称,被称为“川菜之骨”[1],泡菜风味独特,不仅是佐餐佳品,而且还具有刺激食欲,改善肠道环境,促进胃肠健康等功能,广受消费者喜爱[2-5]。但是在泡菜的制作过程中,由于泡菜原料未经过灭菌处理,加之其微生物发酵的自发性,在泡菜正常发酵完成后盐卤中仍保留了大量微生物,在泡菜贮藏的过程中会继续进行生长发酵,造成泡菜的过熟或腐败。发酵或贮藏过程中条件控制不当也会造成大腐败微生物的繁殖引起产品的腐败变质。家庭自制泡菜因为时常加入新的蔬菜或添加白酒等方法,在一定程度上可以避免泡菜的过熟或腐败问题。而工业化泡菜生产中如何控制腐败微生物的生长,保证产品的品质及安全,进而推动四川传统泡菜的产业化发展是一个亟待解决的问题[6]。研究四川泡菜的微生物区系,分离鉴定引起泡菜腐败的微生物,将对泡菜腐败控制起到一定指导作用。
本研究利用不同选择培养基分离纯化不同盐质量浓度四川泡菜正常发酵后与贮藏腐败后的各种微生物,并进行分子生物学菌种鉴定。对比泡菜正常发酵后与贮藏腐败后的微生物变化,分析正常发酵的泡菜中存在的潜在腐败微生物,探讨不同盐质量浓度对腐败微生物及腐败现象的影响。
1 材料与方法
1.1材料与试剂
四川泡菜:原料为白萝卜、胡萝卜及空心菜。将原料洗干净,晾干。白萝卜、胡萝卜切成片状;空心菜切成条状;将白萝卜、胡萝卜与白菜混在一起装入1.7 L土陶坛子,将坛子中的蔬菜压实,装到土陶坛子总体积的2/3刻度处,白萝卜、胡萝卜与白菜的质量比为6∶2∶2。之后在坛子中加入盐质量浓度分别为40、60、80 g/L的冷开水,加到土陶坛子总体积的4/5刻度处,料液比大概在2∶1。液封防止空气进去坛子中,置于室温发酵。每个盐质量浓度平行2 组实验。
1.2仪器与设备
台式冷冻离心机 美国Beckman公司;PCR仪、凝胶成像系统 美国Bio-Rad公司;电泳仪 北京六一仪器厂;立式压力蒸汽灭菌锅 上海申安医疗器械厂。
1.3方法
1.3.1泡菜理化指标的测定
泡菜中亚硝酸盐是参照GB 5009.33—2010《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定方法》进行测定,氨基态氮是参照GB/T 12143—2008《饮料通用分析方法》进行测定。
1.3.2微生物计数
参照GB 4789.2—2010 《食品安全国家标准 食品微生物学检验 菌落总数测定》的方法制备样品稀释液,选取适当的稀释度涂布于培养基。NA琼脂培养基用于细菌总数计数;MRS琼脂培养基用于乳酸菌的筛选,培养基中添加终质量浓度为35 μg/mL的放线菌酮;VRBA琼脂培养基用于分离大肠菌群;虎红琼脂培养基用于霉菌和酵母菌的分离和计数。NA、VRBA琼脂培养基于37 ℃培养箱培养24~36 h,MRS、虎红琼脂培养基于30 ℃培养先培养24~48 h。
1.3 统计学分析 用SPSS22.0统计软件,计数资料用%表示,采用χ2检验,P<0.05为差异有统计学意义。
1.3.3不同微生物的分离鉴定
从培养基上挑选不同形态的单菌落进行液体培养,使用细菌或真菌DNA提取试剂盒提取总DNA,于1.0%琼脂糖凝胶电泳检验结果。以提取的总DNA为模板,细菌以Eu27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1490R(5'-GGTTACCTTGTTACGACTT-3')为引物,于95 ℃ 5 min;95 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min,35 个循环;72 ℃ 10 min条件下进行扩增16S rDNA全长片段。真菌以NS1(5'-GCATATCAATAAGC GGAGGAAAAG-3')和NS4(5'-GGTCCGTGTTTC AAGACGG-3')为引物,于94 ℃ 3 min;94 ℃ 30 s,40 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min条件下进行扩增18S rDNA部分片段。
扩增产物经胶回收纯化,送上海华津生物科技有限公司测序,测得的序列与GenBank数据库进行相似性分析,并通过Clustal X软件多重比对后用MEGA6.0软件中的Neighbor-Joining法进行构建系统发育树。
2 结果与分析
2.1不同盐质量浓度四川泡菜发酵过程中的理化指标及微生物变化
如图1所示,发酵至第12天时,40、60、80 g/L盐质量浓度泡菜pH值都降至4.0甚至4.0以下,一般认为,pH≤4.0时,泡菜正常发酵完成[7]。在此发酵过程中,40、60、80 g/L这3 种盐质量浓度泡菜盐卤中的氨基态氮、亚硝酸盐的变化情况与余文华[8]、杨瑞[9]等研究一致,氨基态氮含量提高了约2 g/100 g,亚硝酸盐含量在发酵的第4~5天时达到最大值,在第12天时已下降到初始状态。图2所示为12 d发酵过程中,不同盐质量浓度泡菜盐卤中不同微生物的生长变化情况。可以看出,不同盐质量浓度对四川泡菜的微生物生长产生一定影响。四川泡菜的发酵主要是乳酸菌的发酵过程,也是引起泡菜pH值降低的主要原因。40、60、80 g/L盐质量浓度泡菜中的乳酸菌数量分别在第10、9、10天达到了最大值5.8×106、6.8×106、6.7×106CFU/mL,而60 g/L盐更适于乳酸菌的生长(图2B),这与Suzanne等[10]的研究一致。真菌和大肠菌群在该过程中也有一定生长,在发酵第12天时,3 种盐质量浓度泡菜的真菌总数都达到了104CFU/mL,但不同盐质量浓度中真菌生长速率有一定差异(图2D)。大肠菌群在正常发酵后期达到了104CFU/mL,盐质量浓度越高,生长速率越快(图2C)。梭菌在该期间数量很少并无明显变化(结果未显示)。
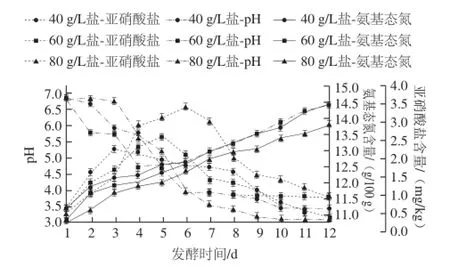
图1 不同盐质量浓度泡菜中理化指标动态变化Fig.1 Dynamic changes of physical and chemical indicators in pickles with different salt concentrations
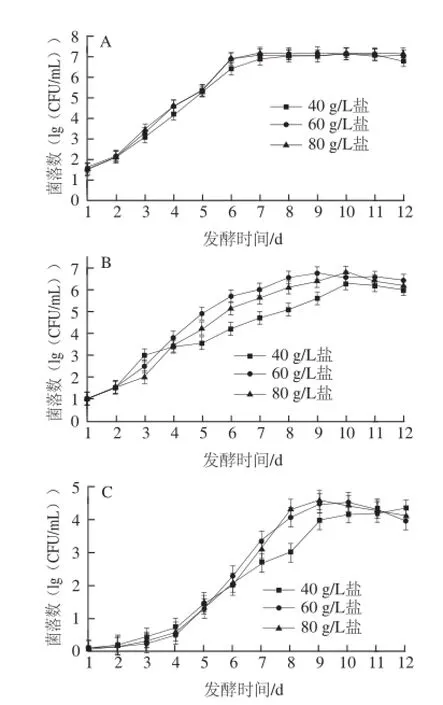

图2 不同盐质量浓度四川泡菜发酵过程中不同微生物的生长变化Fig.2 Growth curves of different microorganisms in Sichuan pickles with different salt concentrations
2.2不同盐质量浓度四川泡菜腐败后理化及微生物指标
当泡菜表面出现白色膜璞[11-13],盐卤出现混浊时,认为泡菜已发生腐败。40、60、80 g/L盐质量浓度泡菜分别于第35、47、37天出现腐败,在盐卤表面出现白色生物膜。40 g/L和80 g/L盐质量浓度泡菜卤水较60 g/L盐质量浓度泡菜混浊,已不具有泡菜特有香味,有一定恶臭气味[7]。泡菜腐败后理化以及微生物指标如表1、2所示。
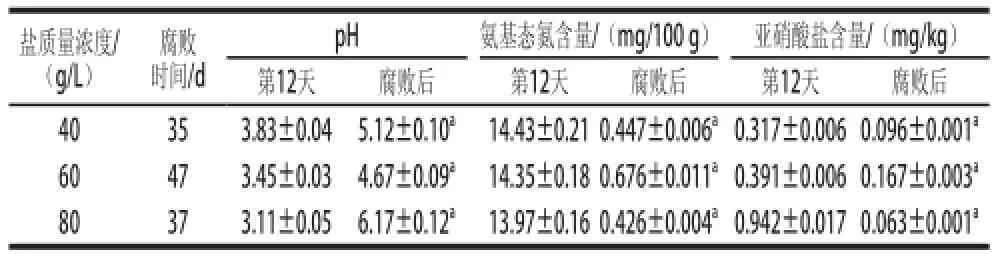
表1 不同盐质量浓度泡菜正常发酵与腐败后理化指标Table1 Comparison of physical and chemical indicators in pickles with different salt concentrations before and after spoilage
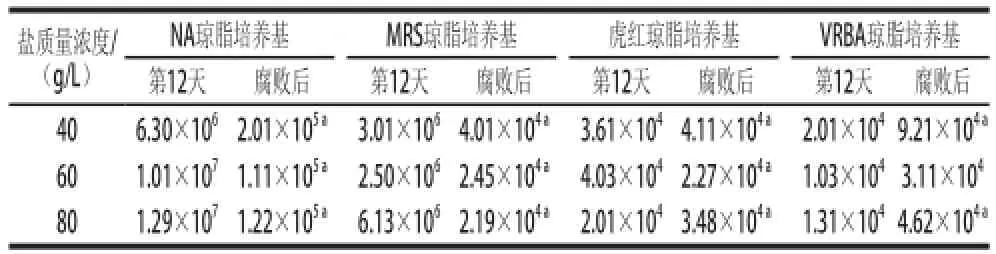
表2 不同盐质量浓度泡菜正常发酵与腐败后的微生物数量Table2 Comparison of microbiological indicators in pickles with different salt concentrations before and after spoilage CFU/mL
由表1可知,泡菜腐败时,盐卤的pH值会有所升高,其中80 g/L盐质量浓度泡菜的pH值变化最大,在腐败时(第37天)pH值已升至6.17。如表2所示,在泡菜发酵腐败后,40、60、80 g/L盐质量浓度泡菜中微生物数量均变化显著,总数下降了一个数量级,乳酸菌数量均下降了两个数量级。其中以80 g/L盐质量浓度泡菜中乳酸菌数量下降最为明显,由发酵第12天的6.1×106CFU/mL下降至2.2×104CFU/mL。40、60、80 g/L盐质量浓度泡菜中真菌的数量有一定波动,40 g/L和80 g/L盐质量浓度泡菜在腐败后真菌数量分别增加了0.5×104CFU/mL和1.5×104CFU/mL,而60 g/L盐质量浓度泡菜腐败后真菌数量下降了1.7× 104CFU/mL。大肠菌群的数量在不同盐质量浓度泡菜腐败后均提高了3~4倍,其中40 g/L盐质量浓度泡菜腐败后(第35天)大肠菌群的数量达到了9.2×104CFU/mL,为3 个盐质量浓度泡菜腐败后大肠菌群数量中最高。
一般认为,在泡菜发酵后期,由于pH值降至4.0左右,乳酸菌的生长在该pH值条件下会受到抑制[14-17],在图2B中可看出乳酸菌数量在发酵第9~12天时已有所下降,并在泡菜贮藏 的过程中一直受到抑制并出现数量大幅降低(表2)。泡菜发酵后,基质中残存的糖将被以酵母为主的真菌所利用,也可能利用由乳酸菌发酵产生的乳酸、醋酸等有机酸引起基质pH值的上升[18-19]。本实验中,真菌在泡菜发酵过程中数量持续增长(图2D),在贮藏过程中数量也有一定增加(表3),但60 g/L盐质量浓度泡菜中真菌数量有小幅度下降。Franco等[18]报道在酸黄瓜的腐败过程中,大肠菌群也是重要的腐败菌之一,腐败真菌生长引起的pH值上升和基质的还原为大肠菌群的生长提供了条件。本实验中,泡菜发酵后期(第9~12天)低pH值条件下,大肠菌群受到抑制,数量有所下降,但在贮藏过程中却大量生长,腐败后泡菜中大肠菌群的数量已超过了乳酸菌和真菌,这应该与真菌在腐败过程中改变泡菜基质条件有关。
pH值主要是来自原料在发酵过程中乳酸菌代谢乳酸和在腐败后腐败微生物消耗有机酸。氨基态氮主要来自于原料中蛋白质的水解和微生物的自溶[20]。在泡菜腐败过程中,pH值的升高的原因是腐败微生物利用泡菜中的乳酸、醋酸等有机酸以及残糖来代谢生长[18-19]。在本实验中,40 g/L和80 g/L盐质量浓度的泡菜腐败微生物生长较厉害,有机酸被大量利用,造成pH值上升,所以在腐败后40 g/L和80 g/L盐质量浓度泡菜的pH值较60 g/L盐质量浓度泡菜要高。在泡菜腐败的过程,氨基态氮的变化是原料中蛋白的水解和微生物的自溶。40 g/L和80 g/L盐质量浓度泡菜中的腐败微生物的大量快速生长,造成氨基态氮的破坏,所以氨基态氮的含量减少。
2.3四川泡菜正常发酵后与腐败后腐败细菌的分离与比较

表3 不同盐质量浓度泡菜正常发酵与腐败后优势微生物的挑选Table3 Dominant microorganisms in normal and spoiled pickles with different salt concentrations
将3 种盐质量浓度泡菜在发酵第12天和泡菜腐败后,分别取样稀释并涂布于NA、MRS、VRBA、虎红4 种琼脂培养基上并培养,分离培养数量较多的优势菌株进行分子生物学鉴定,菌株挑选数量与分布如表3所示,共挑选菌株168 株。图3、4分别为部分菌株的基因组和16S rDNA/18S rDNA琼脂糖凝胶电泳图。
图3 部分真菌(A)、细菌(B、C)基因组琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of genomic DNAs from fungi (A) and bacteria (B, C)
图4 部分菌株PCR扩增18S rDNA(A)、16S rDNA(B)琼脂糖凝胶电泳图Fig.4 Agarose gel electrophoresis of PCR-amplified products from 18S rDNA (A) and 16S rDNA (B)
PCR扩增的16S rDNA或18S rDNA片段经测序并BLAST分析及多重比对后,构建发育树。Devereux等[21]认为当16S rDNA的序列同源性≥97%时可以认为是一个属,同源性≥98%时则可以认为是同一个种。进行鉴定的168 株菌株分别属于16 个菌种,包括11 种细菌,分别是枯草芽孢杆菌(Bacillus subtilis,21 株)、地衣芽孢杆菌(Bacillus licheniformis,6 株)、甲级营养型芽孢杆菌(Bacillus methylotrophicus,4 株)、短小芽孢杆菌(Bacillus pumilus,5 株)、苏金云芽孢杆菌(Bacillus thuringiensis,5 株)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens,7 株)、戊糖乳杆菌(Lactobacillus pentosus,4 株)、植物乳杆菌(Lactobacillus plantarum,5 株)、路德肠杆菌(Enterobacter ludwigii,15 株)、阴沟肠杆菌(Enterobacter cloacae,19 株)和奇异变形杆菌(Proteus mirabilis,7 株);5 种真菌,分别是库德里阿兹威毕赤酵母(Pichia kudriavzevii,16 株)、白地霉(Galactomyces geotrichum,17 株)、塔克斯假丝酵母(Candida tanzawaensis,13 株)、热带念珠酵母(Candida tropicalis,10 株)和克鲁维毕赤酵母(Pichia kluyveri var. cephalocereana,14 株)。这些微生物在不同盐质量浓度泡菜正常发酵第12天和腐败后样品中的分布如图5、6所示。
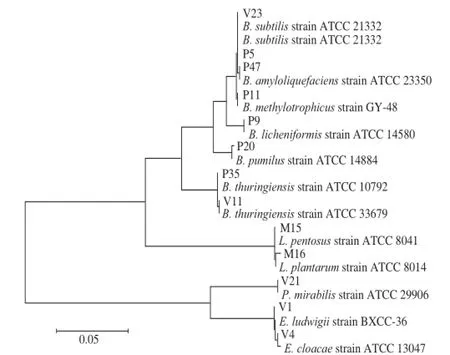
图5 基于16S rDNA构建的发酵第12天与腐败后不同盐质量浓度泡菜卤水中细菌的系统发育树Fig.5 Phylogenetic tree based on 16S rDNA sequences of strains from 12-day fermented and spoiled pickle brines with different salt concentrations
由图5可知,发酵后(第12天)的不同盐质量浓度泡菜中微生物以乳酸菌为主,主要为植物乳杆菌和戊糖乳杆菌,共占微生物总数的48%左右,这与Yan Pingmei等[22-24]的研究一致。中国泡菜发酵过程中的主要微生物包括植物乳杆菌(43.6%)、戊糖乳杆菌(19.1%)、短乳杆菌(11.0%)和肠系膜明串珠球菌(7.3%)等乳酸菌。在泡菜发生腐败后,不同盐质量浓度泡菜中乳酸菌数量下降明显,由发酵第12天的106CFU/mL下降至104CFU/mL。
由图5可知,在泡菜发酵(第12天)和泡菜腐败后,泡菜盐卤中均筛选出枯草芽孢杆菌,数量级基本都在105CFU/mL,说明不同盐质量浓度的泡菜在发酵前(第12天)和腐败后枯草芽孢杆菌的数量差别不大。在发酵后第12天的泡菜盐卤中,大肠菌群以路德肠杆菌、阴沟肠杆菌为主,但泡菜腐败后没有发现这两株菌株。虽然表2中,泡菜腐败后样品在VRBA上生长的微生物数量达到104CFU/mL,但却不是大肠菌群而主要是枯草芽孢杆菌。
地衣芽孢杆菌、甲级营养型芽孢杆菌、短小芽孢杆菌、苏金云芽孢杆菌、解淀粉芽孢杆菌、路德肠杆菌、阴沟肠杆菌和奇异变形杆菌在腐败泡菜中出现,这应该是随着pH值的升高,低pH值对腐败菌抑制解除的结果。例如Franco等[18]在对黄瓜的二次发酵研究中发现,随着酸黄瓜pH值的升高,阴沟肠杆菌等腐败微生物逐渐富集。
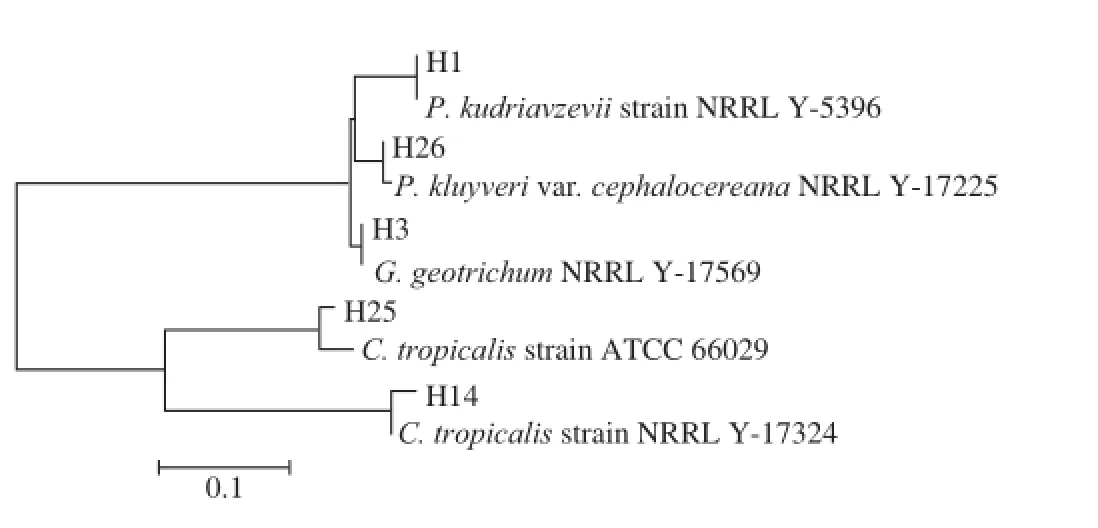
图6 部分基于18S rDNA构建的发酵第12天与腐败后不同盐质量浓度泡菜卤水中真菌系统发育树Fig.6 Phylogenetic tree based on 18S rDNA sequences of 12-day fermented and spoiled pickle brines with different salt concentrations
由图6可知,发酵后(第12天)的泡菜盐卤真菌以库德里阿兹威毕赤酵母、白地霉、塔克斯假丝酵母、热带念珠酵母和克鲁 维毕赤酵母为主。泡菜腐败时5 株真菌的数量有所增加,数量是发酵后(第12天)的1~3 倍。泡菜腐败时,40 g/L盐质量浓度泡菜盐卤以库德里阿兹威毕赤酵母、塔克斯假丝酵母和热带念珠酵母为主,60 g/L盐质量浓度泡菜盐卤以克鲁维毕赤酵母、热带念珠酵母以及塔克斯假丝酵母为主,80 g/L盐质量浓度泡菜盐卤以库德里阿兹威毕赤酵母、白地霉、塔克斯假丝酵母以及克鲁维毕赤酵母为主。有文献报道这5 株真菌均为腐败菌[7,11,25]。
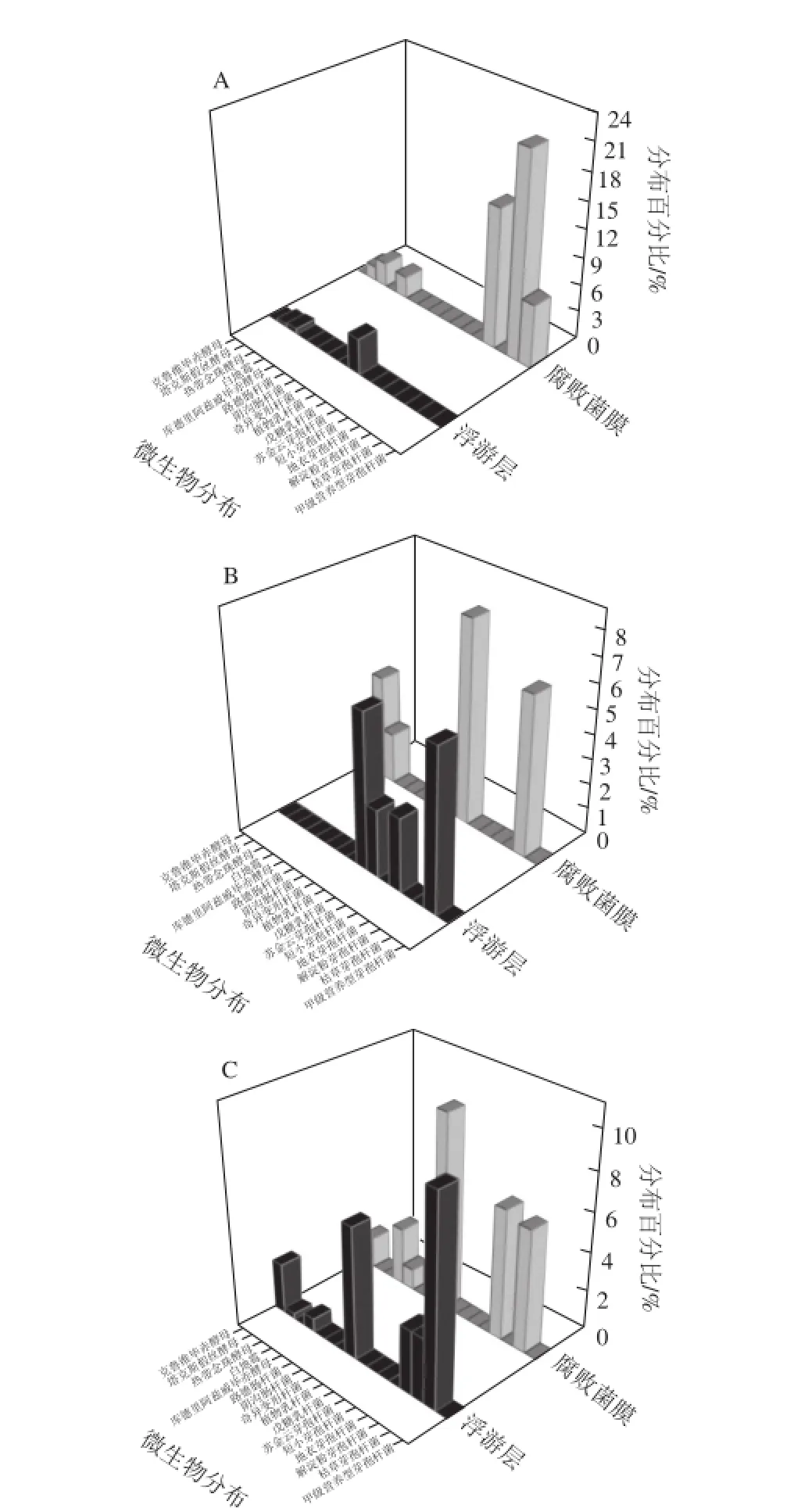
图7 不同盐质量浓度泡菜样品中细菌及真菌的分布Fig.7 Bacterial and fungal distribution in pickle brines with different salt concentrations
一般认为,腐败泡菜表面形成的膜醭(俗称生花)主要由真菌组成[3,7],但本实验中,泡菜腐败时盐卤所形成生物膜是由真菌和细菌共同组成(图7),且盐质量浓度越低,膜醭中细菌所占微生物总数的比例越高(图7A)。
3 结 论
在不同盐质量浓度四川泡菜的正常发酵过程中,以植物乳杆菌和戊糖乳杆菌为主要优势菌群。当泡菜发生腐败后,不同盐质量浓度泡菜中的腐败微生物都以芽孢杆菌和酵母为主,但不同盐质量浓度腐败泡菜盐卤中芽孢杆菌和酵母种类有所差异;腐败泡菜盐卤表层的膜醭是由细菌和真菌共同形成的。该研究结果为四川泡菜的腐败防控提供了理论参考。
[1] 田伟, 张琦, 邓珍珍, 等. 利用16S rRNA分析传统四川发酵泡菜中的细菌多样性[J]. 食品科学, 2013, 34(17): 215-218. doi: 10.7506/ spkx1002-6630-201317046.
[2] 林燕文, 黄君红, 黄建杏, 等. 泡菜营养强化食品的研制初探[J]. 食品科技, 2001, 26(2): 28-29.
[3] 罗冬英, 尹传武. 乳酸菌制剂对人体保健功效的机理探讨[J]. 鄂州大学学报, 2002(4): 53-54.
[4] CHOI S M, JEON Y S, RHEE S H, et al. Red pepper powder and kimichi reduce body weight and blood and tissue lipids in rats fed a high fat diet[J]. Nutraceuticals and Food, 2002, 7(2): 162-167.
[5] 蒋和体, 卢新军. 泡菜对大鼠血脂的调节作用研究[J]. 食品科学,2008, 29(1): 314-316.
[6] 钟少枢, 吴克刚, 柴向华, 等. 七种单离食用香料对食品腐败菌抑菌活性的研究[J]. 食品工业科技, 2009, 30(5): 68-71.
[7] 饶瑜, 常伟, 龚丽, 等. 四川泡菜生花酵母的分离与鉴定[J]. 食品与发酵科技, 2013, 49(3): 19-22.
[8] 余文华, 张蜀艳, 陈功, 等. 直投式功能菌对青菜盐渍发酵过程中各指标变化研究[J]. 食品与发酵科技, 2011, 47(6): 22-25.
[9] 杨瑞, 张伟, 徐小会. 泡菜发酵过程中主要化学成分变化规律的研究[J]. 食品工业科技, 2005, 26(2): 95-98.
[10] SUZANNE D J, FRANCO W, PEREZ-DIAZ I M, et al. Influence of Sodium chloride, pH, and lactic acid bacteria on anaerobic lactic acid utilization during fermented cucumber spoilage[J]. Food Microbiology,2012, 77(7): 394-404.
[11] 敖晓琳, 蔡义民, 夏姣, 等. 引起泡菜“生花”腐败微生物的分离鉴定[J]. 食品科学, 2013, 34(21): 95-98. doi: 10.7506/spkx1002-6630-201321042.
[12] 鄯晋晓. 四川泡菜菌系分离、筛选及发酵剂的研究[D]. 重庆: 西南大学, 2008: 5-9.
[13] 何玲, 李勤振. 浆水芹菜发酵过程中优势菌群的分离、鉴定及变化[J].食品科技, 2010, 35(5): 36-40.
[14] FRANCO W, PEREZ-DIAZ I M, JOHANNINGSMEIER S, et al. Characteristics of spoilage-associated secondary cucumber fermentation[J]. Applied and Environmental Microbiology, 2013,78(4): 1273-1284.
[15] XIONG Tao, GUAN Qiangqian, SONG Suhua, et al. Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentation[J]. Food Control, 2012, 26(1): 178-181.
[16] PLENGVIDHYA V, BREIDT F, LU Zhongjing, et al. DNA fingerprinting of lactic acid bacteria in sauerkraut fermentations[J]. Applied and Environmental Microbiology, 2007, 73(23): 7697-7702.
[17] YU Jie, GAO Wa, SUN Zhihong, et al. Identification and characterization of lactic acid bacteria isolated from traditional pickles in Sichuan, China[J]. Journal of General and Applied Microbiology,2012, 58(3): 163-172.
[18] FRANCO W, PEREZ-DIAZ I M. Role of selected oxidative yeasts and bacteria in cucumber secondary fermentation associated with spoilage of the fermented fruit[J]. Food Microbiology, 2012, 32(2): 338-344.
[19] FRANCO W, PEREZ-DIAZ I M. Development of a model system for the study of spoilage associated secondary cucumber fermentation during long-term storage[J]. Journal of Food Science, 2012, 77(10):586-592.
[20] 李由. 提高郫县豆瓣氨基碳氮含量关键技术的研究[D]. 成都: 西华大学, 2010: 3-4.
[21] DEVEREUX R, HE S H, DOYLE C L, et al. Diversity and origin of Desulfovibrio species: phylogenetic definition of a family[J]. Journal of Bacteriology, 1990, 172(7): 3609-3619.
[22] YAN Pingmei, XUE Wentong, TAN S S, et al. Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J]. Food Control, 2008, 19(1): 50-55.
[23] OH C K, OH M C, KIM S H. The depletion of sodium nitrite by lactic acid bacteria isolated from kimchi[J]. Journal of Medicinal Food,2004, 7(1): 38-44.
[24] OH M C, OH C K, KIM S H. Depletion of nitrite by lactic acid bacteria isolated from commercial kimchi[J]. Journal of the Korean Society of Food Science and Nutrition, 2009, 38(7): 892-901.
[25] MOON S H, CHANG Mi, KIM H Y. Pichia kudriavzevii is the major yeast involved in film-formation, off-odor production, and texturesoftening in over-ripened kimchi[J]. Food Science and Biotechnology,2014, 23(2): 489-497.
Comparative Analysis of Microflora Profile in Spoilage Sichuan Pickles with Different Salt Concentrations before and after Spoilage
WANG Meng1, JIANG Yunlu1, YANG Jiantao1, CHANG Wei2, CHE Zhenming1, CHEN Gong3, RAO Yu1,*
(1. College of Bioengineering, Xihua University, Chengdu 610039, China; 2. Institute of Salmon, Tongwei Group Co. Ltd.,Dujiangyan 611800, China; 3. Sichuan Academy of Food and Fermentation Industries, Wenjiang 611130, China)
The microbial population, diversity and dynamics of Sichuan pickles with different salt concentrations were assessed. Using different selective media, 168 microbes were isolated from pickle brines with three different salt concentrations and identified by 16S rDNA or 18S rDNA analysis. The results showed the lactic acid bacteria Lactobacillus plantarum and Lactobacillus pentosus dominated the normal process of Sichuan pickle fermentation. When Sichuan pickle was deteriorated, Bacillus and yeast especially Bacillus subtilis and Candida tanzawaensis were the dominant flora in the pickle samples. Furthermore, Bacillus methylotrophicus, Bacillus licheniformis, Pichia kudriavzevii and Candida tropicalis were isolated from pickle brine with 40 g/L salt. Bacillus pumilus, Pichia kluyveri var. cephalocereana and Candida tropicalis were the most abundant isolates from pickle brine with 60 g/L salt. The major representatives of spoilage-causing microbes involved in pickle brine with 80 g/L salt were Proteus mirabilis, Bacillus amyloliquefaciens, Galactomyces geotrichum, Bacillus licheniformis, Pichia kudriavzevii and Pichia kluyveri var. cephalocereana. The biofilms formed on the surface of spoiled pickle brines consisted of bacteria and fungi. When the salt concentration was higher in the pickle brine,the more proportion of bacteria existed in the biofilm.
Sichuan pickles; salt concentration; normal fermentation; spoilage; dominant flora
TS201.3
A
1002-6630(2015)13-0184-06
10.7506/spkx1002-6630-201513034
2014-09-15
四川省教育厅科研重点项目(13ZA0026);西华大学开放基金项目(szjj2013-047);西华大学“西华杯”大学生科技创新项目(2014134);西华大学研究生创新基金项目(ycjj2014105)
王猛(1988—),男,硕士,研究方向为食品工程。E-mail:164651862@qq.com
饶瑜(1982—),女,副教授,博士,研究方向为食品微生物。E-mail:ryfish@163.com
