副溶血性弧菌整合接合元件核心基因表达对温度变化的响应
2015-10-29朱春花李云霞陈兰明
朱春花,李云霞,陈兰明*
(上海海洋大学食品学院,上 海 201306)
副溶血性弧菌整合接合元件核心基因表达对温度变化的响应
朱春花,李云霞,陈兰明*
(上海海洋大学食品学院,上 海 201306)
采用实时荧光定量聚合酶 链式反应方法分析在15~42 ℃温度范围内副溶血性弧菌(Vibrio paraha emolyticus)CHN25整合接合元件(integrative and conjugative elements,ICEs)ICEVpaChn1核心基因表达对温度变化的响应。结果表明:温度介导ICEVpaChn1元件保守模块核心基因表达发生显著变化,其中,编码进入排斥蛋白Eex(entry exclusion)的基因对温度变化最为敏感,低于或高于37 ℃的温度条件均强烈抑制eex基因表达(>10 倍)。此外,在15~37 ℃范围内,温度的升高显著激活编码整合酶Int(integrase)、接合转移蛋白TraI(transfer protein I)和TraG、DNA修复蛋白RumA基因的表达,且在37 ℃达到最大值;与其他检测基因明显不同,温度升高抑制转录抑制子SetR基因的表达,促进int等基因转录激活子SetC和SetD的积累,进而刺激切离,促进ICEVpaChn1元件的接合转移。实验结果揭示了环境温度对ICEs元件核心基因表达的影响,发现低温(<15 ℃)和高温(>37 ℃)条件均可能阻遏ICEVpaChn1元件及其携带基因信息在不同种属细菌间的接合转移。
副溶血性弧菌;整合接合元件;实时荧光定量聚合酶链式反应;基因表达
整合接合元件(integrative and conjugative elements,ICEs)是一类具有自主转移活性的可移动遗传性元件,携带大量基因信息,介导遗传物质的横向(水平)基因转移(lateral/horizontal gene transfer,LGT/HGT),在细菌基因组进化和生物多样性形成中发挥重要作用[1]。SXT/R391家族ICEs于1992年从印度分离的霍乱弧菌临床分离菌株(Vibrio cholerae O139)中最初被发现[2],携带氯霉素、链霉素、新诺明和甲氧氨苄嘧啶抗性基因[3]。迄今为止,已在弧菌属(Vibrio)[4-6]、变形菌属(Proteus)[7-8]、葡萄球属(Staphylococcus)[9-10]、链球菌属(Streptococcus)[11-12]等革兰氏阴性(G-)和革兰氏阳性(G+)细菌中发现了该家族ICEs元件,它们均含有3 个高度保守的功能模块(modules),包括整合与切离(integration and excision)、接合(conj ugation)和调控(regulation)模块[13]。
近年来,有研究报道显示,不同的环境应激压力影响大肠杆菌(Escherichia coli)、嗜热链球菌(Streptococcus thermophilus)和枯草芽孢杆菌(Bacillus subtilis)携带的ICEs元件的切离转移,例如紫外照射[14]、丝裂霉素C处理[15]、异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG)诱导RapI(regulator aspartate phosphatase I)蛋白过量表达[16]等。本实验运用实时荧光定量聚合酶链式反应(real-ti me polymerase chain reaction,real-time PCR)方法分析副溶血性弧菌CHN25携带的整合接合元件ICEVpaChn1[17]保守功能模块核心基因对温度变化的响应,包括接合转移相关蛋白基因traI(transfer protein I)和traG、整合酶基因int(integrase)、整合接合调控蛋白基因setR、进入排斥相关蛋白基因eex(entry ex clusion)和DNA修复蛋白基因rumA,以探索ICEs元件的环境应激反应机制。
1 材料与方法
1.1菌株与试剂
副溶血性弧菌CHN25菌株由上海海洋大学食品学院陈兰明教授实验室分离、鉴定和保存[17]。
FastStart Universal SYBR Green Master 瑞士Roche公司;Trizol试剂 生工生物工程(上海)股份有限公司;PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real time) 日本TaKaRa公司;LB(Luria-Bertani)培养基 北京陆桥技术有限责任公司。
1.2仪器与设备
小型高速冷冻离心机 德国Eppendorf公司;实时荧光定量PCR仪 美国Applied Biosystems公司;BioTek Synergy™ 2多模块微板读数仪 美国BioTek公司;电泳仪、凝胶成像系统 美国Bio-Rad公司。
1.3副溶血性弧菌总RNA提取和cDNA合成
挑取在LB琼脂平板(pH 8.0~8.5、3% NaCl)上生长良好的副溶血性弧菌单菌落接种于5 mL LB液体培养基中,分别于15、20、25、30、37、42 ℃条件下180 r/min振荡培养。采用多模块微板读数仪测定副溶血性弧菌的生长曲线。分别收集不同培养温度条件下对数生长中期的菌液1 mL,4 ℃、12 000×g离心5 min,弃上清液,收集菌体沉淀。根据Trizol试剂盒说明书的操作步骤,提取菌体总RNA,置于-80 ℃保存备用。采用PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real time)试剂盒去除RNA样品中的基因组DNA并进行反转录反应,合成cDNA。
1.4ICEs保守模块核心基因的引物设计与合成
采用Primer 5软件(http://www.PremierBiosoft.com),基于霍乱弧菌SXT元件DNA序列(GenBank登录号:AY055428.1)设计int、setR、traI、eex和rumA基因的引物,traG基因的引物序列设计参考Song Yuze等[17]的研究。寡核苷酸引物(表1)由生工生物工程(上海)股份有限公司合成。

表1 寡核苷酸引物碱基序列Table1 Oligonucleotide primers used in this study
1.5Real-time PCR反应体系及其优化
Real-time PCR反应总体系为20 μL,包括10 μL SYBR Green、1.5 μL上游/下游引物、2 μL cDNA、5 μL无菌水。反应条件为95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,40 次循环。利用实时荧光定量PCR仪完成Real-time PCR反应。
根据赵玉华等[18]的报道,分别对Real-time PCR反应体系中的引物浓度和cDNA模板量进行优化,其中上游和下游引物终浓度分别设计为0.4、0.6、0.8 μmol/L,模板量分别设计为每20 μL体系添加1 000、200、20、2、0.2 ng。选择pvuA和pvsA基因作为Real-time PCR反应的内参基因[19]。
1.6熔解曲线分析
鉴于SYBR Green可以结合所有双链DNA,因此引物二聚体、单链二级结构及错误扩增产物的出现均会增加荧光值,进而影响Real-time PCR反应中基因表达量检测的准确性。通过熔解曲线(melting curves)分析产物的均一性,有助于提高SYBR Green法获得检测结果的准确性[20]。熔解曲线的设置在整个Real-time PCR反应完成后进行,当温度从60 ℃升至95 ℃,实时荧光定量PCR仪以0.5 ℃/s的速率自动收集荧光信号,随着温度的升高,双链DNA解链,荧光信号不断降低,且在退火温度时下降速率最快,用荧光信号值改变的一次导数的相反数与温度作图,即得到相应的熔解曲线。
2 结果与分析
2.1不同培养温度条件下副溶血性弧菌CHN25细胞总RNA的制备
收集副溶血性弧菌CHN25在15、20、25、30、37、42 ℃培养温度下生长至对数生长中期的细胞,采用Trizol法分别提取菌体总RNA,取2 μL RNA样品进行1%琼脂糖凝胶电泳检测,电泳图谱显示有3 条RNA条带,分别对应于23S rRNA、16S rRNA和5S rRNA(图1)。其中,23S rRNA和16S rRNA条带明亮清晰,23S rRNA条带的亮度约为16S rRNA条带的2 倍,表明本研究制备的总RNA样品完整性好、无降解(图1)。利用多模块微板读数仪测定总RNA样品的浓度,结果显示均高于800 ng/μL,OD260nm/OD280nm值约为2.0,表明提取的总RNA质量较高,符合Real-time PCR反应要求。

图1 不同培养温度下副溶血性弧菌CHN25总RNA琼脂糖凝胶电泳检测结果Fig.1 Agarose gel electrophoresis analysis of total RNA isolated from V. parahaemolyticus CHN25 incubated at different temperatures
2.2Real-time PCR反应条件的优化
采用终浓度为0.4、0.6、0.8 μmol/L的引物进行Real-time PCR反应,结果表明,扩增产物无明显差异(文中未给出相应图片结果)。为避免检测中因引物添加量过少或过多而影响扩增效果,故选取Real-time PCR反应引物终浓度为0.6 μmol/L。此外,在20 μL反应体系中添加1 000、200、20、2、0.2 ng的cDNA模板进行Real-time PCR反应,结果显示,当模板添加量为20 ng时,扩增效率较高,因此,将待测样品的RNA质量浓度均稀释为200 ng/μL。
2.3ICEs保守模块核心基因的Real-time PCR扩增
基于2.2节得到优化的Real-time PCR反应条件,本研究对15~42 ℃培养条件下的副溶血性弧菌CHN25携带的ICEVpaChn1元件核心基因traI、traG、int、setR、eex和rumA分别进行了Real-time PCR扩增(引物见表1)。如图2所示,ICEVpaChn1元件各核心基因的扩增曲线无非特异性产物的扩增,扩增曲线呈现明显的“S”型,且具有较好的重复性,实验结果具有较高的可靠性和稳定性,可用作下一步分析。

图2 不同培养温度下ICEVV ppaaChn1元件核心基因Real-ttiimmee PCR扩增曲线Fig.2 Amplification plots of real time PCR products derived from ICEVpaChn1 of V. parahaemolyticus CHN25 grown at different temperatures
2.4熔解曲线分析
采用优化的Real-time PCR反应体系,获得在15~42 ℃培养温度下,获得ICEVpaChn1保守模块各核心基因rumA、int、eex、setR、traG和traI的熔解曲线。如图3所示,除空白对照,各核心基因熔解曲线均为单峰型,表明Real-time PCR扩增特异性良好,无明显的引物二聚体和错误扩增产物的出现,该实验结果可作为下一步分析的依据。

图3 副溶血性弧菌CHN25在不同培养温度下VICpEaChn1元件核心基因Real-time PCR熔解曲线Fig.3 Melting curves of real-time PCR with core genes of ICEVpaChn1 in V. parahaemolyticus CHN25 grown at different temperatures
2.5ICEs保守模块核心基因的Real-time PCR分析
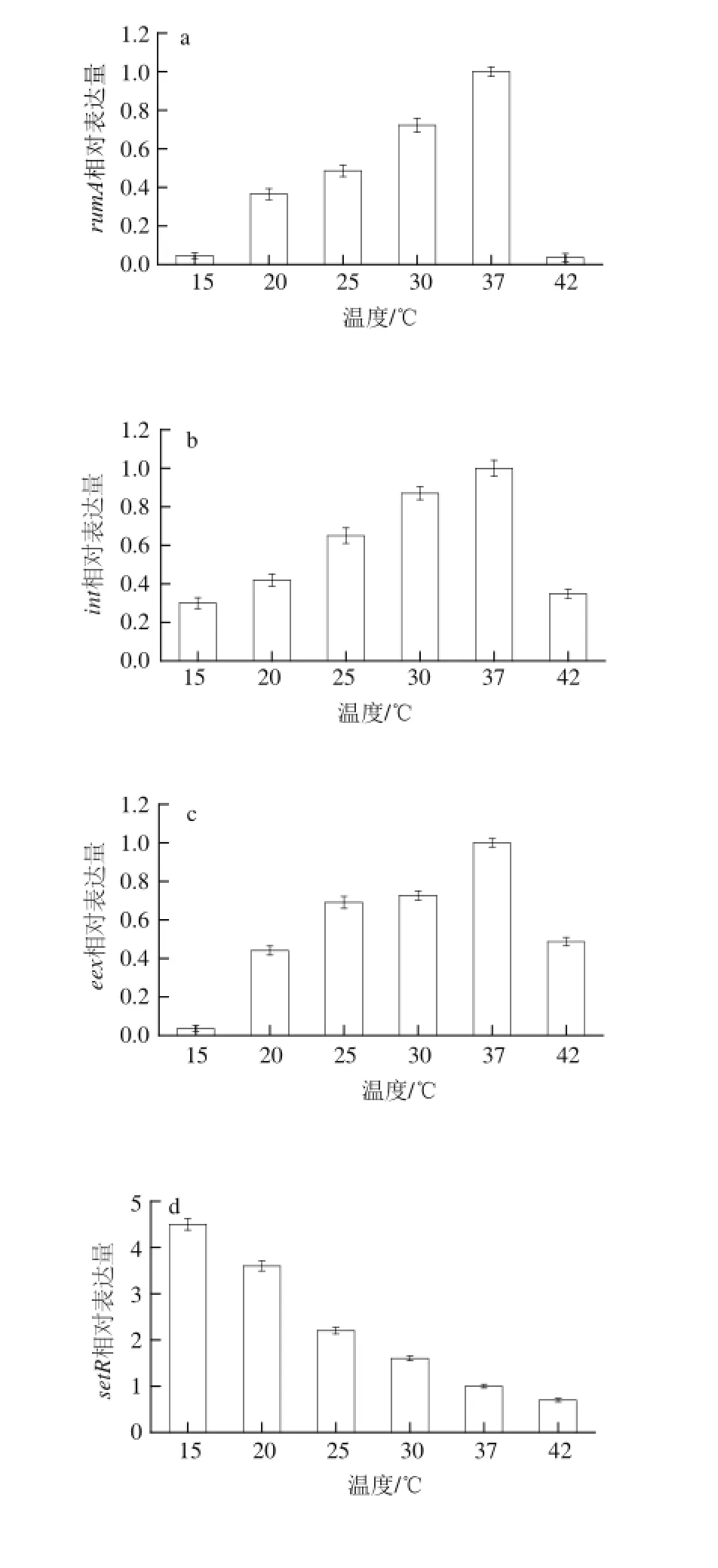

图4 副溶血性弧菌CHN25在不同培养温度下ICEVV ppaaChn1元件核心基因表达量Fig.4 Expression of core genes of ICEVpaChn1 in V. parahaemolyticus CHN25 grown at different temperatures
基于上述优化的反应条件,运用Real-time PCR技术检测副溶血性弧菌CHN25在不同培养温度下ICEVpaChn1元件保守模块核心基因的表达量,结果如图4所示。鉴于副溶血性弧菌最适生长温度为37 ℃,故数据分析时将该条件下的基因表达量设为1(作为对照)。结果显示,副溶血性弧菌在37 ℃条件下,ICEVpaChn1元件的int和traI基因的表达水平均达到最大值,而处于<15 ℃和>42 ℃培养条件下则被强烈抑制。int基因编码整合与切离模块必需的整合酶,而traI基因编码的单链释放因子,在接合转移模块接合转移初期催化SXT元件断裂形成单链DNA[21]。本研究结果表明,在15~37 ℃条件下,温度的升高很可能促进ICEVpaChn1元件接合转移。SXT/R391家族的进入排斥系统能够特异性阻止同一类型基因元件在细菌间重复传递[1]。研究发现,虽然SXT和R391拥有几乎相同的接合转移基因,但它们之间并不相互排斥,这归因于eex和traG基因编码的介导R/S进入排斥系统的蛋白Eex和TraG[22]。在副溶血性弧菌CHN25中,Eex和TraG介导ICEVpaChn1元件的R型进入排斥系统,eex基因表达水平在低于或高于37 ℃条件下均显著下降10 倍以上,而在20~37 ℃条件下,traG基因表达水平仅少许被抑制(<2.5 倍),表明表达于供体菌中的Eex对温度变化的响应更为敏感,推测有利于ICEs的进入,相关分子机制有待于进一步的研究。rumA和rumB基因与大肠杆菌(Escherichia coli)的umuDC基因在系统发育上具有同源性,在损伤或诱变所致的突变DNA修复中发挥作用[23]。研究表明,一些ICEs的rumAB基因簇还是抗菌素抗性基因的插入热点[24]。可是,Song Yuze等[17]研究发现ICEVpaChn1元件rumAB基因簇完整,其间并无插入序列。本研究结果显示,<25 ℃或>42 ℃的温度条件显著抑制rumA基因的表达,提示不利的生长温度并未启动rumA的DNA损伤修复功能,推测它在ICEVpaChn1中可能有未知的生物学功能。此外,setR基因编码的转录抑制子SetR能够抑制int等基因转录激活子setC和setD的表达,从而抑制接合转移过程,使SXT在细菌内呈现不活化状态[24]。本研究结果显示,与其他检测基因明显不同,setR基因表达随温度的升高而降低,从而激活setC和setD基因以启动int和tra基因的表达,刺激切离,促进ICEVpaChn1元件在不同宿主菌间水平横向传播[14,25]。
3 结 论
获得高质量的RNA是应用Real-time PCR方法检测不同培养温度下ICEVpaChn1元件核心基因表达的关键之一,本研究通过预实验并结合该菌株自身特性,采用Trizol法提取菌体总RNA并获得了完整、无明显降解的RNA样品。另外,运用SYBR Green法进行Real-time PCR反应,荧光染料SYBR Green与双链DNA微槽结合后,其荧光强度增加100 倍,有效地提高了检测的灵敏度。同时,所需设计的引物较简单,成本较低。此外,为了精确测定ICEVpaChn1元件核心基因的表达量,本研究对Real-time PCR反应体系的引物浓度和cDNA模板添加量分别进行了优化,确定了最佳反应体系;每组Real-time PCR反应均设置空白对照,避免假阳性结果;并根据Real-time PCR反应获得的熔解曲线进行反应体系特异性评定。
基于优化的Real-time PCR反应体系,本实验研究了不同温度对ICEs保守模块核心基因表达的影响,结果表明,低于或高于37℃的温度应激条件很可能阻遏ICEVpaChn1元件及其携带基因信息在不同种属细菌间的接合转移,为进一步探讨可移动遗传元件的环境应激反应机制奠定了基础。
[1] WOZNIAK R A, WALDOR M K. Integrative and conjugative elements: mosaic mobile genetic elements enabling dynamic lateral gene flow[J]. Nature Reviews Microbiology, 2010, 8(8): 552-563.
[2] WALDOR M K, TSCHAPE H, MEKALANOS J J. A new type of conjugative transposon encodes resistance to sulfamethoxazole,trimethoprim, and streptomycin in Vibrio cholerae O139[J]. Journal of Bacteriology, 1996, 178(14): 4157-4165.
[3] HOCHHUT B, LOTFI Y, MAZEL D, et al. Molecular analysis of antibiotic resistance gene clusters in Vibrio cholerae O139 and O1 SXT constins[J]. Antimicrobial Agents and Chemotherapy, 2001,45(11): 2991-3000.
[4] SPAGNOLETTI M, CECCARELLI D, RIEUX A, et al. Acquisition and evolution of SXT-R391 integrative conjugative elements in the seventh-pandemic Vibrio cholerae lineage[J]. mBio, 2014, 5(4):e01356-14. doi: 10.1128/mBio.01356-14.
[5] RODRIGUEZ-BLANCO A, LEMOS M L, OSORIO C R. Integrating conjugative elements as vectors of antibiotic, mercury, and quaternary ammonium compound resistance in marine aquaculture environments[J]. Antimicrobial Agents and Chemotherapy, 2012,56(5): 2619-2626.
[6] TAVIANI E, CECCARELLI D, LAZARO N, et al. Environmental Vibrio spp., isolated in Mozambique, contain a polymorphic group of integrative conjugative elements and class 1 integrons[J]. FEMS Microbiology Ecology, 2008, 64(1): 45-54.
[7] DACCORD A, MURSELL M, POULIN-LAPRADE D, et al. Dynamics of the SetCD-regulated integration and excision of genomic islands mobilized by integrating conjugative elements of the SXT/ R391 family[J]. Journal of Bacteriology, 2012, 194(21): 5794-5802.
[8] MATA C, NAVARRO F, MIRO E, et al. Prevalence of SXT/R391-like integrative and conjugative elements carrying blaCMY-2 in Proteus mirabilis[J]. The Journal of Antimicrobial Chemotherapy,2011, 66(10): 2266-2270.
[9] SCHIJFFELEN M J, BOEL C H, VAN STRIJP J A, et al. Whole genome analysis of a livestock-associated methicillin-resistant Staphylococcus aureus ST398 isolate from a case of human endocarditis[J]. BMC Genomics, 2010, 11: 376. doi: 10.1186/1471-2164-11-376.
[10] de VRIES L E, CHRISTENSEN H, SKOV R L, et al. Diversity of the tetracycline resistance gene tet(M) and identification of Tn916- and Tn5801-like (Tn6014) transposons in Staphylococcus aureus from humans and animals[J]. The Journal of Antimicrobial Chemotherapy,2009, 64(3): 490-500.
[11] CHUZEVILLE S, PUYMEGE A, MADEC J Y, et al. Characterization of a new CAMP factor carried by an integrative and conjugative element in Streptococcus agalactiae and spreading in Streptococci[J]. PLoS ONE, 2012, 7(11): e48918. doi: 10.1371/journal.pone.0048918.
[12] MINGOIA M, TILI E, MANSO E, et al. Heterogeneity of Tn5253-like composite elements in clinical Streptococcus pneumoniae isolates[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(4): 1453-1459.
[13] BI D, XU Z, HARRISON EM, et al. ICEberg: a web-based resource for integrative and conjugative elements found in bacteria[J]. Nucleic Acids Research, 2012, 40: D621-D626.
[14] ARMSHAW P, PEMBROKE J T. Control of expression of the ICE R391 encoded UV-inducible cell-sensitising function[J]. BMC Microbiology, 2013, 13: 195. doi: 10.1186/1471-2180-13-195.
[15] CARRARO N, LIBANTE V, MOREL C, et al. Differential regulation of two closely related integrative and conjugative elements from Streptococcus thermophilus[J]. BMC Microbiology, 2011, 11: 238.doi: 10.1186/1471-2180-11-238.
[16] AUCHTUNG J M, LEE C A, MONSON R E, et al. Regulation of a Bacillus subtilis mobile genetic element by intercellular signaling and the global DNA damage response[J]. Proceedings of the National Academy of the Sciences of the United States of America, 2005,102(35): 12554-12559.
[17] SONG Yuze, YU Pan, LI Bailin, et al. The mosaic accessory gene structures of the SXT/R391-like integrative and conjugative elements derived from Vibrio spp. isolated from aquatic products and environment in the Yangtze River Estuary, China[J]. BMC Microbiology, 2013, 13: 214. doi: 10.1186/1471-2180-13-214.
[18] 赵玉华, 王加启. 利用实时定量PCR对瘤胃甲酸甲烷杆菌定量方法的建立与应用[J]. 中国农业科学, 2006, 39(1): 161-169.
[19] COUTARD F, LOZACH S, POMMEPUY M, et al. Real-time reverse transcription-PCR for transcriptional expression analysis of virulence and housekeeping genes in viable but nonculturable Vibrio parahaemolyticus after recovery of culturability[J]. Applied and Environmental Microbiology, 2007, 73(16): 5183-5189.
[20] LIN C Z, RASKIN L, DA S. Mirobial community soucture in gastrointestinai tracts of domestic animais: comparative analyses using rRNA-targeted oligonucleotide probes[J]. FEMS Microbiology Ecology, 1997, 22: 281-294.
[21] BURRUS V, MARRERO J, WALDOR M K. The current ICE age: biology and evolution of SXT-related integrating conjugative elements[J]. Plasmid, 2006, 55(3): 173-183.
[22] MARRERO J, WALDOR M K. Determinants of entry exclusion within Eex and TraG are cytoplasmic[J]. Journal of Bacteriology,2007, 189(17): 6469-6473.
[23] KULAEVA O I, WOOTTON J C, LEVINE A S, et al. Characterization of the umu-complementing operon from R391[J]. Journal of Bacteriology, 1995, 177(10): 2737-2743.
[24] BEABER J W, HOCHHUT B, WALDOR M K. Genomic and functional analyses of SXT, an integrating antibiotic resistance gene transfer element derived from Vibrio cholerae[J]. Journal of Bacteriology, 2002, 184(15): 4259-4269.
[25] BEABER J W, WALDOR M K. Identification of operators and promoters that control SXT conjugative transfer[J]. Journal of Bacteriology, 2004, 186(17): 5945-5949.
Effect of Temperature on the Expression of Core Genes of Integrative and Conjugative Elements in Vibrio parahaemolyticus
ZHU Chunhua, LI Yunxia, CHEN Lanming*
(College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
In this study, for the first time, we investigated the effect of temperature (15-42 ℃) on the expression of core genes of the integrative and conjugative element (ICE, ICEVpaChn1) in Vibrio parahaemolyticus CHN25 using real time polymerase chain reaction (real-time PCR). The results revealed distinct expression patterns of the tested genes. The eex gene involved in the entry exclusion system was strongly inhibited by m ore than 10 folds when the bacterium was incubated at the temperatures below or above 37 ℃. Along with increasi ng temperature in the range of 15-37 ℃, the expression of int, traI, rumA, and traG genes was enhanced, and reached the highest level at 37 ℃ as the optimal growth temperature for V. parahaemolyticus CHN25. In contrast, increasing temperature could significantly repress the expression of the gene encoding a repress or protein SetR that can stimulate the activators of the int gene (SetC and SetD) and promote the conjugation and transfer of ICEVpaChn1. In addition, self-transmissible activity of the ICE was likely inhibited when the bacterium was grown at temperatures lower than 15 ℃ or above 37 ℃. The results of this study will facilitate better understanding of the molecular mechanism underlying the effects of environment stresses on the conjugative transfer of ICEs.
Vibr io parahaemolyticus; integrative and conjugative elements; real-time polymerase chain reaction; gene expression
Q933
A
1002-6630(2015)13-0101-06
10.7506/spkx1002-6630-201513020
2015-02-11
国家自然科学基金面上项目(31271830)
朱春花(1990—),女,硕士,研究方向为食品质量与安全。E-mail:m120250549@st.shou.edu.cn
陈兰明(1965—),女,教授,博士,研究方向为食品安全与质量控制。E-mail:lmchen@shou.edu.cn
