长爪沙鼠淋巴细胞脉络丛脑膜炎病毒抗体ELISA检测方法的建立与应用
2015-10-15李晓波王淑菁冯育芳岳秉飞贺争鸣
王 吉, 卫 礼, 付 瑞, 李晓波, 王淑菁, 邢 进, 冯育芳, 巩 薇, 岳秉飞, 贺争鸣
(中国食品药品检定研究院实验动物资源研究所、国家实验动物微生物、遗传检测中心, 北京 100050)
长爪沙鼠淋巴细胞脉络丛脑膜炎病毒抗体ELISA检测方法的建立与应用
王吉, 卫礼, 付瑞, 李晓波, 王淑菁, 邢进, 冯育芳, 巩薇, 岳秉飞, 贺争鸣
(中国食品药品检定研究院实验动物资源研究所、国家实验动物微生物、遗传检测中心, 北京 100050)
目的 建立长爪沙鼠淋巴细胞脉络丛脑膜炎病毒(LCMV)抗体ELISA检测方法, 应用于长爪沙鼠携带LCMV的检测。方法 培养Vero细胞,接种LCMV毒种,制备Vero正常抗原和LCMV特异抗原,滴定酶结合物、正常抗原及特异抗原最佳工作浓度,并进行方法的特异度、灵敏度、精密性、稳定性实验。结果 正常抗原、特异抗原和酶结合物最佳工作浓度分别为0.4 μg/mL、10 μg/mL和1∶5 000; 正常抗原、特异抗原批内变异系数分别为6.8%和8.9%,批间平均变异系数分别为9.3%和8.4%; 检测灵敏度达到1∶1 280; 与小鼠仙台病毒(SV)、小鼠呼肠孤病毒3型(Reo3)均无交叉反应。稳定性试验相对偏差小于25%。结论 建立的ELISA方法特异度、灵敏度强,重复性、稳定性好,可用于长爪沙鼠LCMV抗体的检测。
淋巴细胞脉络丛脑膜炎病毒(LCMV); ELISA; 长爪沙鼠
长爪沙鼠又称蒙古沙鼠(Meriones unguiculatus;Mongolian gerbil),分类学上属于啮齿目、仓鼠科、沙鼠亚科、沙鼠属,产于我国内蒙、河北、山西、甘肃等地,是一种正在开发、有着广阔应用前景的多功能实验动物[1-5]。国内外大量研究资料表明,长爪沙鼠具有多方面独特的生物学特性,已被广泛应用于医学、生物学、行为学等生物学领域[1-5],而且由于长爪沙鼠的乳鼠对流行性出血热病毒的易感性,一直用作流行性出血热疫苗的研究及生产[2,4,5]。应贤平等[6]和段明丽等[7]经实验证实屏障系统长爪沙鼠、开放饲养的长爪沙鼠和野生长爪沙鼠对淋巴细胞脉络丛脑膜炎病毒均易感。
淋巴细胞脉络丛脑膜炎病毒(LCMV)属于沙粒病毒科(Arenaviridae),沙粒病毒属(Arenavirus)。是一种由鼠类携带的人兽共患病毒,自然储存宿主主要有小鼠和地鼠[8-11]。大鼠、豚鼠、仓鼠、犬、猴、鸡、马、兔和棉鼠均易感[8]。LCMV在全球分布广泛,在北美、南美、亚洲和欧洲均有流行的报道。我国也有LCMV感染人和鼠的报道[8]。动物感染临床主要表现精神呆滞、嗜睡、被毛粗乱、弓背、消瘦、生长缓慢、惊厥和结膜炎等症状,严重影响实验和生产,而且会给饲养人员和实验人员带来潜在感染的危险[8,12-14]。人类主要由于接触携带病毒的鼠类排泄物而引起感染,临床主要表现流感样症状和脑膜炎,严重者会留下神经后遗症甚至死亡[8,12-14]。
本文旨在建立长爪沙鼠淋巴细胞脉络丛脑膜炎病毒抗体ELISA方法,为保证长爪沙鼠的安全使用及标准化研究提供检测技术手段。
1 材料与方法
1.1主要材料
LCMV毒种、Vero细胞: 本室冻存; 兔抗沙鼠IgG-HRP: GeneTex公司产品; 长爪沙鼠LCMV、仙台病毒(SV)、呼肠孤病毒3型(Reo3)、小鼠肝炎病毒(MHV)、小鼠脑脊髓炎病毒(TMEV)标准阴、阳对照血清:浙江省实验动物质量检测中心提供;63 只开放环境饲养的长爪沙鼠,20只经净化屏障系统饲养的长爪沙鼠,均来源于首都医科大学实验动物科学部[SCXK(京)2013-0006]; 22只开放环境饲养的长爪沙鼠,来源于浙江省实验动物中心[SCXK(浙)2014-0001]。所有实验用的动物均按3R原则给予人道关怀。
1.2主要仪器
酶标仪: ThermoMULTISKAN MK3; 37 ℃水浴箱: 上海森信实验仪器有限公司 DK-4500B型; 37 ℃培养箱: WGP-600。
1.3方法
1.3.1病毒感染力滴度(TCID50)测定将LCMV病毒液以10-1~10-11作系列倍比稀释,依次加入培养有Vero细胞的96孔细胞培养板(costor)(1~11列), 每个稀释度接种1列(8孔), 第12列不加病毒, 作为细胞对照。置37 ℃培养观察10 d, 记录结果[5,15-17]。
1.3.2抗原的制备及纯化正常抗原: Vero细胞长满单层, 常规消化, 用PBS洗涤, 4 ℃ 1 000 r/min离心10 min, 将离心沉淀溶于适量PBS 冻融3次后,超声破碎,4 ℃ 10 000 r/min离心30 min, 取上清,测定蛋白含量[5,15-17]。
特异抗原: 收获LCMV细胞毒于4 ℃, 10 000 r/min离心1 h, 取上清于4 ℃, 40 000 r/min离心3 h, 收集沉淀于适量PBS中[5,15-17]。再经质量分数20%蔗糖离心后, 用紫外分光光度法测定抗原蛋白含量[5,15-17]。
1.3.3判断标准的确定依据国标选择D490来读取吸光度。在阴、阳对照血清成立的情况下,待检血清特异抗原孔D值≥0.2、待检血清特异抗原孔D值/阴性对照特异抗原孔D值≥2.1, 判为阳性。否则判为阴性。待检血清处于临界值(D值=0.2± 0.01,D值变化率≤5%),同时待检血清特异抗原孔D值/阴性对照特异抗原孔D值≥2.1时,需要复检。复检结果与初检结果一致,则按初检结果进行判定;复检结果与初检结果不一致,则需要二次复检,二次复检结果符合阳性结果判定标准,则结果判为阳性,二次复检结果符合阴性结果判定标准,则结果判为阴性[18]。
1.3.4正常抗原与特异抗原、酶结合物最佳工作浓度的确定将阴、阳对照血清和待检血清1∶40稀释[5,15-18]。正常抗原分别以0.05 μg/mL、0.1 μg/mL、 0.2 μg/mL、0.4 μg/mL进行包被,特异抗原分别以5 μg/mL、10 μg/mL、20 μg/mL进行包被,羊抗沙鼠IgG-HRP以1∶5 000~1∶64 000倍比稀释,采用方阵滴定法确定正常抗原、特异抗原和酶结合物最佳工作[5,15-17]。
1.3.5特异度试验用已建立的ELISA法分别检测沙鼠SV、Reo3、MHV、TMEV阴性血清和阳性血清,同时设沙鼠LCMV标准阴性血清和阳性血清对照[5,15-17]。
1.3.6稳定性试验将4 ℃放置0 d、30 d和90 d 的3个不同批次抗原包被板,同时检测已知4份阴性血清和4份阳性血清,计算D490变化率(相对偏差),确定ELISA法的稳定性[5,15-17]。
1.3.7精密性试验同一份阳性血清的同一稀释度用同一批板同时做20孔, 计算D490的变异系数[5,15-17]。
将4 ℃放置0 d、30 d、60 d和90 d的4个不同批次抗原包被板,同时检测不同抗体水平的同8份阴性血清和同8份阳性血清,进行批间重复性试验,计算批间平均变异系数[5,15-17]。
1.3.8灵敏度试验LCMV抗体阳性血清从1∶40开始作系列倍比稀释,用建立的ELISA法进行检测,最大稀释比例阳性孔(D490≥0.2)为其检测灵敏度[5,15-17]。
1.3.9初步应用用建立的ELISA方法, 检测63份普通环境饲养的长爪沙鼠血清、42份经净化的长爪沙鼠血清。
1.3.10可信度用XpressBio公司商品化LCMV抗体ELISA检测试剂,检测63份普通环境饲养的长爪沙鼠血清和42份经净化的长爪沙鼠血清,验证实验所建立ELISA方法的可信度[5,15-17,19-20]。
2 结果
2.1病毒感染力滴度
LCMV病毒感染力滴度为7.25 lgTCID50/mL。
2.2抗原浓度测定
Vero正常抗原蛋白含量为: 1.264 mg/mL; 特异抗原LCMV蛋白含量分为5.732 mg/mL。
2.3最佳工作条件确定
正常抗原、特异抗原和兔抗沙鼠IgG-HRP最佳工作浓度分别为0.4 μg/mL、10 μg/mL和1∶5 000。
2.4特异度
在LCMV阴性对照血清和阳对照血清均成立的条件下,与SV、Reo3、MHV和TMEV阴性对照血清、阳性血清均无特异性反应(表1)。
2.5稳定性
8份血清经稳定性实验检测A值变化率(相对偏差)均小于25%(表2)。
2.6精密性
2.6.1批内变异系数测定通过同一份血清同时检测20个复孔的测定结果,得出正常抗原和特异抗原批内变异系数分别为6.8%和8.9%(表3)。
根据不同时间检测16份血清D490变化率,得出正常抗原、特异抗原的批间平均变异系数(CV)分别为9.3%和8.4%。

表1 ELISA方法特异度试验Table 1 Detection results of the specificity of ELISA

表2 ELISA方法稳定性试验测定Table 2 Detection results of the stability of ELISA

表3 ELISA方法批内变异系数测定Table 3 Detection results of the batch variation coefficien of ELISA
2.7灵敏度
通过对不同稀释度的阳性对照的检测,得出检测方法的灵敏度为1∶1 280(表4)。
2.8初步应用
用已建立的ELISA方法检测63份普通环境饲养的长爪沙鼠血清, LCMV抗体阳性率为6.3%(4/63);检测首都医科大学20份经净化的长爪沙鼠血清和浙江实验动物质量检测中心开放环境饲养的22份长爪沙鼠血清,抗体均为阴性。
2.9可信度测定
用XpressBio公司检测试剂检测LCMV抗体阴性的101份血清,结果均为阴性,检测LCMV抗体阳性的4份血清,结果均为阳性。检测结果符合率为100%。
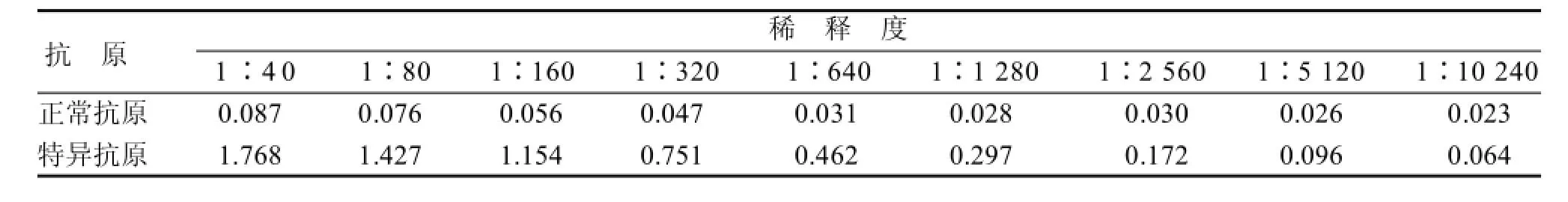
表4 间接ELISA方法灵敏度测定(D490)Table 4 Detection results of the sensivity of ELISA
3 讨论
LCMV广泛存在于世界各地的鼠群中,在自然条件下仅感染啮齿类动物中的鼠科和仓鼠科动物,长爪沙鼠在分类学上属于啮齿目、仓鼠科, 是LCMV在自然条件下可感染的仓鼠科动物之一[8]。应贤平等[6]经血清学检测屏障系统长爪沙鼠和开放饲养的长爪沙鼠LCMV抗体阳性率分别为1.3%和6.0%,段明丽等[7]检测我国内蒙古呼和浩特地区野生长爪沙鼠抗体阳性率为13.3%。而且LCMV是人兽共患病,动物一旦感染,不仅会影响生产和实验,还会对饲养和实验人员带来潜在危险,另外LCMV可经胎盘垂直传播,给动物的净化增加了困难[8]。因此,LCMV感染也是实验长爪沙鼠标准化研究中亟需解决的问题之一。ELISA方法具有微量、特异、高效、经济、方便、安全和结果客观等特点,广泛应用于生物学和医学的许多领域,在理论研究和实际工作中都发挥了重要作用[21]。本实验建立了长爪沙鼠LCMV抗体ELISA方法,为沙鼠的净化提供检测手段。
试验用Vero细胞培养LCMV作抗原,虽经过蔗糖纯化,但也会存在细胞类等非特异性物质,为排除细胞类等物质可能引起的非特异性反应,同时用处理过的Vero细胞作正常抗原对照,可以有效排除非特异性反应而造成的假阳性,提高了检测结果的特异性和准确性[5,15-17]。ELISA方法的批内变异系数均小于10%,批间平均变异系数均小于15%, 说明精密性良好[5,15-17]; 灵敏度达到1∶1 280,说明敏感性较高[5,15-17]; 特异度试验显示,与小鼠仙台病毒和小鼠呼肠孤病毒3型均无免疫交叉反应,证明ELISA方法的特异度令人满意[5,15-17]。
用建立的ELISA方法检测63份普通环境饲养的长爪沙鼠血清,结果显示, 抗体阳性率为6.3%,与文献报道[6]的开放饲养长爪沙鼠LCMV抗体阳性率(6.0%)基本相符。说明开放饲养的沙鼠确实携带LCMV。检测首都医科大学20只经净化长爪沙鼠和浙江省实验动物中心22只净化长爪沙鼠,抗体检测结果均为阴性。说明经过净化的沙鼠群LCMV感染率降低。本实验结果只能说明这两个不同地区净化沙鼠群的感染情况,如果确切了解净化后的沙鼠群是否携带LCMV,还需扩大检测样本量,或长期跟踪检测。可信度试验中, 用XpressBio公司检测试剂检测同一批105份血清, 有101份阴性,4份阳性,两种方法检测结果的符合率为100%,说明建立的ELISA法灵敏度高、准确性好[5,15-17]。
虽然早在1995年就建立了长爪沙鼠MHV ELISA检测方法[6], 且当时已应用于长爪沙鼠的检测,但该方法是通过肉眼观察判断结果,在检测结果判断上主观性比较强,且此方法并没有推广[5,7,15-17]。本次试验建立的长爪沙鼠LCMV ELISA检测方法的检测结果是通过仪器(酶标仪: Thermo MULTISKAN MK3)进行检测, 因此检测结果更加客观可靠[5,15-17]。段明丽等[7]在2013年用ELISA方法对长爪沙鼠进行了LCMV的检测,使用的检测抗原来源于本实验室。作者在用本实验室抗原作为检测抗原的基础上,对方法的特异度、灵敏度、稳定性、精密性等均作了充分的验证,还通过与国外商品化检测试剂进行比较,来验证所建立的检测方法的准确性和可信度[17]。
作者建立的长爪沙鼠LCMV抗体ELISA检测方法特异、敏感、稳定,精密性好、检测准确性高,操作快速、简便、易于推广,为长爪沙鼠LCMV抗体检测试剂盒的研制及开展沙鼠LCMV的检测工作和质量标准的制定奠定了基础。
[1]冯育芳, 邢进, 王吉, 等. 普通环境长爪沙鼠肠道菌群的分离鉴定[J]. 实验动物科学, 2012, 29(3):27-30.
[2]刘月环, 吴旧生, 施张奎. 鼠肝炎病毒在长爪沙鼠消化系统的分布及其组织病理学改变[J]. 中国比较医学杂志, 2007,17(4):197-200.
[3]刘先菊, 扬帆, 林树柱, 等. 长爪沙鼠IgG的纯化及抗血清的制备[J]. 中国比较医学杂志, 2007, 17(11):641-643.
[4]聂金荣, 聂朝晖. Z: ZCLA长爪沙鼠培育及其生物学特性研究[J]. 医学研究通讯, 2004, 33(6):27-28.
[5]卫礼, 王吉, 付瑞, 等. 长爪沙鼠小鼠肝炎病毒(MHV)抗体ELISA检测方法的建立与初步应用[J]. 实验动物与比较医学, 2013, 33(3):1-6.
[6]应贤平, 钱琴, 刘连生, 等. 清洁级长爪沙鼠病毒抗体ELISA检测方法的建立[J]. 中国实验动物学杂志, 1995,15(1):24-27.
[7]段明丽, 杜小燕, 王迎, 等. ELISA法检测野生和驯养长爪沙鼠携带病毒情况[J]. 中国人兽共患病学报, 2013, 29(4):366-368.
[8]田克恭. 实验动物病毒性疾病[M]. 北京: 中国农业出版社,1992, 68-76.
[9]胡群, 裘炯良, 马思杰, 等. 鼠类感染淋巴细胞脉络丛脑膜炎病毒的RT-PCR检测与N基因序列分析[J]. 中国媒介生物学及控制杂志, 2013, 24(6):483-485.
[10] Takagi T, Ohsawa M, Morita C, et al. Genomic analysis and pathogenic characteristics of lymphocytic choriomeningitis virus strains isolated in Japan[J]. Comp Med, 2012, 62(3):185-192.
[11] N' Dilimabaka N, Berthet N, Rougeron V, et al. Evidence of lymphocytic choriomeningitis virus (LCMV) in domestic mice in Gabon: risk of emergence of LCMV encephalitis in Central Africa[J]. J Virol, 2015, 89(2):1456-1460.
[12] Barton LL, Mets MB, Beauchamp CL.Lymphocytic chori-omeningitis virus: emerging fetal teratogen[J]. Am J Obstet Gynecol, 2002, 187(6):1715-1716.
[13] Souders HT, Byler D, Marupudi N, et al. Protracted symptoms in lymphocytic choriomeningitis: a case report[J]. J Child Neurol, 2015, 30(5):644-647.
[14] Childs JE, Glass GE, Ksiazek TG, et al. Human-rodent contact and infection with lymphocytic choriomeningitis and Seoul viruses in an inner-city population[J]]. Am J Trop Med Hyg,1991, 44(2):117-121.
[15] 王吉, 卫礼, 付瑞, 等. 犬瘟热病毒(CDV)ELISA检测方法的建立与应用[J]. 中国比较医学杂志, 2009, 19(4):59-62.
[16] 王吉, 岳秉飞, 贺争鸣, 等. 乙型脑炎病毒(JEV)ELISA检测方法的建立[J]. 中国比较医学杂志, 2010, 20(8):56-59.
[17] 王吉, 卫礼, 付瑞, 等.猫疱疹病毒Ⅰ型抗体ELISA检测方法的建立与初步应用[J]. 实验动物科学, 2014, 31(4):1-5.
[18] GB/T 14926.50-2001. 实验动物 微生物学检测方法[S]. 酶联免疫吸附试验: 1-4.
[19] 许宝华, 张玉珍, 穆松牛, 等. 两种不同组织嗜性的小鼠肝炎病毒组合抗原检测抗体的间接ELISA方法[J]. 中国比较医学杂志, 2006, 16(8):495-498.
[20] 杨艳艳, 张改平, 邓瑞广, 等. 氯霉素残留检测阻断ELISA试剂盒的研制及性能测定[J]. 中国预防兽医学报, 2007,29(2):130-134.
[21] 王凤玲, 冯秀河, 毕丽凤, 等. 酶联免疫吸附法检测梅毒抗体假阳性产生的原因探讨[J]. 实用医技杂志, 2007, 14(11):1417-1418.
Establishment and Preliminary Application of ELISA in Detecting Lymphocytic Choriomeningitis Virus Antibody in Mongolian Gerbil
WANG Ji, WEI Li, FU Rui, LI Xiao-bo, WANG Shu-jing, XING Jin,FENG Yu-fang, GONG Wei, YUE Bing-fei, HE Zheng-ming
(National Institutes for Food and Drug Control, National Center for Quality of Laboratory Animal, Beijing 100050, China)
Objective To develope the ELISA method for determination of lymphocytic choriomeningitis virus (LCMV) antibody in Mongolian gerbils. Methods Raised the Vero cell, vaccinated the LCMV, prepared the normal Vero antigen and specific LCMV antigen, titrated the best working density of enzyme union, the normal and specific antigen and verified the specificity, sensitivity, accuracy and stability of the method. Result The best working density of normal, specific antigen and the enzyme union were 0.4 μg/mL, 10 μg/mL and 1∶5 000, respectively. The inter-assay coefficient of variation of normal antigen and specific antigen were 6.8% and 8.9%, respectively, the intra-assay average coefficient of variation were 9.3% and 8.4%, respectively. The detection sensitivity was 1∶1 280. There was no cross-reactivity with mammalian orthoreovirus 3 (Reo3) and murine encephalomyelitis virus (M-TMEV). The stability test shows the relative deviation was below 25%. Conclusion The ELISA method is good in specificity, sensitivity, duplication, and stability, so ELISA could be used in detecting the LCMV antibody.
Lymphocytic choriomeningitis virus (LCMV);ELISA; Mongolian gerbil
Q95-33
A
1674-5817(2015)06-0473-05
10.3969/j.issn.1674-5817.2015.06.009
2015-06-15
国家科技支撑计划项目(2013BAK11B01)
王吉(1974-), 女, 副研究员, 研究方向: 微生物学和免疫学。E-mail: wj_nd_jds@sina.com
贺争鸣(1957-), 博士, 男, 研究员,研究方向: 微生物学和免疫学。E-mail: zhengminghe57@163.com
