利用qPCR技术检测柑橘溃疡病菌的灵敏度分析
2015-10-09李文娟戴素明李大志邓子牛
李文娟,肖 翠,戴素明,李大志,邓子牛
(湖南农业大学园艺园林学院,国家柑橘改良中心长沙分中心,湖南 长沙410128)
柑橘溃疡病(Citrus bacterial canker disease,CBCD)是由柑橘溃疡病菌(Xanthomonas axonopodis pv.citri,Xac)引起的一种世界性检疫病害,严重危害柑橘产业的发展[1]。对于非疫区要严格禁止携带溃疡病菌的柑橘材料流入,加强对柑橘溃疡病菌的检测。目前,常用的柑橘溃疡病菌检测方法有典型症状目测法、组织病理切片法、病原分离物致病性检测、噬菌体检测法、酶联免疫吸附法(ELISA)和斑点免疫结合法(DIA)等,但这些方法普遍存在检测周期长、特异性不强、灵敏度不高的局限性,不能很好地满足检验检疫工作的要求[2]。相比传统检测方法,常规PCR 检测技术更快速、更准确。王中康等[3]根据柑橘溃疡病菌全基因组中独有的保守蛋白质基因序列,设计筛选出一对特异性引物(JYF5/R5),能将柑橘溃疡病菌与非致病性黄单胞菌、野油菜黄单胞菌等近缘种进行区分,且d在健康柑橘样品中不能扩增出条带。
实时荧光定量PCR (Real-time Quantitative Polymerase Chain Reaction,qPCR)是对常规PCR 进行改进的新型核酸定量技术,具有实时、精确、灵敏等特点。研究表明,采用实时荧光定量PCR 建立的柑橘溃疡病菌检测体系,特异性强,灵敏度比常规PCR 技术高2~3个数量级[4]。
湖南省是我国重要的柑橘生产基地,其主栽品种冰糖橙常年遭受柑橘溃疡病危害,急需建立快速准确的冰糖橙溃疡病菌检测方法。研究以常规PCR 为对照,分析qPCR 检测柑橘溃疡病菌DNA 和柑橘溃疡病菌菌量的灵敏度;同时,应用该方法对接种柑橘溃疡病菌后的冰糖橙样品进行动态监测,以期为实现冰糖橙溃疡病菌早期检测提供依据。
1 材料与方法
1.1 试验材料
无病毒冰糖橙植株、柑橘溃疡病菌种均由国家柑橘改良中心长沙分中心提供。
1.2 试验方法
1.2.1 菌悬液制备 挑取28℃划线培养48 h 的柑橘溃疡病菌单菌落至LB 液体培养基中,于28℃下200 rpm 振荡培养20 h;室温下以8 000 rpm 离心5 m in 收集菌体;用无菌水重悬菌体,并调整OD600≈0.6 后用系列稀释法确定菌悬液浓度。
1.2.2 病原菌接种 将不同浓度的溃疡病菌液接种于冰糖橙叶片上,以无菌水作对照,接种量为5 μL。取样以接种点为中心用6 mm 打孔器打取圆片,每个处理打取圆片10 片,重复3 次,用于后续DNA 提取和溃疡病菌检测。
1.2.3 基因组DNA 的提取 采用细菌基因组DNA提取试剂盒(TIANGEN)提取柑橘溃疡病菌DNA,步骤参照说明书。冰糖橙DNA 的提取采用CTAB 法,步骤参考高志明等[5]的方法。
1.2.4 qPCR 反应程序 反应混合液体系:SYBR Green SuperM ix(Bio-Rad)10 μL,上游引物1 μL(10 μM),下游引物1 μL(10 μM)(引物参照赵云等[2]Xac F06/R06 引物对),反应总体积为20 μL。反应程序:95℃预变性5 m in;95℃变性15 s,62℃退火30 s,72℃延伸20 s,进行40个循环;72℃延伸3 min,16℃保存。
1.2.5 常规PCR 反应程序 反应混合液体系:10×Buffer(含Mg2+)2 μL,Taq DNA 聚合酶(全式金公司)0.2 μL(5 u/μL),dNTPs(全式金公司)1 μL(10 mM),上游引物1 μL(10 μM),下游引物1 μL(10 μM)(引物参照赵云等[2]Xac F06/R06 引物对),反应总体积为20 μL。反应程序:95℃预变性5 m in;95℃变性15 s,62℃退火30 s,72℃延伸20 s,进行35个循环;72℃延伸3 min,16℃保存。
2 结果与分析
2.1 PCR 检测柑橘溃疡病菌DNA 的灵敏度分析
以未感病冰糖橙叶片DNA 为对照,用qPCR 和常规PCR 对纯柑橘溃疡病菌DNA 和混有植物DNA的柑橘溃疡病菌DNA 进行检测。从图1 中可以看出,常规PCR 检测纯溃疡病菌DNA 的质量下限为2×10-4ng,其中DNA 质量在200~2×10-3ng 范围内常规PCR扩增条带亮度明显,DNA 质量为2×10-4ng 时条带亮度微弱,DNA 质量为2×10-5ng 及以下数量级时,没有条带。
从图2 中可以看出,当柑橘溃疡病菌DNA 混有植物DNA 时,常规PCR 检测下限为2×10-3ng,其中DNA 质量在200~2×10-2ng 范围内常规PCR 扩增条带亮度明显,DNA 质量为2×10-3ng 时条带亮度微弱,DNA 质量为2×10-4ng 及以下数量级时,没有条带。由此可见,植物DNA 会影响常规PCR 扩增效果,使其检测灵敏度下降1个数量级。
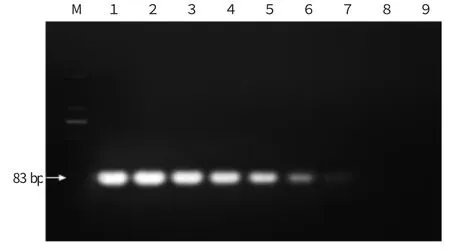
图1 Xac DNA 常规PCR 检测电泳图
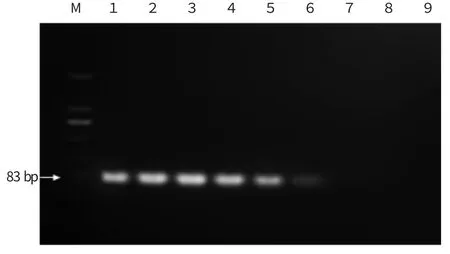
图2 Xac DNA 与植物DNA 混合后常规PCR 检测电泳图
从表1 中可以看出,对于纯柑橘溃疡病菌DNA,试验所配置的所有数量级qPCR 都能检测到,而常规PCR 检测不到2×10-5ng 及以下数量级;同样,对于混有植物DNA 的柑橘溃疡病菌DNA,所有数量级qPCR 都能检测到,而常规PCR 检测不到2×10-4ng 及以下数量级。此外,对于混有或不混有植物DNA 的样品,qPCR 检测的结果较为相似,由此可知,植物DNA对qPCR 检测影响不显著。
2.2 PCR 检测柑橘溃疡病菌量的灵敏度分析
用常规PCR 和qPCR 对不同浓度柑橘溃疡病菌液进行检测,结果见图3 和表2。由图3 可知,常规PCR 检测柑橘溃疡病菌菌量下限为40 cfu,其中菌量在4×106~4×102cfu 范围内常规PCR 扩增条带亮度明显,菌量为40 cfu 时条带亮度微弱,菌量为4 cfu 时没有条带。而由表2 可知,qPCR 所有数量级都能检测到,常规PCR 检测不到的4 cfu 也能检测到。
用qPCR 和常规PCR 对接种不同菌量的冰糖橙样品DNA 进行检测,结果见图4 和表3。从图4 中可以看出,常规PCR 检测柑橘溃疡病菌接菌量下限为1.5×104cfu,其中接菌量在1.5×107~1.5×105cfu 范围内常规PCR 扩增条带亮度明显,接菌量为1.5×104cfu时条带亮度微弱,接菌量在1.5×103cfu 及以下数量级时没有条带。而从表3 中可以看出,qPCR 所有数量级都能检测到,常规PCR 检测不到的1.5×103cfu 及以下数量级也能检测到。
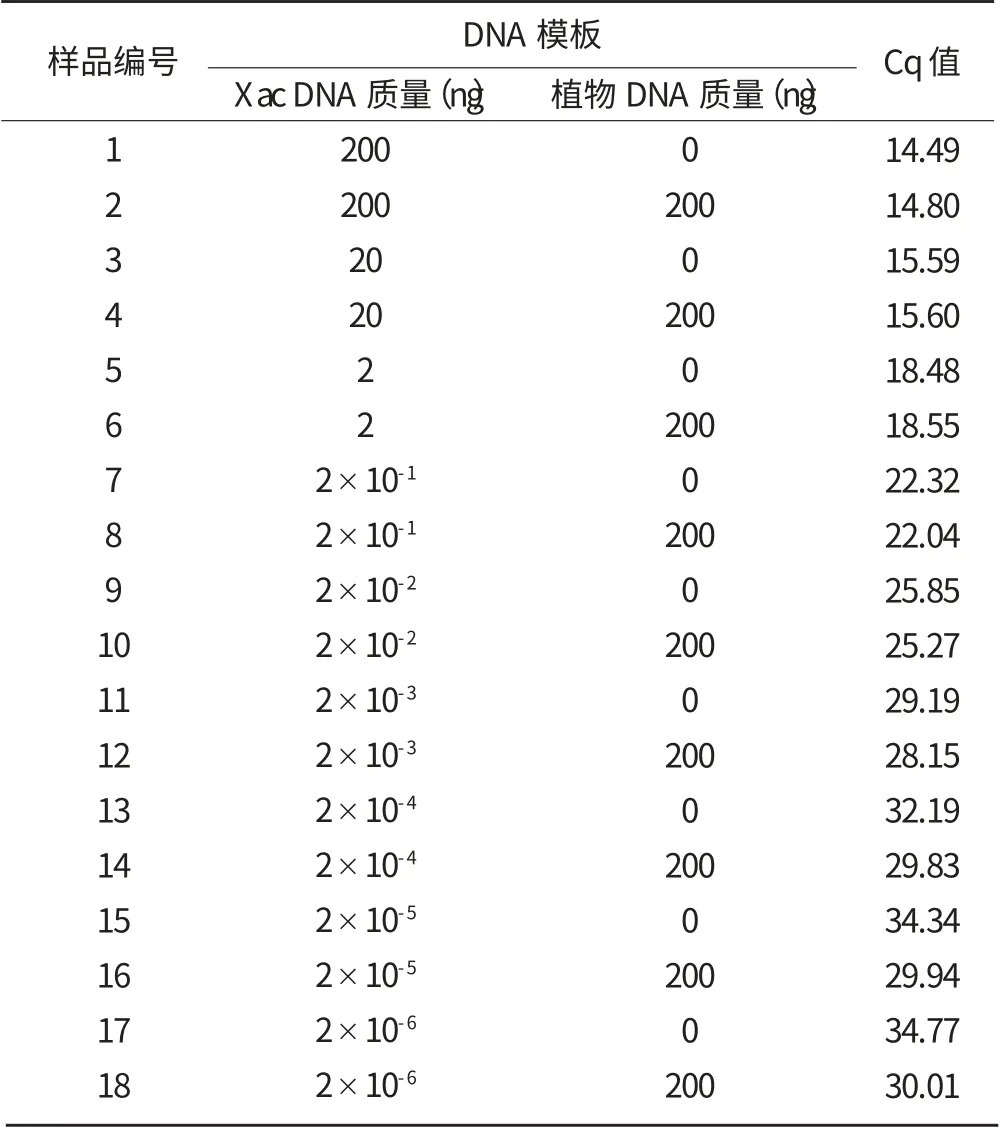
表1 不同DNA 模板qPCR 检测结果
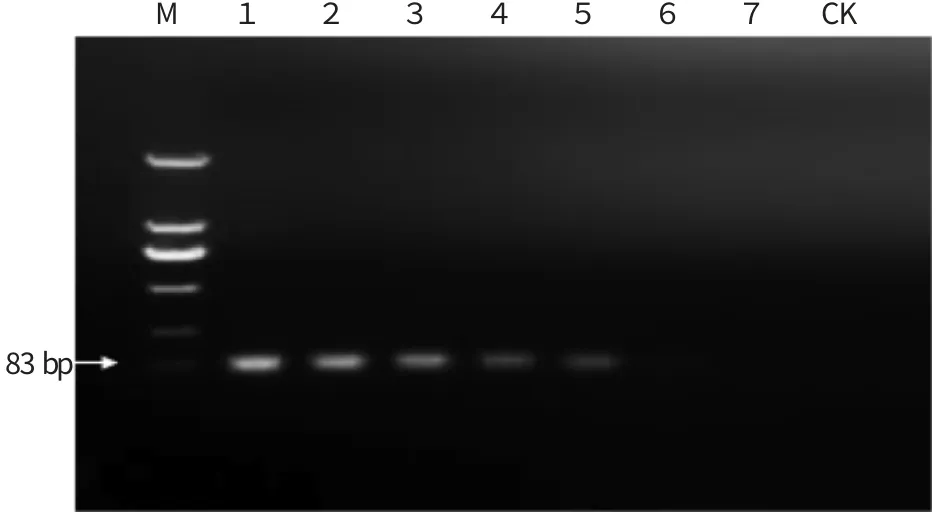
图3 不同菌量的常规PCR 检测电泳图
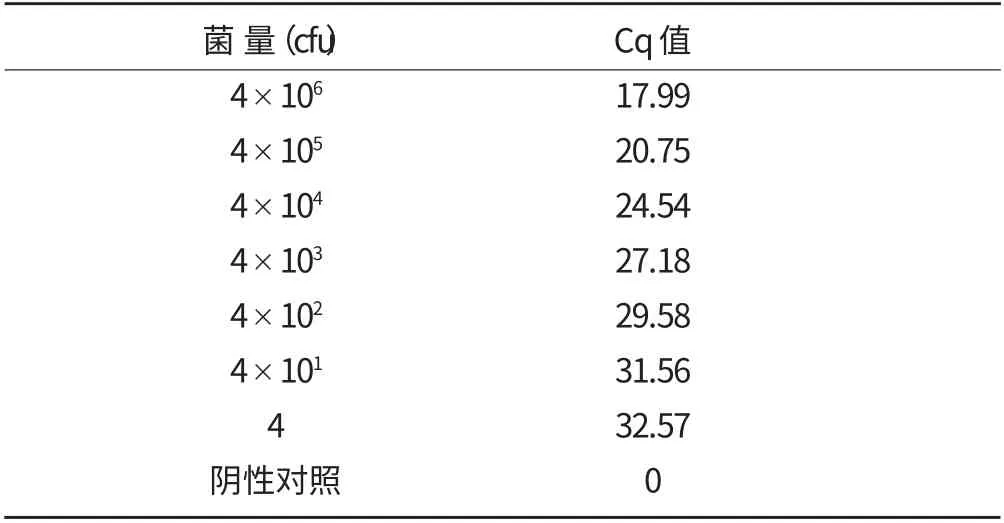
表2 不同菌量的qPCR 检测结果
2.3 利用PCR 对冰糖橙接种后进行动态监测
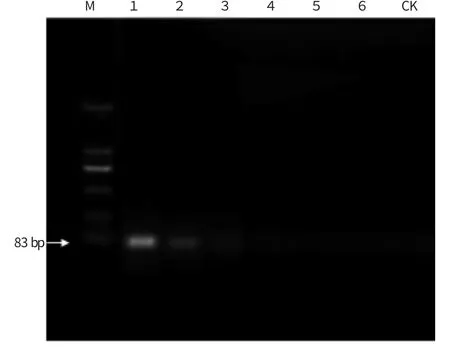
图4 接菌量不同的冰糖橙样品的常规PCR 检测
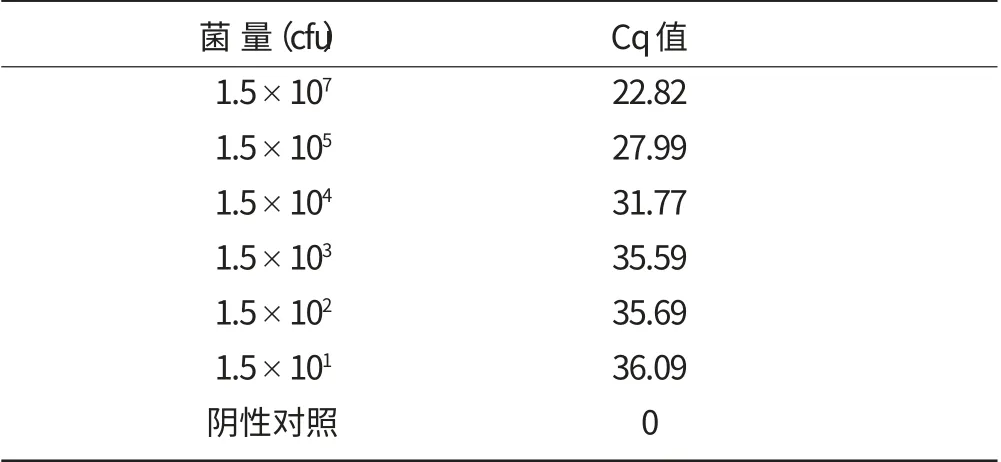
表3 接菌量不同的冰糖橙样品的qPCR 检测
通过观察,接菌量为5×103cfu 的冰糖橙在第9 天开始出现溃疡病典型病斑。分别用常规PCR 和qPCR 对接种后不同天数材料进行取样分析,结果见图5 和图6。由图5 可知,常规PCR 仅能在接种后第2 天的样品中检测出柑橘溃疡病菌,且条带非常微弱;随着接种后的时间延长,常规PCR 扩增条带的亮度逐渐增强。而由图6 可知,qPCR 在接种后立刻就能在植物样品中检测出柑橘溃疡病菌。随着时间推移Cq 值减小,说明接种后溃疡病菌在逐渐增殖,其中接种后1~3 d增殖缓慢,第4 天开始增殖迅速。
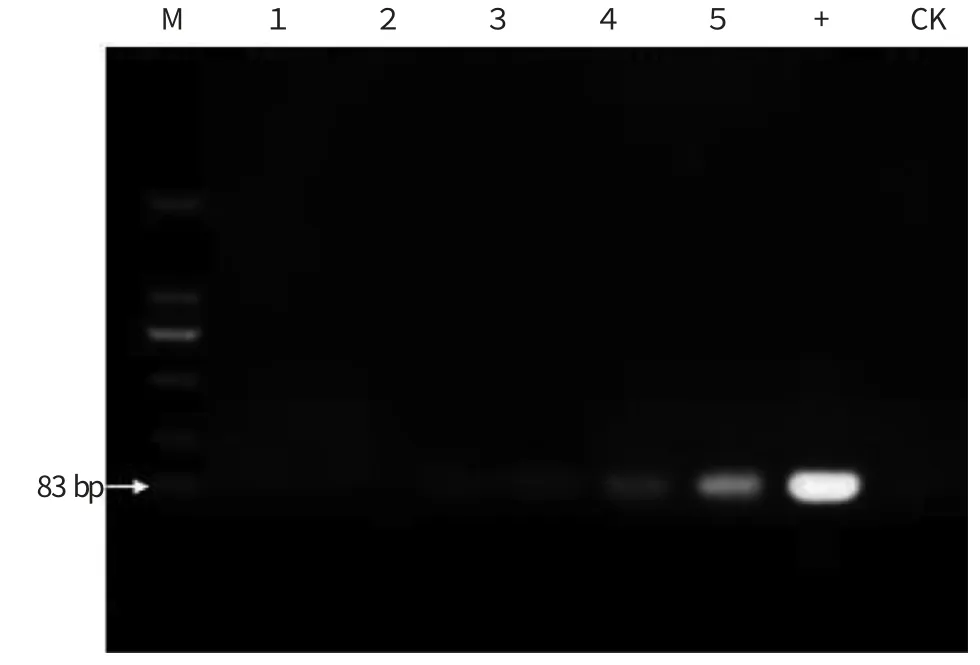
图5 接种溃疡病菌后冰糖橙样品的常规PCR 检测
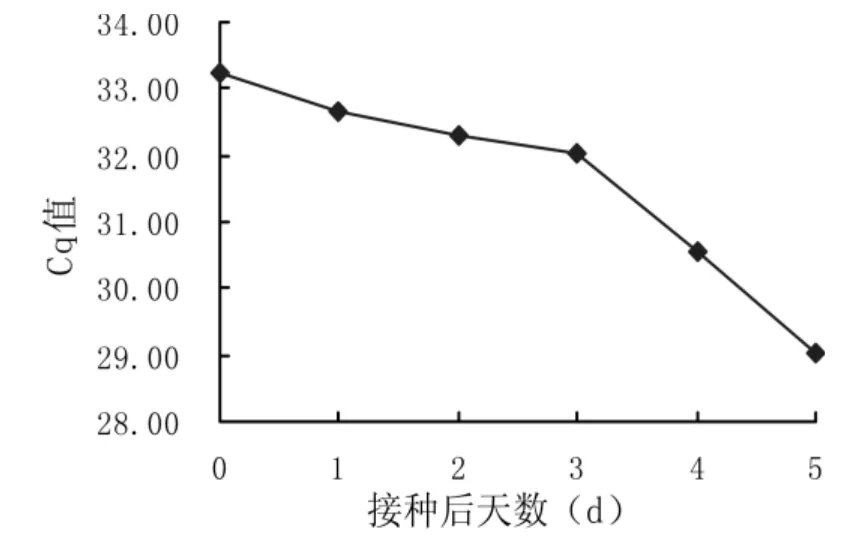
图6 接种溃疡病菌后冰糖橙的qPCR 检测
3 讨论
柑橘溃疡病是柑橘类作物的主要病害,建立快速准确的诊断鉴定体系是柑橘种植地区病情监测以及柑橘苗木、果品出入境检验检疫服务的迫切需求[6]。试验通过常规PCR 对柑橘溃疡病菌DNA 和柑橘溃疡病菌进行检测,结果显示其检测灵敏度比qPCR 低1~3个数量级,且植物DNA 会影响常规PCR 对溃疡病菌DNA 的检测,使其检测灵敏度下降1个数量级,而qPCR 不受植物DNA 的影响。
相关研究表明,基于PCR 的检测方法,柑橘材料制样会影响PCR 扩增,田间病害防治大量施用的多种铜制剂中Cu2+残存于柑橘叶面,会抑制PCR 扩增,制样时柑橘组织外渗的色素、多元酚以及氯原酸[7]等物质也会抑制PCR 扩增,这些物质的抑制作用可能导致检测的假阴性,从而影响病害诊断与病原鉴定。
柑橘溃疡病菌感染柑橘时有一定的潜伏期,在潜伏期内柑橘植株不表现感病症状,采用传统的检测方法难以检测出带菌但不显症的柑橘材料,因此难以避免这类材料流入非疫区。目前,针对柑橘溃疡病菌的分子检测多是利用常规PCR 和实时荧光定量PCR 等方法[8]。2012年,Bruno D 等[9]利用实时荧光定量PCR对Venturia spp. 在苹果叶片上的动态生长进行监控。这表明也可以利用实时荧光定量PCR 来监控柑橘材料上溃疡病菌的增殖。研究利用qPCR 和常规PCR 对接种后冰糖橙样品进行分析,qPCR 即时就能检测到柑橘溃疡病菌,并能观察到溃疡病菌先慢后快的增殖趋势,而常规PCR 要接种后2 d 才能检测到柑橘溃疡病菌,且扩增条带很微弱。由此可见,qPCR 适用于柑橘无症带菌材料的早期检测,这将为qPCR 应用于冰糖橙溃疡病菌检测提供参考,也将为利用qPCR 实现冰糖橙溃疡病菌早期检测提供依据。
[1]刘 鹏,易图永,安 然,等.湖南省柑橘溃疡病病菌生理生化特性初步研究[J].中国植保导刊,2009,29(6):5-8.
[2]赵 云.柑橘溃疡病的定量PCR检验检疫技术研究[D].重庆:重庆大学,2006.
[3]王中康,孙宪昀,夏玉先,等.柑橘溃疡病菌PCR快速检验检疫技术研究[J].植物病理学报,2004,31(1):14-20.
[4]殷幼平,黄冠军,赵 云,等.柑橘溃疡病菌实时荧光定量PCR检测与应用[J].植物保护学报,2007,34(6):607-613.
[5]高志明,范少辉,彭镇华,等.基于CTAB法提取毛竹基因组DNA的探讨[J].林业科学研究,2006,19(6):725-728.
[6]Tim S S,Shabbir A R,Sun X A,et al.Meeting the challenge of eradicating citrus canker in Florida-Again[J].Plant Disease,2001,85:340-356.
[7]Singh R P,Singh M,King R R.Use of citric acid for neutralizing polymerase chain reaction inhibition by chlorogenic acid in potato extracts[J].JournalofVirologicalMehtods,1998,(74):231-235.
[8]陈小帆,莫 瑾,左 静,等.利用双重PCR技术检测柑橘溃疡病菌[J].华南农业大学学报,2010,31(3):32-35.
[9]Bruno D,Anke D L,Rozemarijn D,etal.Real-time PCR asa promising tool tomonitorgrowth ofVenturiaspp.in scab-susceptibleand resistant apple leaves[J].European Journal of Plant Pathology,2012,134:821-833.
