利用EMS诱变获得抗溃疡病甜橙突变体的研究
2015-10-09葛红娟谢玉明邓子牛
罗 丽,李 益,葛红娟,谢玉明,邓子牛
(湖南农业大学园艺园林学院、国家柑橘改良中心长沙分中心,湖南 长沙410128)
柑橘溃疡病(Xanthomonas citri subsp. citri)是一种世界性检疫性病害,严重危害柑橘产业。而柑橘是我国南方地区的第一大水果,大多柑橘商业品种都易感溃疡病,因此寻找抗病资源、培育抗病商用品种是解决该问题的根本途径。利用化学诱变处理,定向筛选抗病品种育种方法已广泛运用在作物改良领域[1-7],且在禾本植物和草本植物上的应用较多,如水稻[8]、小麦[9]、烟草[10]、香蕉[11-12]、草莓[13]等,在木本植物上应用较少。柑橘属于木本类常绿果树,目前应用理化因子诱变获得其抗性突变体的研究相对较少,大多集中在生态抗逆方面[14-15]。因此,研究利用化学诱变剂甲基磺酸乙酯(EMS)对甜橙节间茎段进行离体诱变,以溃疡病菌粗提物作为选择压来筛选抗性不定芽并进一步将其嫁接成苗,以期探索一条简单可行的柑橘育种途径,也为培育柑橘抗病新品种奠定基础。
1 材料与方法
1.1 供试材料与培养基
以大红甜橙[C.sinensis(L.)Osbeck]实生苗上胚轴节间茎段为试验材料。
培养基由播种培养基(MT+琼脂8 g/L+蔗糖30 g/L,pH 值5.7),不定芽诱导培养基(MT+1.0 mg/L 6-BA +琼脂8 g/L+蔗糖30 g/L,pH 值5.7),生根培养基(1/2MT+0.5 mg/L NAA+0.1 mg/L IBA +琼脂8 g/L+蔗糖30 g/L,pH 值5.7)等。
溃疡病菌重悬液为MT+1.0 mg/L 6-BA+琼脂8 g/L+蔗糖30 g/L,pH 值5.7;细菌液体培养基为LB 培养基,pH 值7.4。
高纯甲基磺酸乙酯(EMS,上海劲马生物科技有限公司),浓度达99%。
1.2 试验方法
1.2.1 大红甜橙实生苗上胚轴的获得 取大红甜橙种子,剥去外种皮,用75%酒精表面消毒30 s,再用2%的NaClO 消毒20 m in;消毒后,用无菌水冲洗3 遍以上,在无菌纸上用解剖刀将种子内种皮轻轻划开,将其播种于播种培养基中;暗培养20 d,再转光照培养10 d,待用。
1.2.2 EMS 诱变处理方法 用不定芽诱导液体培养基配制体积百分比浓度分别为1.0%、1.2%、1.4%、1.6%、1.8%、2.0%的EMS 溶液,备用;取大红甜橙试管苗的上胚轴,切成约1 cm 长的“梯形”节间茎段;将其浸泡在上述六种浓度的EMS 溶液中,持续处理时间分别为0.5 h、1 h、2 h,以无菌水代替EMS 作为对照(浓度记为0);处理结束后加入0.5 m L 的5%硫代硫酸钠溶液终止反应(待溶液不再浑浊即可),用无菌水冲洗6 遍以上,在无菌纸上吸干多余水分,分别接种于不定芽再生培养基中;每盒20 根,每个处理3 盒,重复3 次;观察并统计不定芽再生情况,计算不定芽再生率,确定EMS 的半致死剂量(LD50);以半致死剂量(LD50)处理大红甜橙实生苗上胚轴节间茎段,用于下一步抗病突变体的筛选。再生率(%)=(再生数/接种数)×100
1.2.3 溃疡病菌提取液的制备和抗性选择压的确定(1)制备溃疡病菌粗提物。挑取溃疡病菌单菌落,接种于LB 液体培养基中,28℃,180 r/m in 的条件下培养24~48 h,培养至其OD 值为1.0 左右;离心收集溃疡病菌菌体,用无菌水洗涤1 次后重悬;加入溶菌酶(0.2 mg/m L)在37℃中水浴处理30 m in,用Polytron 匀浆机将菌液匀质化;离心取上清,浓缩10 倍,过滤灭菌待用,即为溃疡病菌粗提物(XccE)。(2)溃疡病菌粗提物选择压的确定。制备好的XccE 分别以0.5%、1.0%、2.0%、4.0%浓度添加至不定芽诱导培养基中,以不加XccE 为对照。将长约1 cm 的“梯形”节间茎段接种至添加了XccE 的培养基中,30 d 后观察并统计茎段不定芽的再生率和再生系数,确定XccE 的致死剂量(致死剂量下,茎段不定芽相对生长量接近零),以致死剂量作为选择压来定向筛选经诱变处理后的材料。
1.2.4 抗性突变体的筛选 含XccE 选择培养基的制备:在不定芽诱导培养基和生根培养基中添加致死剂量的XccE 溶液。用LD50的EMS 处理节间茎段,无菌水清洗6 遍,接种于含致死剂量的XccE 不定芽诱导培养基中培养,待茎段两端诱导出不定芽(芽>5 mm),将其从茎段上切下,先转至MT 培养基中进行复壮培养4 周后,再转至含致死剂量XccE 的生根培养基中进行离体筛选,对存活下来并生根的不定芽进行编号及复壮培养。
1.2.5 离体接种鉴定 取经过复壮培养的不定芽第三片完全展开呈新绿色的叶片,进行针刺接种(不能刺破叶片),在每个伤口处接1μL 溃疡病菌液,将叶片放置于含有MT 的培养皿上,并与不定芽一一对应编号;对照有3 组:CK,未经任何处理直接诱导再生得到的不定芽;TC,保存于种质资源温室大棚中的大红甜橙(感病品种);JY,抗病品种枸橼C-05;分别接种1 μL 溃疡病菌和无菌水,观察叶片感抗病情况。将经生物学重复鉴定显示具有一定抗性的不定芽嫁接至一年生酸橙砧木上使其成活成苗,保存编号。
2 结果与分析
2.1 不同浓度EMS 诱变处理对不定芽再生的影响
从表1 中可以看出,相同处理时间,随着EMS 浓度的增加不定芽的再生率随之降低;相同EMS 处理浓度下,随着处理时间的延长,不定芽的再生率也随之降低;当EMS 浓度为1.8%,处理时间为2 h 时,不定芽的再生率为对照的一半,由此可知该诱变条件为EMS 诱变剂的半致死剂量(LD50)。

表1 不同浓度EMS 对诱导不定芽再生率的影响
2.2 抗溃疡病选择压的确定
把节间茎段置于含不同浓度XccE 的培养基中培养30 d 后,观察统计不同浓度XccE 对不定芽再生率的影响。由图1 可知,随着培养基中XccE 浓度的增加,不定芽的再生率随之降低,再生系数也随之降低,而且不定芽的萌发时间也延长。
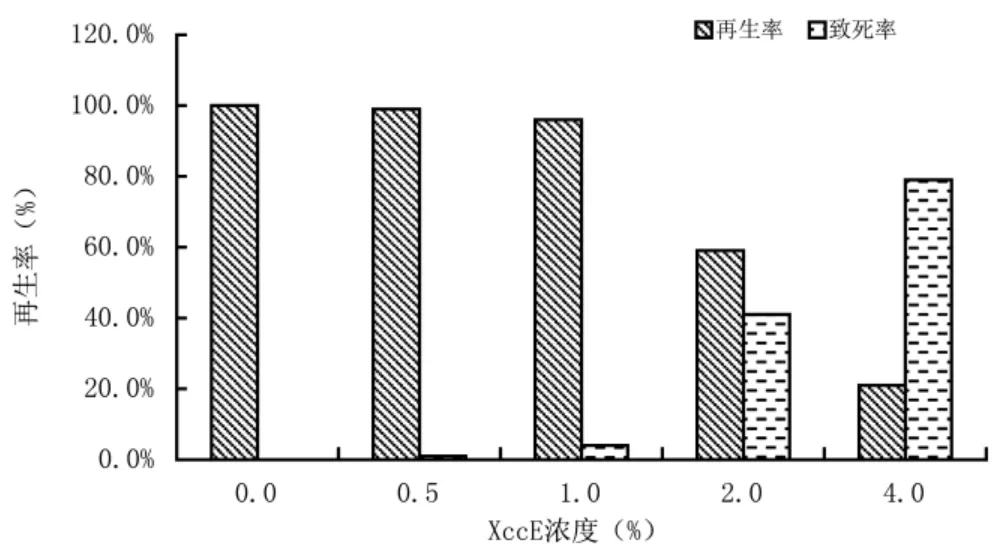
图1 不同浓度XccE 对诱导不定芽再生率的影响
从表2 中可以看出,XccE 浓度为4.0%时,不定芽再生率为21%,但大部分茎段两端伤口处组织褐化,类似溃疡病病斑,且在诱导不定芽过程中,其所需时间长且叶片黄又弱,大多数不定芽的大小在2~5 mm左右,因此认定其相对生长量接近零。因此,以4.0%的XccE 为选择压。
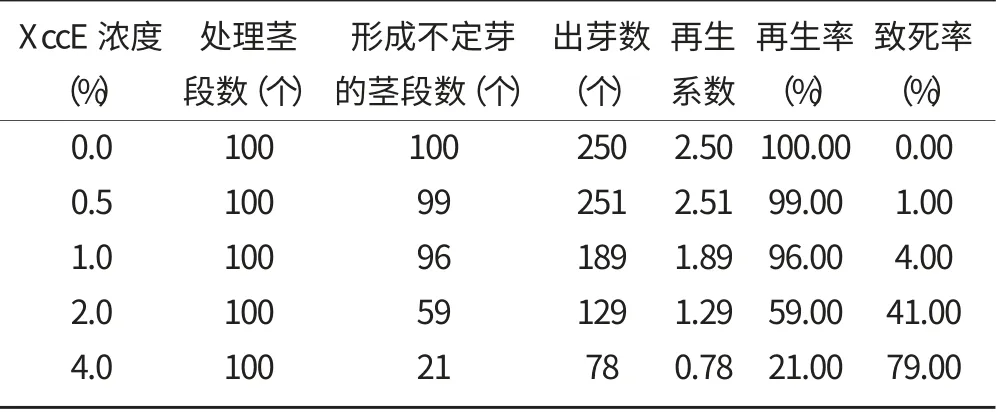
表2 不同浓度XccE 对诱导不定芽再生的影响
2.3 抗性突变体的筛选
经过EMS 诱变处理后,茎段两端伤口处绝大部分组织细胞都被杀死,少数逃逸细胞和突变的细胞经诱导再生成不定芽。由图2 可知,只经过诱变处理未经过选择压选择培养的B 组不定芽再生率要明显高于既经过诱变处理又经过选择压选择培养的D 组再生率;从C 组和D 组来看,C 组不定芽再生率比D 组低,这可能由于未经过诱变处理的外植体细胞不抗溃疡病,虽然在分化过程中可能会发生突变,但是得到突变体的概率很低,而经过EMS 诱变处理增加了细胞突变率,在选择压的定向选择下,获得抗溃疡病突变体的概率要大得多。最后,经过半致死浓度EMS 诱变处理以及选择压的选择培养共诱导再生出1 030个不定芽。
将第一次筛选得到的不定芽进行复壮培养,再转入含XccE 的生根培养基中进行第二次筛选。从图3中可以看出,经过4%XccE 的第二次筛选,大部分不定芽逐渐黄化、叶片脱落甚至溃烂死亡;有些不定芽虽然叶片黄化,但是没有出现脱落及溃烂;有些不定芽叶片呈微黄或健康绿色。从这些症状可以得出,经过诱变及选择后得到的不定芽表现出的抗病或耐病能力各不相同,经过两次筛选,存活下来487个不定芽。

图2 甜橙不定芽的诱导再生

图3 抗性筛选
2.4 离体接种抗溃疡病鉴定
将不定芽复壮培养4 周后,对其进行离体接种溃疡病菌的处理。经过14 d 的培养观察,从图4 中可以看出,在接种溃疡病菌时,枸橼C-05 叶片的伤口处褐化,无黄色晕圈,也无突起;大红甜橙叶片的伤口处先出现水渍圈,逐渐有白白的愈伤组织突起并伴有黄色晕圈,而接种无菌水的枸橼C-05、大红甜橙和不定芽叶片均未出现白色愈伤组织或晕圈。因此,当不定芽叶片伤口有突起及黄色晕圈,甚至出现脓状物时,认为该叶片感溃疡病;伤口无明显变化或出现褐化,并无明显突起和黄色晕圈时,认为该叶片抗溃疡病。
经3 次重复,离体接种鉴定筛选到35个抗性芽,将这些抗性芽嫁接于枳砧或酸橙砧木上,获得突变体株系23 株,目前突变株系在温室中生长良好。
3 讨论
试验结果表明,随着EMS 浓度的增加以及处理时间的延长,茎段的存活率、不定芽的再生率都随之降低,与香蕉[16]、菊花[17]、矮牵牛[18]、大豆[19]等植物中的研究结论一致。突变体的离体筛选,如果只使用单一的化学诱变剂,因其突变方向不定,所获得的突变体性状具有较大的随机性[20]。因此,利用化学诱变剂结合病原菌粗提物的选择压力来进行突变体的筛选,可在一定程度上实现定向诱变[21]。
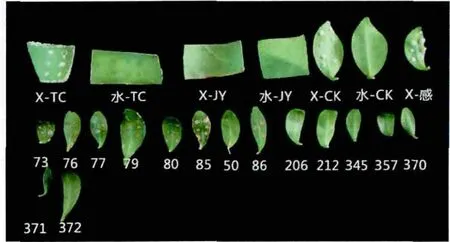
图4 离体接种鉴定结果
在抗性筛选过程中,只有部分组织细胞接触到选择剂,因此在抗性选择时可能因大部分组织细胞未接触到选择剂,而导致出现假阳性材料,从而增加试验的不确定性。在离体接种抗溃疡病鉴定时发现,大多数不定芽叶片仍表现感病,这可能如Hartman[22]认为的那样,在病原菌毒素的选择压力下,植物易产生某些生理适应性变异体,一旦选择压力消失,这些变异体又会恢复到原来的对毒素敏感状态,而且毒素处理后只是少数细胞发生突变,难以获得稳定遗传的抗病突变体;另一方面,因为接种对象是甜橙不定芽的第三片叶,相对自然环境下完全展开呈新绿色的叶片要更为幼嫩,而接种溃疡病菌的浓度却远远高出田间溃疡病的浓度,可能会造成漏筛。为了弥补以上不足,在抗病筛选过程中采取多步定向筛选法可能会更有效。该研究采用两次不连续离体筛选法以及离体接种抗性鉴定法,成功地筛选出抗溃疡病粗提物的甜橙突变体,这些抗溃疡病菌粗提物的再生植株对病菌的抗性和在田间的抗性程度如何有待进一步研究。
[1]TiwariR K,Pan Y F,TrivediM,etal.Research Advances in Improving the Traitsof Fruit Treesby in vitroMutation Induction and Screening[J].Acta Botanica Sinica,2005,25(10):2124-2133.
[2]Svabova L,Lebeda A.In Vitro Select ion for Improved PlantResistance to Toxin-Producing Pathogens[J].Journal of Phytopathology,2005,153:52-64.
[3]刘艳萌,张学英,葛会波,等.EMS处理对草莓离体叶片再生植株耐盐性的影响[J].河北农业大学学报,2006,29(6):25-29.
[4]王忠华,贾育林.水稻类病变突变体lmm1的诱发与初步分析[J].核农学报,2006,(4):255-258.
[5]黄俊生,孔德春,黄峰.EMS诱变菠萝愈伤组织选择抗性突变体的研究[J].热带作物学报,1995,16(12):1-6.
[6]刘君绍,田时炳,皮伟,等.茄子抗黄萎病突变体离体筛选Ⅱ.突变体筛选[J].西南农业学报,2003,16(4):102-106.
[7]陈丽,董举文,唐寅,等.EMS诱变处理定向筛选杨树耐盐突变体研究[J].上海农业学报,2007,23(3):86-91.
[8]查中萍,万丙良.籼稻细胞悬浮培养诱变体系的建立[J].湖北农业科学,2012,51(23):5496-5499.
[9]姚秋燕,王国芬,徐智斌,等.EMS诱导小麦条锈菌毒性突变的研究[J].西北农林科技大学学报,2006,34(6):120-123.
[10]Carlson P S.Mehtionine sulfoximine-resistantmutants of tabacco[J].Science,1973,180:1366-1368.
[11]Bhagwat B,Duncan E J.Mutation breeding of banana cv.Highgate(Musa spp.,AAA group)for tolerance to Fusarium oxysporum f.sp.cubense using chemicalmutagens[J].Scientia Horticulturae,1998,73(1):11-22.
[12]杨媚,舒灿伟,陈健仪,等.利用甲基磺酸乙酯和枯萎病菌毒素诱变筛选香蕉抗毒素突变体[J].园艺学报,2012,39(8):1465-1470.
[13]罗 静,周厚成,王永清,等.EMS离体诱变及抗草莓灰霉病愈伤组织的筛选[J].核农学报,2009,23(1):90-94.
[14]张建华,熊 丽,夏诗慧,等.基于柑橘绿霉菌CYP51同源模建的定点突变与抗性机制分析[J].植物保护学报,2012,39(1):81-86.
[15]邓占鳌.柑橘耐盐系的离体诱发与原生质体植株再生[J].园艺学报,1993,20(2):127-132.
[16]Omar M S,Novak F J,Brunner H.In vitro action of ethyl methane sulphonate on banana shoots tips[J].Scientia Horticulturae,1989,40:283-295.
[17]LatadoRR,AdamesAH,Neto A T.In vitromutation ofchrysanthemum(Dendranthema grandiflora Tzvelev)with ethyl methane sulphonate(EMS)in immature floral pedicels[J].Plant Cell Tissue and Organ Culture,2004,77:103-106.
[18]BerenschotA S,ZucchiM I,Neto A T,etal.Mutagenesis in Petunia×hybrida Vilm.and isolation ofanovelmorphologicalmutant[J].Brazilian JournalofPlantPhysiology,2008,20(2):95-103.
[19]Hofmann N E,Raja R,Nelson R L,et al.Mutagenesis of embryogenic cultureofsoybean and detecting polymorphism using RAPDmarkers[J].Biologia Plantarum,2004,48(2):173-177.
[20]安学丽,蔡一林,王久光,等.化学诱变及其在农作物育种上应用[J].核农学报,2003,17(3):239-242.
[21]Jain SM.Tissue culture-derived variation in crop improvement[J].Euphytica,2001,118:153-166.
[22]Hartman C L.Selection of alfalfa(Medicago stativa)cell lines and regeneration resistant to the toxin produced by Fusarium oxysporum f.sp.medicaginis[J].PlantScience Letters,1984,34:183-194.
