反义I型转化生长因子β受体和反义TIMP-1联合作用对大鼠肝纤维化的抑制作用
2015-08-12李紫琼木尼拉
李紫琼,木尼拉,高 峰
反义I型转化生长因子β受体和反义TIMP-1联合作用对大鼠肝纤维化的抑制作用
李紫琼,木尼拉,高峰
【摘要】目的观察转化生长因子βI型受体(TβRI)反义RNA联合TIMP-1反义RNA对实验性肝纤维化的影响。方法构建TβRI和TIMP-1反义RNA真核细胞表达质粒,共同导入实验性肝纤维化大鼠体内;应用免疫印记技术检测实验大鼠肝组织TIMP-1、TβRI和MMP-13蛋白表达水平。结果正常对照组、反义TβRI组、反义TIMP-1组、联合治疗组、空质粒组和模型组动物肝组织TIMP-1蛋白相对表达量分别为(23.6±2.8)、(57.96±3.8)、(62.3±2.8)、(34.2±2.8)、(279.2±29.8)和(287.3±23.7),TβRI蛋白的相对表达量分别为(56.2±2.7)、(70.5.±1.8)、(77.0±1.7)、(60.6±2.2)、(232.0±19.4)和(241.0±18.3),MMP-13蛋白相对表达量分别为(17.84±2.3)、(36.2±3.7)、(41.3±2.4)、(28.6±2.0),(127.3±1.2)和(118.5±2.5),与正常对照组及空质粒组比,反义TβRI组、联合治疗组和反义TIMP-1组TβRI、TIMP-1和MMP-13蛋白表达明显减少(P<0.05),但空质粒组与模型组比无显著性差异。结论TβRI和TIMP-1反义RNA能有效抑制TβRI、TIMP-1和MMP-13蛋白表达,两者联合应用可产生叠加效应。
【关键词】肝纤维化;反义RNA;质粒;转化生长因子β;基质蛋白酶组织抑制因子
肝纤维化的形成主要是由于细胞外基质(ECM)降解减少,导致ECM沉积增多所致。在肝纤维化形成过程中,一般认为存在转化生长因子-β(TGF-β)/Smad信号传导通路,首先活化的TGF-β与II型TGF-β受体(TβRII)结合,并使之磷酸化而具有激酶活性;与TGF-β结合的TβRII再结合I型TGF-β受体(TβRI),形成I型和II型受体复合物,并使TβRI磷酸化,具有激酶活性;最后,激活的TβRI激活酶磷酸化其特殊的受体Smads(R-Smads),从而调节肝星状细胞(HSC)的转化和ECM的合成与降解。TβRI是唯一的直接将信号传递到细胞内的受体。ECM的降解受基质金属蛋白酶-基质金属蛋白酶抑制剂(MMPs-TIMPs)系统的调节,其中间质胶原酶(人MMP-1和鼠MMP-13)在降解纤维化肝脏ECM过程中起重要作用。本研究通过基因重组及反义技术,构建了反义TβRI和反义TIMP-1真核表达质粒,导入到实验性肝纤维化大鼠体内,观察它们对实验性大鼠肝组织TβRI、TIMP-1和MMP-13蛋白表达的影响。
1 材料与方法
1.1动物与试剂正常纯种系雌性SD大鼠(新疆医科大学实验动物中心提供),Trizol Reagent、质粒抽提试剂盒为美国Invitrogen公司产品。QIAGEN一步法RT-PCR试剂盒为德国QIAGEN公司产品。BCA蛋白定量试剂盒、T4 DNA连接酶、限制性内切酶Xholl、EcoRI为美国Promega公司产品。JM-109大肠杆菌菌株(石河子大学医学院生化实验室惠赠)。抗TβRI单克隆抗体、抗 MMP-13单克隆抗体、抗TIMP-1单克隆抗体、抗β-actin均为美国R&D公司产品。碱性磷酸酶标记的鼠抗IgG等为碧云天生物科学技术研究所产品。
1.2反义 TβRI和反义TIMP-1质粒的构建与鉴定根据TβRI和TIMP-1 cDNA序列,设计PCR引物,由上海Sangon生物公司合成:取正常大鼠肝组织50 mg,提取总RNA。经琼脂糖凝胶电泳,行RT-PCR获得TβRI和TIMP-1cDNA基因片段,经PCR扩增、纯化和回收。对基因片段应用双切酶进行两次双酶切、线性化、纯化后回收。应用T4 DNA连接酶分别将线形化的质粒与TβRI和TIMP-1基因片段定向及反向连接,构建以pcDNA31(+)为载体的反义TβRI和反义TIMP-1真核表达质粒。取阳性克隆,送上海生物工程公司测序分析,证实以pcDNA3.1(+)为载体的反义TβRI和反义TIMP-1真核表达质粒构建成功。
1.3实验性肝纤维化大鼠模型制备及质粒的导入取雌性SD大鼠90只,体质量160~200 g。将大鼠随机分为6组:即反义TβRI治疗组、反义TβRI+反义TIMP-1治疗组、反义TIMP-1治疗组、pcDNA3.1(+)空质粒对照组、模型组和正常对照组,每组15只。采用尾静脉注射CCl4、高脂食物混合喂养,其中肝纤维化大鼠在实验过程中死亡1只。通过病理组织学观察,制备大鼠肝纤维化模型成功。各实验组大鼠体内分别导入相应的质粒治疗,正常对照大鼠同时给予生理盐水500 mL腹腔注射。所用质粒在注射前按比例与Lipofectmine2000混匀,经腹腔定期注射至实验大鼠腹腔内,至第8周末处死动物,取实验大鼠肝组织50 mg进行下一步实验,对部分大鼠肝组织行病理学检查。
1.4肝组织TIMP-1、TβRI和MMP-13蛋白表达的检测采用Western bloting法。取大鼠肝组织50 mg,按照蛋白提取试剂盒说明书操作,提取总蛋白。应用BCA蛋白定量试剂盒定量。加入蛋白质60 μg,使用10%聚丙烯酰胺凝胶在电泳仪上电泳,分离蛋白。将分离后的蛋白通过电转膜仪,电转移至PVDF膜。分别用封闭液封闭PVDF膜,分别加抗TIMP-1单克隆抗体、抗TβRI单克隆抗体、抗MMP-13单克隆抗体和抗β-actin孵育,再加二抗孵育。应用发光试剂盒对转移在PVDF膜上的蛋白进行曝光,洗片,照相,应用Quantity one凝胶成像分析,对胶片进行照相,计算每个条带的光密度值,用 TIMP-1/β-actin、TβRI/β-actin、MMP-13/β-actin光密度比值表示TIMP-1、TβRI和MMP-13蛋白的相对表达水平。
1.5统计学处理计量资料以(x±s)表示,应用SPSS17.0统计软件行方差分析,P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠肝组织TIMP-1、TβRI和MMP-13蛋白相对表达量的比较见表1和图1~3。结果显示,与空质粒组和模型组相比,反义TIMP治疗组TβRI蛋白表达量显著降低(P<0.05),反义TIMP-1治疗组肝组织TIMP-1和MMP-13蛋白表达量显著降低(P<0.05);与空质粒组和模型组比,反义TβRI+反义TIMP治疗组肝组织TβRI、TIMP-1和MMP-13蛋白表达量显著降低(P<0.01);肝纤维化模型组与空质粒组比,三
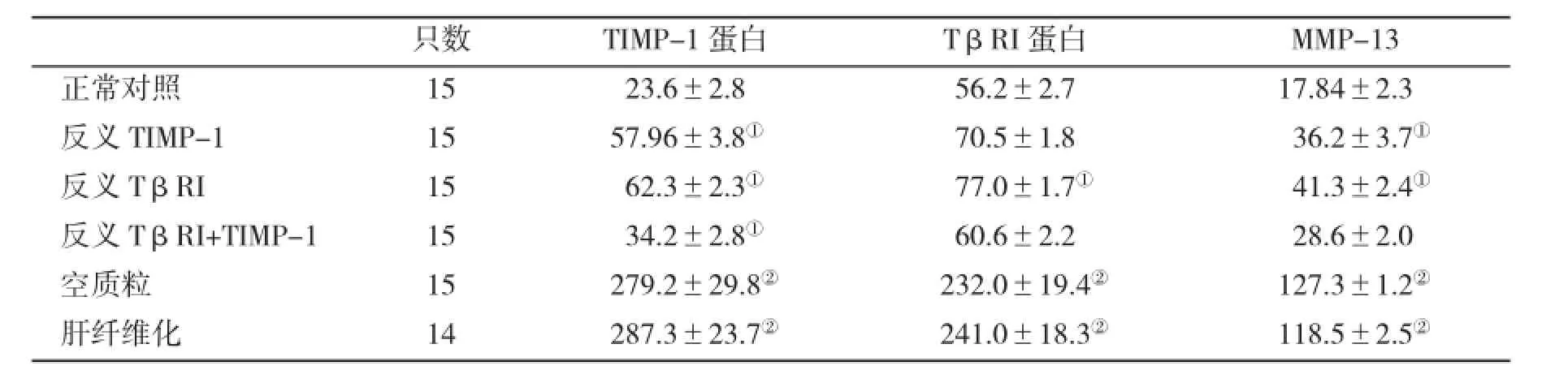
表1 各组大鼠肝组织TIMP-1、TβRI和MMP-13蛋白表达水平(x±s)
种蛋白表达的差异无显著性统计学意义(P>0.05)。

图1 各组大鼠肝组织MMP-13蛋白的表达
A:空质粒;B:肝纤维化;C:反义TβRI治疗;D:反义TIMP-1治疗;E:反义TβRI+反义TIMP-1治疗;N:正常对照组
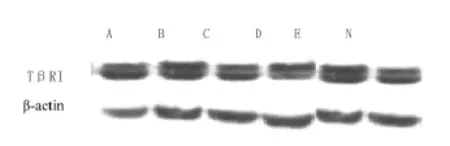
图2 各组大鼠肝组织TβRI蛋白的表达
A:空质粒;B:肝纤维化;C:反义TβRI治疗;D:反义TIMP-1治疗;E:反义TβRI+反义TIMP-1治疗;N:正常对照组

图3 各组大鼠肝组织TIMP-1蛋白的表达
A:空质粒;B:肝纤维化;C:反义TβRI治疗;D:反义TIMP-1治疗;E:反义TβRI+反义TIMP-1治疗;N:正常对照组
3 讨论
肝纤维化的主要病理生理特征是肝内细胞外基质的生成和降解的失衡,调节这一平衡的主要系统是基质金属蛋白酶-基质金属蛋白酶抑制因子系统及TGF-β信号传导通路。在肝纤维化形成过程中,肝实质细胞和非实质细胞都会分泌释放大量的TGF-β,可明显激活HSC转化为成纤维细胞,大量合成ECM,对肝纤维化的发生,发展起着重要作用[1~6]。目前,人们公认在肝组织受到损伤因子的作用后,TGF-β的大量活化和释放是机体损伤修复的重要过程[7]。在正常情况下,TGF-β的这一生物学功能对机体具有积极的意义,当TGF-β超过正常表达时,它可以使组织修复过程变成慢性过程,最终导致组织器官发生纤维化、硬化、结构破坏、功能丧失。如果选择性地调节和阻断TGF-β的功能,对肝纤维化逆转有着积极的意义。
在肝纤维化形成过程中,MMP-13活性受到其特异性抑制剂TIMP-1的调节。关于MMP-13在整个肝纤维化发生过程中的动态变化规律,国内外的研究结论不一。聂青和等人研究发现TIMP-1可以与MMP-1 和MMP-3结合,并抑制其活性,TIMP-1表达增强可促进纤维化的肝脏间质胶原的沉积,且肝纤维化的程度变得严重,因而认为它是肝纤维化发生过程中一个非常重要的促发因素[8]。国外Kossakowska et al[9]认为在大鼠肝纤维化形成过程中TIMP-1表达持续增高,但MMP-13表达水平几乎保持不变。Okazaki et al[10]认为,MMP-13表达在大鼠肝纤维化发生过程中有一短时轻度增高的过程,然后在肝纤维化逆转的早期也有一短时明显增高过程,在其它时段没有什么变化。朱跃科等[11]研究了肝纤维化过程中基质金属蛋白酶及其抑制因子表达的动态变化及相互关系显示,在大鼠肝组织受到二甲基亚硝胺损伤后数天,TIMP-1即先于MMP-13表达增高,表明在肝纤维化发生初期,胶原的降解即受到抑制,有利于胶原的沉积;在肝纤维化的发展阶段,虽然MMP-13的表达明显增高,但由于TIMP-1也处于明显增高的水平,这个阶段MMP-13活性依然相对受到抑制,沉积的胶原得不到有效降解;在实验后期,即进入肝纤维化晚期或早期肝硬化阶段,MMP-13表达明显降低,而TIMP-I表达仍持续增高,MMP-13降解胶原的能力绝对受到抑制,加上胶原的表达与沉积不断增多,最终促成肝纤维化乃至肝硬化的形成。
本研究应用CCL4混合法成功制备大鼠肝纤维化模型。成功构建反义TβRI及反义TIMP-1真核细胞表达质粒,导入实验性肝纤维化大鼠体内,反义TβRI及反义TIMP-1真核细胞表达质粒能在大鼠体内有效表达。实验发现,肝纤维化大鼠在导入反义TβRI及反义 TIMP-1真核表达质粒后,发现TIMP-1、TβRI、MMP-13蛋白表达量明显下降,故可认为两种反义质粒有效地抑制了相应蛋白的表达,证实质粒导入成功,作用可靠。当两种反义质粒同时使用时可使TβRI蛋白、TIMP-1蛋白、MMP-13蛋白表达量显著降低,可能与TGF-β和TIMP-1两种细胞因子之间存在相互影响有关。
杨长青等[12]在免疫诱导的肝纤维化大鼠体内导入通过基因重组技术构建的大鼠MMP-1和反义TIMP-1真核细胞表达质粒,试图通过单纯阻断某一个信号传导通路来阻断肝纤维化的发生和发展。结果发现肝纤维化程度在一定程度上得到了逆转。Knittel T et al[13]研究发现在四氯化碳诱导的肝纤维化大鼠,在肝纤维化明显时仅能检测到低水平的MMP-13 mRNA,在肝纤维化恢复期MMP-13 mRNA水平又显著增加。我们的实验结果与上述结果不完全一致,可能原因是致肝纤维化模型的原因及恢复时的外因不同,而测定MMP-13表达的时期不同也是另外一个可能的原因[14]。
我们研究结果表明,反义TβRI及反义TIMP-1真核表达质粒能够在一定程度上逆转实验性肝纤维化。两者联合作用可产生叠加效应。反义TIMP-1真核细胞表达质粒能够在分子水平封闭肝脏内源性TIMP-1表达,从而促进间质胶原酶MMP-13活性,在一定程度上使实验性肝纤维化得以逆转[15,16]。反义TβRI能在一定程度上经TGF-β信号传导通路阻断实验性肝纤维化的发展[17]。国内有一些应用中药逆转肝纤维化的报道,但具体机制不清[18~20]。本研究从分子水平研究,发现反义TβRI及反义TIMP-1真核表达质粒可在一定程度逆转实验性肝纤维化,为临床抗肝纤维化的基因治疗奠定了基础。
肝纤维化是一个复杂的多因素作用过程,各种细胞因子间的相互协调以及细胞因子与其他因素间的相互作用形成了复杂的细胞因子网络,并共同影响相应的靶细胞。在正常状态下,肝脏细胞因子网络处于一种平衡状态,在各种损伤因素的作用下,这些因子一旦失衡,正向调解肝纤维化的细胞因子就会产生瀑布效应,导致ECM的过度沉积而形成肝纤维化[1]。因此,在肝纤维化的防治过程中,单用一种细胞因子或用一种细胞因子抗体或其受体拮抗剂均不能有效地阻止疾病的发展过程,而对细胞因子网络的整体调整使其构成和所产生的生物学效应趋于正常化或同时采用消除病因等综合措施,才有可能取得较好的治疗效果。
【参考文献】
[1]Bedosa P,Paradis V.Transforming growth factor-β(TGF-β):a key-role in liver fibrogenesis.J Hepatol,1995,22:37-42.
[2]Lewindon PJ,Pereira TN,Hoskins AC,et al.The role of hepatic stellate cells and transforming growth factor-β1 in cystic fibrosis liver disease.Am J Pathol,2002,160:312-315.
[3]Date M,Matsuzaki K,Matsushita M,et al.Modulation of transforming growth factor function in hepatocytes and hepatic stellate cells in rat liver injury.Gut,2000,46:719-724.
[4] Wada W,Kuwano H,Hasegawa Y,et al.The Dependence of transforming growth factor-β-induced collagen production on autocrine factor activin A in hepatic stellate cells.Endocrinology,2004,145:2753-2759.
[5]Shao R,Shi ZD,Gotwals PJ,et al.Cell and molecular regulation of endothelin-1 production during hepatic wound healing. Mol Cell Biol,2003,14:2327-2341.
[6]Kojima S,Hayashi S,Shimokado K,et al.Transcriptional activation of urokinase by the Kruppel-like factor Zf9/COPEB activated latent TGF-beta1 in vascular endothelial cells.Blood,2000,15:1309-1310.
[7]del Re E,Babitt JL,Pirani A,et al.In the absence of type III receptor,the transforming growth factor(TGF)-β type II-B receptor requires the type I receptor to bind TGF-β2.J Biol Chem,2004,279:22765-22772.
[8]Nie QH,Duan GR,Luo XD,et al.Expression of TIMP-1 and TIMP-2 in rats with hepatic fibrosis.World J Gastroenterol,2004,10:86-95.
[9]Boeker KH,Haberkorn CI,Michel D,et al.Diagnostic potential of circulating TIMP-1 and MMP-2 as markers of liver fibrosis in patients with chronic hepatitis C.Clin Chim Acta,2002,316:71-79.
[10]Lichtinghagen R,Matthias J,Michael P,et al.Expression and regulation of matrix metalloproteinases in chronic hepatitis C and hepatitis C virus-inducedliver cirrhosis.Clin Sci,2003,105:373.
[11]Nie QH,Cheng YQ,Xie YM,et al.The inhibiting effect of antisense oligonucleotides phosphorothioate on gene expression of TIMPs in rat liver fibrosis.Gastroenterology,2001,7:363.
[12]杨长青,胡国龄,谭德明,等.基质金属蛋白酶-1、反义金属蛋白酶组织抑制因子-1表达质粒对大鼠肝纤维化的影响.中华传染病杂志,2000,18(1):29-32.
[13]KnittelT,MehdeM,KoblodD,etal.Expressionpatternsof matrix metelloproteinases and their inhibitors in parenchymal and nonparenchymal cells of rat livers:regulation by TNF alfa and TGF beta.J Hepatol,1999,30(1):48-60.
[14]李紫琼,郑勇.TIMPS和MMPS与肝纤维化研究进展.实用肝脏病杂志,2007,10(5):355-358.
[15]李紫琼,郑勇,李睿,等.反义TIMP-1表达质粒对实验性肝纤维化的影响.胃肠病学和肝病学杂志,2008,17(4):325-328.
[16]李紫琼,木尼拉,高峰.反义TIMP-1质粒对实验性肝纤维化中TIMP-1、MMP-13蛋白的影响.实用医学,2013,10:1561-1563.
[17]黄宁,曾令兰,李淑莉,等.TGF-β1、BMP-7 mRNA在实验性肝纤维化中的表达及意义.微循环学杂志,2007,3:20-21.
[18]高萍,邵泽勇,刘春,等.木疏胶囊抗大鼠肝纤维化机制研究.山西医科大学学报,2010,41(7):579.
[19]刘燕,左和宁,杨伟峰.联用阿米洛利与川芎嗪预防大鼠肝纤维化的实验研究.临床医学工程,2010,17(7):49.
[20]赖景绍,蔡红兵,陈文倩,等.大黄蜃虫丸抗实验性肝纤维化的功效组分研究.时珍国医国药,2010,21(6):1322.
(收稿:2014-05-16)(本文编辑:陈从新)
第一作者:李紫琼,男,37岁,医学硕士,主治医师。主要从事肝纤维化研究。E-mail:liazi2006@126.com
DOI:10.3969/j.issn.1672-5069.2015.01.017
作者单位:830000乌鲁木齐市新疆维吾尔自治区人民医院消化内科
Inhibiting effects of antisense transforming growth factor β type I receptor and antisense TIMP-1 on experimental hepatic fibrosis in ratsLi Ziqiong,Mu Nila,Gao Feng.Department of Gastroenterology,People's Hospital,Xinjiang Uygur Autonomous Region,Urumchi 830000,Xin Jiang Uygur Autonomous Region,China
【Abstract】ObjectiveTo observe the effects of transforming growth factor β type I receptor(TβRI)antisense RNA and tissue inhibitor of metalloproteinase 1(TIMP-1)antisense RNA on experimental liver fibrosis in rats.Methods TβRI and TIMP-1 antisense RNA eukaryotic expression plasmids were constructed and transfected into experimental rats with hepatic fibrosis.The impacts of TβRI and TIMP-1 antisense RNA on TIMP-1,TβRI and MMP-13 expression were detected by Western blot.Results The relative expressions of TIMP-1 protein in normal control group,antisense TβRI group,antisense TIMP-1 group,combinational group,plasmid group and model group were(23.6±2.8),(57.96±3.8),(62.3±2.8),(34.2±2.8),(279.2±29.8)and(287.3±23.7),respectively;the relative expressions of TβRI in each groups were(56.2±2.7),(70.5.±1.8),(77.0±1.7),(60.6±2.2),(232.0±19.4)and(241.0±18.3),respectively;and the relative expressions of MMP-13 were(17.84±2.3),(36.2±3.7),(41.3±2.4),(28.6±2.0),(127.3±1.2)and(118.5±2.5),respectively.The relative expressions of TβRI,TIMP-1 and MMP-13 in antisense TβRI group,antisense TIMP-1 group and combinational group were significantly decreased compared with normal control group and plasmid group(P<0.05),while there was no significantly differences between plasmid and model group.Conclusions Antisense TβRI RNA and antisense TIMP-1 RNA can both inhibit the expressions of TβRI,TIMP-1 and MMP-13 protein effectively,and their combination can improve the inhibiting effects.
【Key words】Liver fibrosis;Antisense RNA;Plasmids;Transforming growth factor β receptor;Tissue inhibitor of matrix metalloproteinases
