慢性高原病大鼠肺组织损伤加重及casepase- 3和相关因子的变化
2015-07-31崔金霞时莹庆冯喜英格日力
关 巍,崔金霞,时莹庆,王 晋,冯喜英,格日力
(1.青海大学 高原医学研究中心, 青海 西宁 810001; 2.青海大学附属医院 呼吸科, 青海 西宁 810001;3.武警青海总队医院, 青海 西宁 810000)
慢性高原病大鼠肺组织损伤加重及casepase- 3和相关因子的变化
关 巍1,2,崔金霞2,时莹庆2,王 晋3,冯喜英2,格日力1*
(1.青海大学 高原医学研究中心, 青海 西宁 810001; 2.青海大学附属医院 呼吸科, 青海 西宁 810001;3.武警青海总队医院, 青海 西宁 810000)
慢性高原病(chronic mountain sickness,CMS)发病机制尚不清楚。有报道CMS患者肺弥散功能下降或通气和弥散功能均下降[1]。目前对CMS肺组织结构的变化研究很少。本研究观察CMS大鼠肺组织结构的病理改变、肺组织内半胱氨酸天冬氨酸蛋白酶-3(casepase- 3)及支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)内相关炎性因子的变化。
1 材料与方法
1.1 动物与试剂:清洁级雄性SD大鼠20只,体质量(148±5.2)g,鼠龄6周 [兰州大学动物实验室,合格证号:SCXK(甘)2011- 0001];casepase- 3多克隆抗体、抗兔二抗和免疫组化试剂盒(上海泛柯实业有限公司);大鼠肿瘤坏死因子(TNF-α)、白介素- 6(IL- 6)和IL- 10 ELISA试剂盒(武汉优尔生科技股份有限公司)。
1.2 方法
1.2.1 动物模型及分组:将大鼠随机分为对照组和CMS组,每组10只。对照组饲养于青海大学医学院动物房,海拔2 260 m;CMS组饲养于青海高原医学研究中心低压氧舱,模拟海拔5 500 m,常规喂食,31 d后用于实验。
1.2.2 标本处理:取腹主动脉血液2 mL,测定血常规。分离气管,夹闭左主支气管,插导管至右主支气管,0.9%氯化钠溶液灌洗右肺,收集BALF,双层纱布过滤,离心,上清液-20 ℃冰箱保存,沉淀物涂片,用于细胞计数。左、右心房各开1 cm小口,右房开口插入导管,0.9%氯化钠溶液以20 cm H2O压力,10 mL/分钟的速度滴注至肺叶变白,4%甲醛溶液灌洗双肺,至肺叶变硬、肺缘锐利,分离右肺制作石蜡切片,HE染色检查组织学和免疫组化检测casepase- 3。
1.2.3 标本的测定项目:
1)大鼠肺组织形态定量分析:平均内衬间隔(mean linear intercept,MLI)和肺泡破坏指数(destructive index,DI):Mshot Digital Imaging System V1.0软件系统,光学显微镜(×100)计数。单个肺泡面积(area of pulmonary alveoli, APA)和单位面积肺泡数(density of pulmonary alveoli, DPA):江苏省捷达科技8.0图像分析系统得出结果。
2)免疫组化法测肺组织casepase- 3:肺组织石蜡切片常规脱蜡至水,按免疫组化试剂盒说明书进行操作。
3)ELISA法测BALF中TNF-α、IL- 6和IL- 10浓度:按ELISA试剂盒说明书进行操作。
4)计数BALF中白细胞及各组分: BALF沉淀物涂片巴氏染色,低倍镜观察,行白细胞总数及各组分计数。
2 结果
2.1 血常规比较:CMS组的红细胞数、血红蛋白及红细胞压积显著高于对照组(表1),CMS建模成功。
2.2 光镜下肺组织病理及MLI、DI、APA和DAP的比较:光镜下可见CMS组部分肺泡破裂及肺泡腔扩大。CMS组的MLI、DI和APA明显高于对照组(P<0.001),DAP明显低于对照组(P<0.001)(表1)。
2.3 BALF中白细胞计数及TNF-α、IL- 6和IL- 10水平比较: CMS组与对照组相比,BALF中白细胞总数及巨噬细胞比例明显增高(均P<0.001),TNF-α、IL- 6显著增高(均P<0.001),IL- 10无显著变化(表2)。
2.4 肺组织casepase- 3表达及阳性率变化:CMS组casepase- 3细胞阳性率(10.75±0.96)%显著高于对照组(3.79±1.09)% (P<0.001),casepase- 3阳性在CMS组明显增加(图1)。
3 讨论
CMS以红细胞增多及显著低氧血症为特征。目前认为环境低氧是CMS 低氧血症的主要原因。但有报道CMS 患者的肺弥散功能、通气功能有不同程度的下降[1]。高原红细胞增多症患者尸检发现[2],肺脏散在性出血,肺毛细血管高度扩张淤血,肺泡壁增厚,弹力纤维增多,增粗,肺泡腔扩大或有间质性水肿,间质小血管弹力纤维明显增多。
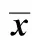
表1 CMS组和对照组血常规和MLI、DI、APA和DAP比较Table 1 The comparison of blood routine test and MLI, DI, APA and DAP in CMS group and control group (±s, n=10)
*P<0.001 compared with control group; RBC.red blood cell; HB.hemoglobin; HCT.hematokrit.
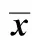
表2 CMS组和对照组BALF中白细胞计数和TNF-α、IL- 6和IL- 10水平比较Table 2 The comparison of white cell count and TNF-α, IL- 6 and IL- 10 in CMS group and control group(±s, n=10)
*P<0.001 compared with control group.
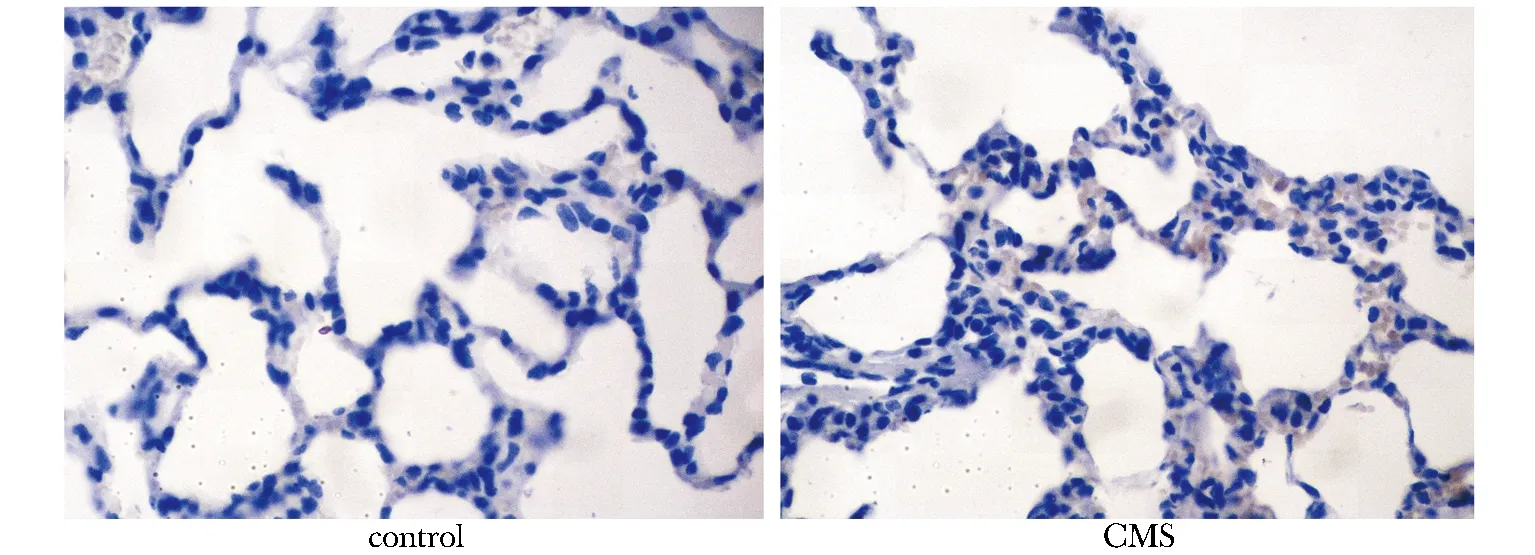
图1 肺组织casepase- 3 表达Fig 1 Casepase- 3 expression in lung tissue(×400)
本研究发现,大鼠在模拟5 000 m的低压氧舱30 d后,红细胞及血红蛋白明显增加,肺泡破坏增加,肺泡腔增大,单位面积肺泡数减少。
肺泡巨噬细胞合成、分泌TNF-α、IL- 1、IL- 6和IL- 8等,在肺部防御和疾病发生过程中发挥重要作用[3]。TNF-α促进多形核白细胞的聚集、黏附和渗出,释放溶酶体酶、 弹性蛋白酶以及活性氧、 超氧离子, 损害肺泡上皮细胞。IL- 6与全身性炎性反应和肺功能的下降程度有直接关系。IL- 10几乎抑制所有促炎细胞因子的合成与释放,因而具有抗感染作用?
本研究发现,BALF中白细胞总数、巨噬细胞数量以及TNF-α、IL- 6水平较对照组明显升高,说明CMS大鼠肺组织炎性反应加重。
有研究显示肺内皮细胞的凋亡与肺损伤相关[4]。本研究发现,CMS大鼠肺组织内促炎因子及凋亡增加,casepase- 3阳性率增高,肺组织破坏增加,提示CMS肺组织损伤,可能是加重CMS患者低氧的重要因素。
[1] 杨彩玲. 30例高原红细胞增多症患者肺功能变化及分析[J]. 高原医学杂志, 2010, 20: 18- 19
[2] 邹恂达, 王旺强, 王鹿朝. 高原红细胞增多症的病理观察[J]. 高原医学杂志, 1994, 2: 29- 32.
[3] Alber A, Howie SE, Wallace WA,etal. The role of macrophages in healing the wounded lung [J]. Int J Exp Pathol, 2012, 93: 243- 251.
[4] Perl M, Chung CS, Perl U,etal. Therapeutic accessibility of casepase- mediated cell death as a key pathomechanism in indirect acute lung injury [J]. Crit Care Med, 2010, 38: 1179- 1186.
2015- 03- 13
2015- 05- 27
1001-6325(2015)11-1542-02
R594.3
A
*通信作者(corresponding author):weiguan110@163.com
