不同鸭茅品种的耐热性评价
2015-06-24左福元邱健东王少青张磊鑫
罗 登,左福元,邱健东,王少青,李 健,袁 扬,张磊鑫,曾 兵
(1.西南大学荣昌校区动物科学系,重庆 荣昌 402460; 2.重庆市涪陵区畜牧技术推广站,重庆 涪陵 408000)
不同鸭茅品种的耐热性评价
罗 登1,2,左福元1,邱健东1,王少青1,李 健1,袁 扬1,张磊鑫1,曾 兵1
(1.西南大学荣昌校区动物科学系,重庆 荣昌 402460; 2.重庆市涪陵区畜牧技术推广站,重庆 涪陵 408000)
以6份鸭茅(Dactylisglomerata)种质资源为试验材料,采用人工模拟高温,测定了不同鸭茅品种的相对含水量、叶绿素含量、相对电导率(REC)、脯氨酸(Pro)、丙二醛(MDA)、过氧化物酶(POD)和超氧化物歧化酶(SOD)7项指标,通过隶属函数法综合评价6份鸭茅种质的耐热性。结果表明,随着高温胁迫时间的增加,叶绿素含量和相对含水量呈下降趋势,REC、Pro和MDA呈上升趋势,POD和SOD总体上呈先升高后降低趋势。通过隶属函数法综合6份鸭茅种质资源的耐热性依次为阿索斯>金牛>01472>宝兴>02-116>安巴。
鸭茅;高温胁迫;生理生化指标;隶属函数法;耐热性
鸭茅(Dactylisglomerata)又名鸡脚草、果园草,属于禾本科鸭茅属,是世界著名的温带多年生禾本科牧草之一,具有耐阴、叶量丰富、营养价值高、适应性强等优点[1-2]。我国是鸭茅起源地之一,野生鸭茅资源丰富,全国已发现野生鸭茅生长地约26个[3-6]。主要分布于四川的峨眉山、二郎山、邛崃山脉、岷山,云贵的乌蒙山、高黎贡山,新疆天山山脉海拔1 000~3 000 m左右的森林边缘、灌丛及山坡草地,并散见于大兴安岭东南坡地[7]。
鸭茅喜温和湿润气候,昼夜温度在12~22 ℃时最宜生长,鸭茅的耐旱、耐寒、耐瘠薄以及耐阴能力均较强,但鸭茅耐热性差[8]。重庆地区属于中亚热带湿润季风气候类型,夏季平均气温在27~29 ℃,部分地区极端高温达42 ℃,致使大部分鸭茅不能安全越夏,严重制约了鸭茅在西南地区推广种植。但目前针对鸭茅种质资源耐热性的评价、筛选的研究较少[9-10],主要集中在耐旱和耐寒等方面[11-13]。本研究采用人工模拟高温,测定与鸭茅耐热性相关的7个生理生化指标,根据模糊数学原理,采用隶属函数法综合评价6份鸭茅种质的耐热性,以期对耐热性鸭茅种质资源进行筛选,发掘优良基因,有效地推进鸭茅新品种的培育工作,为生产上更有效利用耐热性鸭茅品种提供理论依据。
1 材料与方法
1.1 试验材料
通过前期的选育试验,初步筛选出适合在重庆地区种植的鸭茅品种,为宝兴、安巴、金牛、阿索斯、02-116、01472,共6个品种,试验前均未进行任何特殊处理。
1.2 试验设计
试验采用单因素设计,花盆栽培试验法。不同品种鸭茅种子在培养皿内发芽后,将长势均匀、长相一致的幼苗移栽到口径21 cm,深度20 cm的塑料花盆中,填装土壤取自田间沙壤土,每个花盆均装填等量土壤。存活后每个花盆定株6株,幼苗生育期按正常的水肥管理。待所有试验材料生长到拔节期后,将所有花盆移入人工培养箱中,昼夜40 ℃ 14 h/25℃ 10 h,光照强度为7 000 lx,湿度70%左右。试验设3次重复。
1.3 测定指标与方法
根据前期预试验以及针对西南地区夏季高温高湿的气候条件,分别于胁迫后0(对照)、1、2、3、4、5 d测定相关指标,每次随机采取植株中部叶片测定相关生理指标。相对含水量(RWC)采用加热烘干法[14],叶绿素含量采用分光光度法[14],质膜透性(EC)采用电导率仪测定[15],脯氨酸(Pro)含量采用磺基水杨酸抽提法[16],丙二醛(MDA)含量、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性采用南京建成试剂公司生产的专业试剂盒测定。
1.4 数据处理
1.4.1 数据处理与统计分析 用Excel 2007统计分析软件制图,采用SPSS 11.5统计软件进行方差分析及相关性分析。
1.4.2 鸭茅耐热性综合评价 材料各指标隶属函数值计算公式为[17]:
(1)
式中,Xj表示第j个指标值,Xmin表示第j个指标的最小值,Xmax表示第j个指标的最大值。采用标准差系数法(S),用公式(2)计算标准差系数Vj,公式(3)归一化后得到各指标的权重系数Wj。
(2)
(3)
最后用公式(4)计算各材料综合耐热性强弱,即D值。
(4)
式中,D值为各鸭茅品种(系)在高温胁迫下用隶属函数法求得的耐热性。
2 结果与分析
2.1 相对含水量
胁迫1d时,6份鸭茅品种相对含水量差异不显著(P>0.05),然而随着胁迫时间增加,各品种(系)的相对含水量急剧下降,不同品种表现出不同的下降趋势,其中下降最多的为金牛,在胁迫5d时,金牛由对照的93.33%下降到16.69%,下降了76.64百分点;下降最少的是宝兴,由对照的89.13%下降到22.77%,下降了66.36百分点,二者差异显著(P<0.05);02-116相对含水量最少,为15.52%,与相对含水量最多的宝兴差异显著(图1)。
2.2 叶绿素含量
随胁迫时间增加,从开始胁迫到胁迫5d时,叶绿素含量逐渐减少,减少最多的为宝兴,由对照的12.37%减少到2.16%;减少最少的为金牛,由对照的12.13%减少到3.34%,二者在胁迫5d时差异显著(P<0.05);胁迫5d时,安巴叶绿素含量最低,为1.43%,阿索斯含量最高,达3.59%,二者差异显著,金牛与阿索斯叶绿素含量差异不显著(P>0.05)(图2)。
2.3 质膜透性
胁迫初期,相对电导率变化不大,随着高温胁迫时间增加,相对电导率增加明显。到胁迫5d时,相对电导率增加最明显的是安巴,达92.34%,较对照增加了79.09百分点;相对电导率最低的是阿索斯,为80.55%,较对照增加了64.36百分点,且安巴的相对电导率显著高于其他5个材料(P<0.05),宝兴、02-116和01472间差异不显著(P>0.05),金牛、02-116和01472间差异亦不显著(P>0.05)(图3)。
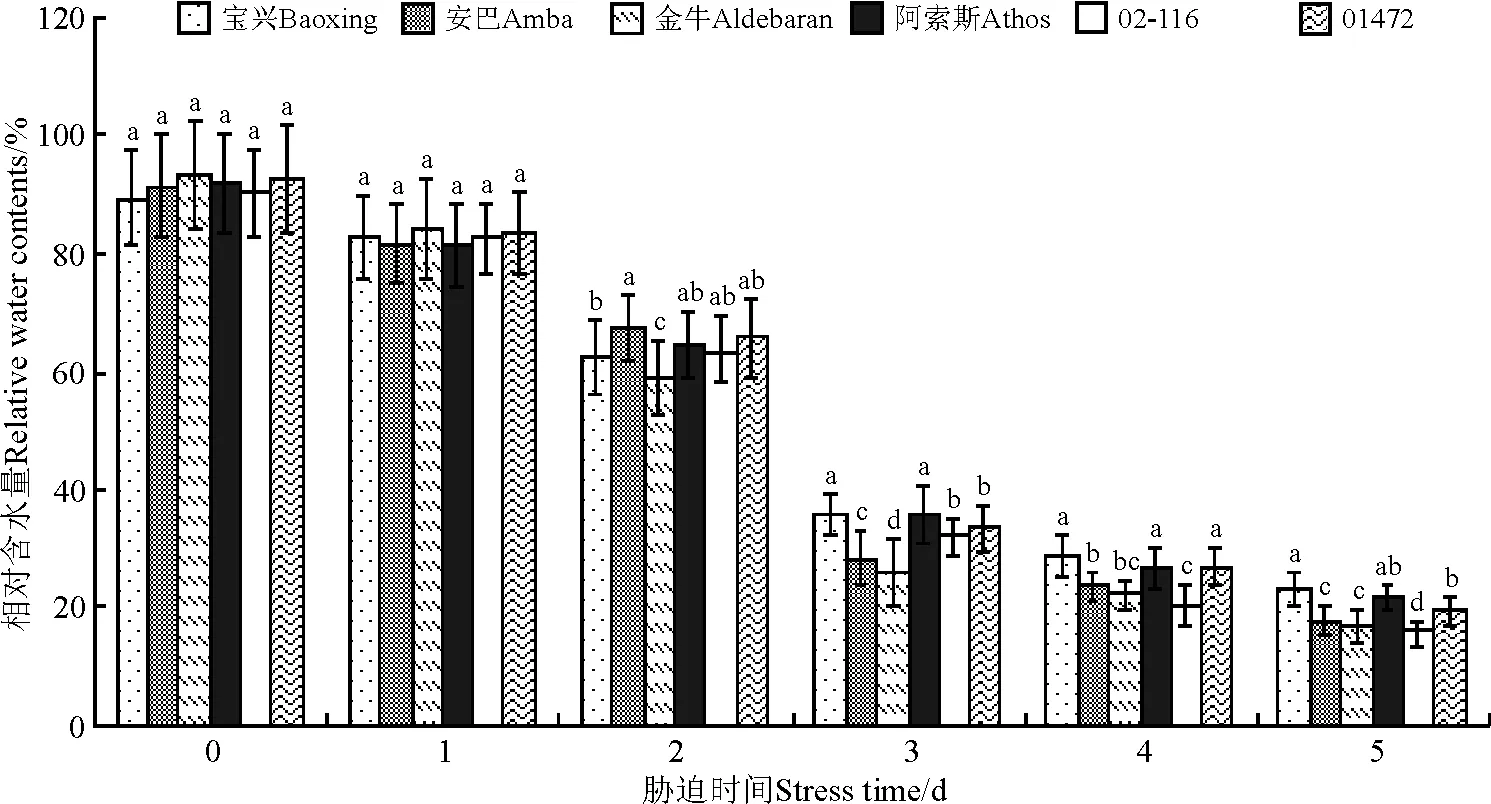
图1 高温胁迫下不同鸭茅品种相对含水量的变化Fig.1 Relative water contents of different orchardgrass cultivars under high temperature stress
注:不同小写字母表示同一时间不同品种之间差异显著(P<0.05)。下同。
Note: Different lower case letters for the same stress time indicate significant difference among different cultivars at 0.05 level. The same below.
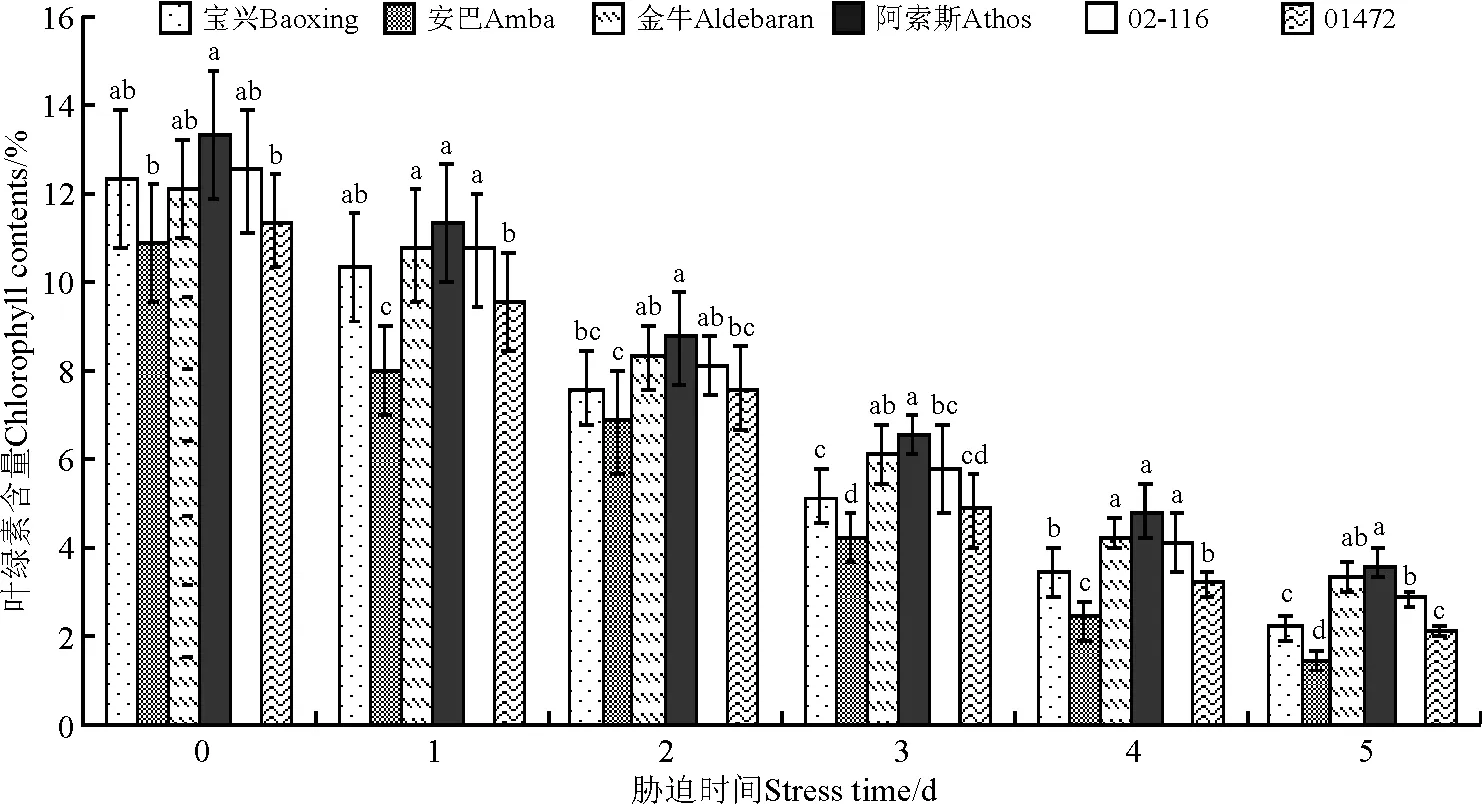
图2 高温胁迫下不同鸭茅品种叶绿素含量的变化Fig.2 Chlorophyll contents of different orchardgrass cultivars under high temperature stress
2.4 脯氨酸含量
随胁迫时间增加,从开始胁迫到胁迫结束时,脯氨酸含量增加明显,其中增加最多的为安巴,由对照的10.58 μg·g-1增加到219.51 μg·g-1;增加最少的为阿索斯,由10.69 μg·g-1,增加到160.38 μg·g-1,也是参试6个鸭茅材料中脯氨酸含量最少的,阿索斯与其他5个材料间差异均显著(P<0.05);宝兴、安巴和02-116间脯氨酸含量差异不显著(P>0.05)(图4)。
2.5 丙二醛含量
随着高温胁迫时间增加,丙二醛含量增加明显,其中增加最明显的是安巴,由对照的0.37 nmol·mg-1增加到胁迫5 d时的10.52 nmol·mg-1;胁迫5 d时,丙二醛含量最低的是阿索斯,为8.59nmol·mg-1,较对照增加了8.08百分点;宝兴、安巴与金牛间丙二醛含量差异不显著(P>0.05),宝兴、02-116和01472间差异也不显著,阿索斯与其他5个材料间差异均显著(P<0.05)(图5)。
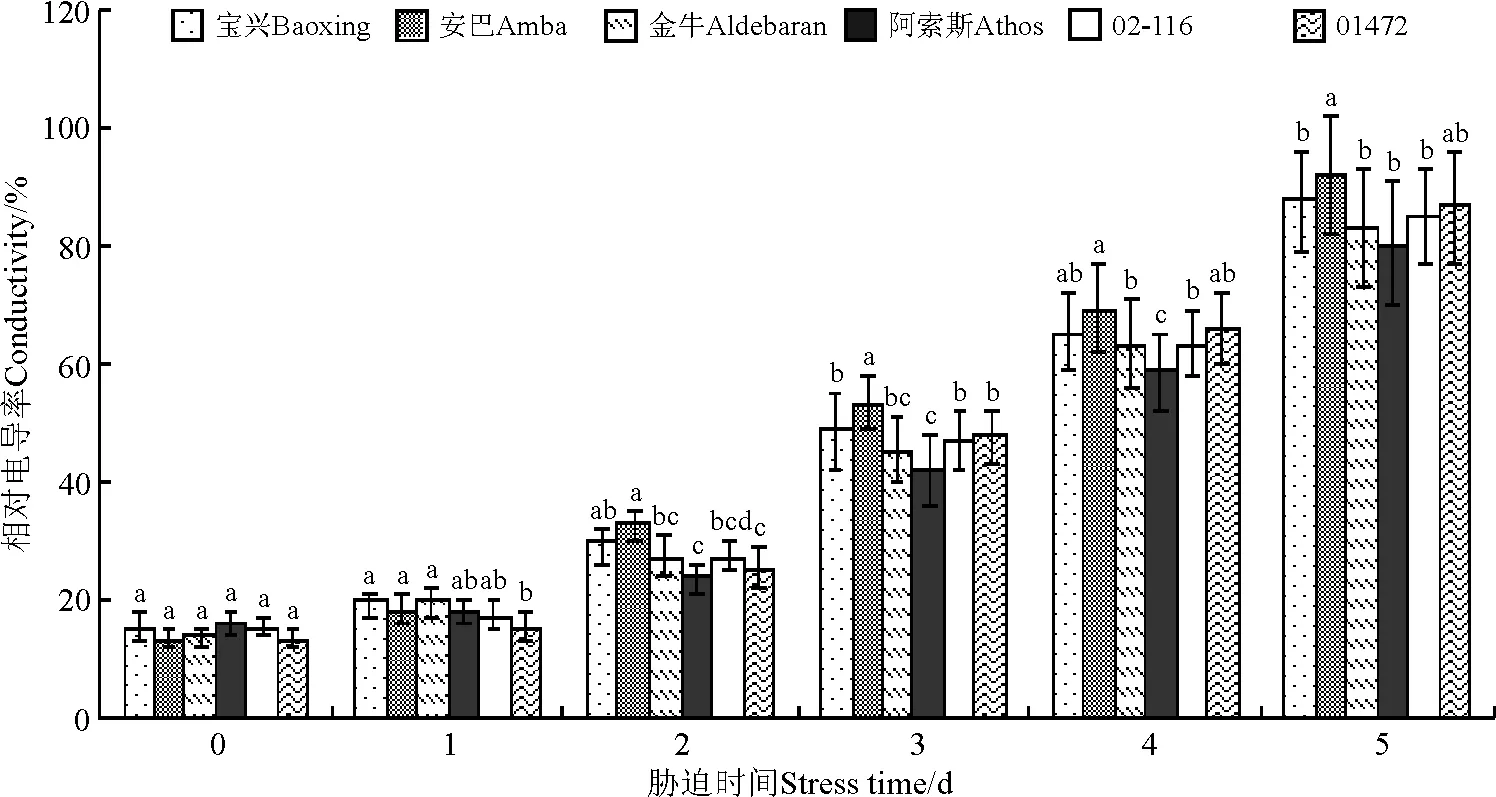
图3 高温胁迫下不同鸭茅品种电导率的变化Fig.3 Relative conductivity of different orchardgrass cultivars under high temperature stress
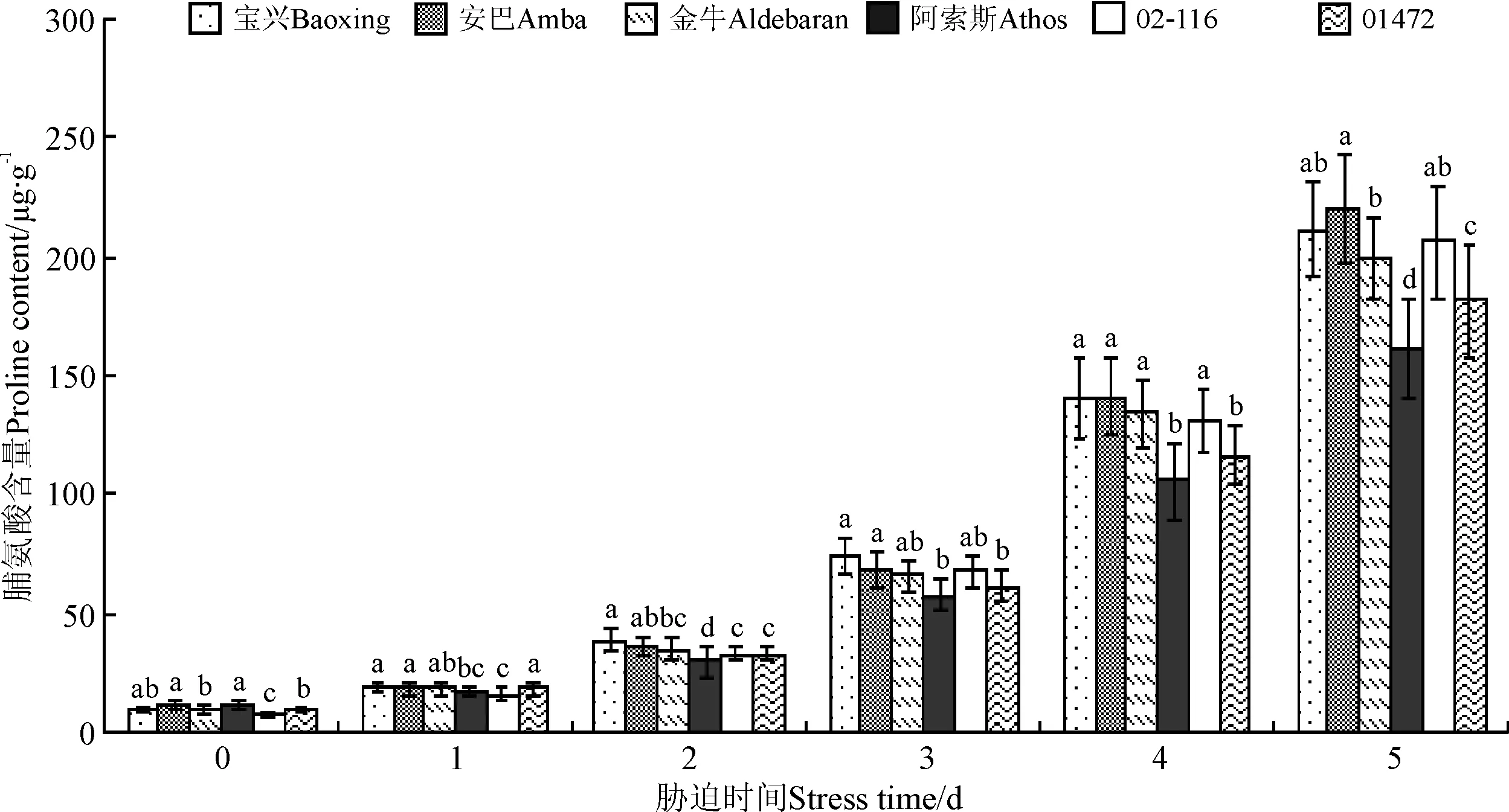
图4 高温胁迫下不同鸭茅品种脯氨酸含量的变化Fig.4 Proline contents of different orchardgrass cultivars under high temperature stress
2.6 过氧化物酶活性
从处理开始到结束时,整体呈先增加后减少的趋势(图6)。处理结束时,金牛、阿索斯和01472间差异不显著(P>0.05),金牛、阿索斯、02-116和02-116、安巴间相互差异不显著,宝兴与金牛、阿索斯和01472间差异显著(P<0.05),01472与宝兴、安巴和02-116间差异显著。
2.7 超氧化物歧化酶活性
各材料SOD活性基本呈先增加后减少的趋势(图7),胁迫开始后,SOD活性显著增加,在胁迫2 d时除阿索斯外,其余材料基本达到峰值,而后逐渐降低,其中SOD增加最明显的是安巴,由对照的220.43 U·mg-1增加到胁迫2 d时的1 787.27 U·mg-1,然后胁迫结束时降低到124.9 U·mg-1;增加最少的是01472,与对照相比增加了1 543.17 U·mg-1;在SOD到达最活跃时,宝兴、安巴、金牛和02-116间差异不显著(P>0.05),阿索斯和01472间差异显著(P<0.05);宝兴、金牛和01472间差异均不显著。
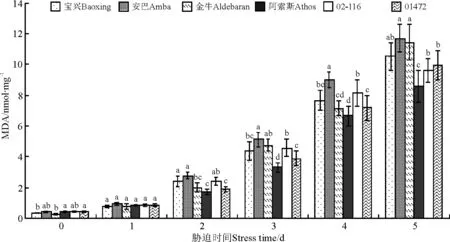
图5 高温胁迫下不同鸭茅品种丙二醛含量的变化Fig.5 MDA of different orchardgrass cultivars under high temperature stress
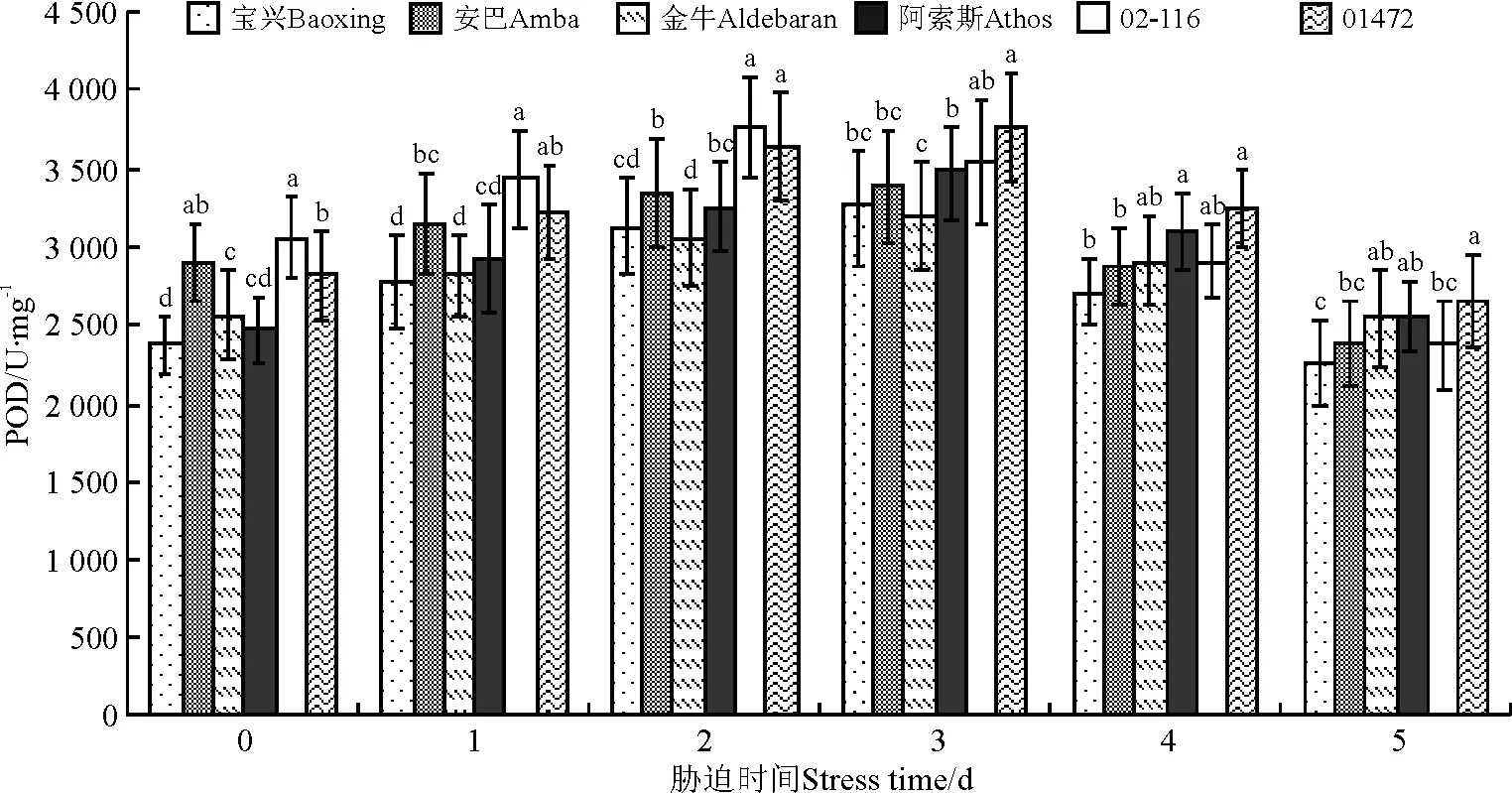
图6 高温胁迫下不同鸭茅品种过氧化物酶活性的变化Fig.6 POD of different orchardgrass cultivars under high temperature stress
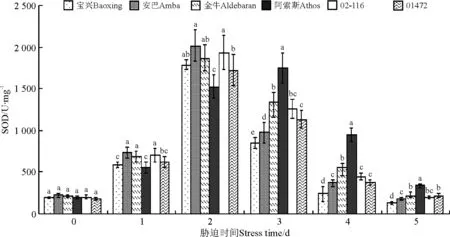
图7 高温胁迫下不同鸭茅品种超氧化物歧化酶活性的变化Fig.7 SOD of different orchardgrass cultivars under high temperature stress
2.8 高温胁迫下鸭茅耐热性综合评价
牧草耐热性是多因素相互作用的复杂的综合性状,以单一指标作为耐热指标的直接评价标准很难全面反映植物的真实耐热能力。因此,在所有参试材料半数失青时(胁迫3 d),通过对相对含水量、叶绿素含量、相对电导率、脯氨酸、丙二醛、过氧化物酶、超氧化物歧化酶7项指标计算鸭茅种质的综合耐热能力D值,以综合评价其耐热性(表1)。D值越大,则耐热性越强,反之越弱。综合7个指标在高温胁迫下各鸭茅种质的D值,得出6份鸭茅耐热性强弱依次为阿索斯>金牛>01472>宝兴>02-116>安巴。
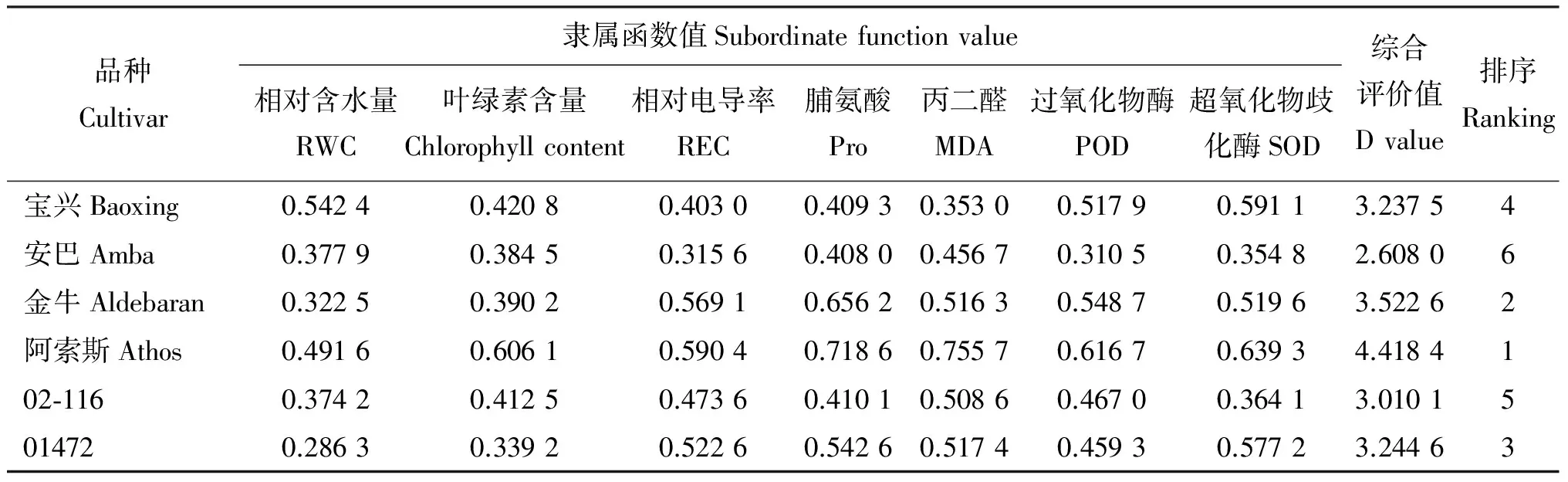
表1 6份鸭茅耐热性综合评价
3 讨论
逆境胁迫是影响植物生长发育的主要因素,而南方地区高温高湿的环境条件无疑成为牧草丰产增收的最大障碍之一。正常情况下,植物体内所有的代谢程序都处于相对稳定而协调的状态,当植物遭受热胁迫时,其代谢作用失调,影响正常生长发育,轻则诱导植物细胞发生程序性死亡,重则会直接导致植物细胞的坏死,使植株整体死亡[18-19]。
水分条件是植物生长的重要环境因子之一,影响着植物形态、生理生化代谢及地理分布范围[20],植物几乎所有的代谢过程都有水的参与。相对含水量的多少是鸭茅遭受热胁迫时最直接的表现,首先表现出叶片蒸腾作用加强,加大了水分从细胞表面蒸发和通过气孔的扩散速率,失水严重;随着高温胁迫时间增加,鸭茅开始自我调节,部分气孔关闭,蒸腾作用逐渐下降,然而由高温导致土面温度过高,直接灼伤鸭茅的根茎组织,且高温伴随的干旱,导致根系活力下降,其吸收能力、合成能力和氧化能力被抑制[19],以及其他代谢失调,产生次生伤害,因此根和叶的交互作用,最终使叶片含水量降低,胁迫初期出现叶片萎蔫状况,随后枯黄,甚至部分叶片出现坏死,这与陈志刚等[21]对西南桦苗(Betulaalnoides)的耐热性研究结果相一致。
叶绿素是植物光合作用最重要的色素,叶绿素含量的多少直接与植物光合机能的大小有密切关系,而光合作用也是植物对高温最敏感的部分之一,因此叶绿素含量可以作为衡量植物在高温胁迫下光合作用潜力的一个重要指标[22]。从胁迫开始至结束时,鸭茅叶绿素含量整体呈下降趋势,且随胁迫时间增加,叶绿素含量下降幅度越大,这与宰学明等[23]对花生(Arachishypogacal)幼苗在高温胁迫时的叶绿素含量变化趋势类似,主要是由于随着高温胁迫,鸭茅呼吸作用和吸收能力降低,鸭茅不能得到水分、能量及其他所需矿物质的支持,使植物叶绿素生物合成减少,降低叶绿素的生成量,甚至引起叶绿素分解,诱发叶片衰老,减少有效叶面积,破坏植物光合作用[24]。
植物在高温逆境下的伤害与脂质透性的增加是高温伤害的本质之一[25]。本研究中,随着胁迫时间增加,鸭茅电导率整体呈增加趋势,且处理时间越长,电导率增加幅度越大,这与多年生黑麦草(Loliumperenne)、大豆(Glycinemax)、百脉根(Lotuscomiculatus)及草地早熟禾(Poapratensis)等植物对高温胁迫的表现一致[24-27],主要是由于高温是改变鸭茅的生物膜结构和破坏其功能的一个重要胁迫因子,鸭茅为了能适应逆境,而自我调节以减轻或避免膜脂结构发生改变,当高温逆境达到不可逆的程度后,就对鸭茅产生了原初直接伤害[18],破坏了线粒体、高尔基体和内质网等内膜系统的结构完整性,膜上离子载体的种类和作用发生了改变,从而导致膜的选择透过性降低或丧失,导致细胞内电解质外渗,组织浸出液的电导率增大,并且随着胁迫时间的延长而增大[28],而鸭茅细胞膜系统的稳定性同抗性呈正相关。
脯氨酸(Pro)作为植物蛋白质的组分之一,以游离状态广泛存在于植物体中,逆境条件下,Pro含量显著增加,增加的Pro主要作为植物细胞质内渗透调节物质,增强其耐热性[29],起到调节细胞质渗透压、降低植物细胞酸度及稳定细胞大分子结构的作用[18]。本研究中,各品种鸭茅的游离Pro含量均显著增加,并且随着胁迫时间的延长其增加幅度也在增大,这与赵丽丽等[26]对百脉根的研究结果类似,说明逆境下Pro含量越高其耐热性强。植物体内存在两条Pro合成途径,分别为谷氨酸(Glu)途径和鸟氨酸(Orn)途径,而高温胁迫导致Pro的增加也有两个途径,分别为从头合成和氧化降解的限制,当鸭茅遭受高温胁迫而导致水分亏缺时,鸭茅体内Pro积累则主要依靠Glu途径,而植物体内Pro的降解代谢基本上是合成代谢的逆过程,由于催化Pro合成的酶位于细胞质或叶绿体中,而氧化降解酶位于线粒体中,因此生物合成和氧化降解的酶基因对胁迫因子的敏感程度就有所不同[18],所以不同的鸭茅品种间Pro增加的幅度也有较大差异。
植物在逆境胁迫过程中,原有植物体内自由基产生与清除的动态平衡被打破,导致·O2-、OH、H2O2等活性氧累积,活性氧促使膜脂中不饱和脂肪酸过氧化产生MDA,而MDA与酶蛋白发生链式反应聚合,导致膜质过氧化、膜结构及生理功能完整性被破坏,进而引起一系列的酶活反应[30-31]。作为膜脂过氧化最终分解产物,叶片中的MDA含量增加表明细胞膜的脂质过氧化程度增强,本研究中也得出类似结论,随着热胁迫时间越久,鸭茅叶片中MDA含量也显著增加,细胞质膜遭到的破坏的程度也越严重,与Liu和Huang[32]对剪股颖(Agrostissoionifera)的耐热性研究结果一致。主要由于,当鸭茅遭受高温胁迫后,产生大量活性氧,诱导有关保护酶类表达量增加或活性提高,相互间共同清除过多的活性氧,以便减轻高温对于鸭茅组织细胞的伤害[33]。
当植物遭受高温胁迫时,植物为了逃避或抵御这种胁迫的伤害,激起或者提高了植物体内清除活性氧、保护膜系统的抗氧化防御系统活性,SOD和POD则属于该系统的主要抗氧化酶[34]。POD是植物体内活性较高的一种酶,它与植物的呼吸作用、光合作用及生长素的氧化等都有关系,且不同阶段其活性也不同。SOD是植物体内清除超氧自由基最关键的保护酶之一,对抵御膜脂过氧化和维护膜结构的完整性有重要作用[35],能够消除细胞内由于逆境而引起的过氧化作用,其活性大小可以反映植物对逆境的适应能力[36]。本研究中,6份鸭茅种质随着处理时间增加,其POD和SOD整体呈先增加后减少的趋势,可能主要因为,当鸭茅遭受高温胁迫初期时,活性氧代谢失调,此时鸭茅则主动调节适应,而细胞防御活性氧毒害的保护酶系统会启动,保护酶类POD和SOD等的表达量和活性会迅速升高,以清除过氧化氢、过氧化物和超氧自由基,并阻止或减少羟基自由基形成,使活性氧的生成和清除达到动态平衡,然而持续胁迫的高强度胁迫会造成膜伤害,活性氧大量产生,导致膜半透性丧失,从而导致膜内物质向外渗透,SOD和POD活性下降,活性氧的产生和清除遭到破坏, 从而导致鸭茅不能正常生长[37],这在水稻(Oryzasativa)等农作物中也得到了验证[38]。
植物的抗性强弱不能由单一的指标决定,它是一个复杂多变、交互影响的过程,其可能是“一因多果”或“一果多因”,相同的逆境可能会导致不同生长状态,反之,不同的逆境也可能会导致相同的生长状态,不同的材料和方法会得出不同的结果,因此在进行相关研究时,应根据不同的环境,采用最适合的方法进行研究,以得出最科学、合理的结论。
4 结论
本研究采用人工模拟高温,随着高温胁迫时间增加,总的来说,叶绿素含量和相对含水量呈下降趋势,相对含水量、脯氨酸和丙二醛呈上升趋势,过氧化物酶和超氧化物歧化酶总体上呈先升高后降低趋势。综合评价得出6份鸭茅耐热性强弱依次为阿索斯>金牛>01472>宝兴>02-116>安巴,由此得出阿索斯具有最强的耐热性,可作为耐热品种加以推广,后期可结合正确的育种手段,加强对其选育,培育出适应性更强,更高产的品种。
[1] Stewart A V,Ellison N W.The Genus Dactylis,Wealth of Wild Species:Role in Plant Genome Elucidation and Improvement[M].New York:Springer,2010:32-33.
[2] 曾兵,左福元,张新全,谢和芳,兰英.利用小麦SSR标记分析鸭茅种质资源的遗传多样性[J].农业生物技术学报,2009,17(4):677-683.
[3] Parker P F,Borrill M.Studies in Dactylis.1 Fertility relationships in some diploid subspecies [J].New Phytologsit,1968,67:649-662.
[4] 耿以礼.中国植物图说——禾本科[M].北京:科学出版社,1959.
[5] 尹少华.横断山地区饲用植物的区系组成特点[J].中国草地,1987(2):7-11.
[6] 杜逸.四川饲草饲用作物品种资源名录[M].成都:四川民族出版社,1986:18-19.
[7] 潘全山,张新全.禾本科优质牧草黑麦草、鸭茅[M].北京:台海出版社,2000:1-3.
[8] 董宽虎,沈益新.饲草生产学[M].北京:中国农业出版社,2003:117.
[9] 曾兵,张新全,彭燕,兰英.野生鸭茅耐热性能评价[J].安徽农业科学,2005,33(12):2288-2290.
[10] 彭燕.野生鸭茅种质资源遗传多样性及优异种质筛选[D].雅安,四川农业大学博士论文,2006.
[11] 李源,师尚礼,王赞,王运琦,张耿,孙桂芝.干旱胁迫下鸭茅苗期抗旱性生理研究[J].中国草地学报,2007,29(2):35-40.
[12] 高扬,张新全,谢文刚.干旱胁迫下鸭茅新品系抗旱性研究[J].湖北农业科学,2007,46(6):981-984.
[13] 陈稼,陈李曦,汪源,程宗汉,周仕波,丁昌思,吴涛,王正忠,曾兵.用Logistic方程法辅助评价鸭茅种质资源的抗寒性[J].湖北农业科学,2012,50(10):2076-2080.
[14] 曾兵,黄琳凯,陈超.饲草生产学实验[M].重庆:西南师范大学出版社,2013.
[15] 陈建勋,王晓峰.植物生理学实验指导[M].2版.广州:华南理工大学出版社,2006.
[16] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[17] 王赞,李源,吴欣明,高洪文,孙桂芝.PEG渗透胁迫下鸭茅种子萌发特性及抗旱性鉴定[J].中国草地学报,2008,30(1):50-55.
[18] 赵福庚,何龙飞,罗庆云.植物逆境生理生态学[M].北京:化学工业出版社,2004:195.
[19] 王三根.高级植物生理学[M].重庆:西南师范大学出版社,2010:50-52.
[20] 李霞,闫秀峰,于涛.水分胁迫对黄蘖幼苗保护酶活性及脂质过氧化作用的影响[J].应用生态学报,2005,16(12):2353-2356.
[21] 陈志刚,谢宗强,郑海水.不同地理种源西南桦苗的耐热性研究[J].生态学报,2003,23(11):2327-2332.
[22] Berr J,John S.Photosynthetic response and adaptation to temperature in high plants[J].Plant Physiology,2000,31:491-543.
[23] 宰学明,钦佩,吴国荣,王光,闫道良.高温胁迫对花生幼苗光合速率、叶绿素含量、叶绿体Ca2+-ATPase、Mg2+-ATPase及Ca2+分布的影响[J]植物研究,2007,27(4):416-419.
[24] 刘大林,张华,胡楷崎,曹喜春,王秀萍,刘兆明,杨俊俏,王奎.多年生黑麦草在高温胁迫下生理生化特性的变化[J].草地学报,2013,21(1):142-151.
[25] Martireau J R,Specht J E.Temperature tolerance in soybeans[J].Crop Science,1979,19:75-81.
[26] 赵丽丽,王普昶,陈超,马林,高温胁迫下百脉根生理生化响应及耐热性评价[J].草业科学,2013,31(1):2018-2023.
[27] 汤日圣,汪军,邓国平,叶晓青.高温胁迫对草地早熟禾某些生理指标的影响[J].江苏农业学报,2010,26(6):1192-1196.
[28] Collins G G,Xie X L,Saltveit M E.Heat shock proteins and chilling sensitivity of mung bean hypocotyls[J].Journal of Experimental Botany,1995,46:795-802.
[29] Zhao F G,Sun C,Liu Y L.The ornthine pathway in proline biosynthesis stimulated salt stress in barley seedings[J].Acta Botanica Sinica,2001,43:36-40.
[30] 段九菊,王云山,康黎芳,张超,王曼,杜少敏,曹冬梅.高温胁迫对观赏凤梨叶片抗氧化系统和渗透调节物质积累的影响[J].中国农学通报,2010,26(8):164-169.
[31] Mukherjee S P,Choudhurim A.Implication of hydrogen peroxide-ascorbate system on membrane permeability of water stressedVignaseedling[J].New Phytologist,1985,99:355-360.
[32] Liu X Z,Huang B R.Heat stress injury in relation to membrane lipid peroxidation in creeping Bentgrass[J].Crop Science,2000,40(2):503-510.
[33] Ali M B,Hahn E J,Paek K Y.Effects of temperature on oxidative stress defense systems,lipid peroxidation and lipoxygenase activity inPhalaenopsis[J].Plant Physiology and Biochemistry,2005,43(3):213-223.
[34] Bowler C, Montagu M V, Lnze D.Superoxide dismutase and stress tolerance[J].Annual Review of Plant Physiology and Plant Molecular Biology,1995,13(1):70-74.
[35] Elstner E F.Oxygen activation and oxygen toxicity[J].Annual Review of Plant Physiology,1982,33:73-96.
[36] 张朝阳,许桂芳.利用隶属函数法对4种地被植物的耐热性综合评价[J].草业科学,2009,26(2):57-60.
[37] 张元,谢潮添,陈昌生,纪德华,周巍巍.高温胁迫下坛紫菜叶状体的生理响应[J].水产学报,2011,35(3):379-386.
[38] 郭培国,李荣华.夜间高温胁迫对水稻叶片光合机构的影响[J].植物学报,1999,42:673-677.
(责任编辑 武艳培)
Heat tolerance evaluation of different ochardgrass cultivars
LUO Deng1,2, ZUO Fu-yuan1, QIU Jian-dong1, WANG Shao-qing1, LI Jian1, YUAN Yang1, ZHANG Lei-xin1, ZENG Bing1
(1.Department of Animal Science, Southwest University, Chongqing 402460 China; 2.Chongqing Fuling Animal Husbandry Extension Station, Chongqing 408000, China)
In order to study the physiological response and heat tolerance of ochardgrass under high temperature stress, relative water content, chlorophyll content, relative electric conductivity (REC), proline (Pro), malondialdehyde (MDA), peroxidase (POD) and superoxide dismutase (SOD) of 6 cultivars of ochardgrass were analyzed with the artificial simulation of high temperature. The heat tolerance of 6 cultivars were comprehensively evaluated using fuzzy subordinate function. The results showed that chlorophyll content and relative water content decreased, REC, Pro and MDA increased and the activities of POD and SOD increased firstly and then decreased with the increase of the stress period. The fuzzy subordinate function analysis suggested that the heat tolerance of 6 cultivars decreased in the order of Athos > Aldebaran > 01472 > Baoxing > 02-116 >Amba.
Dactylisglomerata; high temperature stress; physiological indices; fuzzy subordinate function; heat tolerance
ZENG Bing E-mail:zbin78@163.com
10.11829j.issn.1001-0629.2014-0367
2014-08-05 接受日期:2014-12-11
中央高校基本科研业务费项目:“热胁迫条件下鸭茅种质资源植物生理学响应机理初探”(XDJK2013D023);国家自然科学基金项目“鸭茅抗秆锈病分子标记及核心种质构建”(31101760);国家科技支撑计划课题:“南方优质饲草高效生产加工利用关键技术研究与集成示范”(2011BAD17B03)第一作者:罗登(1988-),男,重庆涪陵人,硕士,主要从事草业研究。E-mail:loudenzh@126.com
曾兵(1978-),男,四川乐至人,教授,硕导,博士,主要从事牧草及草坪草育种与种质资源。E-mail:zbin78@163.com
S543+.303.4;Q945.78
A
1001-0629(2015)06-0952-09
罗登,左福元,邱健东,王少青,李健,袁扬,张磊鑫,曾兵.不同鸭茅品种的耐热性评价[J].草业科学,2015,32(6):952-960.
LUO Deng,ZUO Fu-yuan,QIU Jian-dong,WANG Shao-qing,LI Jian,YUAN Yang,ZHANG Lei-xin,ZENG Bing.Heat tolerance evaluation of different ochardgrass cultivars[J].Pratacultural Science,2015,32(6):952-960.
