桑叶不同提取部位对α-葡萄糖苷酶抑制活性体外研究
2015-05-25唐明敏刘洋田思敏马晓云隗丽程笑赵保胜北京中医药大学中药学院北京000北京中医药大学科研实验中心北京0009
唐明敏,刘洋,田思敏,马晓云,隗丽,程笑,赵保胜(北京中医药大学中药学院,北京000;北京中医药大学科研实验中心,北京0009)
桑叶不同提取部位对α-葡萄糖苷酶抑制活性体外研究
唐明敏1,刘洋1,田思敏1,马晓云1,隗丽1,程笑1,赵保胜2
(1北京中医药大学中药学院,北京100102;2北京中医药大学科研实验中心,北京100029)
目的建立体外α-葡萄糖苷酶抑制活性评价体系,观察桑叶不同提取物对α-葡萄糖苷酶的抑制作用。方法经大鼠小肠获得α-葡萄糖苷酶,以4-硝基苯基-α-D-吡喃葡萄糖苷(pNPG)为底物,以阿卡波糖(Acarbose)为阳性对照,测定桑叶水提液(WE)、水提上清液(AP-A)、水提沉淀(AP-P)及75%乙醇提取液(EE)对α-葡萄糖苷酶活性抑制作用。结果桑叶不同提取液均有α-葡萄糖苷酶抑制活性,不同提取液的半数抑制浓度(IC50)分别是WE:0.08 g/L;AP-A:0.17 g/L;AP-P:0.42 g/L;EE:0.12 g/L;桑叶提取液α-葡萄糖苷酶抑制活性强弱顺序为: WE>AP-A>EE>AP-P,其中WE IC50小于Acarbose(0.11 g/L)。结论桑叶水提液抑制α-葡萄糖苷酶活性作用最强,为桑叶在该机制发挥降糖作用的主要活性部位,体外α-葡萄糖苷酶活性抑制评价体系可作为该药效成分筛选平台。
桑叶;α-葡萄糖苷酶抑制剂;1-脱氧野尻霉素DNJ;半数抑制浓度IC50
α-葡萄糖苷酶为小肠黏膜二糖酶的一种类型,绝大部分附着于小肠绒毛刷状缘的粘膜表面,小肠绒毛两侧酶的活性最高[1]。为了降低餐后血糖,避免葡萄糖稳态异常,从而降低糖尿病、肥胖病、高脂血症(Ⅳ型)等疾病的微血管并发症及心血管疾病的发作风险,20世纪70年代后期研发出了α-葡萄糖苷酶抑制剂,如拜糖平等[2],其作用机制为竞争性的抑制α-葡萄糖苷酶,从而减缓碳水化合物降解为单糖的速度,降低餐后血糖水平。
研究表明,桑叶具有显著的α-葡萄糖苷酶抑制活性,其中1-脱氧野尻霉素(DNJ)为主要活性成分,该化合物为生物碱类化合物,可在水提液中富集[3]。此外,桑叶中多糖类[4]、黄酮类[5]也显示有α-葡萄糖苷酶抑制活性。近年来,结合色谱、质谱、核磁等技术从桑叶中筛选了一部分α-葡萄糖苷酶抑制剂单体,如氧化白藜芦醇、黄芪苷、芦丁等[6]。
本实验建立了α-葡萄糖苷酶体外反应体系,对桑叶不同处理方式获得的提取部位的体外α-葡萄糖苷酶抑制活性进行了评价,为后续活性成分筛选研究提供参考。
1 材料与方法
1.1 材料桑叶药材购买于北京仟草中药饮片有限公司;拜糖平,拜耳医药保健有限公司生产。对硝基苯-α-D-葡萄糖吡喃苷(pNPG),对硝基苯酚,购买于江莱生物有限公司;血清清蛋白(BSA)、HEPES,购买于Sigma公司;其他试剂均为分析纯。
1.2 仪器酶标仪(Multiskan Ascent美国Thermo公司),电动玻璃匀浆机(DY89-Ⅱ宁波新芝生物科技股份有限公司生产),混合器(QL-866浙江海门市其林贝尔仪器厂),离心机(1-15PK德国Sigma公司),真空干燥箱(DZ-2BC南京远拓科学仪器有限公司),智能溶出仪(ZRS-8G天津大学无线电厂),电子天平(BSA124S赛多利斯科学仪器有限公司)。
1.3 实验动物SPF级SD大鼠,雄性,体质量280~300 g,由斯贝福(北京)实验技术有限公司提供,合格证号:SCXK(京)2011-0004。动物饲养于北京中医药大学实验动物部标准屏障环境内,许可证号: SYXK(京)2011-0024,自由饮食,明暗节律12 h/ 12 h。
1.4 方法
1.4.1 桑叶不同提取物制备30 g桑叶药材,加12倍量水浸泡30 min,加热回流90 min,过滤,滤渣加10倍量水回流60 min后,过滤,合并两次滤液,得桑叶总水提物(WE);取部分水提液浓缩,加入95%乙醇至含醇量为60%,静置24 h以上,3 000 r/min,离心15min,取上清液回收乙醇至无醇味,得桑叶水提上清液部位(AP-A);沉淀为桑叶水提沉淀部位(APP);桑叶药材加75%乙醇,方法同WE回流提取得桑叶醇提物(EE)。
1.4.2 大鼠小肠α-葡萄糖苷酶制备雄性大鼠,禁食12 h,麻醉,腹主动脉取血致死,取胃幽门以下小肠约15 cm,预冷的生理盐水冲洗2次,刮取黏膜层,按1∶10比例加入0.5 mol/L NaCl-KCl溶液,匀浆。于4℃,10 000 r/min,离心30 min,弃上清液,沉淀用预冷的生理盐水洗冲2次,4℃,10 000 r/min,离心30 min,最后沉淀按体积1∶5用生理盐水稀释后,于4℃,500 r/min,离心10 min,取上清液,考马斯亮蓝法测定上清液蛋白含量,-20℃保存备用[7-9]。
1.4.3 α-葡萄糖苷酶反应体系优化[10]
1.4.3.1 对硝基酚浓度-吸光度标准曲线分别吸取浓度为2 mmol/L的对硝基苯酚20、40、80、120、160、200、240μL,并分别加入400μL Na2CO3及一定体积67 mmol/L磷酸缓冲液至总体积为750μL,样品溶液置于96孔板中,405 nm处测定吸光度。以对硝基苯酚浓度为横坐标,405 nm处吸光度为纵坐标,作标准曲线。
1.4.3.2 蛋白浓度-酶活力标准曲线取10 mmol/L对-硝基苯酚-α-吡喃葡萄糖苷(pNPG)底物溶液50μL,分别加入不同浓度的大鼠小肠粘膜α-糖苷酶提取液50μL(0.21、0.42、0.62、0.83、1.03、1.65 mg/mL),反应30 min,405 nm处测定吸光度值,计算α-葡萄糖苷酶活力,观察酶浓度对酶活力的影响。
1.4.3.3 底物浓度-酶活力曲线在体系中加入50μL酶液(0.62 mg/mL),并加入不同体积pNPG,使底物终浓度为0.33、0.83、1.67、2.08、2.92、3.75、5.00、6.67、8.33、10.00 mmol/L,观察不同底物浓度对酶活力的影响,Lineweaver-Burk作图法计算该酶的Km。
1.4.4 桑叶提取物体外α-葡萄糖苷酶抑制试验
取50μL肠提取液加入67 mmol/L磷酸盐缓冲液(pH 6.8),37℃水浴温孵10min,加入桑叶提取物饱和5 min后再加入100μL pNPG(10 mmol/L),体系总体积为350μL,水浴30 min后,加入0.1 mol/L Na2CO3400μL终止反应。样品溶液置于96孔板中用酶标仪于405 nm处测定吸光度,每组反应平行做3次。同时设立阳性对照(相应浓度的阿卡波糖),阴性对照(不加抑制剂,补充缓冲液)和空白对照(不加底物和抑制剂,补充缓冲液)计算抑制率,并绘制不同浓度提取物抑制率曲线,计算IC50。
抑制率(%)=[(A阴性-A试样)/(A阴性-A空白)]×100%。
此外,酶活力定义为37℃,pH 6.8条件下,酶蛋白每分钟催化1μmol对硝基苯酚生成为一个活力单位。
2 结果
2.1 α-葡萄糖苷酶体外反应体系优化
2.1.1 对硝基苯酚标准曲线如图1所示,对硝基苯酚在8~88mol/L浓度范围内线性良好(r=0.999 9)。2.1.2最适蛋白浓度考马斯亮蓝法测定大鼠小肠提取液的蛋白含量为:1.65 mg/m L,结果显示在酶反应体系中,蛋白终浓度在0.03~0.28 mg/mL范围内与酶的活力呈线性(r=0.987 9),根据实验实际情况选择蛋白终浓度为0.17 mg/mL,如图2。
2.1.3 最适底物浓度酶活力随着底物浓度的增大,变化速率减缓,最终选择3.3 mmol/L底物终浓度为反应最适浓度,如图3。此外,Lineweaver-Burk作图结果显示,37℃,pH 6.8条件下,以对-硝基苯基-α-吡喃葡萄糖苷为底物,α-葡萄糖苷酶Km值为1.8±0.2 mmol/L,如图4。
2.1.4 最适反应时间根据酶活力-时间曲线,如图5显示,产物生成量在10~60 min内呈良好的线性(r=0.997 9),根据酶活力检测及操作可行性,酶反应终止时间选择为30min。
2.2 桑叶提取物对α-葡萄糖苷酶活性的抑制作用对生药浓度为0.062 5、0.250 0、0.500 0、0.750 0、1.000 0 g/L的桑叶不同提取物进行α-葡萄糖苷酶的抑制率测定,根据测定结果绘制抑制率曲线并计算IC50,如图6,表1。比较各提取物IC50结果显示,α-葡萄糖苷酶抑制活性强度顺序为WE>AP-A>EE>AP-P,其中,水提液活性较阿卡波糖高,为活性最高的提取物,水提液上清液活性较沉淀高,表明桑叶水提物中α-葡萄糖苷酶抑制活性成分可能大多存在于上清液中。此外,桑叶75%醇提液也存在一定的α-葡萄糖苷酶抑制活性,但是较水提液活性低,水提仍然为桑叶在进行此方面研究的最佳提取方式。

表1 桑叶提取物不同部位对α-葡萄糖苷酶抑制率
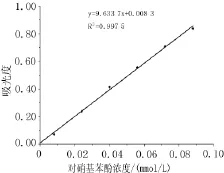
图1 对硝基苯酚标准曲线

图2 蛋白浓度与酶活力的关系

图3 底物浓度与酶活力关系

图4 1/Vma x-1/[S]关系图
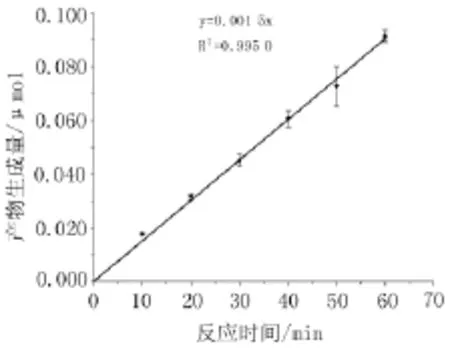
图5 反应时间与产物生成量
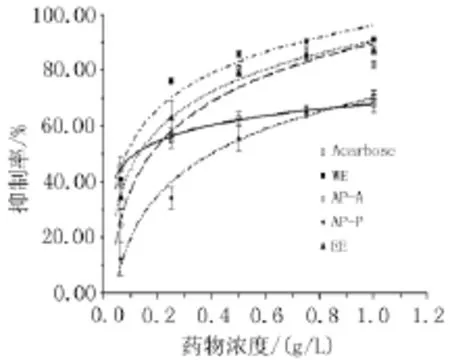
图6 桑叶不同提取物对α-葡萄糖苷酶的抑制
3 讨论
桑叶降糖作用的有效成分(部位)已有许多报道,其中以DNJ为代表的生物碱类成分为主要活性组分,桑叶水提物中含有较多的DNJ,75%醇提物主要存在黄酮、酚类化合物[3],其水提沉淀可能主要以多糖类成分为主,本实验证明这些成分均存在一定的α-葡萄糖苷酶抑制活性。中药具有“多成分、多靶点、多途径”综合起效的作用特点,而“多成分”的问题为首要问题,并不是所有成分都能起效,都可到达靶点部位,因此有必要进一步明确暴露于靶点部位的成分种类及效量。
“暴露-反应-机制”三联研究模式为中医药现代化研究提供创新性研究方法,一方面,药物的体内暴露成分是产生反应的物质基础,在药物作用靶标定位明确的基础上,可通过各种手段明确中药产生作用的“反应成分组”和不产生作用的“无反应成分组”[11]。
本研究结果显示,桑叶不同提取部位IC50比较,水提液抑制作用最强,该提取方式仍可做为桑叶在α-葡萄糖苷酶抑制活性研究的首选提取方式,也符合桑叶传统的水煎煮入药方式,水提液中的“暴露”成分与α-葡萄糖苷酶靶点接触直接“反应”。水提液醇沉后,上清液较整体水提液抑制率有所下降,可将沉淀弃去,有针对性地提取保留与治疗相关的有效成分,去除药效拮抗成分和无作用成分,不仅可以提高疗效、减少副作用,而且还可以大幅度缩小制剂剂量。水提醇沉法即可为桑叶提取工艺优化提供参考,也为下一步动物实验、细胞实验及分子机制研究提供适宜的物质基础。另一方面,桑叶总水提液的抑制活性较上清液与沉淀高,可能为这两部位的协同作用的最终结果。因此,在考虑单个“暴露”成分分离研究的同时,多成分配伍也应该被关注[12]。中药药物良好的成药性是以适合有效组分和功能组分的最优化配置,通过筛选中药有效组分的组成和功能组分的组成,最终开发中药创新药物[13-14]。
同时,本研究拟合了桑叶不同提取部位的α-葡萄糖苷酶抑制率曲线,反映了α-葡萄糖苷酶抑制活性随药物浓度的变化规律。与阿卡波糖对比,桑叶提取液在高浓度时抑制活性均高于阿卡波糖,桑叶在α-葡萄糖苷酶抑制活性方面存在较大潜质,各个类型的化合物可做为该方面深入研究的对象。但是,就抑制率曲线的趋势来看,阿卡波糖α-葡萄糖苷酶活性抑制率随药物浓度变化率较小,桑叶提取液在该药效发挥的过程中受药物浓度变化较灵敏,这也是桑叶做为天然药物在开发过程中需要克服的问题。
此外,实验优化了α-葡萄糖苷酶活性体外评价体系,获得了37℃,PH 6.8环境下以4-硝基苯基-α-D-吡喃葡萄糖苷(pNPG)为底物,大鼠肠α-葡萄糖苷酶酶促反应动力学研究的最适体系。酶促反应随反应环境变化较灵敏,需根据具体实验设计来确定反应体系,本研究则为α-葡萄糖苷酶酶促反应体外评价体系的建立提供了比较完整的方法学研究依据。
[1]Dahlqvist A.Localization of the small-intestinal disaccharidases[J].Am JClin Nur,1967,20(2):81-88.
[2]Puls W,Keup U,Krause HP,et al.Glucosidase inhibition.A new approach of the treatment of diabetes obesity and hyperlipoproteinaemia[J].Naturwiss,1977,64(10):536-537.
[3]Kim JY,Chung HI,Jung KO,et al.Chemical profiles and hypoglycemic activities ofmulberry leaf extracts vary with ethanol concentration[J].Food Sci.Biotechnol,2013,2(5):1-5.
[4]胡竟一,雷玲,刘亚欧,等.桑叶的α-葡萄糖苷酶抑制作用研究[J].中药药理与临床,2006,22(6):44-45.
[5]Hong HC,Li SL,Zhang XQ,et al.Flavonoidswithα-glucosidase inhibitory activities and their contents in the leaves of Morus atropurpurea[J].Chinmed,2013,8(1):19-22.
[6]Tao Y,Zhang Y,Cheng Y,et al.Rapid screening and identification ofα-glucosidase inhibitors from mulberry leaves using enzymeimmobilized magnetic beads coupled with HPLC/MS and NMR[J].Biomed Chromatogr,2013,27:148-155.
[7]Dahlqvist A.Method for assay of intestinal disaccharidases[J].A-nal Biochem,1964,7(1):18-25.
[8]张冉,刘泉,申竹芳,等.应用α-葡萄糖苷酶抑制剂高通量筛选模型筛选降血糖中药[J].中国药学杂志,2007,10(24): 740-743.
[9]Marshall T,Williams KM.Coomassie blue protein dye-binding assaysmeasure formation of an insoluble protein-dye comp lex[J].Anal Biochem,1992,24(1):107-109.
[10]Hao H,Lu YH.Comparison of inhibitory activities and mechanisms of fivemulberry plantbioactive components against α-glucosidase.[J].JAgric Food Chem,2013,61:8110-8119.
[11]赵保胜,刘洋,王晶娟,等.“暴露-反应-机制”三联研究模式学术思想及其中医药领域应用[J].世界中医药,2014,12 (9):1234-1237,1240.
[12]刘洋,潘艳丽,王晶娟,等.多成分药物代谢理论及技术方法分析[J].中草药,2014,45(12):1663-1667.
[13]张涓,张晶晶,程江雪,等.清热药体外抗菌作用的文献再评价[J].川北医学院学报,2013,28(1):23-26.
[14]贾晓斌,陈彦,李霞,等.中药复方物质基础研究新思路和方法[J].中华中医药杂志,2008,30(5):420-425.
α-glucosidase inhibition by different extracts of folium mori in vitro assay
TANG Mingm in1,LIU Yang1,TIAN Sim in1,MA Xiaoyun1,YU Li1,CHENG Xiao1,ZHAO Baosheng2
(1College of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 100102,China;2Center of Scientific Experiment,Beijing University of Chinese Medicine,Beijing 100029,China)
Objective To establishα-glucosidase inhibitory activity evaluation in vitro system,and study the activity ofα-glucosidase inhibitation of differentmulberry extracts.Methods The experimentwas carried outwith 4-nitro phenol-α-D-glucopyranoside(pNPG)as substrate tomeasurewater extractofmulberry leaves(WE),water extraction supernatant(AP-A),precipitation(AP-P)and 75%ethanol extract(EE)for the inhibitory activity ofαglucosidase obtained from small intestine in rats.Resu lts All mulberry leaves extracts haveα-glucosidase inhibitory activity,and the concentrations of IC50of the extracts are as follows:WE:0.09 g/L;AP-A:0.18 g/L; AP-P:0.40 g/L;EE:0.25 g/L;that is,WE>AP-A>EE>AP-P,where IC50ofWE was less than Acarbose(0.16 g/L).Conclusion The water extraction ofmulberry leaf has the strongestα-glucosidase inhibition activity which plays the role on themechanism of hypoglycemic as principal components.The evaluation system ofα-glucosidase inhibition activity in vitro provided a platform for screening the compounds ofα-glucosidase inhibition.
Mulberry leaves;α-glucosidase inhibitors;DNJ;IC50
R963
A
1009-5551(2015)06-0711-04
10.3969/j.issn.1009-5551.2015.06.012
2015-01-05]
(本文编辑施洋)
国家自然科学基金(81374027)
唐明敏(1992-),女,在读硕士,研究方向:多成分药物代谢与新药研发。
赵保胜,男,博士,副教授,硕士生导师,研究方向:中药药效与物质基础研究,E-mail:zhaobs1973@163.com。
