Hippo信号通路在结直肠黏膜癌变过程中的作用
2015-05-09吴桐张翠萍梁坤赵坤张琪田字彬
吴桐,张翠萍,梁坤,赵坤,张琪,田字彬
(青岛大学附属医院,山东 青岛 266003 1 消化内科; 2 感染科)
Hippo信号通路在结直肠黏膜癌变过程中的作用
吴桐1,张翠萍1,梁坤2,赵坤1,张琪1,田字彬1
(青岛大学附属医院,山东 青岛 266003 1 消化内科; 2 感染科)
目的 探讨Hippo信号通路的核心组件哺乳动物绝育20样激酶1(MST1)和Yes相关蛋白(YAP)在结直肠黏膜癌变过程中的作用。方法 应用实时荧光定量PCR法,检测癌旁正常组织、结直肠腺瘤及结直肠癌组织中MST1和YAP mRNA的表达水平;应用免疫印迹法,检测3种组织中MST1和YAP蛋白表达水平。结果MST1在癌旁正常组织、结直肠腺瘤及结直肠癌组织中的表达呈下降趋势,各组间差异有统计学意义(F=13.425、125.092,P<0.05)。YAP在癌旁正常组织、结直肠腺瘤及结直肠癌组织中的表达呈上升趋势,各组间差异有显著意义(F=40.775、181.187,P<0.05)。MST1与YAP1在所有组织中的表达呈负相关(r=-0.399、-0.644,P<0.01)。结论 Hippo信号通路可能在结直肠黏膜癌变过程中起关键作用,该通路可为结直肠癌的预防、治疗和预后判断提供新的靶向指导。
结直肠肿瘤;哺乳动物绝育20样激酶1;原癌基因蛋白质c-yes
多年来,世界上多数国家结直肠癌发病率呈上升趋势[1],我国新发病例每年以4%的比例增加,目前结直肠癌占所有恶性肿瘤的第3~5位[2],上海市2008年更是升至第2位。近年来,结肠镜的广泛应用使得早期结直肠癌的发现逐渐增加,结直肠癌病人生存率逐年提高。大约85%的结直肠癌源于腺瘤性息肉,故腺瘤性息肉被认为是癌前疾病。目前被大多数学者认可的演变过程为正常肠上皮→过度增生上皮→结直肠腺瘤→结直肠癌,此发展过程大约需要10年。结直肠恶性肿瘤的发生与结直肠细胞过度增殖、分化异常及细胞凋亡等多种因素密切相关,是一个多因素、多阶段、多基因变异积累以及相互作用的复杂过程,与体内多种信号通路表达异常相关。Hippo信号通路是近年来新发现的抑癌通路,它在细胞生长、凋亡过程中起着极其重要的调控作用[3]。Hippo信号通路有多种重要调控因子,其中哺乳动物绝育20样激酶1(MST1)和Yes相关蛋白(YAP)在正常组织细胞向癌细胞发展过程中发挥重要的作用。已有研究证实,MST1的表达直接决定了YAP的定植,从而决定正常细胞是否向恶性肿瘤方向发展[4]。本研究旨在探讨Hippo信号通路的核心组件MST1和YAP在癌旁正常组织、结直肠腺瘤及结直肠癌组织中的表达及临床意义。
1 材料与方法
1.1 材料来源
经我院伦理委员会批准及病人同意,选取30例结直肠癌组织及其癌旁正常组织,均取自2013年于我院行手术治疗的结直肠癌病人;选取30例结直肠
腺瘤组织,均取自我院行电子结肠镜检查并行镜下息肉切除术的病人。结直肠癌和结直肠腺瘤均经病理检查证实。结直肠癌病人手术前均未接受放化疗,癌旁正常组织为距离癌组织边缘>5 cm的结直肠黏膜组织。组织离体后立即置液氮中暂存,随后将组织置于-80 ℃冰箱保存。
1.2 实验方法
1.2.1 实时荧光定量PCR方法检测MST1和YAP mRNA表达 使用Trizol试剂盒提取组织总RNA,并进行浓度和纯度检测。选用磷酸甘油醛脱氢酶(GAPDH)作为内参。PCR引物由上海生工生物工程有限公司设计,序列见表1。应用逆转录试剂盒合成cDNA后,按照试剂盒说明书应用SYBR法进行实时荧光定量PCR。反应体系为20.0 μL:SYBR Premix 10.0 μL,上游引物1.6 μL,下游引物1.6 μL,cDNA 2.0 μL,ddH2O 4.8 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。反应结束后根据扩增曲线得到CT值,结果以2-△△CT表示。Trizol试剂盒、TaKaRa Pri-merScriptTMRT、核酸分子质量标准以及SYBR®Premix Ex TaqTMⅡ均购自大连宝生物公司,氯仿、异丙醇购自南京化学试剂有限公司。
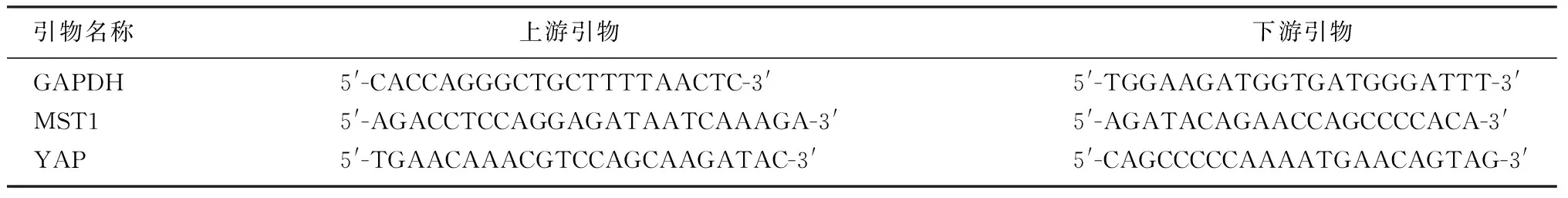
表1 实时荧光定量PCR所用引物序列
1.2.2 免疫印迹法检测MST1和YAP蛋白的表达在低温条件下应用BCA试剂盒提取组织总蛋白,用酶标仪测定波长562 nm处吸光度值,根据标准曲线计算蛋白浓度。具体操作步骤参照试剂盒说明书进行。BCA试剂盒购自美国Pierce公司,β-actin兔抗人一抗、MST1兔抗人一抗、YAP兔抗人一抗、辣根过氧化物酶标记羊抗兔二抗购自Abcam公司,ECL化学发光显色试剂盒购自BIO-RAD公司。
1.3 统计学处理
采用SPSS 18.0软件进行统计学处理。计量数据比较采用单因素方差分析,P<0.05为差异有统计学意义;采用Pearson相关性检验进行相关性分析,P<0.01为差异有统计学意义。
2 结 果
2.1 MST1、YAP mRNA在各组织中的表达
MST1 mRNA在癌旁正常组织、结直肠腺瘤及结直肠癌组织中的表达呈下降趋势,各组间差异有显著性(F=13.425,P<0.05);YAP mRNA在癌旁正常组织、结直肠腺瘤及结直肠癌组织中的表达呈上升趋势,各组间差异有显著性(F=40.775,P<0.05)。见表2。
2.2 MST1、YAP蛋白在各组织中的表达
MST1蛋白在癌旁正常组织、结直肠腺瘤及结直肠癌组织中的表达呈下降趋势,各组间差异有显著性(F=125.092,P<0.05);YAP蛋白在癌旁正常组织、结直肠腺瘤及结直肠癌组织中的表达呈上升趋势,各组间差异有显著意义(F=181.187,P<0.05)。与结直肠癌组织相比,结直肠腺瘤和癌旁正常组织中MST1蛋白的表达分别上升了37.3%和71.2%,YAP的表达分别下降了29.5%和51.3%。见表2、图1。
2.3 所有组织中MST1与YAP1表达的相关性
所有组织中MST1与YAP1 mRNA和蛋白的表达均呈负相关(r=-0.399、-0.644,P<0.01)。
表2 MST1和YAP在各组织中的表达
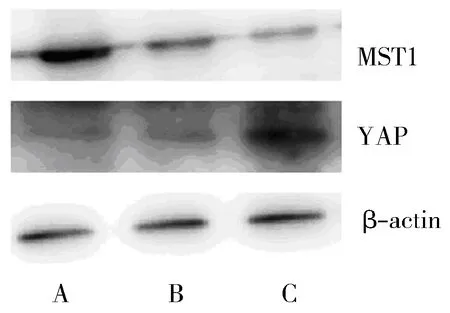
A:癌旁正常组织,B:结直肠腺瘤组织,C:结直肠癌组织。
3 讨 论
内环境的相对稳定对于机体的生长发育十分重要。哺乳动物体内存在着多种细胞信号通路,其在维持细胞正常的生长、发育、凋亡方面扮演着极其重
要的角色。各通路一旦失活,就会促进细胞增殖和(或)抑制细胞凋亡,最终引起细胞发生恶变,导致肿瘤的发生[5]。
Hippo信号通路是近年来发现的一种细胞内部信号通路。作为一种抑癌通路,该通路主要在抑制细胞生长、诱导细胞凋亡和调控器官大小方面发挥作用[6]。Hippo信号通路首先在黑腹果蝇体内被发现,研究者对该通路施予外在干预后,观察到果蝇的眼睛和翅膀大小发生变化,证实Hippo通路的作用之一是影响细胞增殖过程[7]。Hippo信号通路是高度保守的生长控制通路,其在哺乳动物中主要由MST、Lats、YAP等因子构成[8]。研究证实,MST直接对YAP起调控作用:MST基因失活后,该通路下游靶基因YAP即被激活,激活后的YAP促进通路中下游因子转录与表达,最终促进细胞增殖、抑制细胞凋亡、解除接触抑制和促进肿瘤发生[9]。
MST1是Hippo信号通路中上游信号分子之一,与果蝇体内hpo蛋白激酶都属于STE蛋白激酶家族成员[10]。MST1分子结构中,N末端含有丝氨酸-苏氨酸蛋白激酶结构域,C末端包含卷曲螺旋结构域,这一结构域即为SARAH结构域。正常机体的细胞增殖过度时,MST基因激活,编码的MST蛋白会促进细胞凋亡过程,维持机体细胞数目的稳定。相关研究证实,MST通过MST1(Thr183)/2(Thr180)位点发生自身磷酸化,然后进一步地活化Lat1/2,Lat1/2磷酸化后使YAP失活,失活后的YAP被留置于细胞质内并与14-3-3蛋白结合,最终被降解,从而诱导细胞的凋亡,阻止细胞过度增殖[11]。磷酸化的Lat1/2同时也会激活SAPK、Jnk及P53等信号通路,最终结果都是诱导细胞凋亡[12]。CINAR等[13]的研究显示,MST基因缺失后,前列腺细胞会向恶性细胞发展。本研究结果表明,不论是在mRNA还是在蛋白表达水平上,结直肠癌组织MST1的表达量均明显低于结直肠腺瘤与癌旁正常组织,结直肠腺瘤组织MST1的表达水平介于癌旁正常组织和结直肠癌组织之间,表明肠黏膜细胞在恶变过程中Hippo信号通路中的MST基因是受到抑制的,并且结直肠腺瘤中MST基因在一定程度上也处于抑制状态。
YAP是Hippo信号通路下游的转录共激活因子,与果蝇体内Yki蛋白同源,有相似的生物学活性。YAP具有致癌活性,其通过促进细胞增殖与抑制细胞凋亡导致恶性肿瘤的发生。正常情况下,YAP受通路上游因子的影响发生磷酸化,磷酸化后的YAP积聚于细胞浆内,通过磷酸化的ser127与14-3-3蛋白结合,无法进入细胞核内,从而抑制细胞增殖。而在肿瘤发展过程中,YAP失去上游因子的控制,无法磷酸化,非磷酸化的YAP进入到细胞核内,与核内转录增强因子TAZ形成YAP-TAZ复合体,进而与TEA功能域转录因子TEAD结合,促进细胞周期蛋白Cycling E表达,从而促进细胞增殖。并且,非磷酸化的YAP还可以诱导凋亡调控因子cIAPI表达增加,抑制细胞增殖[14]。已证实YAP蛋白过度表达和(或)在细胞核内过度蓄积在多种恶性肿瘤中存在,如肝癌、胃癌、乳癌、肺癌及前列腺癌等[15]。本研究结果显示,结直肠癌组织YAP的表达水平较正常肠黏膜与结直肠腺瘤组织显著升高,表明肠黏膜细胞在从结直肠腺瘤向结直肠癌进展过程中,Hippo信号通路中的YAP蛋白磷酸化受到了抑制,非磷酸化的YAP蛋白相对增多,后者无法被留置于细胞浆内,而是进入细胞核,通过一系列级联反应,促进细胞增殖,抑制细胞凋亡,最终引起恶性肿瘤发生。
另外,本研究结果显示,同一标本中,不论是癌旁正常组织、结直肠腺瘤组织,还是结直肠癌组织,MST1与YAP的表达呈负相关,这与之前有关研究的结果一致[16]。并且本研究结果呈现出随着疾病严重程度进展,这种负相关程度减弱的趋势,表明在结肠黏膜细胞恶变过程中,MST对YAP的负向调控作用逐渐减弱。
总之,在结直肠黏膜癌变过程中,Hippo信号通路发挥着非常重要的调节作用。而检测MST1和YAP,为阐明结直肠黏膜发生恶性转化提供了新的分子机制,也为未来结直肠癌的早期预防及基因治疗提供了新的靶向治疗措施。
[1] JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics, 2008[J]. CA Cancer J Clin, 2008,58(2):71-96.
[2] 梁晨,韩盛玺,王晋萍. 辣椒素对人结肠癌SW480细胞株增殖作用的影响[J]. 齐鲁医学杂志, 2011,26(1):11-12,16.
[3] ZHAO B, LEI Q Y, GUAN K L. The Hippo-YAP pathway: new connections between regulation of organ size and cancer[J]. Curr Opin Cell Biol, 2008,20(6):638-646.
[4] 张红珠,张翠萍,张琪,等. MST1与YAP1在食管疾病中的表达及意义[J]. 青岛大学医学院学报, 2014,50(1):62-63,67.
[5] PAN D. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy(CLASSIC): a phase 3 open-label, randomized controlled trial[J]. Lancet, 2012,379(9813):315-321.
[6] ZHENG T, WANG J, JIANG H, et al.
Hippo signaling in oval cells and hepatocarcinogenesis[J]. Cancer Lett, 2011,302(2):91-99.
[7] BADOUEL C, GARG A, MCNEILL H. Herding hippos: re-gulating growth in flies and man[J]. Curr Opin Cell Biol, 2009,21(6):837-843.
[8] ZENG Q, HONG W. The emerging role of the hippo pathway in cell contact inhibition, organ size control, and cancer deve-lopment in mammals[J]. Cancer Cell, 2008,13(3):188-192.
[9] YU F X, ZHAO B, PANUPINTHU N, et al. Regulation of the Hippo-YAP pathway by g-protein-coupled receptor signaling[J]. Cell, 2012,150(4):780-791.
[10]MORINAKA A, FUNATO Y, UESUGI K, et al. Oligomeric peroxiredoxin-Ⅰ is an essential intermediate for p53 to activate MST1 kinase and apoptosis[J]. Oncogene, 2011,30(40):4208-4218.
[11]WANG L, SHI S, GUO Z, et al. Overexpression of YAP and TAZ is an independent predictor of prognosis in colorectal cancer and related to the proliferation and metastasis of colon cancer cells[J]. PLoS One, 2013,8(6): e65539.
[12]AVRUCH J, ZHOU D, FITAMANT J, et al. Mst1/2 signalling to Yap: gatekeeper for liver size and tumour development[J]. Br J Cancer, 2011,104(1):24-32.
[13]CINAR B, COLLAK F K, LOPEZ D, et al. MST1 is a multifunctional caspase-independent inhibitor of androgenic signaling[J]. Cancer Res, 2011,71(12):4303-4313.
[14]LI Z, ZHAO B, WANG P, et al. Structural insights into the YAP and TEAD complex[J]. Genes Dev, 2010,24(3):235-240.
[15]ZENDER L, SPECTOR M S, XUE W, et al. Identification and validation of oncogenes in liver cancer using an integrative oncogenomic approach[J]. Cell, 2006,125(7):1253-1267.
[16]LIU A M, POON R T, LUK J M. MicroRNA-375 targets Hippo-signaling effector YAP in liver cancer and inhibits tumor properties[J]. Biochem Biophys Res Commun, 2010,394(3):623-627.
(本文编辑 马伟平)
EFFECT OF HIPPO PATHWAY ON THE PROCESS OF COLORECTAL MUCOSA CARCINOGENESIS
WUTong,ZHANGCuiping,LIANGKun,ZHAOKun,ZHANGQi,TIANZibin
(Department of Gastroenterology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
ObjectiveTo investigate the effect of Hippo pathway components-mammalian sterile 20-like kinase 1 (MST1) and Yes associated protein (YAP)-on the process of mucosa carcinogenesis in colon and rectum.MethodsEmploying real-time polymerase chain reaction (RT-PCR), the expressions of mRNA of MST1 and YAP in paraneoplastic normal intestinal tissue, colorectal adenoma, and colorectal cancer were detected, and using Western blot method, the expressions of MST1 protein and YAP protein in three kinds of the tissues were measured.ResultsThe MST1 mRNA expression presented a decreasing tendency in normal paraneoplastic tissue, colorectal adenoma and colorectal cancer, the difference between each group was significant (F=13.425,125.092;P<0.05). And the YAP mRNA expression in the above three kinds of the tissues showed an increasing tendency, the difference between each group was significant (F=40.775,181.187;P<0.05). The expression of MST1 in all the tissues was negatively correlated with YAP expression (r=-0.399,-0.644;P<0.01).ConclusionHippo signal pathway may play a key role in the development from colorectal adenoma to colorectal cancer, which provides a new target guidance for prevention, therapy and prediction of prognosis of this malignancy.
colorectal neoplasms; mammalian sterile 20-like kinase 1; proto-oncogene proteins c-yes
2015-01-15;
2015-05-28
吴桐(1989-),女,硕士研究生。
张翠萍(1962-),女,主任医师,硕士生导师。
R735.3
A
1008-0341(2015)04-0459-04
