18株植物内生真菌的分离纯化及鉴定
2015-05-05浅井禎吾大島吉輝
鲁 群,浅井禎吾,大島吉輝
(1.华中农业大学食品科学技术学院,湖北武汉 430070;2.日本东北大学药学研究科,宫城仙台 980-8578)
18株植物内生真菌的分离纯化及鉴定
鲁 群1,浅井禎吾2,大島吉輝2
(1.华中农业大学食品科学技术学院,湖北武汉 430070;2.日本东北大学药学研究科,宫城仙台 980-8578)
植物内生真菌生活环境特殊、种类多,通过大量的分离和筛选得到有价值的内生真菌,可以为新型天然产物的获得提供更丰富的来源。本实验随机采摘了12种植物,采用组织分离法从中有选择性地分离纯化得到了18株内生真菌,通过28S rDNA序列测定和系统发育树分析,对18株真菌进行了鉴定。结果表明,这18株内生真菌主要属于Cladosporium,Paramicrothyrium,Mycosphaerella,Colletotrichum,Corynespora,Sarocladium,Guignardia,Phoma,Pseudocercospora,Collembolispora,Alternaria,Glomerella等属,说明了植物内生真菌的丰富多样性。得到的18株内生真菌中有3株不常见真菌和一株新真菌,其次级代谢产物值得进一步研究。
内生真菌,分离,鉴定
植物内生真菌(endophytic fungi)是指在其生活史中部分或者全部时期生活在植物体内,而不会引起宿主植物产生明显病害症状的一类真菌[1]。内生真菌广泛存在于植物体中,来源广、种类繁多,可以通过传统的人工组织分离法获得,操作简便、成本低。内生真菌次级代谢产物非常丰富,可以合成与宿主植物相同或不同的活性物质[2]。1993年美国Stierle等[3]从短叶红豆杉的韧皮组织中分离得到一株内生真菌(Taxomyces andreanae),也可以合成抗癌物质紫杉醇;另外有研究表明从内生真菌分离得到的活性物质中有50%以上是新化合物[4]。
内生真菌合成的黄酮、生物碱、萜类、甾体等多种化合物大多具有抗菌、抗癌、生物防治等活性[5-6]。目前关于天然产物的研究中,对植物的研究较多,以至于植物的过度使用。内生真菌的开发不仅可以解决资源问题,而且对新型天然产物的获得具有重大意义。由于不同地域不同环境中植物的内生真菌有所不同,不能准确预测从某种植物中能分离得到哪些内生真菌或是否能分离得到新菌株,所以本实验采取随机采摘,采摘的12种植物大多数为药用植物,希望能获得产活性物质的内生真菌。分离得到的内生真菌采用分子手段对其进行鉴定,rDNA序列分析是鉴定真菌的常用方法,其中28S rDNA基因序列进化缓慢、相对保守,通过测定未知真菌的该序列,再与数据库中的序列进行比较来鉴定真菌。

表1 采集植物信息
1 材料与方法
1.1 材料与仪器
植物样品 日本东北大学药用植物园,分别采集植物的果实、叶、茎、根等部位,并做好详细记录,见表1;Prime STAR TAKARA公司;QIAEX II Gel Extraction Kit 德国Qiangen公司;选择性分离培养基 马铃薯葡萄糖琼脂(PDA)加氯霉素,氯霉素终浓度为50 μg/mL。
TP600梯度PCR仪 日本TaKaRa公司;PRISMTM310测序仪 美国ABI公司;Nanodrop 2000分光光度计 美国Thermo公司;YXQ-LS-50S11立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;KA-1000台式离心机 上海安亭科技仪器厂。
1.2 实验方法
1.2.1 植物内生真菌的分离纯化 采用严格的表面消毒法分离植物中的内生真菌[7-8]。采摘新鲜植物样品,用流水冲洗干净除去表面泥沙,组织较柔软部位,如叶、花,放入80%乙醇溶液中消毒2 min;组织较硬部位,如根,先放入80%乙醇溶液中消毒1 min,再放入1%次氯酸钠溶液中消毒5 min,最后放入80%乙醇溶液中消毒1 min。取出消毒后的植物组织,置于无菌培养皿中,剪取组织中间部分约0.5 cm×0.5 cm大小的小块贴放于分离培养用平板中,每皿4块。记录植物名、部位、日期等,置于25 ℃的恒温培养箱静止培养。植物内生的真菌相对生长缓慢,大约培养后的第三天才开始缓慢生长,培养过程中根据菌落长出的时间、形态和颜色的差异等,分别挑取菌落边缘的少量菌丝接于新的平板上,继续培养并仔细观察菌落特征,再挑取菌落边缘的菌丝接于新的平板上,反复纯化,最后得到纯化的植物内生真菌。
1.2.2 植物内生真菌DNA的提取 内生真菌基因组DNA的提取参考SDS法[9],稍加改进。具体提取步骤如下:在超净台中挑取约1~2 cm2的菌体于无菌离心管中,研钵置于冰上,加入少量液氮,倒入菌体,迅速充分研磨,转移至离心管。加200 μL TE和200 μL溶菌液(2% SDS,0.1 mol/L NaCl,10 mmol/L EDTA,50 mmol/L Tris-HCl),涡旋,静置5 min,15000 r/min离心30 s,上清液转移。加400 μL抽提液,抽提液为苯酚/氯仿/异戊醇(体积比25∶24∶1)。涡旋,15000 r/min离心5 min,上清液转移。加1 mL无水乙醇和40 μL 3 mmol/L NaAc,15000 r/min离心15 min,舍弃上清液。加200 μL 70%乙醇,15000 r/min离心5 min,舍弃上清液。
1.2.3 目标DNA片段的PCR扩增 真菌基因组中编码核糖体的基因28S rDNA中D1/D2区域序列长度适中,适用于真菌鉴定[10]。以提取的DNA为模板,利用rDNA的保守序列设计引物,PCR扩增未知真菌的28S rDNA D1/D2区域,引物为NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)。使用Prime STAR体系,反应液总体积为15 μL,其组成见表2。

表2 PCR反应体系
PCR的反应条件为:98 ℃ 1 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 40s,40次循环;4 ℃ 保存。
1.2.4 DNA片段的回收 使用QIAEX II胶回收试剂盒对DNA片段进行回收,具体操作步骤:PCR产物用0.8%琼脂糖(Gene pure)凝胶电泳后,用ViewaBlue染色10 min。多次浸洗,切出被染色的目的DNA的琼脂糖凝胶,称重。加入3倍凝胶重量的溶胶液Buffer Q和10 μL QIAEX,涡旋。50 ℃ 加热10 min。4 ℃ 12000 r/min离心30 s,舍弃上清液,加500 μL Buffer Q,涡旋。与上一步相同操作,加500 μL Buffer PE,涡旋。重复上一步,舍弃上清液,风干。加20 μL超纯水,涡旋,静置5 min,4 ℃ 12000 r/min离心30 s,上清液转移。重复此步骤。Nanodrop 2000测定仪测定DNA浓度。计算其在260 nm和280 nm的光吸收值的比值(OD260/OD280)。

表4 植物内生真菌的形态特征
1.2.5 测序 使用Big Dye测序试剂盒,将回收的DNA片段再一次PCR扩增,引物NL1、NL4分别稀释100倍。每个真菌样品分别做两个反应,一管中加入引物NL1,另一管中加入引物NL4,以保证测序的准确性,反应液总体积为10.6 μL,其组分见表3。

表3 测序用PCR反应体系
PCR的反应条件为:96 ℃ 1 min;96 ℃ 10 s,50 ℃ 5 s,60 ℃ 40 min,25次循环;4 ℃ 保存。产物全部转移到离心管中,加30 μL 无水乙醇和0.625 μL 0.5 mol/L EDTA,静置15 min,14000 r/min离心20 min。舍弃上清液,加30 μL 70%乙醇溶液,14000 r/min离心5 min。舍弃上清液,风干,加26 μL HI-DI甲酰胺。96 ℃加热2 min,置于冰上,将待测品全部转移到测序管中,用DNA测序仪进行序列测定。
1.2.6 测序结果分析 测序仪测定后,得到真菌28S rDNA D1/D2区域序列。将序列在NCBI数据库中进行BLAST序列相似性搜索,下载相似性高的菌株的序列,使用软件ClustalX 1.8进行多序列对比。再用软件MEGA5.10进行聚类分析,采用邻位相连算法(Neighbor-Joining),通过自举分析(bootstrap)进行置信度检测,自展次数为1000,选择Kimura 2双参数模型计算进化距离,构建系统发育树。分离得到的内生真菌全部鉴定后,用上述方法进行多序列对比及构建系统发育树。
2 结果与分析
2.1 菌落形态特征

图1 植物内生真菌的照片Fig.1 Photos of endophytic fungi from plants注:(1)WLY,(2)WLJ,(3)SLGB,(4)SLGG,(5)RGY-1,(6)RGY-2,(7)FCMY,(8)TGJ,(9)HGZY,(10)HGZG,(11)YJJ,(12)BXG,(13)QMY,(14)QMG,(15)ZSY-1,(16)ZSY-2,(17)SLSY,(18)SCHY。
本实验共采摘12种植物,对果实、叶、茎等27个部位进行表面消毒后培养。培养过程中,选择性的分离纯化了18株内生真菌(表4),菌落形态见图1。从表4和图1可以看出,选择的植物内生真菌大多从叶片中分离得到,菌落大多具有颜色,与平时常见的丝状真菌相比形态较为特别。
2.2 PCR产物的检测
提取植物内生真菌的基因组DNA,以其为模板,在特异性引物的引导下,PCR扩增出内生真菌28S rDNA D1/D2片段,回收目的DNA片段,进一步纯化。测定DNA的浓度并计算OD260/OD280值,结果见表5。OD260/OD280值在1.6~2.0之间,说明DNA没有蛋白质、RNA等杂质污染;OD260/OD280值在1.8左右说明DNA纯度最高。由表中可以看出,18组DNA的OD260/OD280值均在1.6~2.0之间,表明回收的DNA片段纯度较高。
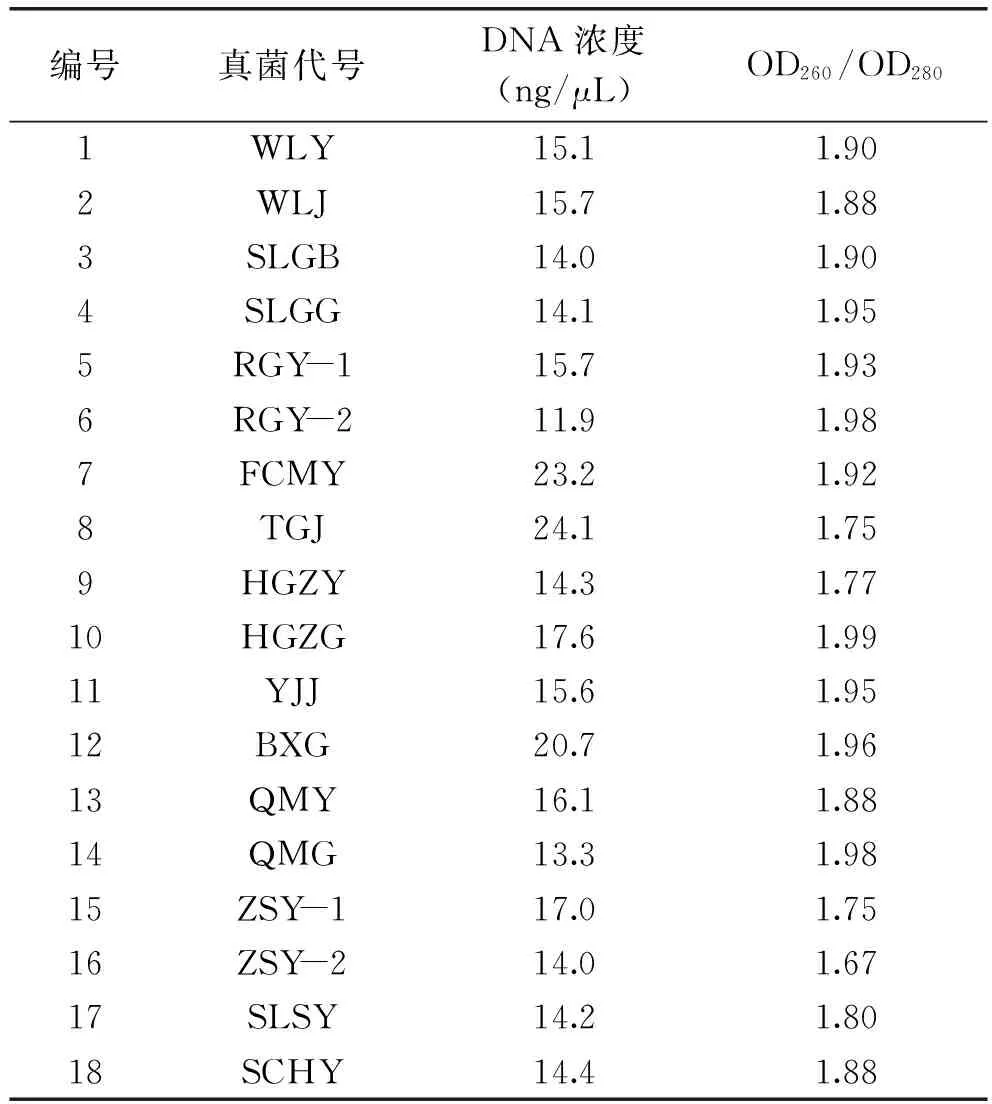
表5 回收DNA片段的定量
2.3 28S rDNA D1/D2区域序列的分析
测序仪测序得到18株植物内生真菌的28S rDNA D1/D2区域碱基序列长均为600 bp左右,长度符合此区域序列。测序得到的序列与NCBI数据库中的已知序列进行比对分析,搜索出相似性高的序列,相似率达到99%以上说明相似性很高,再结合菌落形态特征和系统发育分析,鉴定出内生真菌(表6)。
菌株WLJ、SLGB、SLGG、RCY-1、RGY-2、FCMY、HGZG、YJJ、QMY、QMG和SLSY的序列在数据库中均搜索到一株相似率最高的菌株,结果见表6。菌株WLY、TGJ、ZSY-2、SCHY的序列分别与Cladosporium、Colletotrichum、Alternaria、Glomerella属的多株菌株的序列相似率最高,所以分别鉴定为Cladosporiumsp.、Colletotrichumsp.、Alternariasp.、Glomerellasp.。菌株HGZY与Guignardiamangiferae(KF955298.1)、Guignardiavaccinii(EU167584.1)、Phyllostictafallopiae(AB454307.1)、Dothideomycetessp. genotype 233(JQ760442.1)等多株菌株的序列相似率都达到100%,结合菌落形态特征分析,鉴定为Guignardiamangiferae。菌株BXG与Phialophorasp. 5H1-P3-P7-2(KM232467.1)、Acremoniumsp. 5H1_P3_P5_1(KM232466.1)、Mollisiadextrinospora(HM116757.1)、Protoventuriasp. M1069-OL(AB831875.1)和Collembolisporabarbata(KC005812.1)的序列相似率都达到99%,构建系统发育树(图2),结果显示菌株BXG与Collembolisporabarbata在同一发育分支上,故鉴定为Collembolisporabarbata。

表6 内生真菌鉴定结果

图2 内生真菌BXG 28S rDNA D1/D2序列的聚类分析Fig.2 Phylogenetic analysis of 28S rDNA D1/D2 sequence of endophytic fungus strain BXG
菌株ZSY-1与数据库中搜索到的菌株的序列相似率都在87%以下,说明ZSY-1可能是新菌株,其28S rDNA D1/D2区域碱基序列如下:

2.4 构建系统发育树
18株植物内生真菌鉴定后,使用软件ClustalX 1.8对18株真菌的28S rDNA D1/D2序列进行多重对比,再使用MEGA5.10构建系统发育树,结果见图3。从图中可以直接看出各菌株的亲缘关系和进化地位;图中显示RGY-2和SLSY、RGY-1和TGJ的亲缘关系高,与BLAST搜索得出的结果一致,RGY-2鉴定为Corynesporatorulosa、SLSY鉴定为Corynesporacassiicola,两株真菌都是Corynespora属,RGY-1鉴定为Colletotrichumboninense、TGJ鉴定为Colletotrichumsp.,两株真菌都是Colletotrichum属,但从菌落特征上看,TGJ和RGY-1明显不是同一株真菌;BLAST搜索结果中有3株不常见真菌SLGB、QMY和QMG,虽然可以在数据库中搜索到,但尚没有属种名称,从图3中可以看出QMG和HGZG(Phoma minor)的亲缘关系高;在数据库中未搜索到的菌株ZSY-1在图中与其他菌株的亲缘关系低。

图3 基于28S rDNA D1/D2序列分析构建的内生真菌的系统发育树Fig.3 Phylogentic tree constructed for endophytic fungi based on 28S rDNA D1/D2 sequence
3 结论
采用组织分离法从12种植物中选择性分离纯化得到18株内生真菌,通过28S rDNA序列测定和系统发育树分析鉴定出18株植物内生真菌主要属于Cladosporium,Paramicrothyrium,Mycosphaerella,Colletotrichum,Corynespora,Sarocladium,Guignardia,Phoma,Pseudocercospora,Collembolispora,Alternaria,Glomerella等属,其中菌株SLGB、QMY和QMG为3株不常见真菌,真菌ZSY-1经数据库检索未搜索到相似序列,可能是新菌株。本研究结果说明了植物内生真菌的丰富多样性,是一类具有潜在应用价值的微生物资源,值得更充分深入的研究;本实验分离得到的内生真菌,特别是新菌株,为天然产物的获得和开发提供了更丰富的来源,其次级代谢产物值得进一步研究。
[1]胡凤,程玉鹏,王振月,等.药用植物内生真菌研究现状及其应用前景[J].生物技术通讯,2008,19(5):781-783.
[2]Zhu YY,Ai C,Zhang J,et al. Bioactive secondary metabolites from endophytic fungi in plants[J]. Prog Chem,2011,23(4):704-730.
[3]Stierle A,Strobel G,Stierle D. Taxol and taxane production by Taxomyces andreanae,an endophytic fungus of Pacific Yew[J]. Science,1993,260(5105):214-216.
[4]Strobel G A. Endophytes as sources of bioactive procducts[J]. Microbes Infect,2003,5(6):535-544.
[5]Joseph B,Priya R M. Bioactive compound from endophytes and their potential in pharmaceutical effect:a review[J]. Am J Biochem Mol Biol,2011,1(3):291-309.
[6]Li J Y,Strobrel G,Harper J,et al. Cryptocin,a potent tetramic acid antimycotic from the endophytic fungus Cryptosporiopsis cf. quercina[J]. Org Lett,2000,2(6):767-770.
[7]Miller K I,Chen Q,Man-Yuen S D,et al. Culturable endophytes of medicinal plants and the genetic basis for their bioactivity[J]. Microb Ecol,2012,64(2):431-449.
[8]Huang Y J,Wang J F,Li G L,et al. Antitumor and antifungal activities in endophytic fungi isolated from pharmaceutical plants Taxus mairei,Cephalataxus fortunei and Torreya grandis[J]. FEMS Immunol Med Mic,2001,31(2):163-167.
[9]陈丹,苏林娟,陈思雅.一株茶树叶部内生木霉的分离和鉴定[J].福建林业科技,2010,37(2):15-18.
[10]马爱瑛. rDNA分析在真菌分类鉴定中的应用[J].安徽农业科学,2010,38(32):18079,18081.
Isolation and identification of 18 strains of endophytic fungi from plants
LU Qun1,TEIGO Asai2,YOSHITERU Oshima2
(1.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China;2.Graduate School of Pharmaceutical Sciences,Tohoku University,Sendai 980-8578,Japan)
Plant endophytic fungi have the characteristics of special living environment and variety. By a large number of isolation and screening to obtain valuable endophytic fungi,it can provide more sources for novel natural products. In this study,12 kinds of plants were randomly picked. 18 strains of endophytic fungi were isolated by traditional artificial separation method. These endophytic fungi were identified using 28S rDNA sequencing and phylogenies. The results showed that 18 strains of endophytic fungi mainly belonged toCladosporium,Paramicrothyrium,Mycosphaerella,Colletotrichum,Corynespora,Sarocladium,Guignardia,Phoma,Pseudocercospora,Collembolispora,AlternariaandGlomerellasp.,indicating the rich diversity of endophytic fungi. Among these fungi,there were three rare strains and a new strain of fungi. The secondary metabolites of these fungi were worth further studying.
endophytic fungi;isolation;identification
2015-02-12
鲁群(1987-),女,博士,讲师,研究方向:天然产物化学与食品功能因子,E-mail:luqun@mail.hazu.edu.cn。
中国国家留学基金委资助。
TS201.3
A
1002-0306(2015)21-0152-05
10.13386/j.issn1002-0306.2015.21.023
