绿原酸对高脂饲喂SD大鼠脂肪组织三酰甘油合成降解关键酶基因表达的影响
2015-05-05蔡小庆闫晓东刘思乐
宋 卓,蔡小庆,闫晓东,刘思乐,王 征
(湖南农业大学生物科学技术学院,湖南长沙 410128)
绿原酸对高脂饲喂SD大鼠脂肪组织三酰甘油合成降解关键酶基因表达的影响
宋 卓,蔡小庆+,闫晓东,刘思乐,王 征*
(湖南农业大学生物科学技术学院,湖南长沙 410128)
目的:研究绿原酸对高脂饲喂SD大鼠附睾脂肪组织三酰甘油合成及代谢关键酶基因表达的影响,探讨绿原酸改善肥胖的新靶点。方法:雄性SD大鼠随机分成对照组(NC)、高脂饲料模型组(HFD)、高脂饲料+绿原酸低、高剂量组(20、90mg·kg-1·d-1,HFD-LC、HFD-HC)和罗格列酮组(ROS),饲养12周后处死,测定体脂含量变化以及附睾脂肪组织中二酰甘油酰基转移酶(Diacylgycerol acyltransferase 2,DGAT2)、甘油三脂脂肪酶(Adipose triglyceride lipase,ATGL)和激素敏感脂肪酶(Hormone-sensitive lipase,HSL)mRNA表达水平。结果:与NC组相比,HFD组体脂含量、DGAT2、HSL mRNA表达水平明显升高,ATGL mRNA表达水平下降不显著。与HFD组相比,HFD-LC、HFD-HC对体脂率、DGAT2 mRNA影响不明显(p>0.05),但能极显著提高ATGL mRNA表达水平,HFD-HC组HSL表达水平也极显著上升。结论:绿原酸能显著提高大鼠附睾脂肪组织ATGL和HSL mRNA表达水平,有效控制体脂堆积。
绿原酸,脂代谢,ATGL,HSL,DGAT2
随着社会的飞速发展,人们的饮食生活产生了巨大的改变,肥胖日益成为全球性的公共卫生问题。据报道,到2030年,全球将有21.6亿成年人体重超重,11.2亿人体重达到肥胖[1-2]。由肥胖诱导产生的慢性炎症将进一步引发胰岛素抵抗(Insulin Resistance,IR)并促进各类代谢综合征的发生,如2型糖尿病、心血管疾病、动脉粥样硬化、癌症等等[3]。肥胖的类型分为三大类:遗传性肥胖、继发性肥胖和单纯性肥胖。前两者是基因及机体内分泌障碍所导致,占肥胖人群比例小,后者是由营养过剩导致的全身性脂肪过度积累,占肥胖人群总数90%以上[4]。机体营养过剩时,多余的能量主要以三酰甘油的形式储存起来,因此,对三酰甘油(Triglyceride,TG)合成及代谢关键酶的调控,是缓解肥胖的重要靶点之一。

表1 普通饲料营养成分表Table 1 Composition of the basal diet

表2 高脂饲料配方表Table 2 Composition of the high fat diet
绿原酸(Chlorogenic acid,CGA)是一类广泛存在于食物中的多酚化合物,异构体及其衍生物丰富[5],以5-咖啡酰奎尼酸(5-caffeoylquinic acid ,5-CQA)在自然界中最为常见。在杜仲、金银花、向日葵、咖啡等植物以及苹果、蔬菜、大豆、绿茶等食品中含量较高[6]。Khang[7]等研究发现,绿原酸可通过对AMPK的活化,影响下游乙酰辅酶A羧化酶的表达,进而降低脂肪酸合成;Zhang[8]等用db/db小鼠发现,绿原酸干预12周后,血浆中TG浓度显著降低;邱阳阳[9]体外研究咖啡碱、绿原酸对3T3-L1细胞分化过程中相关基因、酶表达的影响发现,咖啡酸、绿原酸组合能抑制细胞分化前期PPARγ2的表达,增强AMPK、ATGL、HSL mRNA、蛋白的表达和酶活性,从而降低脂肪酸合成、减少TG积累。体内实验[7]发现绿原酸对脂肪酸合成酶的活性显著降低;本实验组前期也发现,绿原酸在抗氧化抗炎症、调节糖脂代谢等方面都有卓著功效,能通过对PPARs的调节,改善长期高脂饮食导致的脂代谢紊乱,减缓脂肪肝的形成[10-13]。但是,关于绿原酸对高脂饮食条件下,脂肪组织三酰甘油合成及代谢关键酶的影响还鲜有报道。因此,本实验拟研究高脂饮食条件下,绿原酸干预对SD大鼠脂肪组织三酰甘油合成及代谢关键酶表达的影响,探讨绿原酸改善肥胖的新靶点。
1 材料与方法
1.1 材料与仪器
绿原酸(CGA) 成都普瑞法科技开发有限公司;罗格列酮 成都恒瑞制药有限公司;雄性Sprague-Dawley(SD)大鼠 40只,SPF级,210~230g,由湖南斯莱克景达实验动物有限公司提供,合格证编号为(No.43004700000100);Trizol 美国Invirtrogen公司;反转录试剂盒 美国Fermentas公司;荧光定量PCR试剂盒(SYBR Green) 天根生化科技有限公司。
实验过程中所用普通饲料及高脂饲料均由湖南斯莱克景达实验动物有限公司生产,普通饲料营养成分列于表1,高脂饲料配方见表2。经计算[14],普通饲料总能13.3兆卡/千克,其中脂肪提供16%的能量;高脂饲料脂肪总能19.5兆卡/千克,其中脂肪提供55%的能量。
1.2 实验方法
1.2.1 处理方法 大鼠适应性饲养一周后,随机分为5组:空白对照组(NC组)、模型组(HFD组)、高低剂量绿原酸干预组(HFD-HC组、HFD-LC组)以及阳性对照组(ROS组),NC组给予普通饲料喂养,其余各组给予高脂饲料喂养,自由摄食饮水。其中HFD-LC和HFD-HC组分别按照绿原酸20mg·kg-1·d-1和90mg·kg-1·d-1剂量进行灌胃;ROS组按照罗格列酮3mg·kg-1·d-1剂量进行灌胃;NC组和HFD组则每天灌胃等体积超纯水。定期测定大鼠体重,饲喂12周后处死,取大鼠肾周脂肪、附睾脂肪称重,计算体脂率。体脂率(g/kg)=(肾周脂肪质量g+附睾脂肪质量g)/大鼠体重(kg)。取部分附睾脂肪组织于冻存管中用液氮速冻后,置于-80℃冰箱保存备用。
1.2.2 荧光定量PCR检测附睾脂肪组织DGAT、HSL、ATGL mRNA表达 TRIZOL法提取脂肪RNA,微量光度计检测RNA含量和纯度;取1μg RNA,按试剂盒步骤反转成cDNA(体积20μL);用Primer Premier 5.0进行引物设计;以β-actin作为管家基因,进行荧光定量PCR(20μL体系)。反应条件如下:95℃预变性15min,95℃变性10s,60℃退火20s,72℃延伸31s,延伸步骤采集荧光信号,扩增40循环后进行溶解曲线分析。引物设计如下:DGAT2 ,F:CTGCTGGTCAGGTTTTTCTTAC,R:TCAGATTGGAG AAGAGGAGTAGG。HSL,F:CGCCTTACGGAGTCT ATGC,R:ATGGCTCTGAGTTGCCCTTA。ATGL,F:GGGTGACCATCTACCTTCCA,R:CCCAGTGAGAGG TTGTTTCGT。β-actin,F:TGAGCGCAAGTACTC TGTGTGGAT,R:TAGAAGCATTTGCGGTGCACGATG。
2 结果与分析
2.1 绿原酸对高脂饲喂SD大鼠体重的影响
表3显示,饲喂12周后,各组大鼠体重都有所增加,其中HFD组差异达显著性水平。与HFD组相比,HFD-LC组、HFD-HC组体重及其增加量均有所降低(p<0.05或0.01),且呈现剂量依赖性。ROS组最终体重接近NC组,与其并未出现差异(p>0.05)。
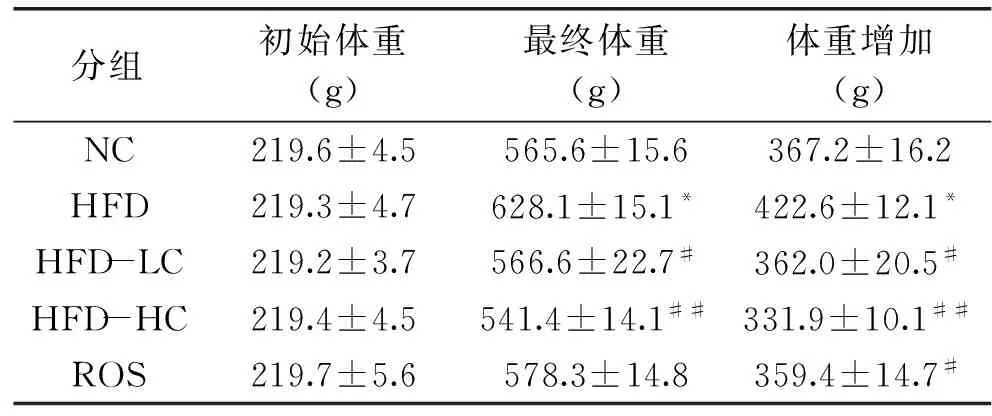
表3 绿原酸和罗格列酮干预对大鼠体重的影响Table 3 Body weights in SD rat follwing 12-week treatment with CGA or ROS
注: *:与NC组相比,p<0.05。#:与HFD相比,p<0.05;##:p<0.01。
2.2 绿原酸对高脂饲喂SD大鼠体脂率的影响
图1结果显示,与NC组相比,其余各组体脂率显著上升,差异有统计学意义。与HFD组相比,HFD-LC组、HFD-HC组、ROS组体脂率分别下降23.6%(p<0.05)、31.0%(p<0.01)、20.5%(p<0.05)。
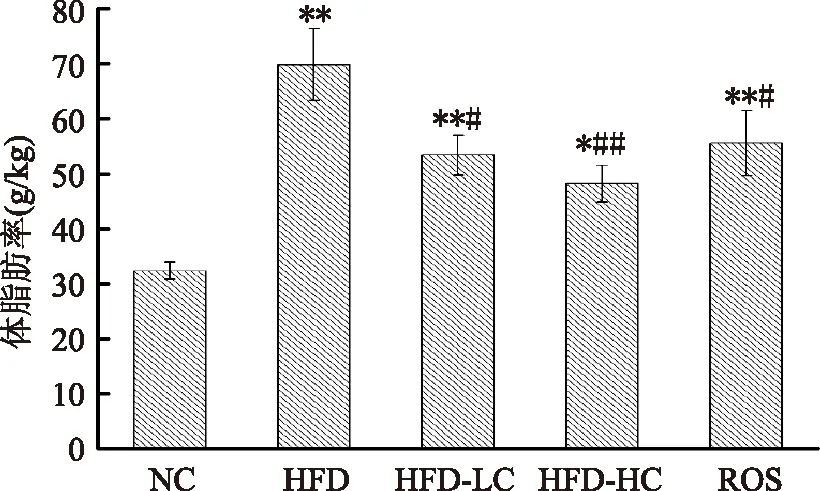
图1 体脂含量Fig.1 The body fat contents注:*:与NC组相比,p<0.05;**:p<0.01。 #:与HFD相比,p<0.05;##:p<0.01,图3同。
2.3 绿原酸对脂肪组织二酰甘油酰基转移酶(DGAT2)表达的影响
图2结果显示,与NC组相比,高脂饲喂SD大鼠附睾脂肪组织中DGAT2表达量上调了80%~105%,其中HFD组和HFD-LC组达到显著性水平(p<0.05);而与HFD组相比,HFD-LC、HFD-HC以及ROS组都有下降的趋势,但无显著性差异(p>0.05)。

图2 附睾脂肪组织中DGAT2的表达Fig.2 DGAT2 gene expression in epididymis adipose tissue注:*:与NC组相比差异显著,p<0.05。
2.4 绿原酸对脂肪甘油三酰脂肪酶(ATGL)和激素敏感脂肪酶(HSL)表达的影响
图3显示,与NC组相比,HFD组大鼠附睾脂肪组织ATGL mRNA表达量下调了42%,HFD-LC、HFD-HC和ROS组ATGL mRNA表达水平虽然也与NC组无统计学差异(p>0.05),但分别上调了35%、29%和44%;与HFD组相比,HFD-LC、HFD-HC和ROS组ATGL mRNA表达量都有极显著提高(p<0.01)。同为脂肪动员关键酶,HSL的结果略有不同。相比于NC组,HFD组、HFD-LC组、HFD-HC组和ROS组附睾脂肪组织HSL mRNA表达量都极显著性的上调(p<0.01),同时,HFD-HC组和ROS组睾脂HSL表达水平较HFD组分别提升了55%(p<0.01)和37%(p<0.05),HFD-LC组HSL水平与HFD组相比,虽有上升趋势,但无显著性差异(p>0.05)。

图3 附睾脂肪组织中ATGL和HSL基因的表达Fig.3 ATGL and HSL gene expression in epididymis adipose tissue
3 结论与讨论
肥胖者IR的形成是多因素造成的,而其主要根源却是脂肪组织[16]。Hirashita[17]研究发现,Zucker糖尿病肥胖大鼠手术去除内脏脂肪后,相比空白对照组,其胰岛素抵抗有所缓解。JP Despres[18]也表明,人类的内脏脂肪与代谢综合症也有众多关联。本研究发现,经过12周饲养,各组大鼠体重均有增加,相比HFD组,HFD-HC组体重显著性降低。相比NC组,高脂饲喂SD大鼠体脂率显著升高。与HFD组相比,ROS组体脂率有所降低,说明罗格列酮可能通过调节体脂缓解机体胰岛素抵抗;高低剂量绿原酸组体脂率都显著下降,说明绿原酸也能有效改善高脂饮食大鼠脂代谢,这与Cho的结果类似[19]。
DGAT与脂代谢关系密切,其作用机制是使二酰甘油加上脂肪酸酰基形成三酰甘油,是三酰甘油合成过程中最后一步的限速酶,其中DGAT2主要在肝脏和脂肪中高表达[20]。而HSL和ATGL作用与之相反,前者是激素敏感脂肪分解酶,受到胰高血糖素、肾上腺激素的激活和胰岛素的抑制。后者在脂解反应第一步中起主要作用,两者占有95%的TG分解活性,是脂肪动员的关键酶[21-22]。本文发现,相比NC组,高脂饲喂SD大鼠附睾脂肪组织DGAT2表达水平有明显提高,与HFD组相比,HFD-LC组、HFD-HC组和ROS组虽有所降低,但并没有达到显著差异(p>0.05),说明长期摄入高脂饮食,会导致体脂率上升,引发肥胖;而绿原酸干预,对TG的合成不能产生直接影响;Oliver[23]等报道,饮食诱导的营养性肥胖,会导致ATGL mRNA表达量降低,本文也得出了类似结论。本研究还发现,相比HFD组,HFD-LC、HFD-HC和ROS组附睾脂肪组织ATGL mRNA表达水平极显著性提升,说明长期高脂饮食会影响ATGL的表达,阻碍TG的降解,造成脂质堆积,而绿原酸能改善此状况,极显著提高ATGL表达水平,加速TG的分解;正常情况下,HSL在体内以有活性和无活性两种形式存在,Levin[24]等发现饲喂高脂饲料后,部分大鼠去甲肾上腺素含量增加,而儿茶酚胺(肾上腺素、去甲肾上腺素)又可以通过一系列作用,使无活性的HSL,转变成有活性型,最终使HSL mRNA表达量升高。这可能是造成本研究中,高脂饲喂后,HFD组HSL表达水平极显著高于NC组的原因。而相比于HFD组,HFD-HC组HSL mRNA表达量极显著性上调,提升效果还略优于ROS组(p>0.05),表明在大鼠自身上调HSL表达量的同时,高剂量绿原酸能进一步加强HSL mRNA的表达,促进三酰甘油降解。ROS组结果表明,罗格列酮干预后,大鼠HSL和ATGL mRNA的表达量上调,与文献报导结果一致[25-26]。
关于绿原酸对大鼠机体组织中ATGL和HSL mRNA表达的调节机制,可能是其对PPARγ表达的影响。研究表明PPARγ一方面,能激活糖代谢相关基因表达,造成脂滴形成并积累[27];另一方面,能直接调控脂代谢中的关键酶,如脂蛋白脂肪酶基因(LPL)、小肠脂肪酸结合蛋白基因(aP2)、HSL等的表达[28]。此外,对脂肪组织的分化也起到重要作用。Brun[29]等发现,MEFs和3T3-L1细胞敲出PPARγ基因后,其成脂分化能力丧失。而事实是否如此,还需要我们进一步探索。
[1]Barry M Popkin,Linda S Adair,Shu Wen Ng. NOW AND THEN:The Global Nutrition Transition:The Pandemic of Obesity in Developing Countries[J]. Nutrition Reviews,2012,70:3-21.
[2]Kastorini CM,Milionis HJ,Ioannidi A,et al. Adherence to the Mediterranean diet in relation to acute coronary syndrome or stroke nonfatal events:A comparative analysis of a case/case-control study[J]. American Heart Journal,2011,162:717-724.
[3]詹莉莉,杨志秋,傅正伟. 肥胖与慢性炎症的研究进展[J].中国细胞生物学学报,2011,33(3):297-305.
[4]王晓珂. 炎性反应与高脂饮食诱导的肥胖和胰岛素抵素抵抗关系的研究[D].武汉:华中科技大学,2011.
[5]Wang Z,Clifford M N,Sharp P. Analysis of chlorogenic acids in beverages prepared from Chinese health foods and investigation,in vitro,of effects on glucose absorption in cultured Caco-2 cells[J]. Food chemistry,2008,108(1):369-373.
[6]Clifford M N. Chlorogenic acids and other cinnamates-nature,occurrence,dietary burden[J]. Journal of the Science of Food and Agriculture,1999,79(3):362-372.
[7]Ong K W,Hsu A,Tan B K H. Anti-diabetic and anti-lipidemic effects of chlorogenic acid are mediated by ampk activation[J]. Biochemical pharmacology,2013,85(9):1341-1351.
[8]Zhang L T,Chang C Q,Liu Y,et al. Effect of chlorogenic acid on disordered glucose and lipid metabolism in db/db mice and its mechanism[J]. Acta Academiae Medicinae Sinicae,2011,33(3):281-286.
[9] 邱阳阳. 咖啡碱和绿原酸对小鼠和3T3-L1细胞脂肪代谢的影响[D].南昌:江西农业大学,2013.
[10]梁秀慈.绿原酸对长期摄取高糖高脂饮食SD大鼠脂代谢的影响[D].长沙:湖南农业大学,2013.
[11]何莞嫣.绿原酸对高糖高脂饲喂SD大鼠肠道葡萄糖转运体和PLG表达的影响[D].长沙:湖南农业大学,2013.
[12]Li S Y,Chang C Q. Biological effects of chlorogenic acid and body health[J]. Journal of hygiene research,2005,34(6):762-764.
[13]粟灵皓.绿原酸对高糖高脂饲喂大鼠肝脏抗氧化能力影响[D].长沙:湖南农业大学,2013.
[14]张永春.畜禽饲料营养价值的能量计算[J].辽宁畜牧兽医,1981,(2):43-45.
[15]张龙江.肥胖与胰岛素抵抗[J]. 实用儿科临床杂志,2009,24(20):1548-1551.
[16]Hirashita T,Ohta M,Endo Y,et al. Effects of visceral fat resection and gastric banding in an obese diabetic rat model[J]. Surgery,2012,151(1):6-12.
[17]Després J P,Lemieux I. Abdominal obesity and metabolic syndrome[J]. Nature,2006,444(7121):881-887.
[18]Cho A S,Jeon S M,Kim M J,et al. Chlorogenic acid exhibits anti-obesity property and improves lipid metabolism in high-fat diet-induced-obese mice[J]. Food and Chemical Toxicology,2010,48(3):937-943.
[19]马海明,施启顺,柳小春. DGAT相关基因研究进展[J]. 遗传学报,2006,32(12):1327-1332.
[20]胡深强,潘志雄,王继文. 脂肪甘油三酯脂肪酶(ATGL)的生物学功能及调控机制[J]. 中国生物化学与分子生物学报,2011,27(8):721-727.
[21]Schweiger M,Schreiber R,Haemmerle G,et al. Adipose triglyceride lipase and hormone-sensitive lipase are the major enzymes in adipose tissue triacylglycerol catabolism[J]. Journal of biological chemistry,2006,281(52):40236-40241.
[22]Oliver P,Caimari A,Díaz-Rúa R,et al. Diet-induced obesity affects expression of adiponutrin/PNPLA3 and adipose triglyceride lipase,two members of the same family[J]. International Journal of Obesity,2011,36(2):225-232.
[23]Levin B E,Triscari J,Hogan S,et al. Resistance to diet-induced obesity:food intake,pancreatic sympathetic tone,and insulin[J]. Am erican Journal of Physiology,1987,252(3 Pt 2):471-478.
[24]Teruel T,Hernandez R,Rial E,et al. Rosiglitazone up-regulates lipoprotein lipase,hormone-sensitive lipase and uncoupling protein-1,and down-regulates insulin-induced fatty acid synthase gene expression in brown adipocytes of Wistar rats[J]. Diabetologia,2005,48(6):1180-1188.
[25]Liu L F,Purushotham A,Wendel A A,et al. Regulation of adipose triglyceride lipase by rosiglitazone[J]. Diabetes,Obesity and Metabolism,2009,11(2):131-142.
[26]鞠大鹏,詹丽杏.脂肪细胞分化及其调控的研究进展[J].中国细胞生物学学报,2010,32(5):690-695.
[27]孙玉茹,杨泽.核转录因子PPARγ2的研究进展[J].遗传,2003,25(6):713-717.
[28]Brun R P,Spiegelman B M. PPAR gamma and the molecular control of adipogenesis[J]. Journal of endocrinology,1997,155(2):217-218.
Study on the effect of chlorogenic acid on the expression of key enzyme genes involved to triglyceride synthesis and degradation in high-fat diet-fed Sprague-Dawley rat adipose tissue
SONG Zhuo,CAI Xiao-qing+,YAN Xiao-dong,LIU Si-le,WANG Zheng*
(College of Bioscience & Biotechnology,Hunan Agriculture University,Changsha 410128,China)
Objective:In order to explored the effect of chlorogenic acid on the expression of key enzyme genes involved to triglyceride synthesis and degradation in high-fat diet-fed SD rat adipose tissue. Methods:Male SD rats were randomly divided into 5 groups:normal control group(NC),high-fat diet group(HFD),HFD with low-dose CGA(20mg/kg;HFD-LC)group,HFD with high-dose CGA(90mg/kg;HFD-HC)group and HFD with rosiglitazone group(ROS). All mice were killed after 12 weeks and body fat mass were detected. Expression of mRNA of DGAT2,ATGL and HSL were assessed by real time PCR. Results:The body fat content,level of DGAT2,HSL mRNA of HFD rats were higher than those of NC rats,while there was no significant difference between NC and HFD rats in the expression of ATGL. The level of ATGL mRNA in HFD-LC and HFD-HC rats were higher than those of HFD rats,HSL mRNA expression in HFD-HC was significantly higher than those in HFD,but it had no significant difference between HFD and HFD-LC,HFD-HC in the expression of DGAT2 mRNA and the body fat mass. Conclusion:Chlorogenic acid enhanced ATGL and HSL mRNA expression in epididymis adipose tissue of SD rat.
chlorogenic acid;lipid metabolism;ATGL;HSL;DGAT2
2014-08-08 +并列第一作者。
宋卓(1991-),男,在读硕士研究生,研究方向:天然产物利用及营养与药理。 蔡小庆(1995-),女,本科在读,研究方向:天然产物利用及营养与药理。
*通讯作者:王征(1967-),女,博士,教授,研究方向:天然产物利用及营养与药理。
国家自然科学基金(31071531);湖南省教育厅重点项目(14A071);湖南农业大学大学生创新性实验计划(XCX14016)。
TS201.4
A
1002-0306(2015)11-0336-05
10.13386/j.issn1002-0306.2015.11.060
