复叶耳蕨渣总黄酮转化提取与DPPH自由基清除活性的研究
2015-05-05张义平胡月萍邬亚华孙维君周许峰王丽丽殷嫦嫦
张义平,胡月萍,邬亚华,孙维君,周许峰,曹 俊,王丽丽,殷嫦嫦
(九江学院 基础医学院,江西九江 332000)
复叶耳蕨渣总黄酮转化提取与DPPH自由基清除活性的研究
张义平,胡月萍,邬亚华,孙维君,周许峰,曹 俊,王丽丽,殷嫦嫦
(九江学院 基础医学院,江西九江 332000)
研究复叶耳蕨渣的土壤真菌发酵转化提取其总黄酮和清除DPPH自由基活性。复叶耳蕨渣直筛发酵用优势菌株;通过单因素和正交实验L9(34)优化总黄酮提取,DPPH法评价转化前后总黄酮抗氧化活性。研究得到优势菌株F2发酵复叶耳蕨渣后黄酮得率为(0.893%±0.035%),较未发酵时总黄酮得率提高了27.0%,差异显著。F2发酵复叶耳蕨渣在最佳提取条件(料液比1∶30(g/mL),乙醇浓度70%,时间40min)下总黄酮产量较发酵前提高了30.6%。复叶耳蕨渣F2发酵前后总黄酮均表现出优于VE的清除DDPH自由基能力,但发酵前后总黄酮清除DPPH自由基能力无显著性差异。土壤真菌F2固体发酵增加了复叶耳蕨渣总黄酮的提取,复叶耳蕨渣黄酮提取物表现出比VE更强的清除DPPH自由基能力,作为一种天然抗氧剂具有良好的应用前景。
复叶耳蕨,土壤真菌,固体发酵,DPPH自由基清除
复叶耳蕨属植物资源分布广泛,具有抗菌消炎、清热利湿、驱虫和镇静作用,民间用于急性黄疸型肝炎、关节炎、腰腿疼、痢疾和抗癌治疗[1-4]。研究表明复叶耳蕨甲醇提取液有促宫缩、抗早孕及堕胎作用[5]。复叶耳蕨乙醇提取物具有抗氧化和肝保护作用和诱导肝癌HepGⅡ凋亡作用[6-7]。李辉敏等证明复叶耳蕨不同提取部位还具有抑制HIV-1蛋白酶和逆转录酶活性,能够阻止艾滋病毒复制[8]。梁广胜等证明复叶耳蕨提取物具有促进大鼠的骨髓间充质干细胞增殖和促成骨分化的雌激素样作用[9]。复叶耳蕨化学成分复杂,主要含有黄酮、三萜皂苷、酚类等成分。目前对它的成分研究主要集中在黄酮类化合物及酚类化合物[10]。周道年等从刺头复叶耳蕨(Arachniodesexilis(Hance)Ching)地上部分的化学成分中分离得到酚类和黄酮类化合物[11]。方伟等从斜方复叶耳蕨(Arachniodesrhomboidea)地上部分也分离得到黄酮类化合物[12]。黄酮类物质在抗氧化抗衰老、抗炎镇痛、抗癌防癌等方面有着重要显著的作用,可以广泛用于食品添加剂及保健食品中[13-14]。机体代谢过程中会产生活性氧自由基,超过体内抗氧化酶和抗氧化物质的生理抗氧化能力,将氧化损伤细胞膜脂质、细胞内DNA和蛋白质,导致酶、细胞膜和遗传物质的损伤和功能失调。活性氧自由基将加速衰老和组织损伤,引起炎症、神经组织功能退化、心血管疾病和癌症[15-16]。目前研究黄酮类化合物的雌激素样作用、抗毛细血管脆性、抗动脉硬化、抗突变和抗癌等功能主要源于它们的抗氧化活性[17-18]。
民间复叶耳蕨往往经水三次煎取利用,它的水煎剩余渣被证明含有未有效利用的黄酮成分。复叶耳蕨渣富含的黄酮类物质直接遗弃致使复叶耳蕨利用价值下降。另外,残渣在环境中的利用效率不高,若经甲醇等有机溶剂再次直接提取,由于研究表明许多天然植物内的黄酮原始含量低,其直接提取效率低。复叶耳蕨渣自身组织尚含有丰富木质纤维素和微量元素,可以成为真菌发酵的有效养分[19],本实验以复叶耳蕨渣为原料,利用土壤真菌多酶催化功能,转化复叶耳蕨渣物质成分,使得黄酮提取率也有提高,探索出了一条新的提取复叶耳蕨黄酮的工艺路线,同时检测复叶耳蕨黄酮的DPPH自由基清除活性,以获得转化后黄酮的抗氧化能力评价,为进一步开发复叶耳蕨提取功能性食品提供依据。
1 材料与方法
1.1 材料与仪器
新鲜土壤 采集于九江学院浔东校区草坪土壤5~10cm处;复叶耳蕨采自江西庐山 经九江森林植物标本馆馆长谭策铭鉴定;芦丁标准品、NaNO2(分析纯)、Al(NO3)3(分析纯)、NaOH(分析纯)和95%乙醇(分析纯) 均购自国药集团化学试剂有限公司。
UV7504C紫外分光光度计 上海精科实业有限公司;GHP-9080恒温培养箱 苏州江东精密有限公司;101A烘箱苏州台华烘箱设备有限公司;SW-CJ-2F超净工作台 苏州净化设备有限公司;培养皿 上海沪粤明科学仪器有限公司;BSA224S-CW电子天平 德国赛多利斯;JD-1000GA超声仪 宁波海曙金达超声波清洗机厂;KQ-8020BP真空泵 郑州博科仪器设备有限公司。
1.2 实验方法
1.2.1 土壤真菌分离和纯化培养 筛选培养基:称取50g复叶耳蕨渣(复叶耳蕨水煎三次提取后残渣恒温干燥,100℃过夜恒重)、5g琼脂糖,加水加热搅拌至沸5min,稍冷,定容至500mL。趁热分装培养皿中,冷却凝固,待用。
土壤真菌分离纯化:采集我校浔东校区草坪5~10cm处土壤,装入无菌保鲜袋带回实验室。配制土壤10-1、10-2、10-3、10-4、10-5、10-6和10-7的梯度稀释液,三倍重复平板划线接种。经二轮挑取独立菌落,分别制备10-1、10-2、10-3、10-4、10-5、10-6和10-7的梯度菌悬液,三倍重复初步纯化倒置培养。最后,挑取单克隆真菌扩大培养[20-21]。
1.2.2 单克隆真菌发酵复叶耳蕨渣 称取干燥后残渣,加适量水湿润,灭菌待用。选择单菌落,采用三区法接种于上述培养基中,每个菌落按3倍重复接种,25℃放置培养一周。将培养后基质置于烘箱100℃过夜高温杀灭真菌,称重记录,置于干燥箱中密闭保存,待用。
1.2.3 不同土壤真菌复叶耳蕨渣发酵前后总黄酮的提取 称取相同条件恒重干燥的发酵前后样品2g,加入40mL 70%的乙醇搅拌浸泡20min,再放入超声仪(工作频率25kHZ/功率50W/温度55℃)超声提取40min。提取后抽滤,收集滤液。由于提取后的溶剂(70%)受热挥发,提取液少于40mL,加70%乙醇定容至40mL。
1.2.4 总黄酮的得率测定 精密称取干燥至恒重的芦丁标准品在509nm测定吸光度建立标准曲线。测定总黄酮吸光度,计算总黄酮得率(%,即g/100g):X(%)=[(C×25×10-6×V/A×W]×100,式中:C为总黄酮的浓度μg/mL,25为反应体系mL,10-6为换算系数,V为提取液体积mL,A为移取液体积mL,W发酵前为黄酮提取样品恒重质量和发酵后黄酮提取样品恒重质量除以(1-平均失重率)g。
1.2.5 单因素实验 设定称取样品1.0000g,20mL 70%的乙醇搅拌浸泡20min,再放入超声仪(工作频率25kHZ/功率50W,通过温度计监测冷水控制温度55℃)超声提取40min为基本条件。分别考察发酵时间(3、5、7、9、11d)、提取pH(4、5、6、7、8)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50(g/mL))、乙醇浓度(50%、60%、70%、80%和95%)与超声提取时间(20、30、40、50、60min)单因素的变化,单因素实验比较以上条件对发酵前后复叶耳蕨渣总黄酮提取率的影响。
1.2.6 正交实验设计 通过分析单因素实验,选取对黄酮提取量影响大的工艺条件:料液比、乙醇浓度和提取时间。以总黄酮提取率为综合评分指标,进行3因素3水平正交实验。按L9(34)正交表进行实验。
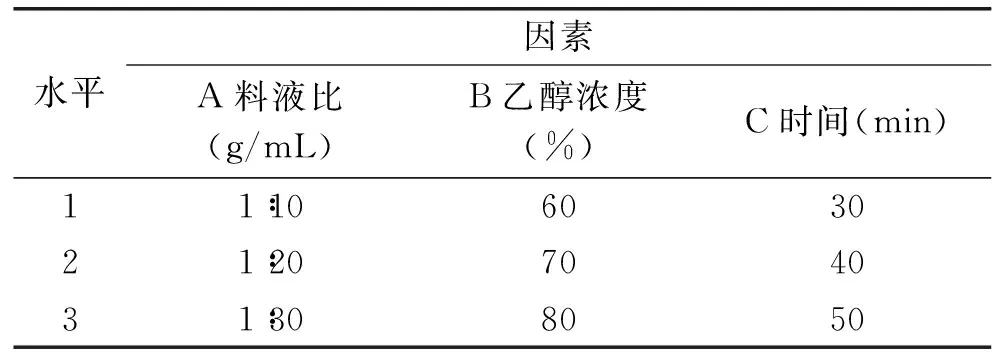
表1 发酵基质总黄酮提取因素水平表Table 1 Factors and levels of extraction of total flavonoids in fermented base

表2 复叶耳蕨药渣发酵前后的总黄酮得率比较Table 2 The yield of the flavonoids extracted from Arachniodes dregs with and without fermentation
注:a:仅列出药渣与F1、F2和F3菌株之间的显著性分析p值。1.2.7 DPPH自由基清除测定 试管中加入样品溶液0.5mL,6.25×10-5mol/L DPPH甲醇溶液2.5mL,30℃保温30min 后,于517nm处测定DPPH的吸光度。甲醇调零,DPPH新鲜配制,每次用前置4℃冰箱暗中保存。实验设3个重复。清除率E(%)=(A空白-A样品)/A空白×100。
2 结果与分析
2.1 复叶耳蕨渣筛选土壤真菌生长形态
土壤真菌梯度稀释实验表明,复叶耳蕨渣培养基上,F1、F2和F3菌株生长状况最好,少部分菌株生长缓慢,培养2周菌苔未能铺满平板,其余菌株生长速度相当,说明复叶耳蕨渣营养条件可以提供土壤菌株萌发与生长条件,能够筛选出部分土壤真菌。选用在PDA平板上萌发早和生长状况好的F1、F2和F3菌株转接进行单克隆纯化筛选。见图1经菌落悬液梯度纯化,观察到培养皿中F1、F2和F3各自近似为单菌落,白色绒毛状,多成圆形向四周匍匐生长;且二次菌落悬液梯度多点接种,相应菌落生长一致,经鉴定单克隆真菌纯化成功。接种相应真菌F1、F2和F3复叶耳蕨渣发酵,培养皿中菌落绒毛状呈圆形向四周生长,同一单菌同一浓度得到的菌落颜色、形态与生长状况一致,也进一步验证了纯菌筛选的成功。

图1 复叶耳蕨药渣发酵菌落形态Fig.1 Morphology of soil fungi screened by Arachniodes exilis dregs注:F1、F2和F3,菌落悬浮梯度稀释纯化二次 和扩大培养获得的典型土壤真菌。
2.2 不同土壤真菌复叶耳蕨渣发酵前后总黄酮得率
筛选获得土壤真菌F1、F2和F3菌株发酵处理复叶耳蕨渣,表2结果说明总黄酮平均得率大小为F2>F1>F3>药渣。其中,F2发酵黄酮得率最高,F1、F2和F3菌株发酵比复叶耳蕨渣直接获得的黄酮分别提高了20.6%,27.0%和4.6%。经SPSS 13.0 Levene方差齐性检验满足方差齐性,适用多重比较检验。多重比较分析表明除复叶耳蕨渣与F3发酵黄酮得率无显著差异,其他两两之间呈现显著性差异。显著性分析F2发酵后渣的p=0.000,F1发酵后渣的p=0.005,说明经F2发酵后渣与未发酵渣的总黄酮得率有显著性差异。因此,土壤真菌不同菌株在复叶耳蕨渣上具有不同的转化和降解特性,提高复叶耳蕨渣黄酮得率的菌株与菌株种属紧密相关,不同种属之间存在较大差别,使得针对复叶耳蕨渣的菌种筛选非常重要。结果分析表明F2菌株是适于处理复叶耳蕨渣提高其黄酮得率的一株土壤真菌。李艳宾等选用黄孢原毛平革菌和青霉菌发酵,研究对甘草渣中黄酮类化合物提取的影响。经发酵后黄酮得率分别为0.89%、0.87%,比未发酵处理的黄酮得率提高了34.85%、31.82%[22-23]。这说明,对于预处理菌株的筛选与评价能够找到显著提高黄酮得率的优势菌株。借助复叶耳蕨渣自身含有的一些营养物质和微量无机元素,如粗蛋白、粗纤维、粗脂肪以及氮、磷、钾等,它们可以提供土壤真菌生长的基本条件[19]。利用土壤真菌自身产酶破环细胞纤维结构和促进有效成分溶出的特点,具有一定转化和富集复叶耳蕨渣有效成分的作用。
2.3 发酵时间对总黄酮得率的影响
由图2可知当F2发酵复叶耳蕨渣在3~7d之间时,随着发酵天数的延长总黄酮提取得率增大,当F2发酵复叶耳蕨药渣7d时,总黄酮提取绝对得率最大为0.8673%;比未发酵处理的黄酮得率提高了25.5%,但时间超过7d时,随着时间的延长总黄酮得率不再增加。同时,图2也可看出随着发酵时间的延长,复叶耳蕨渣重量下降,这说明发酵3~7d时间,F2菌株以改变复叶耳蕨渣木质纤维结构为主,促进黄酮的溶出和转化,而时间延长F2菌株分泌的胞外酶系影响了黄酮的转化和同时导致提取的杂质增多,所以F2发酵复叶耳蕨渣适宜的时间选择7d较好。

图2 F2发酵时间对复叶耳蕨药渣和总黄酮得率的影响Fig.2 Effect of F2fermentation time on extraction rate of total flavonoids and Arachniodes exilis dregs
2.4 pH对F2发酵前后药渣总黄酮得率的影响
由图3可知当F2发酵前后渣提取pH在4~7之间时,随着pH的升高总黄酮得率随之增大,当pH为7时,总黄酮的得率最大为0.8372%,比未发酵处理的黄酮得率提高了23.2%,pH超过7后,总黄酮得率反而有些下降。因为黄酮类化合物酸碱性是影响其溶解度的重要因素,黄酮类化合物的酸性强弱与酚羟基数目的多少和位置有关,原料不同,总黄酮的特性和结构等有所不同。黄酮若以7,4′-二-OH等结构形式,其酸性较强,在p-π共轭效应的影响下,使酸性增强可溶于碳酸氢钠水溶液,而5-OH,因可与4-羰基形成分子内氢键,酸性最弱,需要氢氧化钠等碱性较强的溶液来提取。所以图3表明复叶耳蕨渣总黄酮提取pH选择7较合适。

图3 pH对发酵和未发酵复叶耳蕨药渣总黄酮得率的影响Fig.3 Effect of pH on extraction rate of total flavonoids fromfermented and un-fermented Arachniodes exilis dregs
2.5 料液比对F2发酵前后复叶耳蕨渣总黄酮得率的影响
由图4可知当复叶耳蕨渣(g)和乙醇溶液体积(mL)比例在1∶10~1∶30时,随增加乙醇溶液体积总黄酮得率随之增大,当料液比为1∶30(g/mL)时,总黄酮的提取得率最大为0.8312%,比未发酵处理的黄酮得率提高了23.7%,但乙醇溶液体积超过30mL时,总黄酮的得率反而下降,同时增加了提取溶剂体积的消耗,因此正交实验选择1∶10~1∶30(g/mL)。
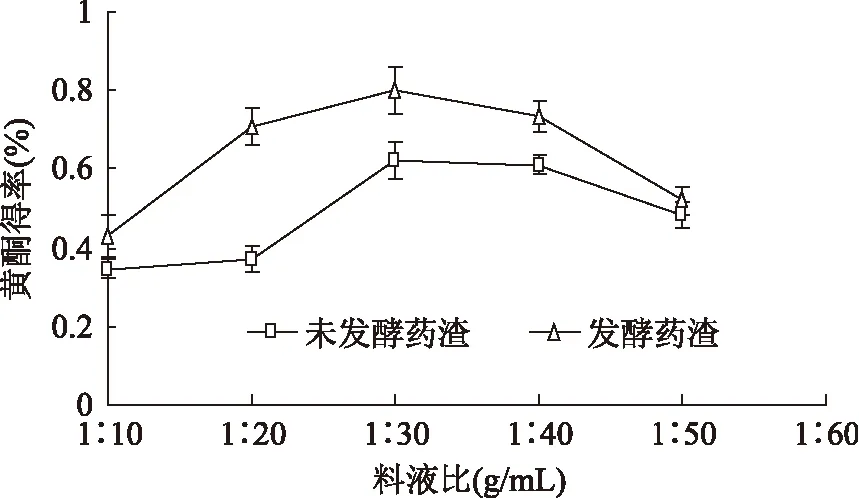
图4 料液比对发酵和未发酵 复叶耳蕨药渣总黄酮得率的影响Fig.4 Effect of solid-to-solvent on extraction rate of total flavonoids from fermented and un-fermented Arachniodes exilis dregs
2.6 乙醇浓度对F2发酵前后渣总黄酮得率的影响
由图5可知当乙醇浓度在50%~70%之间时,随着乙醇浓度的增大复叶耳蕨渣总黄酮得率随之增大,当乙醇浓度为70%时,渣总黄酮的提取得率最高为0.8379%,比未发酵处理的黄酮得率提高了24.7%,因此正交实验选择乙醇浓度60%~80%。

图5 乙醇浓度对发酵和未发酵 复叶耳蕨药渣总黄酮得率的影响Fig.5 Effect of ethanol concentration on extraction rate of total flavonoids from fermented and un-fermented Arachniodes exilis dregs
2.7 超声时间对F2发酵前后渣总黄酮得率的影响
从图6实验结果可知,超声提取时间为40min时,复叶耳蕨渣总黄酮提取得率最高为0.8422%,比未发酵处理的黄酮得率提高了25.4%,随着超声提取时间的继续增加,总黄酮得率反而有些下降,说明复叶耳蕨渣总黄酮随着超声提取时间延长性质不稳定容易分解,因此正交实验选择30~50min。

图6 超声提取时间对发酵和未发酵 复叶耳蕨药渣总黄酮得率的影响Fig.6 Effect of extraction time on extraction rate of total flavonoids from fermented and un-fermented Arachniodes exilis dregs
2.8 复叶耳蕨渣F2发酵前后总黄酮提取正交优化
通过对复叶耳蕨渣总黄酮提取单因素的考察,确定了总黄酮提取率最高的发酵工艺,即复叶耳蕨渣与水比例为5∶6,发酵时间1周,三区接种,25℃培养。通过正交实验方法,确定影响复叶耳蕨中总黄酮提取主次因素及相互关系。实验结果及统计分析见表3和表4。由表3可知,各因素显著性依次为:影响因素顺序次序为:A(料液比)>B(乙醇浓度)>C(超声时间),最佳提取工艺为A3B2C2,即料液比1∶30,乙醇浓度70%,时间40min。由表4方差分析结果可知,查F分布表得:F0.01(2,2)=99.00,F0.05(2,2)=19.00;因为FA=120.333>F0.01(2,2)=99.00,故料液比A有极其显著的影响;因为FB=48.667和FC=31.667>F0.05(2,2)=19.00,故乙醇浓度B、超声时间C有显著的影响。

表3 正交实验结果表Table 3 Results of orthogonal test
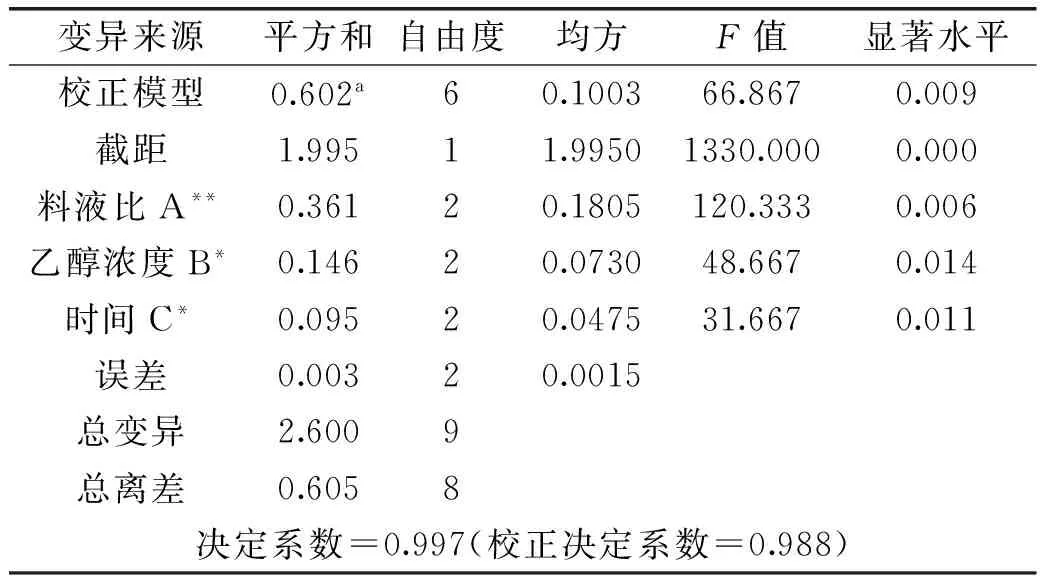
表4 正交实验的方差分析表Table 4 Analysis of variance of orthogonal design
注:标有**的说明该因素有极其显著的影响,标有*的说明该因素有显著的影响,未标有*的说明该因素没有显著影响。
研究以总黄酮得率变化为主要评价指标,考察了复叶耳蕨渣经土壤真菌发酵后总黄酮的变化,由实验可知土壤真菌发酵可显著提高复叶耳蕨渣总黄酮得率,说明土壤真菌生物转化对升高有效成分有意义。
2.9 复叶耳蕨渣F2发酵前后总黄酮提取验证实验
按A3B2C2条件进行F2发酵前后复叶耳蕨药渣3次平行提取实验,从图7实验结果表明发酵后复叶耳蕨渣总黄酮提取得率为0.9177%,比未发酵处理的黄酮得率提高了30.6%,高于表4中每一项实验结果。所以在最佳提取工艺条件A3B2C2下,F2菌株有效地提高了复叶耳蕨渣中总黄酮含量,有利于复叶耳蕨总黄酮的合理开发、利用。复叶耳蕨渣的再利用不仅解决了复叶耳蕨资源的浪费和环境污染的问题,又经发酵增加了其总黄酮的含量,有待进一步深入探讨其作为食品功能和保健成分的生物学意义。

图7 发酵和未发酵复叶耳蕨药渣总黄酮优化得率Fig.7 Optimal extraction rate of total flavonoids fromfermented and un-fermented Arachniodes exilis dregs
2.10 复叶耳蕨渣F2发酵前后总黄酮对DPPH自由基的清除效果
由图8可知,在0.01~0.64g/L质量浓度范围内,复叶耳蕨渣F2发酵前后总黄酮质量浓度和DDPH自由基清除率有着良好的量效关系,清除率随总黄酮质量浓度的增大表现了逐步上升的趋势。发酵后总黄酮清除DPPH自由基能力稍有提高,差异无显著性意义,说明总黄酮得率提高抗氧化能力未见减弱。与VE清除DPPH自由基能力比较,复叶耳蕨渣F2发酵前后总黄酮表现出优于VE的清除自由基的能力。
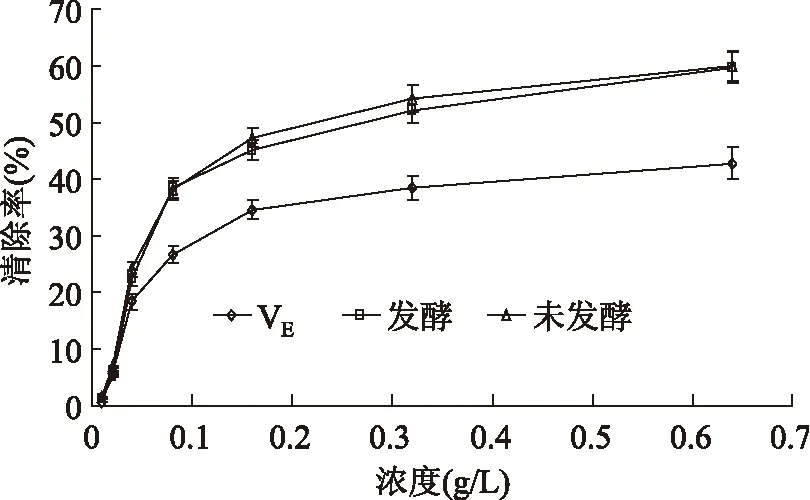
图8 不同质量浓度总黄酮对DPPH自由基清除效果Fig.8 Comparison of scavenging effects of total flavonoids and Vit E at various concentrations on DPPH free radical
3 结论
3.1 研究探索了土壤真菌发酵辅助复叶耳蕨渣提取总黄酮的优势菌株。经复叶耳蕨渣作为直接固体发酵底物,获得F2菌株是适于处理复叶耳蕨渣提高其黄酮得率的一株土壤真菌。
3.2 实验采用正交实验法优选得出F2菌株发酵复叶耳蕨渣前后总黄酮提取的最佳工艺条件:料液比1∶30(g/mL)、乙醇浓度70%、超声提取时间40min,得到发酵后复叶耳蕨渣总黄酮最佳提取率较发酵前提高了30.6%。复叶耳蕨渣F2发酵前后总黄酮均表现出优于VE的良好量效关系的清除DDPH自由基能力,但发酵前后总黄酮清除DPPH自由基能力无显著性差异。
3.3 因复叶耳蕨总黄酮含量较少,实验所得发酵复叶耳蕨渣总黄酮粗品中黄酮含量较低,如何利用微生物转化技术,进一步提高产品得率和纯度,仍有待多方面深入研究。研究也表明,复叶耳蕨渣经土壤真菌F2发酵后,总黄酮的得率显著提高,说明利用微生物发酵能够实现复叶耳蕨渣总黄酮的选择性分离。可见,利用土壤真菌发酵复叶耳蕨渣辅助提取总黄酮工艺具有总黄酮得率高、稳定性好、操作简单和生产成本较低等优点,有利于开发工业生产[24-25]。实验中还发现,发酵时间超过一定天数后,总黄酮得率出现下降。因此,控制好合适的发酵时间尤为重要。除发酵时间外,总黄酮得率还受发酵温度、氮源和发酵基质含水率等因素影响,表明实验所用F2菌株在复叶耳蕨药渣总黄酮的微生物发酵提取领域中进一步研究有较好的应用前景。
[1]秦仁昌.关于复叶耳蕨的命名问题[J].植物学报,1962,10(3):253-263.
[2]Libor E,Renata H,Pavel T,et al. Species boundaries and frequency of hybridization in the Dryopteris carthusiana(Dryopteridaceae)complex:A taxonomic puzzle resolved using genome size data[J]. American Journal of Botany,2010,97(7):1208-1219.
[3]Nakaike T. A synoptical study on theFernGenusArachniodesBlume(Dryopteridaceae)[J]. Journal of phytogeography and taxonomy ,2001,49(1):7-30.
[4]何海.复叶耳蕨属分类研究综述[J].重庆师范学院学报:自然科学版,2003,20(2):42-47.
[5]姚果原,谭爱理,汪又奇,等.复叶耳蕨抗生育实验研究[J].中药通报,1985,10(9):40-41.
[6]Zhou D N,Ruan J L,Cai Y L,et al. Antioxidant and hepatoprotective activity of ethanol extract ofArachniodesexilis(Hance)Ching[J]. Journal of Ethnopharmacology,2010,129(2):232-237.
[7]Li H M,Chen J,Xiong C M,et al. Apoptosis induction by the total flavonoids fromArachniodesexilisin HepG2 cells through reactive oxygen species-mediated mitochondrial dysfunction involving MAPK activation[J].Evidence-based complementary and alternative medicine,2014,(2):1-11.
[8]李辉敏,殷嫦嫦,吴家忠,等.刺头复叶耳蕨不同提取部位体外抗HIV-1蛋白酶活性的研究[J].时珍国医国药,2013,24(1):3-4.
[9]梁广胜,殷嫦嫦,殷明,等.复叶耳蕨总黄酮对大鼠骨髓间充质干细胞的增殖和成骨分化的影响[J].中成药,2014,36(3):456-461.
[10]张磊,李辉敏.AB-8树脂分离提取复叶耳蕨中总黄酮含量的测定[J].九江医学,2003,18(4):193-194.
[11]Zhou D N,Ruan J L,Cai Y L,et al. Three new polyphenols from the rhizomes ofArachniodesexilis[J]. Journal of asian natural product research,2008,10(6):559-563.
[12]方伟,阮金兰,王仲,等. 斜方复叶耳蕨的化学成分研究[J].中国中药杂志,2008,33(6):649-650.
[13]Triantafyllou A,Mylonis I,Simos G,et al. Flavonoids induce HIF-1α but impair its nuclear accumulation and activity[J].Free Radical Biology and Medicine,2008,44(4):657-670.
[14]Fang Y Z,Yang S,Wu G Y. Free radicals,antioxidants,and nutrition[J]. Nutrition,2002,18(10):872-879.
[15]Wang S Y,Feng R T,Bowman L ,et al. Antioxidant activity in lingonberries(Vaccinium vitis-idaea L.)and its inhibitory effect on activator protein-1,nuclear factor-κB,and mitogen-activated protein kinases activation[J]. Journal of Agricultural and Food Chemistry,2005,53(2):3156-3166.
[16]Sana M,Ines B,Imen H,et al. Antioxidant Potential of Ulva rigida Extracts:Protection of HeLa Cells Against H2O2Cytotoxicity[J].The Biology Bulletin,2013,225(1):1-7.
[17]Cvoro A,Paruthiyil S,Jones J,et al. Selective activation of estrogen receptor-beta transcriptional pathways by an herbal extract[J]. Endocrinology,2007,148(2):538-547.
[18]Mersereau J,Levy N,Staub R,et al. Liquiritigenin is a plant-derived highly selective estrogen receptor β agonist[J]. Molecular and Cellular Endocrinology,2008,283(1):49-57.
[19]李辉敏,石向群.复叶耳蕨根中微量元素锌铁铜锰含量测定[J]. 中国现代应用药学,2010,27(4):333-335.
[20]朱灵峰,张召跃,王海燕,等.真菌传统分离方法及应用研究进展[J]. 安徽农业科学,2010,38(30):16717-16719,16741.
[21]梁晨,吕国忠.土壤真菌分离和计数方法的探讨[J].沈阳农业大学学报,2000,31(5):515-518.
[22]李艳宾,张琴,陶呈宇,等. 微生物发酵提高甘草渣中黄酮类物质提取率的研究[J].食品研究与开发,2010,31(9):156-159.
[23]乔仲和,胡自如.甘草渣中大量黄酮类化合物的分离及甘草的综合开发研究[J].中草药,1997(9):522-524.
[24]刘学湘,陈建伟.中药有效成分生物转化的研究进展[J].食品与生物技术学报,2008,27(2):14-18.
[25]潘明,徐轶婷,王世宽,等.利用生物转化技术改良中药材品质[J].安徽农业科学,2010,38(9):4589-4591,4609.
Extraction of total flavonoids inArachniodesexilisdregs assisted by soil fungi
ZHANG Yi-ping,HU Yue-ping,WU Ya-hua,SUN Wei-jun,ZHOU Xu-feng,CAO Jun,WANG Li-li,YIN Chang-chang
(School of Basic Medical Science,Jiujiang University,Jiujiang 332000,China)
The soil fungi-assisted extraction of total flavonoids fromArachniodesdregsand its DPPH scavenging capacity was studied in the paper. Soil fungi were separated and puritied by the gradient dilution method. TheArachniodesdregswere fermented by them,and single factor test and orthogonal test L9(34)were employed to optimize the best condition of extracting their total flavonoids by ultrasonic assistant. The antioxidant activities of total flavonoids were studied by DPPH scavenging test. The yield of the flavonoids was 0.893%±0.035% by the method. Comparing with ultrasonic extraction,the extraction ratio of total flavonoids inArachniodesdregsfermented by F2were 27.0% higher than without fermentation. Under optimized extraction conditions of flavonoids with orthogonal test,which were solid to liquid ratio 1∶30(g/mL),ethanol concentration 70%(v/v)and ultrasonic extract 40min,the yield of the flavonoids was 30.6% higher than without fermentation. The total flavonoids extracted fromArachniodesdregsbefore and after fermentation possessed stronger scavenging effect on DPPH thanVE. The results showed that compared to ethanol extracting method,soil fungi fermentation could promote the yield of flavonoids significantly,total flavonoids inArachniodesdregsfermented by F2are effective as natural antioxidants,which provided the basis of recycling the resources ofArachniodesdregsfor future.
Arachniodesexilis;soil fungi;solid state fermentation;DPPH scavenging
2014-08-08
张义平(1971-),男,硕士,副教授,研究方向:微生物转化天然植物的食药用产品开发和分子机制研究。
国家自然科学基金(81360364)。
TS284.2
A
1002-0306(2015)11-0100-06
10.13386/j.issn1002-0306.2015.11.012
