绿茶多糖的乙酰化修饰及其清除自由基、活性的研究
2015-05-05梁少茹
梁少茹,肖 霄,肖 斌,*
(1.西北农林科技大学园艺学院 ,陕西杨陵 712100;2.北京林业大学林木生物质化学北京市重点实验室 ,北京 100083)
梁少茹1,肖 霄2,肖 斌1,*
(1.西北农林科技大学园艺学院 ,陕西杨陵 712100;2.北京林业大学林木生物质化学北京市重点实验室 ,北京 100083)

绿茶多糖,乙酰化,自由基,亚硝基,清除活性
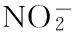
1 材料与方法
1.1 材料与仪器
绿茶 来自西北农林科技大学茶叶实验站;无水乙醇、95%乙醇、氯仿、正丁醇、乙醚、丙酮、氢氧化钠、过氧化氢、乙酸酐、邻二氮菲、邻苯三酚、无水对氨基苯磺酸、盐酸萘乙二胺、硫酸亚铁、亚硝酸钠、盐酸羟胺、柠檬酸、柠檬酸钠、磷酸二氢钾、醋酸钠等试剂均为国产分析纯。
AL-204分析天平电子天平 梅特勒-托利多(上海)仪器有限公司;UV3802准双光束紫外可见分光光度计 上海尤尼柯仪器有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;DK-S26型电热恒温水浴锅 上海森信实验仪器有限公司;TGL-18M高速冷冻离心机 上海卢湘仪离心机仪器有限公司等。
1.2 实验方法
1.2.1 绿茶多糖的提取与纯化 绿茶多糖的提取与纯化方法[10-11]如下:绿茶茶叶粉碎,过30目筛,按茶水比1∶20在55℃下水浸提2.5h,趁热过滤,55℃温度条件下减压浓缩至原体积的三分之一,加入3倍体积95%乙醇沉淀,沉淀物用丙酮、无水乙醇、乙醚交替洗涤3次,经Sevag 法脱蛋白、过氧化氢脱色,再经透析后冻干即为纯化茶多糖(TPS)。
1.2.2 茶多糖的乙酰化修饰及最佳修饰条件确定 茶多糖乙酰化修饰方法[8]如下:取绿茶多糖样品0.5g加入到10mL蒸馏水中并混匀,用0.5mol/L氢氧化钠调pH为9.0,一定温度(20~40℃)保温,其间交替向溶液中加入一定量的乙酸酐和0.5mol/L的氢氧化钠以保持溶液pH为8.0。反应期间温度控制在20~40℃,乙酸酐加入量为10~20mL,保温时间为3~5h。反应结束后,用5mol/L盐酸调整溶液的pH为7.0,冷却后将混合液置于透析袋中流水透析3d,再经减压浓缩、醇沉、冷冻干燥后即得乙酰化茶多糖(Acetylated tea polysaccharides,A-TPS)。乙酰化多糖的取代度采用碱性羟胺比色法[12]进行测定,先绘制乙酰基浓度与其吸光度(A=540nm)的标准曲线,测出样品中乙酰基含量,然后计算取代度。取代度计算公式:

式中,W为茶多糖中乙酰基含量。
通过分析比较,保温时间(A)、茶多糖与乙酸酐的体积比(B)、反应温度(C)是影响反应进程的主要因素[13],以取代度为指标,通过单因素实验对各因素进行考察,得出各因素水平取值。选择这3个指标作为实验三因素,设计三因素三水平的正交实验,参照上述乙酰化茶多糖修饰方法,按L9(34)正交表进行实验,研究得到最高取代度乙酰化茶多糖的反应条件。正交实验因素水平表见表1。

表1 因素水平表Table 1 Factors and levels
超氧阴离子清除率=(A0-A1)/A0×100%
式中,A0为对照组吸光值,A1为样品组吸光值。
1.2.4 茶多糖及其乙酰化产物清除羟自由基(·OH)活性的测定 茶多糖及其乙酰化产物清除·OH活性的测定采用邻二氮菲-Fe氧化法[15]进行:精确移取5mmol/L邻二氮菲溶液(用蒸馏水将50mmol/L邻二氮菲无水乙醇溶液稀释制得)1.5mL,加入50mmol/L pH7.4磷酸缓冲液2.0mL,充分混匀,滴加1.0mL 7.5mmol/L FeSO4溶液,加好后立即混匀,分别加1mL不同浓度(0.2、0.4、0.6、0.8、1.0mg/mL)茶多糖或其乙酰化产物溶液,最后加0.1% H2O21.0mL启动反应,以水补充体积至10mL作为样品管,损伤管中加H2O2不加样品溶液,未损伤管两者均不加,损伤管、未损伤管均以水补充体积至10mL,各管反应液均置于37℃保温60min,取出后在波长536nm处测吸光值。根据下式计算羟自由基清除率:
羟自由基清除率=(A2-A1)/(A0-A1)×100%
式中,A0为未损伤管吸光值,A1为损伤管吸光值,A2为样品管吸光值。

1.2.6 数据处理 正交实验结果分析用Minitab15进行分析,使用SPSS statistics 19进行显著性分析,文中其他图表使用EXCEL完成。
2 结果与分析
2.1 乙酰化茶多糖的合成制备及修饰条件的优化
水提醇沉法提取绿茶多糖得粗茶多糖提取率为2.07%,经过脱色和6次除蛋白得到初步纯化茶多糖。以保温时间(A)、茶多糖质量与乙酸酐体积比(B)、反应温度(C)作为实验三因素,以制得的纯化多糖为原料,参照表1各因素水平进行正交实验。表2为实验因素水平表和正交实验结果及极差分析表,正交实验重复三次,表2中取代度为三次实验平均值。

表2 正交实验结果及极差分析表Table 2 Results of orthogonal test and range analysis
由表2可知,三个实验因素对取代度的影响作用由大到小依次为:茶多糖质量与乙酸酐体积比(B)>保温时间(A)>反应温度(C),正交实验得到的最适条件为茶多糖质量与乙酸酐体积比为1∶40,保温时间4h,反应温度为30℃。在最优条件下进行验证实验,制得乙酰化茶多糖的取代度为0.337,表明该优选条件稳定可行,重复性良好。以该正交实验获得的最佳反应条件制取乙酰化茶多糖,并进行以下清除自由基及亚硝基的实验。


图1 茶多糖与乙酰化茶多糖 对超氧阴离子自由基的清除作用Fig.1 Superoxide anion free radical scavenging effect of TPS and acetylated TPS
2.3 茶多糖及乙酰化茶多糖对羟自由基(·OH)的清除作用
羟自由基是一种氧化活性很强的氧化剂,可直接损伤各种生物膜,导致多种疾病的发生,·OH清除率是抗氧化作用的重要指标[3]。本实验采用邻二氮菲-Fe氧化法测定绿茶多糖及其乙酰化产物对·OH的清除作用,实验结果见图2。

图2 绿茶多糖与乙酰化绿茶多糖对羟自由基的清除作用Fig.2 Hydroxyl free radical scavenging effect of TPS and acetylated TPS
由图2可知,茶多糖及其乙酰化产物对·OH的清除作用与溶液浓度正相关,且乙酰化茶多糖清除活性均高于未修饰前,·OH清除活性最大提高率达36.96%。此外,当溶液浓度为本实验范围内最大即1mg/mL时,乙酰化茶多糖的·OH清除率达到最大值60.36%,说明乙酰化茶多糖具有较强的·OH清除活性,表明乙酰化修饰能够有效地提高茶多糖对·OH的清除活性。


图3 绿茶多糖与乙酰化绿茶多糖对亚硝基的清除作用Fig. scavenging effect of TPS and acetylated TPS


图4 乙酰化修饰茶多糖取代度与清除活性的关系Fig.4 Relationship between modification degree and scavenging effect of acetylated tea polysaccharides

3 讨论
4 结论

[1]宛晓春.茶叶生物化学[M].北京:中国农业出版社,2003,54-55,419-420.
[2]Chen H X,Zhang M,Xie B J. Components and antioxidant activity of polysaccharide conjugate from green tea[J]. Food Chemistry,2005,90(1-2):17-21.
[3]于淑池,侯金鑫.龙井茶多糖对自由基和NO2-清除作用研究[J].食品研究与开发,2012,33(4):28-31.
[4]钱宾宾.多糖化学修饰方法探究[J]. 科技创新导报,2012(8):137.
[5]麻冬滨,东方,季宇彬.多糖结构修饰研究进展[J].黑龙江科技信息,2013(3):53-54.
[6]陈新仁,吴琼,郑成.银耳多糖的分子修饰及抗氧化作用的研究[J].安徽农学通报,2013(17):17-18,38.
[7]魏玉,王元兰,何新建.低分子量k_卡拉胶的制备、分子修饰及其生物活性研究进展[J].食品工业科技,2009,30(4):344-348.
[8]梁进,张剑韵,崔莹莹,等.茶多糖的化学修饰及体外抗凝血作用研究[J].茶叶科学,2008,28(3):166-171.
[9]刘阿娟,张静,张化朋,等.虎奶菇菌核多糖的化学修饰及活性研究[J].陕西师范大学学报:自然科学版,2014,42(1):105-108.
[10]倪德江,陈玉琼,谢笔钧,等.绿茶、乌龙茶、红茶的茶多糖组成抗氧化及降血糖作用研究[J].营养学报,2004,26(1):57-60.
[11]余志,石玉涛,倪德江.酶法修饰绿茶多糖对免疫低下模型小鼠免疫活性的影响[J]. 茶叶科学,2010,30(zl):567-572.
[12]郭晓强,何钢,姚倩,等.乙酰化银耳多糖的制备及其取代度测定[J].食品工业科技,2013,34(12):255-257.
[13]宋逍,张丽华,赵鹏,等.响应面法优选款冬花多糖的乙酰化工艺研究[J].中成药,2013,35(9):2030-2033.
[14]张海容.修饰多糖的抗氧自由基活性及其与DNA结合机理的荧光法研究[D].广州:华南理工大学,2003:54.
[15]彭永华.茶多糖的化学修饰及其衍生物的降血糖活性研究[D].无锡:江南大学,2006:35.
[16]焦中高,刘杰超,周红平,等.硫酸化修饰对红枣多糖自由基和亚硝基清除活性的影响[J].中国食品学报,2007,7(2):17-21.
[17]Macdonald J,Galley H F,Webster N R. Oxidative stress and gene expression in sepsis[J]. British journal of anaesthesia ,2003,90(2):221-232.
[18]林桂兰,许学书,连文思.食用菇多糖提取物体外抗氧化性能研究[J].华东理工大学学报:自然科学版,2006,32(3):278-281.
[19]Frazier C E ,Wendler S L,Glasser W. Long chain branched celluloses by mild trans-glycosidation[J]. Carbohydrate Polymers,1996,31(1-2):11-18.
[20]张难,吴远根,周剑丽,等.多糖的分子修饰及其在功能性食品中的应用展望[J].食品研究与开发,2007,28(8):159-163.

LIANG Shao-ru1,XIAO Xiao2,XIAO Bin1,*
(1.College of Horticulture,Northwest A&F University,Yangling 712100,China;2.Beijing Key Laboratory of Lignocellulosic Chemistry,Beijing Forestry University,Beijing 100083,China)


2014-09-09
梁少茹(1987-),女,硕士研究生,研究方向:茶叶生物化学。
*通讯作者:肖斌(1957-),男,学士,教授,主要从事茶叶生理生态及茶叶生物化学研究。
国家茶叶产业技术体系(CARS-23);陕西省科技统筹工程计划难题招标(2013KTZB02-01-01)。
TS201.2
A
1002-0306(2015)11-0084-05
10.13386/j.issn1002-0306.2015.11.009
