超声波辅助提取鲶鱼内脏蛋白酶的工艺研究
2015-04-24衣杰荣
张 岚,衣杰荣
(上海海洋大学食品学院,上海201306)
超声波辅助提取鲶鱼内脏蛋白酶的工艺研究
张 岚,衣杰荣*
(上海海洋大学食品学院,上海201306)
以鲶鱼内脏为原料,采用超声波辅助提取鲶鱼胃、肠中的蛋白酶,分别研究了NaCl浓度、超声提取时间、超声波强度和提取温度对胃、肠蛋白酶活性的影响,并通过响应面分析法对两种鲶鱼内脏蛋白酶的提取工艺进行优化。实验结果表明,鲶鱼胃蛋白酶最佳提取工艺条件为:NaCl溶液浓度0.3%,超声波强度90 W,提取时间30 min,提取温度为35℃,此时测得的蛋白酶活力为130 U/mL;肠蛋白酶的最佳提取工艺条件为:NaCl溶液浓度0.25%,超声波强度100 W,提取时间40 min,提取温度为35℃,此时测得的蛋白酶活力为114 U/mL。表明在同样的料液比(1∶5)的提取条件下,所获得的单位体积的胃蛋白酶提取液的酶活性显著高于相应的肠蛋白酶提取液的酶活性。
鲶鱼,内脏,蛋白酶,响应面,超声波辅助提取
鲶鱼是国内外养殖的主要淡水鱼品种之一,也是世界上发展最迅速的养殖鱼类,1995年全球养殖产量仅仅1.5万吨,2008年增长到140万吨,2010年接近180万吨[1]。作为我国主要淡水鱼出口品种之一,鲶鱼在2006年出口量高达一万吨[2],之后趋于平缓,到2012年和2013年,国内鲶鱼的年养殖量均维持在1500 t左右[3]。鲶鱼在加工中留下可食用肉质部分,内脏弃去不用。伴随着大批量加工而产生的内脏,不仅造成生态污染,而且也是一种极大的资源浪费[4]。内脏中含有丰富的酶类物质,大量研究表明鱼类内脏可作为蛋白酶的重要来源[4]。因此,研究鲶鱼内脏蛋白酶的提取工艺对鲶鱼产品的综合开发具有重要的现实意义。
目前国内外在鱼内脏蛋白酶的研究上多侧重于酶的分离纯化和酶特性研究,包括:硫酸铵沉淀法[5]、色谱分析法[6]、双水相萃取法[7]、三相分离法[8]等。研究者们围绕这些酶的种类及其最适温度、pH进行研究[9-10],这些提取方法获得的酶活性通常较高,但提取过程复杂、不易操作且提取成本高,不适合作为工业生产用酶制剂使用。而关于粗酶的提取工艺及提取条件优化的研究报道相对较少。近年来超声波辅助提取技术不断发展,利用其强烈的空化效应、机械作用、搅拌作用等,可以加速蛋白酶进入溶剂,从而有效地提高提取效率[11-12]。超声波辅助提取法具有提取方式简单、无需加热、提取率高、提取速度快、提取物的结构未被破坏、提取条件参数易于控制等优点[13]。本文将超声波辅助提取法应用于鲶鱼内脏蛋白酶的提取,在综合参考文献的基础上[14-16],确定采用固定料液比(1∶5),分别研究了NaCl浓度、超声提取时间、超声强度和提取温度对提取得到的蛋白酶活性的影响,并且用响应面法优化提取条件,为以后鱼类内脏蛋白酶的提取方法的研究和工业化生产提供了理论基础和实验依据。
1 材料与方法
1.1 材料与仪器
新鲜鲶鱼 购自上海市浦东新区临港新城农工商超市,挑选个体均一、色泽光亮、健康有活力的新鲜活鲶鱼;酪蛋白粉 Sigma公司;乳酸、乳酸钠、硼酸钠、氢氧化钠、三氯乙酸、氯化钠 分析纯,国药集团化学试剂有限公司;
FJ-200高速分散均质机 上海本昂科学仪器有限公司;DHG-9023A电热恒温鼓风干燥箱 上海新诺仪器厂;SK5200HP超声波仪 上海科导台式清洗器;H2050高速冷冻离心机 湘仪;HWS12电热恒温水浴锅 苏州江东精密仪器有限公司;UV-2100紫外分光光度计 UNICO;BCD-219D冰箱 海尔。
1.2 实验方法
1.2.1 鲶鱼内脏蛋白酶提取方法 新鲜鲶鱼宰杀后取出内脏并洗净,分离胃、肠,再次用蒸馏水洗净,置于-18℃冰箱保存。用时解冻,称重,以NaCl溶液为提取液,按内脏与提取液为1∶5的料液比(W/V)加入一定浓度的NaCl溶液,均质破碎2 min,破碎后超声处理一段时间,取出后经高速冷冻离心机离心(7000 r/min,4℃)20 min,取上清液为粗酶液[14]。
1.2.2 酶活性测定方法 参考张寒俊[17]和GB/T 23527-2009中蛋白酶活性的测定方法,加以修改。以10.00 mg/mL酪蛋白溶液为底物,配制不同pH的酪蛋白缓冲溶液。测胃蛋白酶活性时用pH2.5的酪蛋白缓冲溶液,测肠蛋白酶活用pH9.5的酪蛋白缓冲溶液。取1 mL粗酶液(必要时稀释数倍)置于试管中37℃预热,同时预热相应pH下的蛋白酶缓冲溶液,之后加入1 mL酪蛋白缓冲溶液,37℃静置反应10 min后加入2 mL 0.4 mol/L的三氯乙酸终止反应,过滤后用分光光度计于275 nm波长下测定其吸光度(OD)值,先加三氯乙酸再加蛋白酶液的对照管为空白。进行三次平行实验。绘制酪氨酸标准曲线(参考GB/T 23527-2009),其回归方程 y=0.0075x+0.0019,相关系数r= 0.9998。从标准曲线上根据OD值读出样品的酶活力,单位为U/mL。
1.2.3 超声波提取蛋白酶单因素实验设计
1.2.3.1 NaCl浓度对蛋白酶活性的影响 内脏分别于0.1%、0.3%、0.5%、0.7%、0.9%的NaCl溶液中匀浆(1∶5(W/V)),之后在25℃下80 W超声提取60 min,确定NaCl浓度对蛋白酶活性的影响。
1.2.3.2 提取时间对蛋白酶活性的影响 内脏按料液比1∶5(W/V)置于0.3%NaCl溶液中匀浆,之后分别在25℃下80 W超声提取15、30、45、60、75、90、105 min,通过测定OD值反映不同超声时间条件下提取出的蛋白酶活性,确定提取时间对蛋白酶活性的影响。
1.2.3.3 提取强度对蛋白酶活性的影响 内脏按料液比1∶5(W/V)置于0.3%的NaCl溶液中匀浆,之后分别在25℃下用80、90、100、110 W的超声强度处理30 min,通过测定OD值反映不同超声波强度条件下提取出的蛋白酶活性,确定提取强度对蛋白酶活性的影响。
1.2.3.4 提取温度对蛋白酶活性的影响 内脏按料液比1∶5(W/V)置于0.3%的NaCl溶液中匀浆,之后分别在25、30、35、40、45、50℃下用90 W的超声强度处理30 min,确定提取温度对蛋白酶活性的影响。
1.2.4 蛋白酶提取的响应面实验设计 根据单因素实验的结果,选择NaCl浓度、提取时间和提取强度三个主要因素。选择NaCl浓度0.1%、0.3%和0.5%三个水平,提取时间15、30、45 min三个水平,提取强度选择80、90、100 W三个水平,以蛋白酶活性(Y)为指标进行响应面实验设计(见表1),优化超声波法提取胃蛋白酶的工艺。选择NaCl浓度0.1%、0.3%和0.5%三个水平,提取时间30、45、60 min三个水平,提取强度选择90、100、110 W三个水平,以蛋白酶活性(Y)为指标进行响应面实验设计(见表2),优化超声波法提取肠蛋白酶的工艺。

表1 胃蛋白酶提取的响应面设计因素与水平Table 1 Factors and levers in the Box-Behnken of protease extracted in stomach

表2 肠蛋白酶提取的响应面设计因素与水平Table 2 Factors and levers in the Box-Behnken of protease extracted in intestine
1.2.5 数据处理 采用DesignExpert 8.0.6软件进行响应面优化分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 NaCl浓度对酶活性的影响 由图1可以看出,采用不同的NaCl浓度,提取的胃蛋白酶活性均大于肠蛋白酶活性。当NaCl浓度为0.3%左右时,鲶鱼胃、肠蛋白酶活性均为最高。其中NaCl浓度<0.3%时,随着NaCl浓度的升高,酶活性明显升高;而当NaCl浓度>0.3%时,随着NaCl浓度升高,其酶活下降速率相对缓慢。这说明在超声波提取过程中,一定浓度的NaCl有助于内脏蛋白酶的提取。这可能是与NaCl对蛋白酶的构象的稳定作用有关。Klomklao等[18]研究了NaCl浓度对鲶鱼内脏蛋白酶活性的影响,发现高浓度NaCl使酶活性大大降低,分析原因可能是盐析作用使蛋白酶变性。

图1 NaCl浓度对内脏蛋白酶活性的影响Fig.1 Effect of different concentrations of NaCl on protease activity from viscera
2.1.2 超声波提取时间对酶活性的影响 由图2可以看出,超声时间对从鲶鱼肠中提取的蛋白酶活性有较明显的影响,超声时间为45 min时提取的酶活性最高,之后随着超声提取时间的增加,酶活性明显下降,且伴有曲折。而从胃中提取的蛋白酶在超声时间为60 min时的活性最低,超声时间30 min和90 min提取到的酶活性相对较高。提取时间对鲶鱼胃肠中不同种类的蛋白酶活性的影响机理还有待于进一步研究。

图2 超声时间对内脏蛋白酶活性的影响Fig.2 Effect of different extraction times on protease activity from viscera
2.1.3 超声波强度对酶活性的影响 由图3可以看出,在不同的超声波强度时,提取的胃蛋白酶活性总大于肠蛋白酶。在其他条件不变的情况下,90 W的超声波强度提取得到的鲶鱼胃蛋白酶活性最高,而从肠中提取出的蛋白酶在超声波强度100 W时活性最高。胃、肠蛋白酶的活性受超声波强度的影响较大,所以选择合适的超声波强度在胃蛋白酶和肠蛋白酶的提取过程中尤为重要。
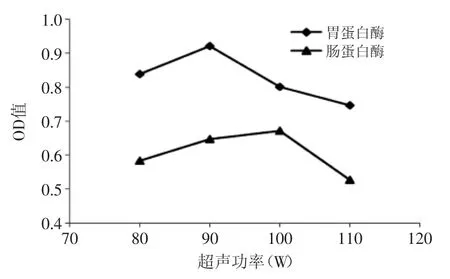
图3 超声波强度对内脏蛋白酶活性的影响Fig.3 Effect of different ultrasonic intensities on protease activity from viscera
2.1.4 超声波提取温度对酶活性的影响 由图4可以看出,从胃、肠中提取的蛋白酶均在35℃提取时表现出最高的活性。此外,从胃中提取的蛋白酶在提取温度为25℃时活性偏低,30℃之后迅速变大,之后几乎保持平稳,这表明低温不利于胃中蛋白酶的提取。而肠中提取蛋白酶活性较胃中的小,50℃活性几乎为0,这有可能是温度高致使蛋白酶失活。在所有实验的温度下,提取的胃蛋白酶活性都大于肠蛋白酶。

图4 超声波提取温度对内脏蛋白酶活性的影响Fig.4 Effect of different extraction temperatures on protease activity from viscera
2.2 响应面分析对提取蛋白酶活性的影响
2.2.1 胃中提取蛋白酶的响应面分析 根据单因素实验结果及实验的实际情况,固定提取温度为35℃,采用响应面分析法,对胃中提取的蛋白酶进行NaCl浓度、超声波提取功率、超声波提取时间的三因素三水平优化,设计方案及实验结果见表3。
利用Design Expert V8.0.6软件分别对表3中的数据进行多元回归拟合,得到胃蛋白酶活性对以上因素的二次多项回归模型为Y=0.990-7.625×10-3A-6.750×10-3B-6.125×10-3C-1.500×10-3AB-7.750×10-3AC-0.034BC-0.10A2-0.024B2-0.11C2。
表4为回归分析结果,回归方差分析显著性检验显示该模型回归显著(p<0.001),失拟项不显著(p失拟>0.05),表明模型失拟度不显著;模型回归系数R2= 0.9639,R2Adj=0.9175,信噪比(AdeqPrecision)=12.472,表明该模型拟合程度较好,误差小,可以用此模型对蛋白酶的活性进行分析和预测。模型分析结果表明:交互项BC对结果的影响显著,二次项A2、C2对结果的影响极显著,表明超声波提取功率和超声波提取时间的交互作用对蛋白酶活性影响显著。
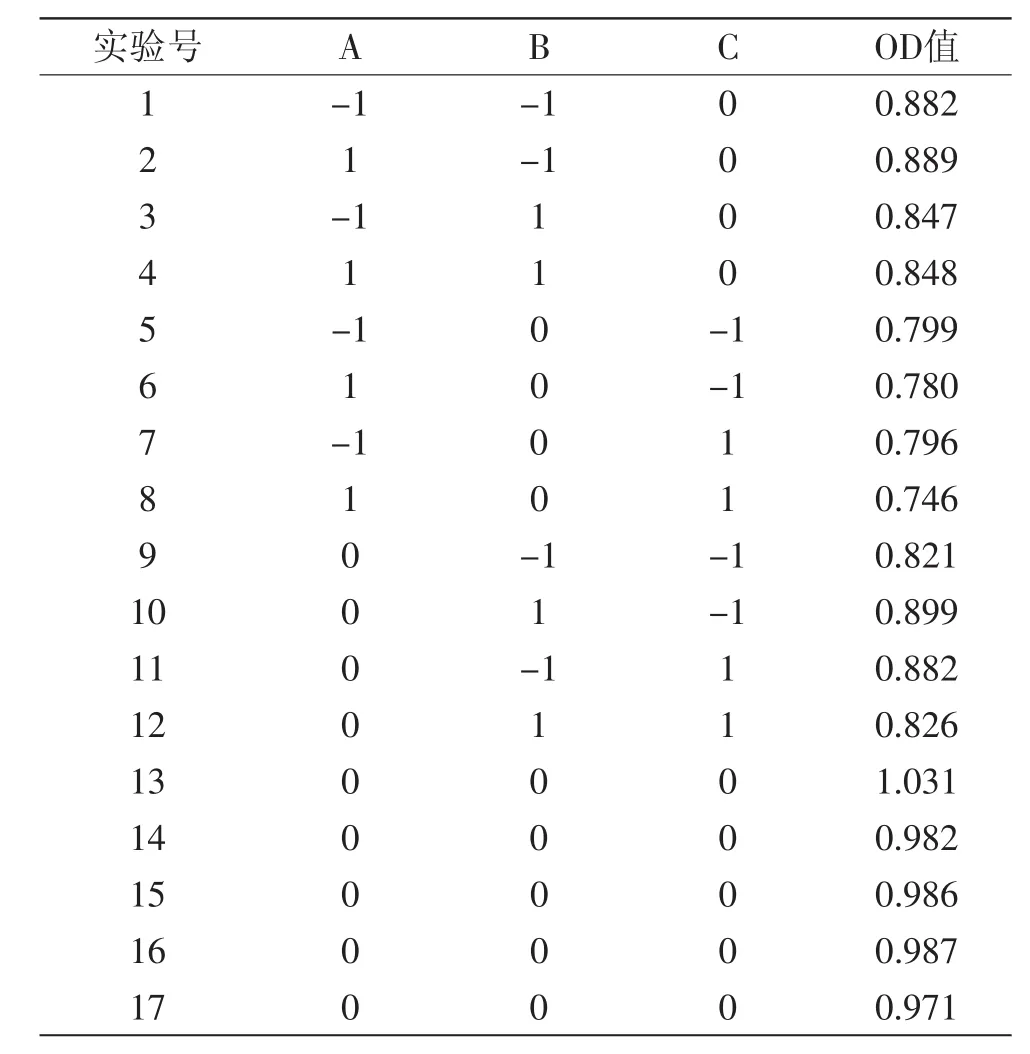
表3 响应面分析实验结果Table 3 Results of Box-Behnken
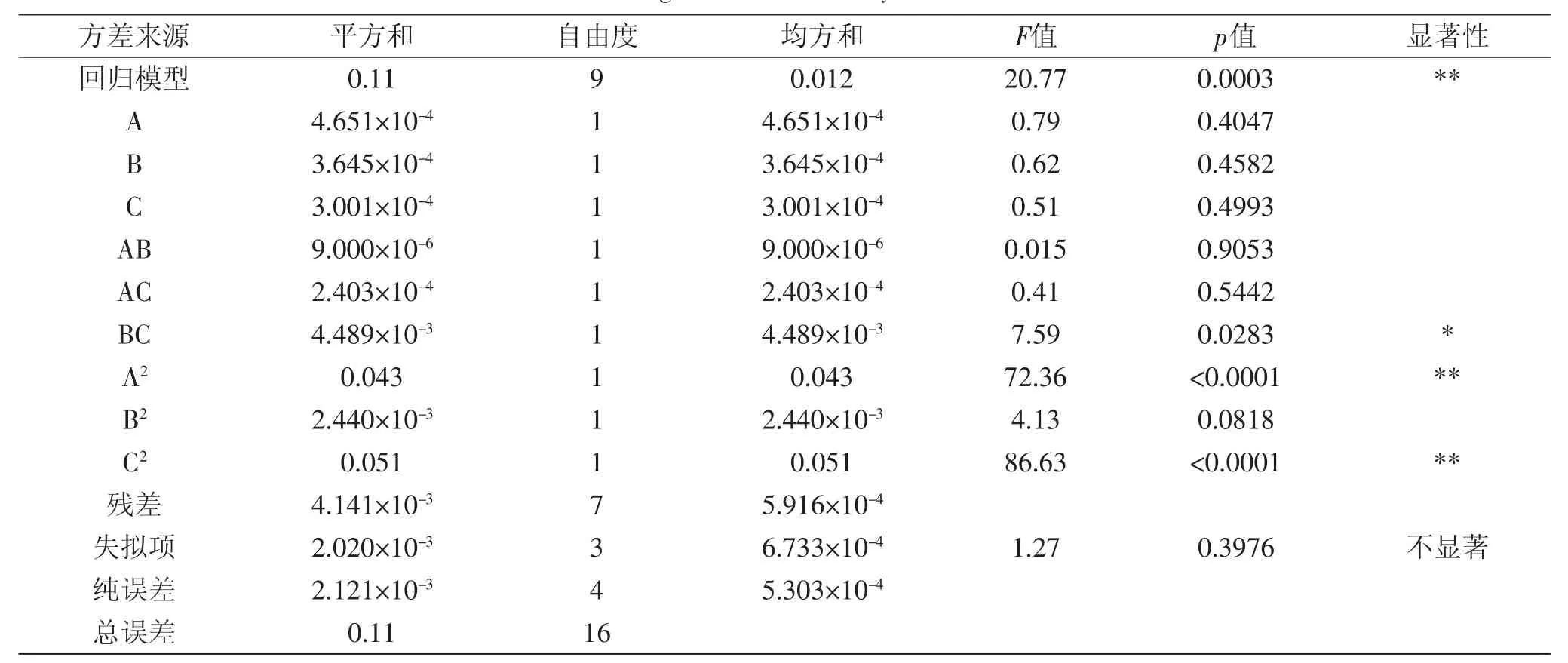
表4 回归模型方差分析Table 4 Regression model analysis of variance
某两个因素之间的交互影响见图5~图7,从曲面的陡势和等高线的形状可以直观的了解因素间的相互作用对结果的影响。从图中可以看出,超声功率和超声时间的交互影响对蛋白酶活性显著,这三组交互作用的曲面中心顶点均接近于零水平,表明了经响应面优化的最佳提取条件应在三个因素的零水平左右。

图5 NaCl浓度(A)与超声功率(B)对鲶鱼胃蛋白酶活性的影响Fig.5 Effect of NaCl concentration(A)and ultrasonic intensity(B)on protease activity from catfish stomach

图6 NaCl浓度(A)与超声时间(C)对鲶鱼胃蛋白酶活性的影响Fig.6 Effect of NaCl concentration(A)and extraction time(C)on protease activity from catfish stomach
利用Design Expert软件对模型进行分析得到胃中蛋白酶的最优提取条件为:NaCl浓度为0.29%,超声提取功率为88.65 W,超声提取时间为29.90 min,在此条件下预测OD值为0.992。根据实验实际情况固定提取温度,调整NaCl浓度为0.30%,超声提取功率为90 W,提取时间为30 min,进行验证实验,通过3次平行实验得到蛋白酶活性的实际OD值为0.988,与预测值0.922的相对误差仅在0.4%,证明用此模型优化超声波提取胃蛋白酶的工艺条件是可行的。根据酪氨酸标准曲线读得此时粗蛋白酶液的酶活力为130 U/mL。
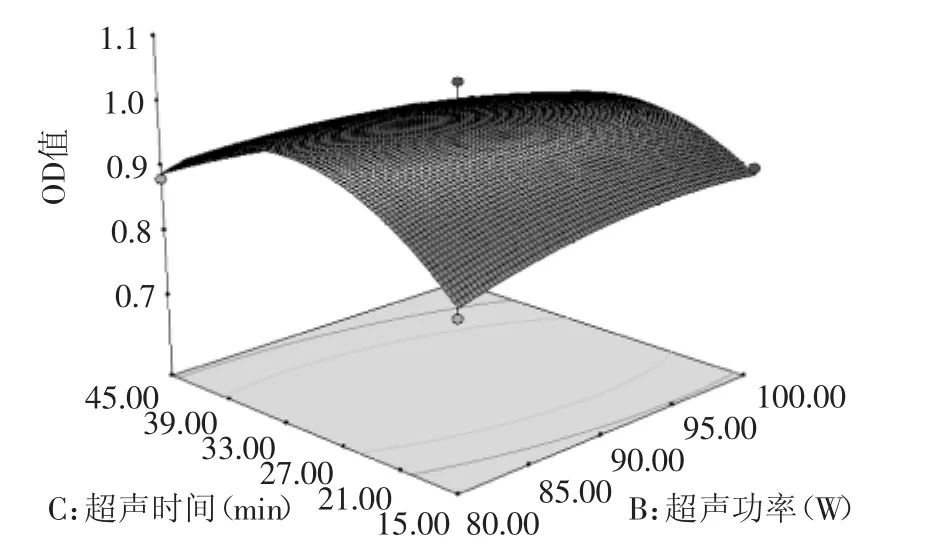
图7 超声功率(B)与超声时间(C)对鲶鱼胃蛋白酶活性的影响Fig.7 Effect of ultrasonic intensity(B)and extraction time(C)on protease activity from catfish stomach
2.2.2 肠中提取蛋白酶的响应面分析 根据单因素实验结果及实验的实际情况,固定提取温度为35℃,采用响应面分析法,对肠中提取的蛋白酶进行NaCl浓度、超声波提取功率、超声波提取时间的三因素三水平优化,设计方案及实验结果见表5。
利用Design Expert V8.0.6软件分别对表3中的数据进行多元回归拟合,得到胃蛋白酶活性对以上因素的二次多项回归模型为Y=0.860-0.048A+0.040B-0.008C-0.002AB+0.006AC+0.001BC-0.06A2-0.061B2-0.020C2。
表6为回归分析结果,回归方差分析显著性检验显示该模型回归显著(p<0.001),失拟项不显著(p失拟>0.05),表明模型失拟度不显著;模型回归系数R2= 0.9847,R2Adj=0.9650,信噪比(AdeqPrecision)=22.054表明该模型拟合程度较好,误差小,可以用此模型对蛋白酶的活性进行分析和预测。模型分析结果表明:一次项A、B对结果的影响极显著,二次项A2、B2对结果的影响极显著,C2的影响显著,表明NaCl浓度和超声波提取功率对响应值有极显著的影响,并且NaCl浓度、超声波功率、超声波时间这三个因素的交互作用对蛋白酶活性影响不显著。
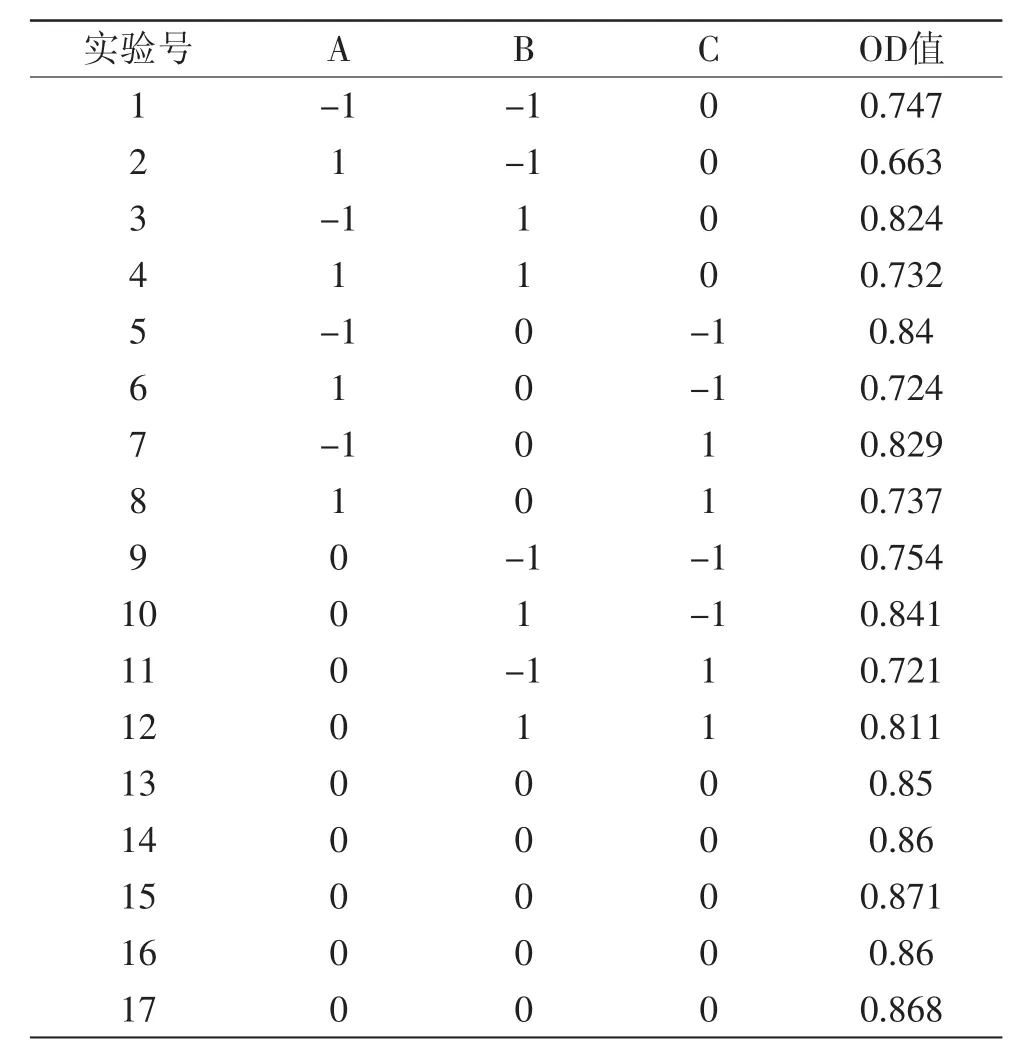
表5 响应面分析实验结果Table 5 Results of Box-Behnken
其中某两个因素之间的交互影响见图8~图10,从曲面的陡势和等高线的形状可以直观的了解因素间的相互作用对结果的影响。从图中可以看出,三组交互作用对蛋白酶活性的影响均不显著,NaCl浓度和超声功率的曲面陡势明显,表明这两个因素对结果影响极显著。

表6 回归模型方差分析Table 6 Regression model analysis of variance
利用Design Expert软件对模型进行分析得到肠中蛋白酶的最优提取条件为:NaCl浓度为0.22%,超声提取功率为103.39 W,超声提取时间为41.21 min,在此条件下预测OD值为0.880。根据实验实际情况固定提取温度,调整NaCl浓度为0.25%,超声提取功率为100 W,提取时间为40 min,进行验证实验,通过3次平行实验得到蛋白酶活性的OD值为0.869,与预测值0.880的相对误差为1.25%,表明用此模型优化超声波提取肠蛋白酶的工艺条件是可行的。根据酪氨酸标准曲线读得此时粗蛋白酶液的酶活力为114 U/mL,低于上面得到的胃蛋白酶液的酶活力130 U/mL,这表明在同样料液比的提取条件下,单位体积的胃蛋白酶提取液的蛋白酶活性显著高于相应的肠蛋白酶提取液的蛋白酶活性。

图8 NaCl浓度(A)与超声功率(B)对鲶鱼肠蛋白酶活性的影响Fig.8 Effect of NaCl concentration(A)and ultrasonic intensity(B)on protease activity from catfish intestine
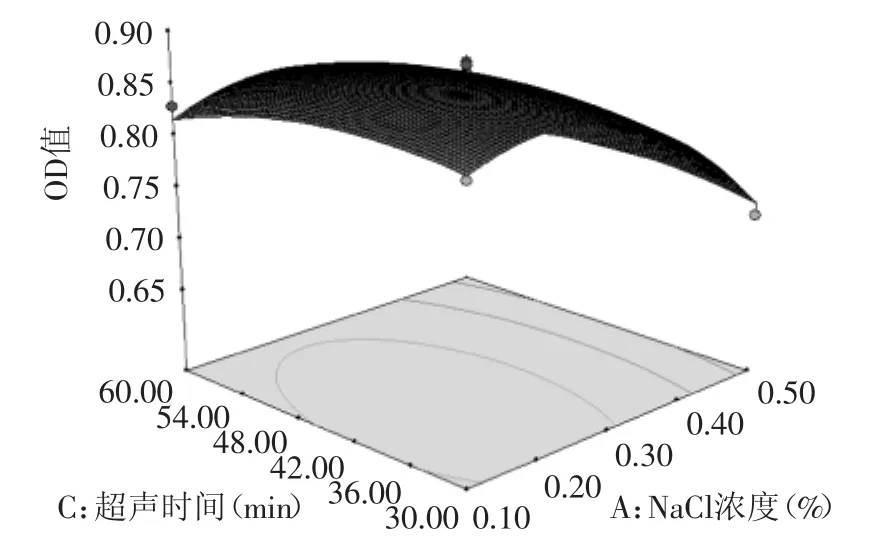
图9 NaCl浓度(A)与超声时间(C)对鲶鱼肠蛋白酶活性的影响Fig.9 Effect of NaCl concentration(A)and extraction time(C)on protease activity from catfish intestine

图10 超声功率(B)与超声时间(C)对鲶鱼肠蛋白酶活性的影响Fig.10 Effect of ultrasonic intensity(B)and extraction time(C)on protease activity from catfish intestine
3 结论
本研究采用超声波辅助提取技术分别从鲶鱼内脏-胃和肠中提取蛋白酶。单因素实验表明,NaCl浓度、超声提取时间、超声波强度和提取温度都对鲶鱼胃和肠中蛋白酶的提取有显著地影响。在单因素实验的基础上,采用响应面分析法优化工艺条件,得到鲶鱼胃中蛋白酶最佳提取条件为:NaCl溶液浓度0.3%,超声波强度90 W,提取时间30 min,此时测得的蛋白酶活力为130 U/mL;鲶鱼肠中蛋白酶的最佳提取条件为:NaCl溶液浓度0.25%,超声波强度100 W,提取时间40 min,测得蛋白酶活力为114 U/mL。表明在同样料液比的提取条件下,所获得的单位体积的胃蛋白酶提取液的酶活性显著高于相应的肠蛋白酶提取液的酶活性。本研究表明采用超声波提取法能有效地从内脏中提取出高活性的蛋白酶粗液,提取产物适合应用到食品工业,为以后鲶鱼内脏蛋白酶的工业化提取和应用提供了很好的实验依据。
[1]樊旭兵.中国罗非鱼:21世纪中国献给世界的鱼——论罗非鱼的全球消费、全球养殖、全球竞争和全球营销[J].海洋与渔业:水产前沿,2011(2):50-52.
[2]蔡春林.中美鱼类进出口贸易分析[J].内陆水产,2009(6):35-37.
[3]朱泽闻,孙岩,王浩,等.2013年全国养殖渔情分析报告[J].中国水产,2014(3):13-19.
[4]Augusto C V,Helane M S,Marcelo Y,et al.Giant Amazonian fish pirarucu(Arapaima gigas):Its viscera as a source of thermostable trypsin[J].Food Chemistry,2012,133(4):1596-1602.
[5]Hayet B K,Rym N,Ali B,et al.Low molecular weight serine protease from the viscera of sardinelle(Sardinella aurita)with collagenolytic activity:Purification and characterisation[J].Food Chemistry,2011.124(3):788-794.
[6]Nalinanon S,Benjakul S,Kishimura H.Biochemical properties of pepsinogen and pepsin from the stomach of albacore tuna(Thunnus alalunga)[J].Food Chemistry,2010.121(1):49-55.
[7]Nalinanon S,Benjakul S,Visessanguan W,et al.Partitioning of protease from stomach of albacore tuna(Thunnus alalunga)by aqueous two-phase systems[J].Process Biochemistry,2009.44(4):471-476.
[8]Ketnawa S,Benjakul S,Martínez-Alvarez O,et al.Threephase partitioning and proteins hydrolysis patterns of alkaline proteases derived from fish viscera[J].Separation and Purification Technology,2014.132:174-181.
[9]El-Beltagy A E,El-Adawy T A,Rahma E H,et al.Purification and characterization of an acidic protease from the viscera of bolti fish(Tilapia nilotica)[J].Food Chemistry,2004,86(1):33-39.
[10]Klomklao S,Kishimura H,Yabe M,et al.Purification and characterization of two pepsins from the stomach of pectoral rattail(Coryphaenoides pectoralis)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,147(4):682-689.
[11]胡斌杰,陈金锋,王宫南.超声波法与传统热水法提取灵芝多糖的比较研究[J].食品工业科技,2007(2):190-192.
[12]钟赛意,王善荣,刘寿春.超声波技术在动物性食品中的应用[J].肉类研究,2006(11):33-37.
[13]王铮敏.超声波在植物有效成分提取中的应用[J].三明高等专科学校学报,2002(4):45-53.
[14]吴燕燕,王剑河,李来好,等.罗非鱼内脏蛋白酶超声波提取工艺的研究[J].食品科学,2007(7):245-248.
[15]郭彩华.带鱼内脏蛋白酶的性质[J].集美大学学报,1997, 2(2):58-61.
[16]李来好,颜伟,吴燕燕.蛇鲻胃蛋白酶的分离纯化和性质研究[J].热带海洋学报,2007,26(2):59-64.
[17]张寒俊,刘大川,杨国燕.紫外光谱法定量测定不同种蛋白酶活力的研究[J].粮食与饲料工业,2004(9):44-45.
[18]Klomklao S,Benjakul S,Kishimura H.Proteinases in Hubrid Catfish viscera:characterization and effect of extraction media[J]. Journal of Food Biochemistry,2010,34:711-729.
Ultrasonic-assisted extracting process of protease from catfish viscera
ZHANG Lan,YI Jie-rong*
(College of Food Science&Technology Shanghai Ocean University,Shanghai 201306,China)
The utilization of catfish processing by-products were studied in this paper.Crude protease from catfish stomach and intestine were extracted using ultrasonic method.The effects of various factors,including concentration of NaCl,extraction time,ultrasonic intensity and extraction temperature on protease from catfish stomach and intestine were investigated,respectively.The optimum conditions for the extraction of catfish viscera proteases were obtained by response surface analysis.The results showed that the optimum conditions of pepsin from stomach of catfish were as follows:0.3%NaCl solution,ultrasonic intensity 90 W,30 min of processing time and at 35℃.Under these optimized conditions,the measured protease activity reached 130 U/mL.The optimum conditions of protease from intestine of catfish were as follows:0.25%NaCl solution,ultrasonic intensity 100 W,40 min of processing time and at 35℃.Under these optimized conditions,the protease activity reached 114 U/mL.The result indicated that with the same solid to liquid extraction ratio(1∶5),protease from stomach had significantly higher enzyme activity than protease from intestine.
catfish;viscera;protease;response surface analysis;ultrasonic-assisted extraction
TS201.1
B
1002-0306(2015)22-0302-07
10.13386/j.issn1002-0306.2015.22.054
2015-03-04
张岚(1991-),女,硕士研究生,研究方向:食品加工中的生物化学变化,E-mail:kkxiaoshizi310@163.com。
*通讯作者:衣杰荣(1969-),女,博士,讲师,研究方向:食品加工中的生物化学变化,E-mail:jryi@shou.edu.cn。
哥本哈根大学食品系合作项目;上海海洋大学研究生科研项目基金。
