秦巴山区野生百合体外抗氧化特性的研究
2015-04-24刘师源
靳 磊,刘师源,张 萍
(宁夏大学农学院,宁夏银川750021)
秦巴山区野生百合体外抗氧化特性的研究
靳 磊,刘师源,张 萍*
(宁夏大学农学院,宁夏银川750021)
以野生百合宜昌百合(3个不同产地)、渥丹、山丹、卷丹、岷江百合和传统食用的兰州百合为研究对象,采用福林-肖卡试剂法测其总多酚含量,NaNO2-AlCl3比色法测定总黄酮含量,香草醛比色法测定其总黄烷醇含量,清除DPPH自由基、清除羟自由基、铜离子还原能力、抑制脂质过氧化物活性、金属离子螯合能力法评价百合鳞茎体外抗氧化活性。结果表明:野生百合鳞茎中的多酚类物质含量及抗氧化活性均显著高于兰州百合(p<0.05),同时百合鳞茎提取物抗氧化能力与提取物浓度间存在剂量-效应关系;百合鳞茎中多酚类物质与其抗氧化能力存在显著(p<0.05)或极显著(p<0.01)相关性,而且不同抗氧化方法间也存在显著相关性(p<0.05);此外,3个不同产地宜昌百合鳞茎中多酚类物质的组分、含量及其抗氧化活性存在显著差异(p<0.05),其中西乡县宜昌百合总酚、总类黄酮含量最高,并且具有最强的铜离子还原能力;留坝县宜昌百合总黄烷醇含量最高,对DPPH自由基的清除力、抑制脂质过氧化能力和金属螯合能力最强;而舟曲县宜昌百合仅对羟自由基清除力最强。这表明在野生百合开发利用时对其优良种源的筛选是非常必要的。
野生百合,多酚类物质,抗氧化活性
百合为百合科(Liliaceae),百合属(Lilium.L.)多年生鳞茎类草本植物的总称。百合鳞茎具有很高的食用和药用价值,具有止咳、祛痰、平喘、镇静等药理作用[1]。随着人们生活水平的提高,保健食品也随之兴起,人们开始注重膳食平衡,注重食物的多样性,百合正是在这种情况下被人们再次认识和接受,使得百合产品的开发应用具有广泛的前景。著称于世的食用百合——兰州百合,早在甘肃《平凉县志》中就有记载,迄今已有450多年的历史,其食用价值除体现在鳞茎肉质肥厚,含有丰富的淀粉、蛋白质及脂肪等,还体现在富含多糖、皂甙、生物碱及多酚类化合物等生物活性成分[2-4]。多酚类物质是一类广泛存在于蔬菜和水果中的天然次生代谢产物[5],其通过提供质子,消除自由基,自身形成稳定的共振结构,从而产生抗氧化作用,而且安全性远高于存在毒性和致癌性的人工合成抗氧化剂,如叔丁基羟基茴香醚、特丁基对苯二酚和二丁基羟基甲苯等,在食品、医药和化妆品中具有良好的应用前景[6]。研究结果发现[7],卷丹(L.lancifolium)鳞茎中多酚类物质具有良好的自由基清除能力,表明百合确有抗氧化活性,为百合属植物抗氧化功能食品方面的开发利用提供了基础理论依据。
百合属植物在全球约有100种,主要分布在亚洲、欧洲和北美洲等地区。我国作为百合属植物自然分布中心之一,拥有野生百合约55种,分布几乎遍布全国各地(除海南省)[8]。然而,百合属植物作为我国重要的野生资源,在生物活性方面的研究重视程度不足,对野生百合资源的抗氧化特性缺少系统的研究,严重阻滞了对这些珍贵资源的开发利用进程。因此,本研究选取在秦巴山区分布广泛的野生百合渥丹、山丹、宜昌百合(3个不同产地)、岷江百合及卷丹为实验材料,以常见的食用百合兰州百合作为对照,研究这些百合鳞茎中多酚类物质的抗氧化特性,发掘中国本土野生百合潜在的生物保健功能,为野生百合资源在医药、食品及保健品行业的开发利用提供研究基础,也为发现高效、安全的天然抗氧化剂提供理论依据。
1 材料与方法
1.1 材料与仪器
不同种类百合 于2014年8月分别收集于陕西省、甘肃省和四川省;渥丹、山丹和卷丹 分别采自陕西省太白县、柞水县和岚皋县;岷江百合 采自四川省茂县;宜昌百合 采自陕西留坝县、西乡县及甘肃的舟曲县;兰州百合 作为对照材料购自甘肃兰州市;福林-酚试剂 北京奥博星生物技术有限责任公司;没食子酸、芦丁、儿茶素、新亚铜、菲洛嗪、DPPH自由基(1,1’-diphenyl-2-picrylhydrazyl)、水溶性维生素E(Trolox) 美国Sigma公司;色谱甲纯、无水碳酸钠、氯化铝、亚硝酸钠、香草醛、盐酸、硫酸铜、醋酸钠、硫酸亚铁、双氧水、水杨酸、大豆卵磷脂、磷酸钠、氯化铁、抗坏血酸、羟甲苯丁酯、硫代巴比妥酸、氯仿、氯化亚铁 天津博迪化工有限公司。
UV-4803型紫外可见光分光光度计 上海尤尼柯仪器有限公司;KDC-140HR型低温冷冻离心机 安徽中科科学仪器有限公司;KQ-500DE型数控超声清洗器 昆山市超声仪器有限公司;SENCO-R型旋转蒸发仪 上海申生生化仪器厂;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 百合鳞茎多酚类物质的制备 采用Antonia的方法[9],略有修改,将各种类百合鳞茎分别去泥洗净,自然阴干后粉碎,过100目筛混匀后待用。称取100.0 g百合干粉倒入已装有1000 mL酸化甲醇溶液(1 mol/L盐酸∶甲醇∶水,1∶80∶19,v/v/v)的三角瓶中,放入超声波提取器中在30℃下提取20 min,之后于4℃低温离心10 min(12000 r/min),收集上清液;向残渣中加入酸化甲醇500 mL,混匀,按上述步骤重复提取2次,合并所有上清液并在30℃下旋转蒸发仪中真空浓缩去除甲醇,残留的水溶液真空冷冻干燥后,残留固体部分用甲醇重新溶解,待用。实验所有步骤均在避光条件下进行。
1.2.2 百合鳞茎中多酚类物质含量测定 总多酚含量采用福林-肖卡试剂法[10]测定,结果以百合鳞茎中含有的没食子酸质量(mg/100 g)表示;总黄酮含量采用NaNO2-AlCl3法[11]测定,结果以百合鳞茎中含有的芦丁质量(mg/100 g)表示;总黄烷醇含量采用香草醛比色法[12]测定,结果以百合鳞茎中含有的儿茶素质量(mg/100 g)表示。
1.2.3 抗氧化活性的测定
1.2.3.1 清除DPPH自由基活性的测定 参考Brand-Williams等的方法,略有改动[13]。精确称取12.50 mg DPPH标准品溶于甲醇中,定容至100 mL,使用前稀释5倍,现配现用。将0.1 mL百合鳞茎提取液(质量浓度0~2.0 mg/mL)加入至3.9 mL DPPH溶液中,避光反应30 min后于515 nm处测定吸光值,以相同体积的甲醇代替样品作为对照,结果以百合鳞茎中所含的水溶性维生素E(Trolox)物质的量(μmol/100 g)表示。
1.2.3.2 还原铜离子的能力(CUPRAC) 参考Apake等的方法,略有改动[14]。吸取0.1 mL百合鳞茎提取液(质量浓度0~2.0 mg/mL),依次加入5 mmol/L硫酸铜、3.75 mmol/L新铜试剂和1 mol/L,pH=7.0的醋酸铵缓冲液各1 mL,加入1 mL蒸馏水后反应30 min后450 nm比色,结果以百克百合鳞茎中所含的水溶性维生素E(Trolox)物质的量(μmol/100 g)表示。
1.2.3.3 清除羟自由基活性的测定(HRSA) 参考Sroka和Cisowski的方法,略有改动[15]。取1 mL百合鳞茎提取液(质量浓度0~2.0 mg/mL),依次加入硫酸亚铁(9 mmol/L)、水杨酸-乙醇(9 mmol/L)、双氧水(8.8 mmol/L)各1 mL。在37℃下反应15 min,4000 r/min离心5 min,在510 nm下测定吸光度。结果以自由基清除率表示。
清除率(%)=(1-AX/A0)×100
式中:A0为空白对照液的吸光值;AX为加入待测溶液后的吸光值。
1.2.3.4 抑制脂质过氧化物活性的测定(TBARS) 参考Tsuda等的方法,略有改动[16]。脂质体的制备:将大豆卵磷脂(5.0 g)溶解于500 mL磷酸缓冲液(20 mmol/L,pH=7.4)中,冰浴下超声溶解。吸取0.1 mL百合鳞茎提取液(质量浓度0~2.0 mg/mL),依次加入1%脂质体2 mL、25 mmol/L氯化铁0.1 mL、25 mmol/L双氧水0.1 mL、25 mmol/L抗坏血酸0.1 mL,再加入1.6 mL磷酸钠缓冲液(pH=7.4),在37℃下水浴1 h后,加入1 mL羟甲苯丁酯(20 mg/mL甲醇溶液)终止反应。随后,加入1 mL硫代巴比妥酸(1%)和1 mL盐酸(10%),沸水浴显色30 min后冰浴15 min,加入氯仿3 mL,离心20 min,收集上清液,于532 nm处测定其吸光值。以甲醇代替待测样液为空白对照,结果以脂质过氧化抑制率表示。
抑制率(%)=(1-AX/A0)×100
式中:AX为加入待测溶液后的吸光值;A0为空白对照液的吸光值。
1.2.3.5 金属离子鳌合能力(MCC) 参考Dinis等的方法,略有改动[17]。取10 mL试管,依次加入1 mL百合鳞茎提取液(质量浓度0~2.0 mg/mL)、50 μL氯化亚铁溶液(2 mmol/L)、0.15 mL菲洛嗪工作液(2.5 mmol/L)和3.8 mL的蒸馏水。反应10 min后在562 nm处测定其吸光值,结果以鳌合铁离子表示。
鳌合率(%)=(1-AX/A0)×100
式中:AX为加入待测溶液后的吸光值;A0为空白对照液的吸光值。
1.2.4 数据统计分析 结果以“平均值±标准差”表示,重复3次。相关性分析和方差分析利用SPSS 16.0软件完成。
2 结果与分析
2.1 不同种类(产地)百合鳞茎中酚类物质的含量
2.1.1 总酚 由图1可知,不同种类(产地)百合鳞茎中多酚类物质含量存在显著差异(p<0.05)。野生百合鳞茎中总酚含量显著高于食用百合兰州百合,其中,岷江百合总酚含量最高,达到了5190.75 mg/100 g,远远高于其他测试的百合种类;此外,3个不同产地宜昌百合鳞茎中总酚的含量差异显著,西乡县宜昌百合含量最高,留坝县宜昌百合总酚含量次之,舟曲县宜昌百合含量最低,仅有788.99 mg/100 g。本研究中分析的不同种类(产地)百合鳞茎中总酚的含量远高于其他常见的百合科植物,如洋葱和大葱[18]。
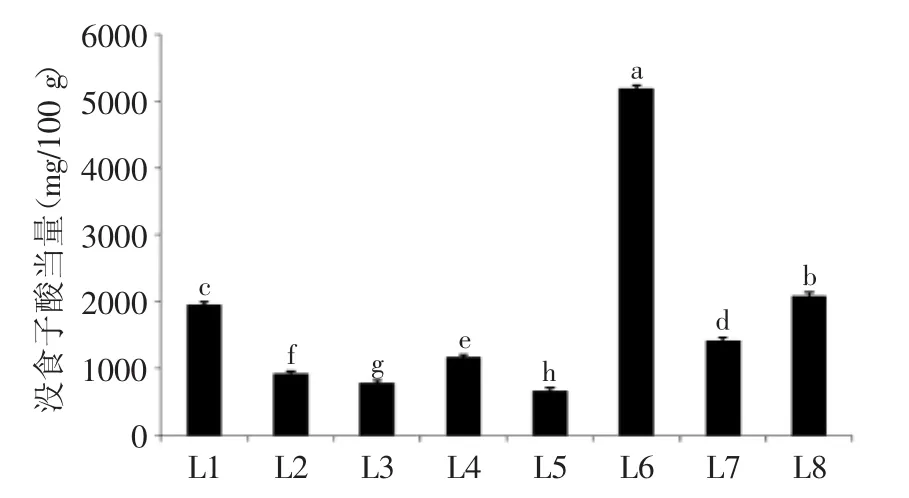
图1 不同种类(产地)百合鳞茎中总酚类物质的含量Fig.1 Contents of total phenolics in bulbs from different Lilium species
2.1.2 总黄酮 黄酮是多酚类物质中具有2-苯基色原酮(flavone)结构的化合物,具有抗氧化、抑制脂肪氧化等生物活性[19]。8种百合鳞茎均含有较高的类黄酮含量(图2),其中以岷江百合含量最高,总类黄酮含量达到2856.43 mg芦丁/100 g,西乡县宜昌百合次之,其余依次为留坝县宜昌百合、渥丹、山丹、卷丹和舟曲县宜昌百合,食用百合兰州百合含量最低,总类黄酮含量仅为301.06 mg芦丁/100 g。关于宜昌百合,3个不同产地之间总类黄酮含量差异显著,西乡县宜昌百合鳞茎中总类黄酮含量达到了1042.38 mg芦丁/ 100 g,其次是留坝县宜昌百合,其含量为836.26 mg芦丁/100 g,而舟曲县宜昌百合总类黄酮含量仅有356.10 mg芦丁/100 g,分别为前两个产地宜昌百合的34.16%和42.58%,这说明生态环境影响了宜昌百合鳞茎中类黄酮物质的积累。
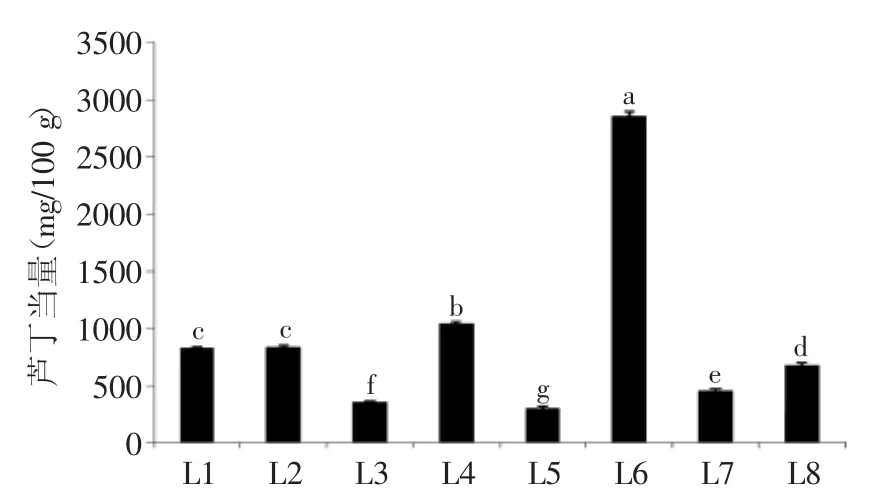
图2 不同种类(产地)百合鳞茎中总类黄酮物质的含量Fig.2 Contents of total flavonoids in bulbs from different Lilium species
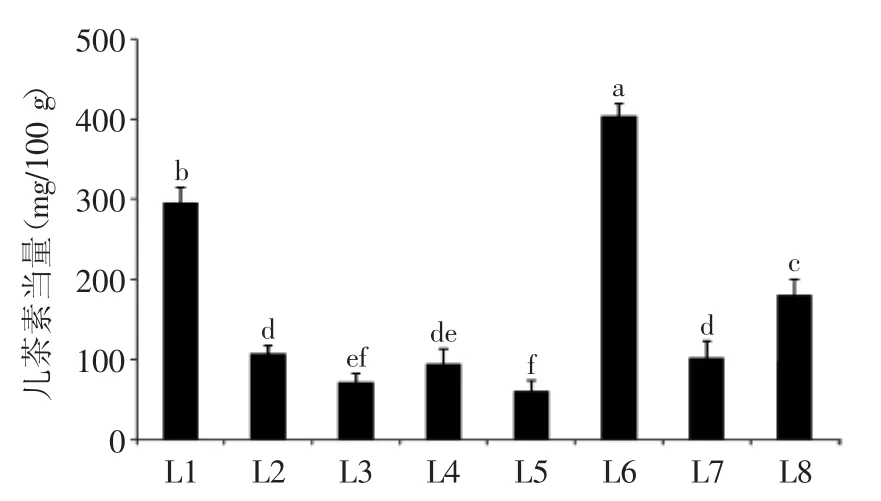
图3 不同种类(产地)百合鳞茎中总黄烷醇物质的含量Fig.3 Contents of total flavanols in bulbs from different Lilium species
2.1.3 总黄烷醇 黄烷醇包括单体儿茶素、寡聚体和多聚体等化合物,是构成植物苦味和结构感的重要的物质[20]。由图3可知,野生百合鳞茎中总黄烷醇的含量显著高于常见的食用百合兰州百合。其中以岷江百合含量最高,总黄烷醇含量达到403.91 mg儿茶素/100 g,兰州百合含量最低,总黄烷醇含量仅为60.73 mg儿茶素/100 g。不同种类百合鳞茎中总黄烷醇的含量由高到低的顺序为:岷江百合>渥丹>山丹>留坝县宜昌百合>卷丹>西乡县宜昌百合>舟曲县宜昌百合>兰州百合。野生百合鳞茎中黄烷醇总量远高于兰州百合,约为兰州百合黄烷醇含量的1.18~6.65倍,推断野生百合食用时苦味要高于食用的兰州百合。
2.2 不同种类(产地)百合抗氧化活性的比较
2.2.1 不同种类(产地)百合鳞茎提取物对DPPH自由基清除效果的比较 由图4可知,不同种类(产地)百合鳞茎提取物对DPPH自由基均有一定的清除能力,且清除力随提取物浓度的增加而增强。在整个测试浓度范围内,野生百合鳞茎提取物对DPPH的清除能力要强于兰州百合,当其质量浓度为2.0 mg/mL时,清除DPPH自由基的能力由强到弱的顺序为:岷江百合>山丹>卷丹>留坝县宜昌百合>西乡县宜昌百合>渥丹>舟曲县宜昌百合>兰州百合。

图4 不同种类(产地)百合鳞茎提取物对DPPH·的清除作用Fig.4 Scavenging effect of bulb extracts from different Lilium species on DPPH free radicals
2.2.2 不同种类(产地)百合对铜离子还原能力的比较(CUPRAC) 由图5所示,在质量浓度0.4~1.6 mg/mL范围内,除岷江百合外,其他百合鳞茎提取物的铜离子还原能力随浓度增幅变化不大。当提取液浓度为2.0 mg/mL时,岷江百合还原力最强,达到了1438.01 μmol/100 g,远高于其他测试的百合种类;在整个测试浓度范围内,野生百合鳞茎提取物的还原能力始终强于传统的食用百合兰州百合。
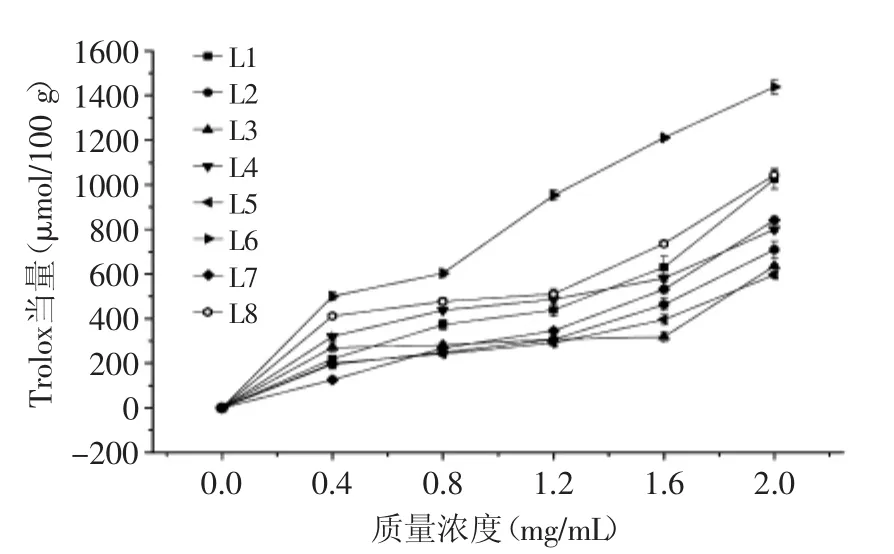
图5 不同种类(产地)百合鳞茎提取物的铜离子还原能力Fig.5 Cupric ion reducing antioxidant capacity of bulb extracts from different Lilium species
2.2.3 不同种类(产地)百合对羟自由基清除能力的比较(HRSA) 由图6可知,不同种类(产地)百合鳞茎提取物对羟自由基均有清除效果,并且在整个实验浓度范围,野生百合鳞茎提取物的清除作用均强于兰州百合,并且清除能力随浓度的升高而增强。当提取物质量浓度为2.0 mg/mL时,清除羟自由基的能力由强到弱的顺序为:岷江百合>舟曲县宜昌百合>渥丹>山丹>西乡县宜昌百合>留坝县宜昌百合>卷丹>兰州百合。

图6 不同种类(产地)百合鳞茎提取物对羟自由基的清除作用Fig.6 Scavenging effect of bulb extracts from different Lilium species on hydroxyl free radicals
2.2.4 不同种类(产地)百合抑制脂质过氧化能力的比较(TBARS) 由图7可以看出,不同种类(产地)百合鳞茎提取物对脂质过氧化反应均具有一定的抑制能力,并且随提取物浓度的升高而增强。在整个测试浓度范围内,野生百合鳞茎提取物对脂质过氧化的抑制能力始终强于食用百合兰州百合,在0.4~1.2 mg/mL时,不同种类(产地)百合鳞茎提取物对脂质过氧化反应的抑制效果差异明显,随后差异逐渐减小,当提取物质量浓度为2.0 mg/mL时,脂质过氧化的抑制能力由强到弱的顺序为:岷江百合>留坝县宜昌百合>舟曲县宜昌百合>西乡县宜昌百合>渥丹>卷丹>山丹>兰州百合。

图7 不同种类(产地)百合鳞茎提取物抑制脂质过氧化的能力Fig.7 Lipid peroxidation inhibition of bulb extracts from different Lilium species
2.2.5 不同种类(产地)百合金属螯合能力的比较(MCC) 由图8可知,不同种类(产地)百合鳞茎提取物对金属离子均具有一定的螯合能力,并且随提取物浓度的升高而增强。在整个测试浓度范围内,野生百合鳞茎提取物的金属螯合力能力始终明显强于食用百合兰州百合,其中岷江百合、山丹、渥丹和卷丹鳞茎提取物的金属螯合力较强(提取物浓度在0.8~2.0 mg/mL时,螯合能力大于50%),而3个不同产地宜昌百合螯合能力较弱。当提取物质量浓度为2.0 mg/mL时,不同种类(产地)百合鳞茎提取物的金属螯合能力由强到弱的顺序为:卷丹>山丹>岷江百合>渥丹>留坝县宜昌百合>舟曲县宜昌百合>西乡县宜昌百合>兰州百合。
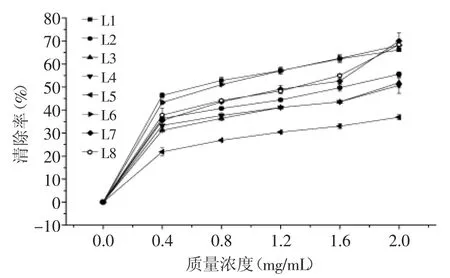
图8 不同种类(产地)百合鳞茎提取物的金属螯合能力Fig.8 Metal chelating capacity of bulb extracts from Lilium species
生物体内存在多种自由基,它们的物理和化学性质各不相同,因而生物体抗氧化特性的评定十分复杂,通常利用多种评价方法来综合衡量其抗氧化特性[21]。本研究中选取了包括DPPH清除力、Cu2+还原力、HRSA、MCC以及TBARS在内的5种抗氧化活性评价方法来评价百合鳞茎多酚类物质的抗氧化特性,分析不同评价方法间的差异性与协同性。结果表明,百合鳞茎中多酚类物质对多种自由基的清除、Cu2+还原、抑制脂质过氧化及金属离子螯合等均表现出良好活性,并且野生百合的抗氧化能力显著强于传统食用的兰州百合。这些研究结果暗示野生百合在天然抗氧化剂和功能性食品开发方面具有更广阔的前景。此外,与常见的蔬菜相比,本研究测试的不同种类(产地)百合鳞茎多酚类物质清除自由基的能力强于常见的马铃薯和胡萝卜等蔬菜[22],而且我国自古就有食用百合的传统。因此,本研究结果不仅为食品安全与健康的专家和政策的制定者提供了理论依据,同时也可以促进百合食品产业的发展,并为野生百合资源的有效保存和充分利用奠定了基础。
2.3 相关性分析
2.3.1 不同方法间的相关性 不同百合鳞茎多酚类物质的体外抗氧化评价方法所得结果之间的相关性具有较大的差异。不同的抗氧化评价方法其反应机理不同,因此选用多种不同反应机理的抗氧化评价方法评估百合抗氧化能力具有重要意义。表1显示了本研究中所选择的5种抗氧化能力评价方法之间的相关性。DPPH与CUPRAC及MCC等方法间彼此达到了显著相关,相关系数分别为0.70、0.72;CUPRAC与HRSA、CUPRAC与MCC、HRSA与TBARS方法间达到了显著相关,相关系数分别为0.71、0.73和0.73(p<0.05)。
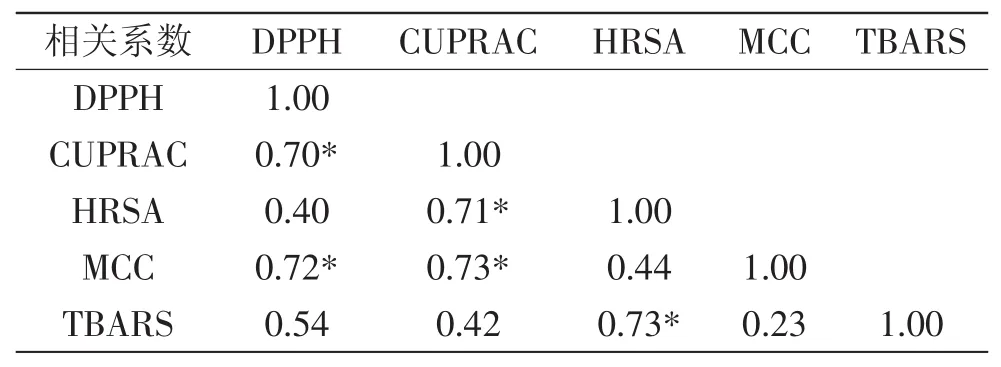
表1 不同抗氧化方法的相关性Table 1 Correlation coefficients among the different methods for antioxidant capacity
2.3.2 百合鳞茎中多酚类物质含量与抗氧化能力的相关性 多酚类物质总量和各单体酚含量与不同抗氧化方法之间存在相关性,见表2。通常情况下,相关系数越大,相关性越强,该酚类化合物可能对抗氧化能力贡献越大。总酚与DPPH、HRSA,总类黄酮与DPPH、HRSA、TBARS,总黄烷醇与HRSA的正相关性均达到了显著水平(p<0.05),而总酚、总类黄酮、总黄烷醇与CUPRAC的相关性达到了极显著水平,相关系数分别为0.96、0.85、0.95(p<0.01)。
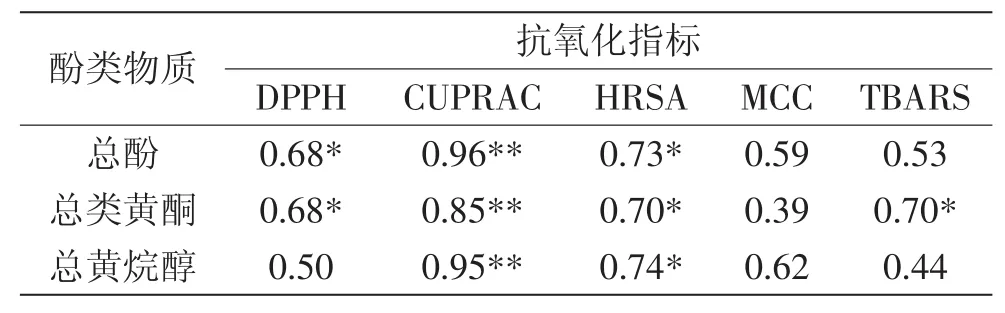
表2 百合鳞茎中多酚类物质含量与抗氧化活性的相关性Table 2 Correlation between polyphenolic contents and antioxidant capacity of bulb extracts from Lilium species
关于植物中多酚类物质与抗氧化能力的相关性,前人的研究较多,但结果不一致。Velioglu等对常见的28种谷物和果蔬等产品测定后认为,总酚含量与抗氧化活性呈显著相关关系[23];而Bocco等的研究结果表明,柑橘果皮和种子提取物中多酚类物质的含量与抗氧化活性无明显的相关性[24]。造成这一现象的原因可能是由于各样品中具有抗氧化活性的多酚类物质的组分和含量存在差异,也有可能在某些植物中抗氧化活性是由多酚类物质以外的其他抗氧化成分引起的。结果表明,百合鳞茎中酚类物质与DPPH、羟自由基清除力、Cu2+还原力和抑制脂质过氧化能力存在显著或极显著相关性;同时也发现,不同抗氧化方法间也存在显著相关性,这表明评价百合鳞茎抗氧化能力时,不同方法间具有可比较性和可替代性,该结果与Jiang和Zhang研究结果一致[25]。
3 结论
本研究中野生百合鳞茎多酚类物质总量显著高于传统食用的兰州百合,且不同种类(产地)百合鳞茎多酚提取物对多种自由基的清除、铜离子还原力、金属螯合力及抑制脂质过氧化等均具有良好的活性,野生百合的抗氧化能力显著强于兰州百合(p<0.05);百合鳞茎中多酚类物质与其抗氧化能力存在显著(p<0.05)或极显著(p<0.01)相关性;此外,3个不同产地宜昌百合鳞茎中多酚类物质的含量及其抗氧化活性存在显著差异,因此,在野生百合开发利用时对其优良种源的筛选是非常必要的。
[1]郭朝晖,蒋生祥.中药百合的研究和应用[J].中医药学报,2004,32(3):27-29.
[2]You X J,Xie C Y,Liu K L,et al.Isolation of non-starch polysaccharides from bulb of tiger lily(Lilium lancifolium Thunb)with fermentation of Saccharomyces cerevisiae[J].Carbohydrate Polymers,2010,81:35-40.
[3]Mimaki Y,Sashida Y.Steroidal saponins and alkaloids from the bulbs of Lilium brownii var.colchesteri[J].Chemical& Pharmaceutical Bulletin,1990,38:3055-3059.
[4]牛立新,李章念,李红卷,等.超声波提取卷丹鳞茎中总黄酮研究[J].中药材,2007,30(1):85-88.
[5]Fiorentino A,D’Abrosca B,Pacifico S,et al.Isolation and structure elucidation of antioxidant polyphenols from quince(Cydonia vulgaris)Peels[J].Journal of Agricultural and Food Chemistry,2008,56(8),2660-2667.
[6]成喜雨,崔馨,刘春朝,等.中草药抗氧化活性研究进展[J].天然产物研究与开发,2006,18(3):514-518.
[7]周中流,石任兵,刘斌,等.卷丹乙醇提取物及其不同极性部位抗氧化活性的比较研究[J].食品科学,2011,32(9):55-58.
[8]Rong L P,Lei J J,Wang C.Collection and evaluation of the genus Lilium resources in Northeast China[J].Genetic Resources and Crop Evolution,2011,58(1):115-123.
[9]Antonia C,Vaios T K,Anastasia M.Currants(Vitis vinifera L.)content of simple phenolics and antioxidant activity[J].Food Chemistry,2007,102(2):516-522.
[10]Singleton V L,Orthofer R,Lamuela-Raventos R M.Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J].Methods in Enzymology,1999,299:152-178.
[11]Kim D O,Chun O K,Kim Y J,et al.Quantification of polyphenolics and their antioxidant capacity in fresh plums[J]. Journal of Agricultural and Food Chemistry,2003,51(22):6509-6515.
[12]Rockenbach I I,Gonzaga L V,Rizelio V M,et al.Phenolic compounds and antioxidant activity of seed and skin extracts of red grape(Vitis vinifera and Vitis labrusca)pomace from Brazilian winemaking[J].Food Research International,2011,44(4):897-901.
[13]Brand-Williams W,Cuvelier M E,Berset C.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[14]Apak R,Guclu K,Ozyurek M,et al.Novel total antioxidant capacity index for dietary polyphenols and vitamins C and E,using their cupric ion reducing capability in the presence of neocuproine:CUPRAC method[J].Journal of Agricultural and Food Chemistry,2004,52(26):7970-7981.
[15]Sroka Z,Cisowski W.Hydrogen peroxide scavenging,antioxidant and anti-radical activity of some phenolic acids[J]. Food and Chemical Toxicology,2003,41(6):753-758.
[16]Tsuda T,Watanabe M,Ohshima K,et al.Antioxidative activity of the anthocyanin pigments cyanidin 3-o-beta-d-glucoside and cyaniding[J].Journal of Agricultural and Food Chemistry,1994,42(11):2407-2410.
[17]Dinis T C P,Madeira V M C,Almeida L M.Action of phenolic derivates(acetaminophen,salicylate,and 5-aminosalicylate)as inhibitors of membrane lipid-peroxidation and as peroxyl radical scavengers[J].Archives of Biochemistry and Biophysics,1994,315(1):161-169.
[18]Lu X N,Wang J,Al-Qadiric H M.Determination of total phenolic content and antioxidant capacity of onion(Allium cepa)and shallot(Allium oschaninii)using infrared spectroscopy[J]. Food Chemistry,2011,129(2):637-644.
[19]房玉林,孟江飞,张昂,等.罐储时间对赤霞珠葡萄酒中酚类化合物及抗氧化活性的影响[J].食品科学,2011,32(11):14-20.
[20]Christian H,Carl L K,Malte K.Flavanols and cardiovascular disease prevention[J].European Heart Journal,2010,31(21):2583-2592.
[21]Komes D,Ulrich D,Ganic K K,et al.Study of phenolic and volatile composition of white wine during fermentation and a short time of storage[J].Vitis,2007,46(2):77-84
[22]Zhou K Q,Yu L L.Total phenolic contents and antioxidant properties of commonly consumed vegetables grown in Colorado [J].LWT-Food Science and Technology,2006,39(10):1155-1162.
[23]Velioglu Y S,Mazza G,Gao L,et al.Antioxidant activity and total phenolics in selected fruits,vegetables,and grain products [J].Journal of Agricultural and Food Chemistry,1998,46(10):4113-4117.
[24]Bocco A,Cuvelier M E,Richard H,et al.Antioxidant activity and phenolic composition of citrus peel and seed extracts[J]. Journal of Agricultural and Food Chemistry,1998,46(6):2123-2129.
[25]Jiang B,Zhang Z W.Comparison on phenolic compounds and antioxidant properties of cabernet sauvignon and merlot wines from four wine grape-growing regions in China[J].Molecules,2012,17(8):8804-8821.
Antioxidant property of wild Lilium species from Qin-ba mountain
JIN Lei,LIU Shi-yuan,ZHANG Ping*
(School of Agriculture,Ningxia University,Yinchuan 750021,China)
Three different habitat of L.leucanthum,L.concolor,L.pumilum,L.lancifolium,L.regale and L.davidii var.unicolor were evaluated for total polyphenol content by Folin-Ciocalteau method,the total flavonoid content content was measured using NaNO2-AlCl3colorimetric method and the determination of total flavanol content was performed colorimetrically by the vanillin method.The scavenging ability of DPPH·and·OH,the cupricion reducing capacity,lipid peroxidation inhibition and metal chelating capacity were used to evaluate in vitro antioxidant activity of lily bulbs.The results showed that the contents of total polyphenolics and antioxidant activities of the wild Lilium species were significantly higher than those of L.davidii var.unicolor(p<0.05). Furthermore,there was a significant dose-effect relationship between the contents of lily bulb extracts and their antioxidant activities.Furthermore,the phenolic compounds of bulbs from tested Lilium species exhibited a significant positive correlation with antioxidant capacity(p<0.05 or p<0.01),and the positive correlation among the different methods was found(p<0.05).In addition,there was a significant differences among the three different habitat of L.leucanthum for their polyphenolis compounds and antioxidant activities(p<0.05).The Xixiang ecotype of the selected L.leucanthum had the highest contents of total polyphenolics and total flavonoid,and showed the strongest cupric-reducing antioxidant capacity.The Liuba ecotype of L.leucanthum had the highest total was flavanol content with the most outstanding DPPH free radical scavenging activity,metal chelating capacity and lipid peroxidation inhibition.The strongest hydroxyl radical scavenging activity was found in Zhouqu ecotype of L.leucanthum bulb extracts.These results strongly suggested that it was necessary to select propriate provenances for the utilization of wild Lilium species.
wild Lilium;polyphenolic;antioxidant activity
TS255.1
A
1002-0306(2015)22-0137-06
10.13386/j.issn1002-0306.2015.22.020
2015-03-16
靳磊(1982-),男,博士,讲师,研究方向:百合营养成分、活性物质及其生物活性的研究,E-mail:1jinlei1@163.com。
*通讯作者:张萍(1981-),女,博士,讲师,研究方向:植物次生代谢物的研究,E-mail:zpyinchuan@163.com。
宁夏大学人才引进科研启动基金资助(2013);国家级大学生创新创业训练计划项目(201410749008)。
