杏鲍菇乙醇提取物的抗氧化活性及成分分离鉴定
2015-04-24姜万舟杨明德张新宇金昌海
姜万舟,高 平,杨明德,王 勤,张新宇,阚 娟,刘 俊,金昌海,*
(1.扬州大学食品科学与工程学院,江苏扬州225127;2.浙江大学生物系统工程与食品科学学院,浙江杭州310058)
杏鲍菇乙醇提取物的抗氧化活性及成分分离鉴定
姜万舟1,2,高 平1,杨明德1,王 勤1,张新宇1,阚 娟1,刘 俊1,金昌海1,*
(1.扬州大学食品科学与工程学院,江苏扬州225127;2.浙江大学生物系统工程与食品科学学院,浙江杭州310058)
以杏鲍菇为原料,通过70%乙醇提取可溶性物质,通过体外抗氧化实验研究其乙醇提取物的抗氧化活性,通过高效液相色谱质谱联用技术(LC-MS)分析乙醇提取物的一些生物活性成分。对杏鲍菇乙醇提取物的成分分析表明,杏鲍菇乙醇提取物中蛋白质含量为2.41 mg/g(DW),总糖含量为25.46 mg/g(DW),多酚含量为12.03 mg/g(DW),黄酮含量为1.53 mg/g(DW)。体外抗氧化实验表明,杏鲍菇乙醇提取物对1,1-二苯基-2-三硝基苯肼(DPPH·)、羟自由基(·OH)、超氧阴离子自由基(O2-)都具有一定的清除能力。结果表明随着杏鲍菇乙醇提取物的浓度增大,抗氧化活性也增加。杏鲍菇乙醇提取物清除自由基能力的大小顺序为:·OH>DPPH·>O2-,而且杏鲍菇乙醇提取物对脂质过氧化具有明显的抑制作用。利用HPLC对多酚类物质进行了分析,其中含有原儿茶酸和黄岑素,利用LC-MS进一步对多酚类物质进行分析,证实其中含有:奎宁酸、没食子酸、原儿茶素、香豆酸和肉桂酸。
杏鲍菇,乙醇提取物,抗氧化活性,酚类化合物
杏鲍菇(Pleurotus eryngii)又名刺芹侧耳,属口蘑科侧耳属,具有菌肉肥厚、营养丰富、质地脆嫩、口感极佳的特点,其子实体色泽雪白,质地脆嫩,是集食用、药用、食疗于一体的食用菌新品种,被誉为“菇中之王”。据文献报道[1],杏鲍菇富含蛋白质、总糖、膳食纤维,而且还含有铜、铁、锰、锌、钙等大量对人体有益的矿物质及微量元素。对杏鲍菇药用功效的研究表明,杏鲍菇具有降血脂、降胆固醇、增强机体免疫力、抗氧化和抗肿瘤的作用。另外,国内外对杏鲍菇研究主要集中于多糖、胞外酶等[2],而对于杏鲍菇乙醇提取物的抗氧化性研究未见报道。随着对食品安全性意识的增高,人们越来越重视天然抗氧化剂。而且,我国杏鲍菇的产量非常大,大部分用于国内外的直接销售,对杏鲍菇的深加工的研究较少。因此,本实验以杏鲍菇为原料,从中提取乙醇提取物,对其成分进行分离鉴定,用HPLC及LC-MS法对多酚类物质进行鉴定,并进行体外抗氧化实验。为我国杏鲍菇产业的发展和其在抗氧化功能性食品方面的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
杏鲍菇 购买于扬州市超市;磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸(TCA)、三氯化铁、抗坏血酸、氢氧化钠、硫代巴比妥酸(TBA)、邻苯三酚、Tris、盐酸、无水乙醇、硝酸铝、1,1-二苯基-2-苦味肼基自由基(DPPH) 均为分析纯;磷酸、葡萄糖、浓硫酸、苯酚、冰乙酸、牛血清蛋白 生工生物工程(上海)有限公司,均为分析纯;甲醇、甲酸、没食子酸、原儿茶酸、儿茶素、绿原酸、对羟基苯甲酸、咖啡酸、对香豆酸、阿魏酸、肉桂酸、黄岑素 上海源叶生物科技有限公司,均为色谱纯。
ULT1386-3-V型超低温冰箱 美国REVCO公司;HH-6型数显恒温水浴 国华电器有限公司;RE-5299型旋转蒸发器 上海亚荣生化仪器厂;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;BS210S型电子天平 北京赛多利斯天平有限公司;ALPHA 1-2LD PLUS冻干机 德国Marin Christ公司;UV-7504紫外可见分光光度计 上海欣亮仪器有限公司;LC-20AT型高效液相色谱仪 日本岛津公司;质谱仪(LCQ Deca Xp MAX) 美国Thermo Fisher公司。
1.2 实验方法
1.2.1 材料预处理 剔除损伤个体,然后洗净切碎,用液氮冷冻,放在-75℃的冰箱中备用。之后用冷冻干燥机将杏鲍菇冷冻干燥,然后用万能粉碎机将杏鲍菇磨成粉末,放入装样瓶中,放在干燥器中备用。
1.2.2 杏鲍菇乙醇提取物的制备 参照Liu等[3]方法,称取杏鲍菇干粉5 g,加入400 mL 70%乙醇,充入氮气,迅速密封,在60℃水浴锅中避光磁力搅拌提取4 h,抽滤,35℃、90 r/min旋转蒸发,至溶液体积为20 mL左右为止,冷却至室温后放入-75℃超低温冰箱中预冻,冷冻干燥得杏鲍菇乙醇提取物。
1.2.3 杏鲍菇乙醇提取物各成分分析
1.2.3.1 蛋白质含量的测定 蛋白含量的测定采用考马斯亮蓝法,参照Bradford[4]的方法。
1.2.3.2 总糖含量的测定 总糖含量的测定采用苯酚-硫酸法,参照Dubois等[5]的方法。
1.2.3.3 总酚含量测定 总酚含量测定采用Folin-Ciocalteu比色法,参照Prior[6]的实验方法。
1.2.3.4 总黄酮含量的测定 总黄酮含量的测定采用NaNO2-Al(NO3)3-NaOH显色法,参照郭亚建[7]的方法。
1.2.4 杏鲍菇乙醇提取物体外抗氧化活性的研究
1.2.4.1 DPPH自由基清除率的测定 测定参考Begona[8]方法。以VC作为对照。实验重复三次。按照下式计算DPPH·自由基的清除率。
清除率(%)=[l-(Ai-Aj)/Ac]×100
式中:Ai为DPPH·乙醇溶液和试样液混合后测定的吸光度;Aj为试样液和无水乙醇混合后测定的吸光度;Ac为DPPH·乙醇溶液和无水乙醇混合后测定的吸光度。
1.2.4.2 还原力的测定 还原力的测定参照Oyaizu等[9]的方法。以VC作为对照。实验重复三次。
1.2.4.3 超氧阴离子自由基清除率的测定 测定参照陈灵然等[10]方法。以VC作为对照,实验重复三次。按照下式计算超氧阴离子自由基的清除率。
清除率(%)=[A0-(A1-A2)]/A0×100
式中:A0为蒸馏水代替受试物,在325 nm下测定的吸光度;A1为实验组在325 nm下测定的吸光度;A2为蒸馏水代替邻苯三酚作为空白组,在325 nm测定的吸光度。
1.2.4.4 羟基自由基清除率的测定 测定参照Smirnoff等[11]水杨酸法。以VC作为对照,实验重复三次。按照下式计算不同浓度受试物对羟基自由基的清除率。
清除率=[A0-(A1-A2)]/A0×100
式中:A0为蒸馏水代替受试物,在510 nm下测定的吸光度;A1为实验组在510 nm下测定的吸光度;A2为蒸馏水代替过氧化氢作为空白组,在510 nm测定的吸光度。
1.2.4.5 脂质过氧化抑制率的测定 抗脂质过氧化的测定主要参考Halliwell等[12]的方法。以VC作为对照,实验重复三次。根据以下公式计算受试物对脂质过氧化的抑制率。
抑制率(%)=[1-(A1-A2)/A0]×100
式中:A0为以蒸馏水代替受试物,在532 nm处测定的吸光度;A1为实验组在532 nm下测定的吸光度;A2为以蒸馏水代替TBA溶液,在532 nm处测定的吸光度。
1.2.5 杏鲍菇乙醇提取物中多酚类物质HPLC和LC-MS的分离鉴定
1.2.5.1 HPLC分离鉴定杏鲍菇提取物中多酚类物质
参照Palacios等[13]方法改进。高效液相色谱的条件:色谱柱:Inertsil ODS-SP C18(4.6 mm×250 mm,5 μm),检测器:SPD-20A UV-Vis紫外检测器,流动相:A:0.1%甲酸;B:甲醇。洗脱梯度:0~2 min,15%B;2~10 min,30%B;10~11 min,50%B;11~15 min,50% B;15~16 min,70%B;16~25 min,70%B;25~26 min,80%B;26~30 min,80%B;30~35 min,100%B。柱温:30℃,进样体积:10 μL,流速:1 mL/min,检测波长:280 nm。
1.2.5.2 LC-MS分离鉴定杏鲍菇乙醇提取物中多酚类物质 质谱条件:离子源:ESI+安捷伦喷射,气体温度:300℃,气体流速:10 L/min,喷雾器:15 psi,外壳气体温度:250℃,外壳气体流速:7 L/min,毛细管电压:4000 V,喷雾电压:500 V。
2 结果与分析
2.1 杏鲍菇乙醇提取物中营养成分含量

图1 杏鲍菇乙醇提取物中各活性物质的含量Fig.1 The content of various active substances in ethanol extract of Pleurotus eryngii
由图1可知,杏鲍菇乙醇提取物中蛋白质、总糖、多酚和黄酮的含量分别为2.41、25.46、12.03、1.53 mg/g(DW),占杏鲍菇干重比例分别为:0.06%、0.61%、0.29%和0.04%。且由图1可知,杏鲍菇乙醇提取物中总糖和多酚的含量较高。
2.2 杏鲍菇乙醇提取物对DPPH自由基清除率的影响
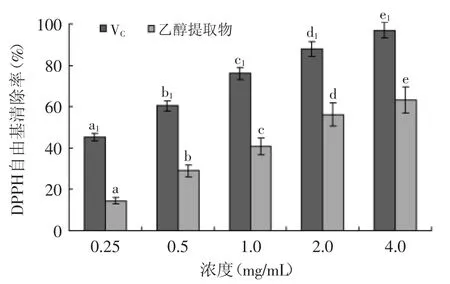
图2 杏鲍菇乙醇提取物对DPPH自由基清除率的影响Fig.2 Effect of ethanol extract of Pleurotus eryngii on DPPH scavenging
杏鲍菇乙醇提取物对DPPH自由基清除率测定结果如图2所示,由图2可知,随着提取物浓度的升高,其对DPPH自由基清除能力也升高,不同浓度之间存在显著性差异(p<0.05)。当提取物的浓度低于0.5 mg/mL时,杏鲍菇提取物清除DPPH自由基的能力比较低。浓度为4.0 mg/mL时,提取物对DPPH自由基的清除率为63%。结果表明,杏鲍菇乙醇提取物对DPPH自由基具有一定的清除能力。Prasad等[14]和Zhao等[15]研究表明酚类物质和黄酮类物质能减少DPPH自由基,这与其供氢能力有关。本研究中杏鲍菇乙醇提取物对DPPH自由基的清除能力与酚类物质密切相关。
2.3 杏鲍菇乙醇提取物对还原力的影响

图3 不同浓度杏鲍菇乙醇提取物还原力大小Fig.3 Effect of ethanol extract of Pleurotus eryngii on reducing power
铁氰化钾(K3Fe(CN)6)与抗氧化剂反应,被还原成亚铁氰化钾(Fe4(CN)6),Fe3+与亚铁氰化钾发生反应,生成普鲁士蓝,该物质在700 nm处有强吸收峰,从而通过吸光值测定其还原力。还原力与抗氧化能力成正比,吸光度值越大,说明抗氧化剂的还原力越强。杏鲍菇乙醇提取物还原力测定结果如图3所示,由图3可知,随着提取物浓度的增大,还原力增加。尤其当提取物的浓度小于1.0 mg/mL时,提取物还原力较小,当浓度为1.0 mg/mL时,其还原力有所增加,浓度为4.0 mg/mL时,其还原力显著(p<0.05)增加。表明随着提取物浓度增加,其抗氧化能力增加。
2.4 杏鲍菇乙醇提取物对超氧阴离子清除率的影响

图4 不同浓度杏鲍菇乙醇提取物对超氧阴离子自由基清除率的影响Fig.4 Effect of ethanol extract of Pleurotus eryngii on O2-·scavenging
乙醇提取物对超氧阴离子清除率测定结果如图4所示,由图4可知,随着浓度的增加,清除超氧阴离子的能力增加。当杏鲍菇提取物的浓度为0.5 mg/mL时,其清除超氧阴离子能力在25.33%,当浓度为2.0 mg/mL时,清除率为36.21%,当浓度为4.0 mg/mL时,清除率为45.01%。杏鲍菇乙醇提取物对超氧阴离子具有一定的清除能力。这与乙醇提取物中抗氧化成分密切相关。
2.5 杏鲍菇乙醇提取物对羟基自由基(·OH)清除率的影响
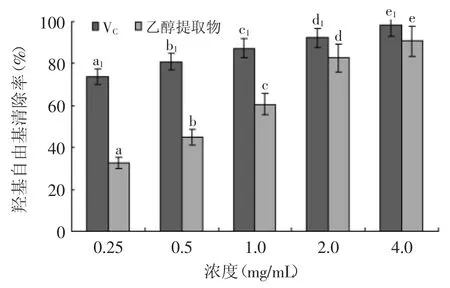
图5 杏鲍菇乙醇提取物对羟基自由基清除率的影响Fig.5 Effect of ethanol extract of Pleurotus eryngii on ·OH scavenging
·OH是目前发现的活性最高的自由基团,可以跟大部分生物大分子发生反应,破坏细胞内代谢平衡。清除·OH能够有效的减少机体损伤。乙醇提取物对羟基自由基清除率测定结果如图5所示,由图5可知,随着杏鲍菇乙醇提取物浓度的增加,清除羟基自由基的能力也随之增加。当浓度为0.25 mg/mL时,羟基自由基的清除率为32.67%,随着浓度的增加,清除率明显增加,差异性显著。当杏鲍菇提取物浓度大于2.0 mg/mL时,对羟基自由基(·OH)清除率与VC相接近。表明杏鲍菇乙醇提取物对·OH具有很强的清除作用,这与马齿苋70%的乙醇提取物[16]、蛇鞭菊乙醇提取物[17]、穿心莲乙醇提取物[18]都具有相似的抗氧化活性,对羟基自由基具有一定清除能力结果相一致。
2.6 杏鲍菇乙醇提取物对脂质过氧化抑制率的影响
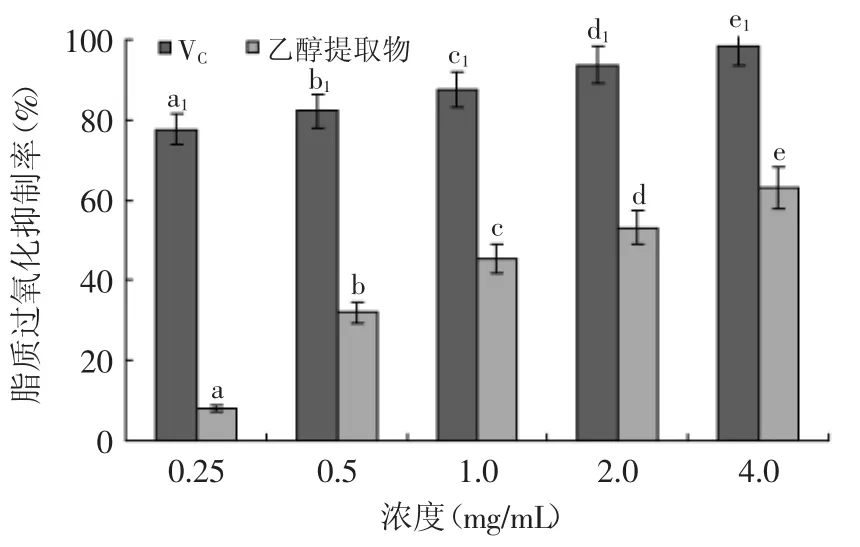
图6 不同浓度的杏鲍菇乙醇提取物对脂质过氧化抑制率的影响Fig.6 Effect of ethanol extract of Pleurotus eryngii on lipid peroxidation inhibition ratio
乙醇提取物对脂质过氧化抑制率测定结果如图6所示,当杏鲍菇提取物的浓度为0.25 mg/mL时,脂质过氧化抑制率仅为8.01%,抑制率较低,但随着浓度的增加,其对脂质过氧化的抑制率明显增加,且不同浓度间差异性显著(p<0.05)。
2.7 杏鲍菇乙醇提取物的高效液相色谱法分离鉴定
混合标准品的高效液相色谱图如图7,1、2、3、4、5、6、7、8、9、10和11所对应的峰分别是没食子酸、原儿茶酸、儿茶素、绿原酸、对羟基苯甲酸、咖啡酸、对香豆酸、阿魏酸、奎宁酸、肉桂酸和黄岑素。
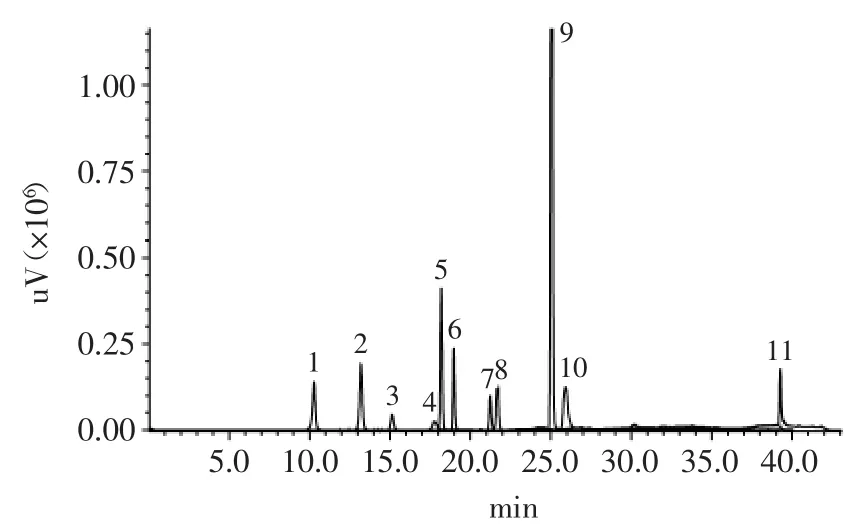
图7 酚类物质混合标准品的高效液相色谱图Fig.7 High-performance liquid chromatogram of the mixed standard samples
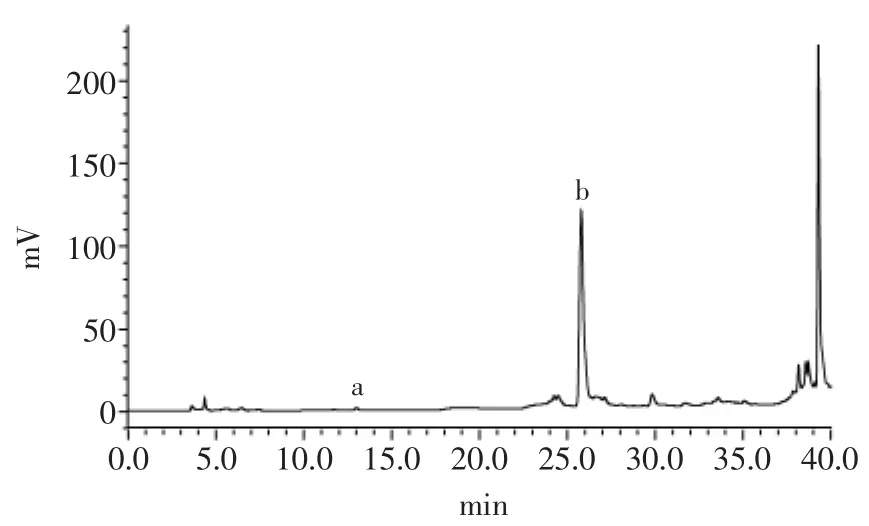
图8 杏鲍菇多酚的高效液相色谱图Fig.8 High-performance liquid chromatogram of Pleurotus eryngii polyphenols
杏鲍菇多酚的高效液相色谱图如图8所示,a、b对应的峰分别是原儿茶酸和肉桂酸。
2.8 杏鲍菇乙醇提取物的LC-MS法分离鉴定

图9 酚类物质混合标准品的质谱图Fig.9 The mass spectrum of the mixed standard samples
混合标准品的质谱分析结果如图9所示,1、2、3、4、5、6、7、8、9、10和11对应的峰分别是奎宁酸、没食子酸、原儿茶酸、儿茶素、绿原酸、对羟基苯甲酸、咖啡酸、对香豆酸、阿魏酸、肉桂酸和黄岑素。
杏鲍菇多酚的质谱分析结果如图10所示,a、b、c、d和e对应的峰分别是奎宁酸、没食子酸、原儿茶酸、对香豆酸和肉桂酸。
3 结论
判定抗氧化活性需要多体系评价。本实验中测定了还原力、DPPH自由基清除率、羟基自由基清除率、超氧阴离子清除率和脂质过氧化抑制率评价杏鲍菇乙醇提取物的抗氧化活性。在体外抗氧化实验中,杏鲍菇乙醇提取物具有很强的抗氧化活性,对DPPH·、·OH、O2-·都具有一定的清除能力,且杏鲍菇乙醇提取物对自由基清除能力的大小依次为:·OH>DPPH·>O2-·。而且杏鲍菇乙醇提取物具有一定的还原能力和抗脂质过氧化的能力,但杏鲍菇乙醇提取物的还原力不强,而对脂质过氧化抑制率较强。另外,随着杏鲍菇乙醇提取物的浓度的增加,其抗氧化的能力也逐渐增加。用HPLC法分离鉴定对乙醇提取物中多酚进行测定,其中可能含有原儿茶酸和肉桂酸,用LC-MS法对杏鲍菇乙醇提取物多酚进一步证实其中含有奎宁酸、没食子酸、原儿茶素、对香豆酸和肉桂酸。

图10 杏鲍菇多酚的质谱图Fig.10 The mass spectrum of the Pleurotus eryngii polyphenols
本研究中杏鲍菇70%乙醇提取物中多酚含量为12.03 mg/g(DW)。国内外学者对植物中抗氧化活性与总酚之间的关系进行大量的研究,结果表明,大多数植物提取物中抗氧化活性跟酚物质含量有关[18-19]。植物多酚能抑制各种酶反应产生的超氧阴离子自由基[20],同时植物中多酚的含量也代表其具有抗氧化活性的大小[21]。本研究证实杏鲍菇乙醇提取物在较高浓度下具有较强的抗氧化活性,且杏鲍菇乙醇提取物抗氧化活性与多酚密切相关,具有替代抗氧化剂的潜质。
[1]王凤芳.杏鲍菇中营养成分的分析测定[J].食品科学,2002,23(4):132-135.
[2]万善霞,滑静,王文平,等.杏鲍菇漆酶部分酶学性质的研究[J].中国农学通报,2009,25(21):107-109.
[3]Liu J,Jia L,Kan J,et al.In vitro and in vivo antioxidant activity of ethanolic extract of white button mushroom(Agaricus bisporus)[J].Food and Chemical Toxicology,2013,51:310-316.
[4]Bradford M.Rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[5]Dubois M,Gilles K,Hamilton J,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28:350-356.
[6]Prior R,Wu X,Schaichs K.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J].Journal of Agriculture,2005,85:1461-1468.
[7]郭亚建,范莉,王晓强.关于NaNO2-Al(NO3)3-NaOH比色法测定总黄酮方法的讨论[J].药物分析杂志,2002,2(2):97-99.
[8]Begona B,Veronica N,Maria M,et al.In vitro antioxidant activity of red grape skins[J].European Food Research and Technology,2004,218:173-177.
[9]Oyaizu M.Studies on products of browning reaction:antioxidative activity ofbrowning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44:307-315.
[10]陈灵然,王琴.蓖麻多糖的提取及其清除自由基的作用[J].中国兽医科技,2004,34(4):59-62.
[11]Smirnoff N,Quinton J,Cumbe S.Hydroxyl radical scavenging activity of Compatible solutes[J].Phytochemistry,1989,28:1057-1060.
[12]Halliwell B,Chirico S.Lipid peroxidation:its mechanism,measurement,and significance[J].The American Journal of Clinical Nutrition,1993,57:715-724.
[13]Palacios M,Lozano C,Moro M,et al.Antioxidant properties of phenolic compounds occurring in edible mushrooms[J].Food Chemistry,2011,128:674-678.
[14]Prasad NK,Divakar S,Shivamurthy GR,et al.Isolation of a free radical scavenging antioxidant from water spinach(Ipomoea aquatica Forsk)[J].Journal of Science of Food and Agriculture,2005,85:1461-1468.
[15]Zhao F,Wang L,Liu K.In vitro anti-inflammatory effects of arctigenin,a lignan from Arctium lappa L.,through inhibition on iNOS pathway[J].Journal of Ethnopharmacology,2009,122:457-462.
[16]苏锐,张红.马齿苋黄酮抗氧化活性研究[J].安徽农业科学,2010,38(8):4068-4070.
[17]Kanatt S,Chander R,Sharma A.Antioxidant potential of mint(Mentha spicata L.)in radiation-processed lamb meat[J]. Food Chemistry,2007,100:451-458.
[18]Tripathi R,Mohan H,Kamat JP.Modulation of oxidative damage by natural products[J].Food Chemistry,2007,100:81-90.
[19]Huang B,Ban X,He JS,et al.Heteroprotrective and antioxidant activity of ethanolic extracts of edible lotus(Nelumbo nucifera Gaern.)leaves[J].Food Chemistry,2010,120:873-878.
[20]Rice-Evans C.The relative antioxidant activities of Plantdevived polyphenolic flvaonoids[J].Free Radical Research,1995,22:375-383.
[21]Skerget M,Kotnik P,Hadolin M,et al.Phenols,proanthocyanidins,flavones and flavonols in some plant materials and their antioxidant activities[J].Food Chemistry,2005,89:191-198.
Antioxidant activity and component identification of ethanol extract of Pleurotus eryngii
JIANG Wan-zhou1,2,GAO Ping1,YANG Ming-de1,WANG Qin1,ZHANG Xin-yu1,KAN Juan1,LIU Jun1,JIN Chang-hai1,*
(1.College of Food Science and Engineering,Yangzhou University,Yangzhou 225127,China;2.Zhejiang University,College of Biosystems Engineering and Food Science,Hangzhou 310058,China)
The antioxidant activities of ethanolic extract from Pleurotus eryngii were evaluated by various methods in vitro.Some bioactive components of ethanolic extract were analysed by high performance liquid chromatography mass spectrometry(LC-MS).In the ethanol extract of Pleurotus eryngii,the protein content was 2.41 mg/g(DW),the polysaccharide content was 25.46 mg/g(DW),polyphenol content was 12.03 mg/g(DW)and the flavonoids content was 1.53 mg/g(DW).In antioxidant assays in vitro,ethanolic extract of Pleurotus eryngii was found to have strong reducing power,superoxide radical,hydroxyl radical and 2,2-diphenyl-1-picrylhydrazyl radical scavenging activity.The results also showed that with the concentration of ethanol extract of Pleurotus eryngii increased,the antioxidant activity also increased.Free radical scavenging capacity of ethanolic extracts from Pleurotus eryngii was:·OH>DPPH·>O2-,and the ethanol extract of Pleurotus eryngii had a certain ability of reducing ability and anti lipid peroxidation.The main phenolic compounds in ethanolic extract analyzed by ultra-high performance liquid chromatography tandem mass spectrometry were quinic acid,gallic acid,catechin,and p-coumaric acid and cinnamic acid.
Pleurotus eryngii;ethanol extract;antioxidant acitivity;phenolic compound
TS255.1
A
1002-0306(2015)22-0087-05
10.13386/j.issn1002-0306.2015.22.009
2015-04-14
姜万舟(1991-),男,在读硕士研究生,研究方向:现代调理食品的研究与开发,E-mial:1245156981@qq.com。
*通讯作者:金昌海(1963-),男,博士,教授,研究方向:农产品加工与贮藏,E-mial:chjin@yzu.edu.cn。
江苏省科技计划项目(BC2013408);教育部大学生创新创业训练计划项目(201311117021);江苏省大学生实践创新训练计划立项项目(201311117021Z)。
