离子液体水溶液吸收模拟烟气中SO2
2015-04-01王晨星任树行侯玉翠王一鸣田士东吴卫泽
王晨星,任树行,侯玉翠,王一鸣,田士东,吴卫泽
(1北京化工大学化学工程学院,化工资源有效利用国家重点实验室,北京 100029;2太原师范学院化学系,山西 太原 030031;3中南大学化学化工学院,湖南 长沙 410083)
引言
我国是多煤少油的能源消耗大国,一次能源消费中煤炭占据了70%左右,并且其中约有80%用于直接燃烧,为我国提供电力和热能。然而,燃煤烟气中含有大量的污染物,如粉尘、SO2、NOx、CO2,其中SO2的影响更为严重。SO2不仅会形成酸雨对环境造成污染[1],而且对人身体健康也会造成伤害。与此同时,SO2又是一种重要的化工原料。因此,对SO2的控制及回收具有重要意义。目前成熟的湿法脱硫技术有:钙法脱硫技术[2]、氨法脱硫技术[3-4]、钠法脱硫技术[5-6]等。虽然这些技术能解决一定的脱硫问题,但或多或少存在一些问题。如钙法脱硫技术中,使用的石灰石脱硫会生产出大量的副产品石膏,易出现结垢、堵塞等问题[7],并且产生的石膏品位低,没有回收利用的价值,从而形成二次污染[8];氨法脱硫技术中,使用的氨水本身就具有挥发性,在吸收过程中,不免会有氨以气态形式进入大气造成资源浪费和二次污染[9];钠法脱硫技术中,长时间运行后,系统中的Na2SO4结晶易堵塞管道,而且在处理吸收后的富液时会产生大量的废水[10]。研究发现,离子液体具有很多优良的性质,如蒸气压低、热稳定性好、可设计性等[11-13],这使得离子液体在各个领域都有广泛的应用。离子液体作为一种新型吸收剂,在烟气脱硫方面也具有很强的优势,具有处理 SO2浓度低、脱硫效率高、吸收速度快等优点[14]。Wu等[15]首次以四甲基胍和乳酸为原料,经过中和得到四甲基胍乳酸盐[TMG]L,并进行SO2吸收实验。研究发现,在常压、45℃时,[TMG]L对体积分数为8%的SO2饱和吸收量可达0.982 mol SO2·(mol IL)-1。Wu等[16]研究了水对TMGL吸收SO2的影响,发现离子液体在吸收 SO2的过程中不断吸收水分,使得离子液体黏度降低,增加了传质效果。Yuan等[17]合成了一系列醇胺类离子液体,并考察了其对 SO2的吸收性能以及离子液体的再生循环利用情况,发现醇胺类离子液体可以有效地吸收SO2,并可以在较温和的条件下进行再生。然而,目前离子液体还很少用于工业吸收SO2,缺少必要的放大数据。
本研究以乙醇胺和乳酸为原料,通过中和法制备了乙醇胺乳酸盐[MEA]L,将所制[MEA]L稀释配制成一定浓度的水溶液,直接用于放大脱硫实验。建立了一套放大装置,在装置中进行脱硫实验,考察了吸收剂含水量、烟气中SO2浓度、气液比、烟气成分等对吸收过程的影响,以此获得最佳实验条件,并在此条件下进行吸收-解吸循环实验,为工业应用提供放大数据。
1 实验材料和方法
1.1 材料
乙醇胺,AR,阿拉丁试剂有限公司提供,质量分数 >99.0%;乳酸,AR,阿拉丁试剂有限公司提供,质量分数85.0%~90.0%;二氧化硫,北京海普气体有限公司提供,体积分数 >99.95%;二氧化碳,北京海普气体有限公司提供,体积分数 >99.995%;去离子水,化工资源有效利用国家重点实验室提供,电导率σ<1.5 μS·cm-1。
1.2 实验装置
脱硫实验装置如图1所示,主要包括:模拟烟气制备系统、吸收系统、解吸系统、烟气分析系统以及尾气吸收系统。模拟烟气通过空气泵和SO2钢瓶提供原料气体,在混合罐中进行混合,由转子流量计控制流量;吸收系统中吸收塔为316 L不锈钢材质(高1.8 m,内径46 mm),内装陶瓷拉西环填料(填料层高1.0 m),富液罐为316 L不锈钢材质(容积12 L);解吸塔为316 L不锈钢材质(高1.5 m,内径50 mm),内装陶瓷拉西环填料(填料层高0.5 m),解吸塔塔釜通过内置加热器进行加热,贫液罐为316 L不锈钢材质(容积12 L);烟气分析系统中,通过综合烟气分析仪(Kane International limited 公司生产,KM9106型,SO2测量范围 0~14285 mg·m-3,精度15 mg·m-3,对模拟烟气及尾气中的 SO2进行测定;尾气吸收系统中用浓度为 1.0 mol·L-1NaOH进行尾气处理。
1.3 实验方法
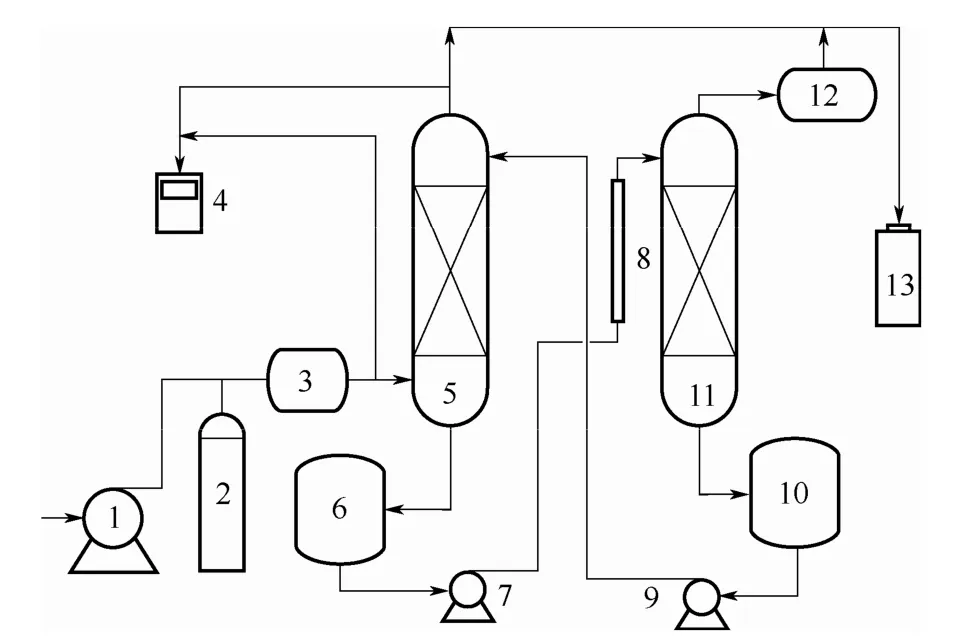
图1 实验装置Fig.1 Schematic diagram of experiment apparatus
1.3.1 乙醇胺乳酸盐吸收剂的制备 乙醇胺乳酸盐([MEA]L)通过将乙醇胺与等物质的量的乳酸中和制备,具体合成方法见文献[18]。将合成的[MEA]L与去离子水混合,配制成不同含水量的吸收剂。实验中用到的离子液体水溶液均为新鲜配制。离子液体和去离子水按一定比例混合后,通过水分滴定仪进行水分测定,每个数值重复测试3次,取其平均值。
1.3.2 SO2吸收实验 储存在贫液罐中的吸收剂由隔膜泵以一定流量从吸收塔塔顶进入,空气和SO2经混合罐混合成模拟烟气,从吸收塔塔底进入,吸收剂与模拟烟气逆流接触并吸收。吸收后的富液储存于富液罐中,尾气中SO2浓度,由综合烟气分析仪跟踪测定。富液由隔膜泵从富液罐中抽出,经预热进入解吸塔,由解吸塔塔釜加热产生的蒸汽对其进行再生。再生的贫液经冷却进入贫液罐,再次打入吸收塔进行循环吸收。解吸塔出口的SO2经尾气吸收系统处理后排空。
1.3.3 分析测试 模拟烟气中 SO2浓度和尾气中SO2浓度由综合烟气分析仪测定。SO2的去除率η(%)由式(1)进行计算

式中,Cin为模拟烟气中SO2的浓度, mg·m-3,Cout为尾气中SO2浓度,mg·m-3。
吸收后富液中 SO2含量根据国标 GB/T 11198.12—1989提供的方法进行测定。
2 实验结果与讨论
2.1 吸收剂中水含量对吸收的影响
合成好的离子液体与去离子水混合成不同含水量的吸收剂,根据式(2)计算出最小液气比,以此得到离子液体的最小用量,并得到在保持离子液体用量一定的条件下吸收剂用量。
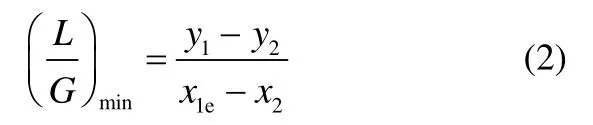
式中,G为模拟烟气的摩尔流量;L为[MEA]L的摩尔流量;y1为模拟烟气中 SO2的摩尔分数;y2为出口排放的SO2摩尔分数,根据《锅炉大气污染物排放标准》GB 13271—2014中燃煤锅炉的 SO2排放浓度定为 300 mg·m-3;x1e为平衡时[MEA]L中 SO2的摩尔分数,该数据从文献[19]中获得;x2定为0。
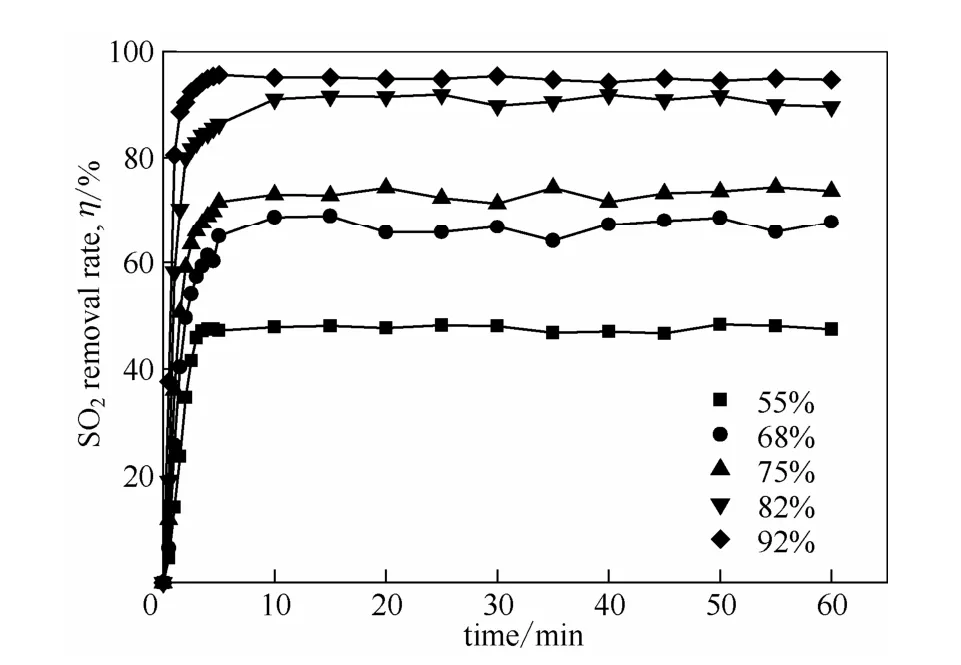
图2 在40℃、常压下不同含水量[MEA]L水溶液对SO2的去除率随时间的变化关系Fig.2 Removal rate of SO2as a function of time with different mass fractions of water in [MEA]L solution
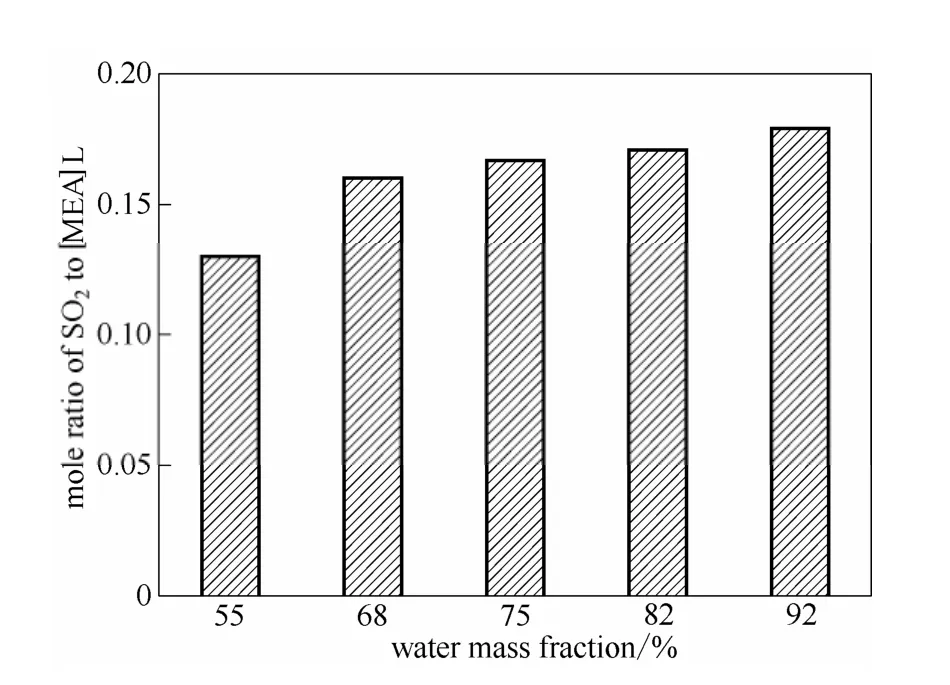
图3 在40℃、常压下不同含水量[MEA]L水溶液对SO2的摩尔吸收量Fig.3 Mole ratio of SO2to [MEA]L with different water contents in [MEA]L solution
如图2和图3所示,吸收剂对烟气中SO2的去除率随含水量的增加而增加,与之相对应,从塔顶到塔釜这一过程中[MEA]L对SO2的摩尔吸收量也随着水分的增加而增加。这与之前离子液体对SO2的饱和吸收实验结果相符合,这是由于 SO2不断通入体系中,水含量的增加不会引起亚硫酸的浓度改变,只会使其他成分的浓度下降,根据勒夏特列原理,平衡向正方向移动,从而增加了离子液体对SO2的吸收量[20]。与此同时,水含量的增加也降低了吸收剂的黏度,增强了流动性和分散性,从而提高了传质效果。然而,在应用时,含水量并不是越高越好,因为含水量越大,吸收剂中的有效成分离子液体越少,需要输送的动力消耗就越大,因此,含水量在 70%左右即可满足操作需求。
2.2 吸收剂用量(气液比)对吸收的影响
配制含水量为 75%的[MEA]L溶液作为吸收剂,在不同的气液体积比进行吸收SO2实验,结果如图4、图5所示。发现在SO2浓度为10000 mg·m-3时,随着吸收剂用量的增加(气液比的减少)出口SO2的浓度是下降的,在气液比为420时就能满足排放标准(≤300 mg·m-3)。在更低的气液比时,虽然SO2的浓度达到排放标准,但是从塔顶到塔釜这一过程中[MEA]L对SO2的摩尔吸收量却不是很高。因此,在此条件下选择气液比为420时,既满足排放标准,离子液体的利用率也比较高,消耗的动力也相对较少。
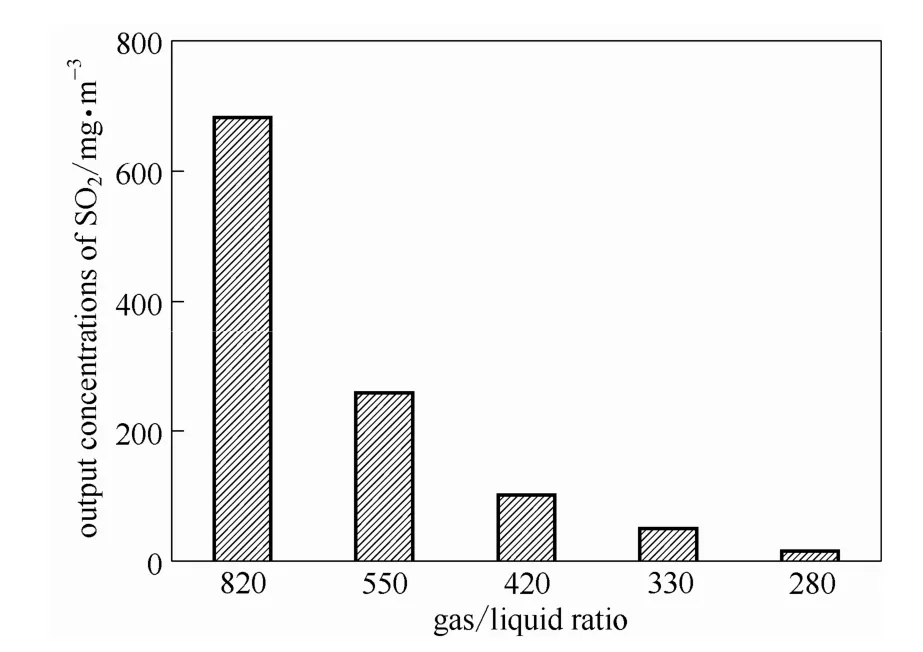
图4 在40℃、常压下含水量75%[MEA]L水溶液吸收SO2后出口浓度的变化Fig.4 Output concentration of SO2as a function of vapor/liquid ratio after SO2absorption
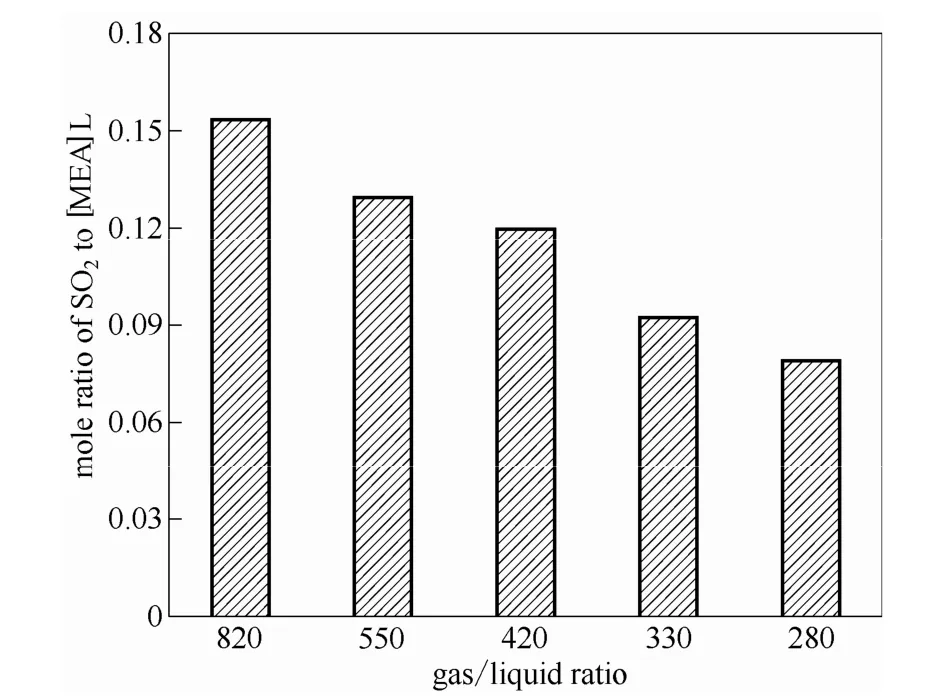
图5 在40℃、常压下不同气液比时[MEA]L对SO2的摩尔吸收量Fig.5 Mole ratio of SO2to [MEA]L with different vapor/liquid ratios
2.3 烟气中SO2浓度对吸收的影响
烟气中SO2浓度对吸收的影响结果如图6、图7所示。在气液比为420时,含水量为75%的[MEA]L溶液,对不同浓度SO2的去除率随着SO2浓度的变化没有显著的变化,这是因为在浓度较低时,虽然传质推动力较低,但是对应的吸收剂量比较大,吸收得比较彻底。在浓度较高时,传质推动力比较大,因此也具有较高的去除率。然而,由于吸收剂的吸收能力有限,出口SO2的浓度却有明显的增加。在此操作条件下,烟气中 SO2浓度为 2850~14280 mg·m-3时,出口浓度小于300 mg·m-3,满足排放标准。
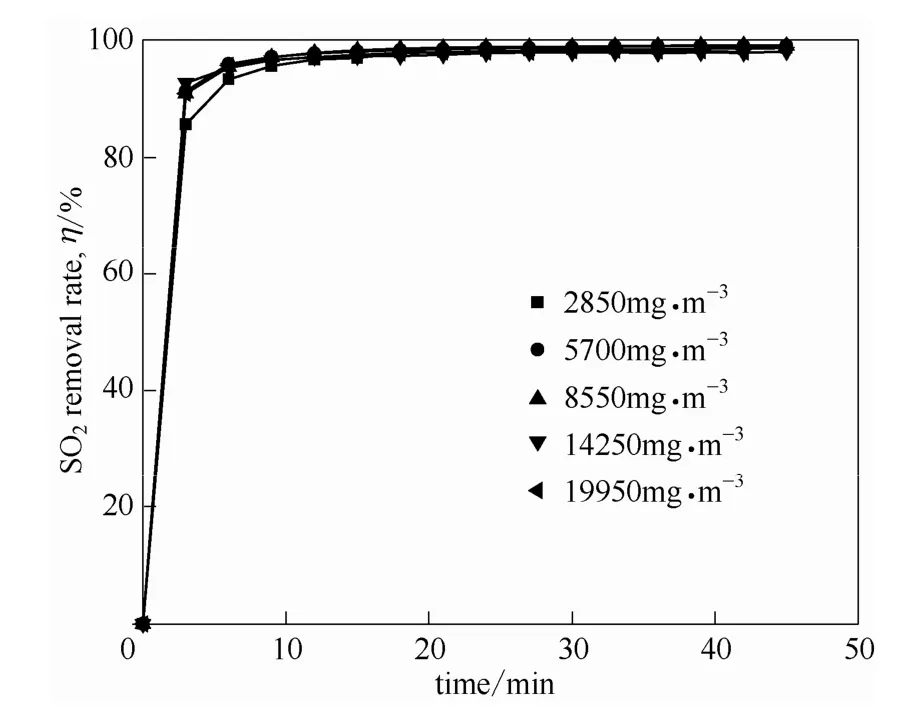
图6 在40℃、常压下含水量75%[MEA]L水溶液吸收对不同浓度SO2去除率随时间的变化Fig.6 Removal rate of SO2as a function of time with different SO2concentrations in flue gas
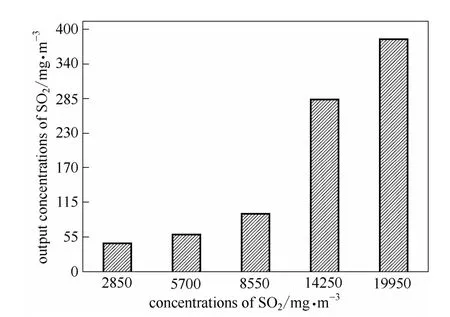
图7 在40℃、常压下含水量75%[MEA]L水溶液吸收不同浓度SO2后出口SO2浓度的变化Fig.7 Output concentration of SO2as a function of SO2concentration
2.4 烟气中CO2对吸收的影响
燃煤烟气中含有10%~15%的CO2,因此需要考虑CO2对吸收的影响。实验测定了吸收剂对含有体积浓度为11% CO2的模拟烟气的吸收效果。如图8所示,烟气中的CO2对SO2的去除率没有影响。并且,使用 TOC对吸收前后吸收剂的分析可以知道,吸收前吸收剂中的CO2为20.68 mg·m-3,吸收后吸收剂中CO2为17.72 mg·m-3,即吸收前后吸收剂中 CO2的含量没有变化,这说明吸收剂对CO2没有吸收,仅对烟气中的SO2进行选择性吸收。
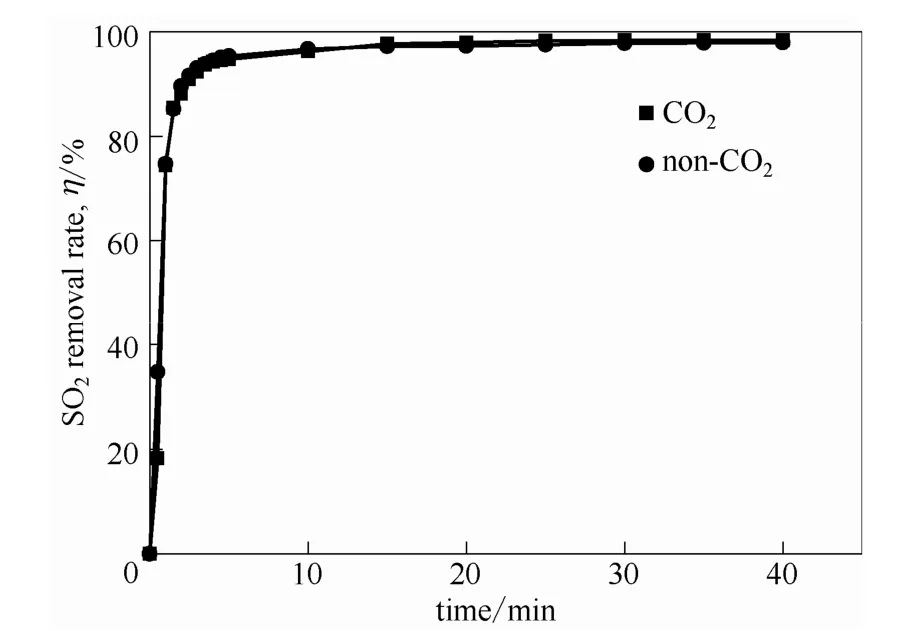
图8 在40℃、常压下含水量75%[MEA]L水溶液吸收对SO2去除率随时间的变化Fig.8 Removal rate of SO2as a function of time
2.5 再生对吸收的影响
通过前几组实验,可确定出一个最佳吸收实验条件,在此条件下进行吸收-解吸循环实验。结果如图9所示,在没有进行解吸时,循环到220 min时SO2脱除率即下降至95%以下,然而,进行解吸再生后,SO2脱除率保持在95%以上的时间延长了一倍,通过在解吸塔塔釜加热,产生蒸气对吸收后的富液进行气提再生,可以显著提高离子液体的使用时间。说明该脱硫剂可以解吸再生,并且再生后仍具有很好的吸收能力。然而,由于解吸塔的高度不足,致使富液没有完全解吸,吸收剂逐渐积累SO2,因此,随着时间的增加,SO2去除率逐渐下降,如在500 min时,SO2的脱除率为94%。在后续的工作中,将提高解吸塔高度,使富液解吸比较完全,实现高效的SO2吸收-解吸循环。
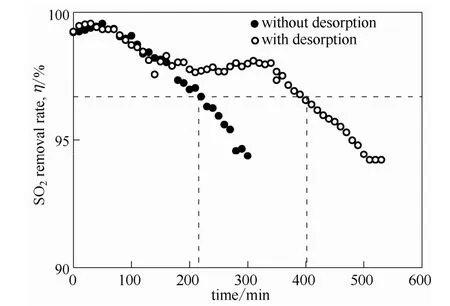
图9 40℃,常压下含水量75%[MEA]L水溶液吸收对SO2去除率随时间的变化Fig.9 Removal rate of SO2as a function of time without desorption and with desorption
3 结 论
通过研究[MEA]L水溶液在放大装置中对 SO2的吸收行为,可以得到以下结论。
[MEA]L水溶液对SO2的脱除率随着含水量的增加而增加,最合适的含水量为70%~80%;随着气液比的下降而增加,最合适的气液比为 420,对于浓度为2850~14280 mg·m-3SO2有着很强的去除率,并且出口浓度保持在300 mg·m-3之下,满足国家排放标准;烟气中的CO2对[MEA]L吸收SO2没有影响,[MEA]L选择性吸收SO2。
[MEA]L水溶液作为吸收剂,可以有效地吸收低浓度的 SO2,而且通过蒸气气提,达到再生的目的,并可以进行循环使用,可实现吸收-解吸循环脱硫的过程。
[1] Xu Y. Improvements in the Operation of SO2scrubbers in China’s coal power plants [J].Environ. Sci. Technol., 2011, 45(2):380-385.
[2] Tan Xin(谭鑫), Zhong Rugang(钟儒刚), Zhen Yan(甄岩),et al.Progresses in research on calcium-based processes for flue gas desulfurization [J].Environmental Protection of Chemical Industry(化工环保), 2003, 23(6):322-328.
[3] Wang Jiaming(汪家铭). Use of desulfurization with ammonia in treatment of tail gas from manufacture of acid based on sulfur [J].Journal of the Chemical Fertilizer Industry(化肥工业), 2010, 37(4):14-17.
[4] Ge Nengqiang(葛能强), Shao Yongchun(邵永春). Application of wet ammonia desulphurization process [J].Sulphuric Acid Industry(硫酸工业), 2006, (6):10-15.
[5] Erga O. SO2recovery by a sodium citrate solution scrubbing [J].Chem. Eng. Sci., 1980, 35(1):162-169.
[6] Liu Y, Bisson T M, Yang H Q,et al. Recent developments in novel sorbents for flue gas clean up [J].Fuel Process Technol., 2010, 91(10):1175-1197.
[7] He Zhiqiang(禾志强), Qi Liming(祁利明), Ma Qingshu(马青树).The study of demister blocking in lmiestone-gypsum desulfurization technology [J].Boiler Technology(锅炉技术), 2010, 41(1):77-80.
[8] Hansen B B, Fogh F, O K N,et al. Performance of a wet flue gas desulfurization pilot plant under oxy-fuel conditions [J].Ind. Eng.Chem. Res., 2011, 50(8):4238-4244.
[9] Bao Jingjing(鲍静静), Yin Huabin(印华斌), Yang Linjun(杨林军),et al. Removal of fine aerosol particles formed in wet ammonia flue gas desulfurization process by heterogeneous condensation [J].Journal of Power Engineering(动力工程), 2009, 29(2):178-183.
[10] Xia Yuzheng(夏宇正), Du Shimao(杜士帽), Wei Jiaming (魏甲明),et al. Preparation of poly (1,1,3,3-tetramethylguanidine acrylate) and its absorption-desorption properties to SO2[J].The Chinese Journal of Process Engineering(过程工程学报), 2012, 12(4):583-589.
[11] Li Ruxiong(李汝雄), Wang Jianji(王建基). Research and application on green solvent——the ionic liquid [J].Chemical Industry and Engineering Progress(化工进展), 2002, 21(1):43-48.
[12] Dupont J, de Souza R F, Suarez P A Z. Inoic Liquid (molten salt)phase organometallic catalysis [J].Chem. Rev., 2002, 102:3667-3692.
[13] Fredlake C P, Crosthwaite J M, Hert D G,et al. Thermophysical properties of imidazolium-based ionic liquids [J].J. Chem. Eng. Data.,2004, 49(4):954-964.
[14] Lei Z G, Dai C N, Chen B H. Gas solubility in ionic liquids [J].Chem.Rev., 2014, 114(2):1289-1326.
[15] Wu W Z, Han B X, Gao H X,et al. Desulfurization of flue gas:SO2absorption by an ionic liquid [J].Angew. Chem. Int. Ed., 2004, 43(18):2415-2417.
[16] Ren S H, Hou Y C, Wu W Z,et al. Effect of H2O on the desulfurization of simulated flue gas by an ionic liquid [J].Ind. Eng.Chem. Res., 2009, 48(10):4928-4932.
[17] Yuan X L, Zhang S J, Lu X M. Hydroxyl ammonium ionic liquids:synthesis, properties, and solubility of SO2[J].J. Chem. Eng. Data,2007, 52(2):596-599.
[18] Zhai L Z, Zhong Q, He C,et al.Hydroxyl ammonium ionic liquids synthesized by water-bath microwave:synthesis and desulfurization[J].J. Hazard. Mater., 2010, 177:807-813.
[19] Jin M J, Hou Y C, Wu W Z,et al.Solubitions and thermodynamic properties of SO2in inoic liquids [J].J. Phys. Chem. B, 2011, 115(20):6585-6591.
[20] Qian J G, Ren S H, Tian S D. Highly efficient and reversible absorption of SO2by aqueous triethyleneteramine tetralactate solutions [J].Ind. Eng. Chem. Res., 2014, 53(39):15207-15212.
