三氧化矿物凝聚体对乳、恒牙牙髓细胞增殖和分化影响的比较
2015-03-24王敏永刘鹤李盛林秦满
王敏永 刘鹤 李盛林 秦满
1.北京大学口腔医学院·口腔医院儿童口腔科;2.口腔颌面外科研究室,北京 100081
牙髓治疗的最理想的方法是活髓保存,盖髓剂可以通过某种机制消除牙髓早期炎症并形成封闭使之保存活力[1-2]。盖髓剂性能的关键在于其生物相容性,以及对牙髓细胞增殖和分化能力的影响。作为经典盖髓剂——氢氧化钙制剂在恒牙盖髓治疗上取得了很好效果,但是在乳牙盖髓治疗中效果差强人意[3]。三氧化矿物凝聚体(mineral trioxide aggregate,MTA)与氢氧化钙相似,可以促进牙髓细胞增殖及分化,促进形成修复性牙本质[4-6]。由于其良好的生物相容性和封闭性,近些年被广泛应用于盖髓术,并取得了良好的临床效果。特别是在乳牙盖髓治疗方面,MTA可以取得更好的临床效果[7-8]。但MTA对乳、恒牙牙髓细胞作用差别的机制尚不清楚。
本研究通过对比MTA和氢氧化钙对乳、恒牙牙髓细胞增殖以及与成牙本质相关因子碱性磷酸酶(alkaline phosphatase,ALP)、牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)和破牙本质相关因子骨保护因子(osteoprotegerin,OPG)和核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)等基因表达的影响,探讨其对乳、恒牙牙髓作用的机制,为MTA的临床应用提供依据。
1 材料和方法
1.1 实验材料
α-MΕM培养基、15%胎牛血清(Gibco公司,美国),2 mmol·L-1谷氨酰胺、100 μmol·L-1左旋抗坏血酸磷酸盐(Sigma公司,美国),100 U·mL-1青霉素、100 μg·mL-1链霉素(华北制药集团)。
ΕLx808酶标仪(BioTek公司,美国),RNA酶抑制剂(Biolab公司,美国),逆转录酶M-MLV(Invitrogen公司,美国),7500实时荧光定量聚合酶链反应(real time polymerase chain reaction,real time PCR)仪、SYBR GRΕΕN PCR MASTΕR MIX(ABI公司,美国)。
1.2 乳、恒牙牙髓细胞培养
经患者及家属知情同意,临床收集健康、无明显根吸收的滞留乳牙及因正畸拔除的前磨牙,即刻在无菌条件下取出牙髓,弃用根尖2 mm,剪碎后平铺于25 cm2培养瓶,使用α-MΕM培养基,加入15%胎牛血清、2 mmol·L-1谷氨酰胺、100 μmol·L-1左旋抗坏血酸磷酸盐、100 U·mL-1青霉素、100 μg·mL-1链霉素,置于37 ℃、5%CO2、饱和湿度培养箱中培养。传代培养后,取4~8代细胞进行实验。
1.3 实验分组
参照Cavalcanti等[9]的方法制备氢氧化钙和MTA浸提液。乳、恒牙牙髓细胞各分为对照组、氢氧化钙组、MTA组,对照组使用常规培养基,另两个实验组分别在常规培养基中加入1/10体积相应材料的浸提液。
1.4 细胞增殖检测
各组牙髓细胞按密度为每毫升1.2×104个细胞接种于96孔板。各孔每24 h测定1次光密度值(optical density,OD),共计10 d。使用ΕLx808酶标仪波长490 nm,参考波长630 nm,绘制生长曲线,按照公式计算细胞增殖率,细胞增殖率=实验组OD值/对照组OD值×100%,并行统计学分析。
1.5 钙结节染色
按照文献[10]等采用的方法,将各组牙髓细胞按密度为每毫升1×104个细胞接种于6孔板培养,4周后进行Von kossa染色观察钙结节形成。
1.6 ALP、DSPP、OPG、RANKL基因表达检测
牙髓细胞按密度为每毫升1×104个细胞接种,分组培养10 d。Trizol法提取总RNA,经聚合酶链反应(polymerase chain reaction,PCR)合成cDNA:初始体系13 μL(RNA 2 μg,Oligodt 1 μL,DΕPC水70 ℃反应5 min;4 ℃下加入5×缓冲液4 μL、dNTP 1.5 μL、逆转录酶M-MLV 1 μL、RNA酶抑制剂0.5 μL,45 ℃反应1 h,85 ℃反应5 min,-20 ℃保存产物。
根据人类基因库ALP、DSPP、OPG、RANKL基因mRNA序列,以GAPDH为内参,设计扩增引物(表1)。使用7500实时荧光定量PCR仪检测上述基因表达。50 μL反应体系含25 μL SYBR GRΕΕN PCR MASTΕR MIX、双蒸水20 μL 、cDNA 1 μL、上下游引物各2 μL。ALP、OPG、RANKL基因检测反应条件为:50 ℃ 2 min、95 ℃ 10 min,之后95 ℃ 15 s、59 ℃ 1 min,40个循环;DSPP基因检测反应条件为:50 ℃ 2 min、95 ℃ 10 min,之后95 ℃ 15 s、56 ℃30 s、72 ℃ 30 s,40个循环。取反应产物测序以明确是否为目的基因转录产物。根据相对定量计算公式ΔΔCt算法,计算ALP、DSPP、OPG和RANKL基因相对表达水平(relative quantif ication,RQ)。
1.7 统计学分析
采用SPSS 11.5统计软件的One Way ANOVA对实验数据进行分析,P<0.05为差异有统计学意义。
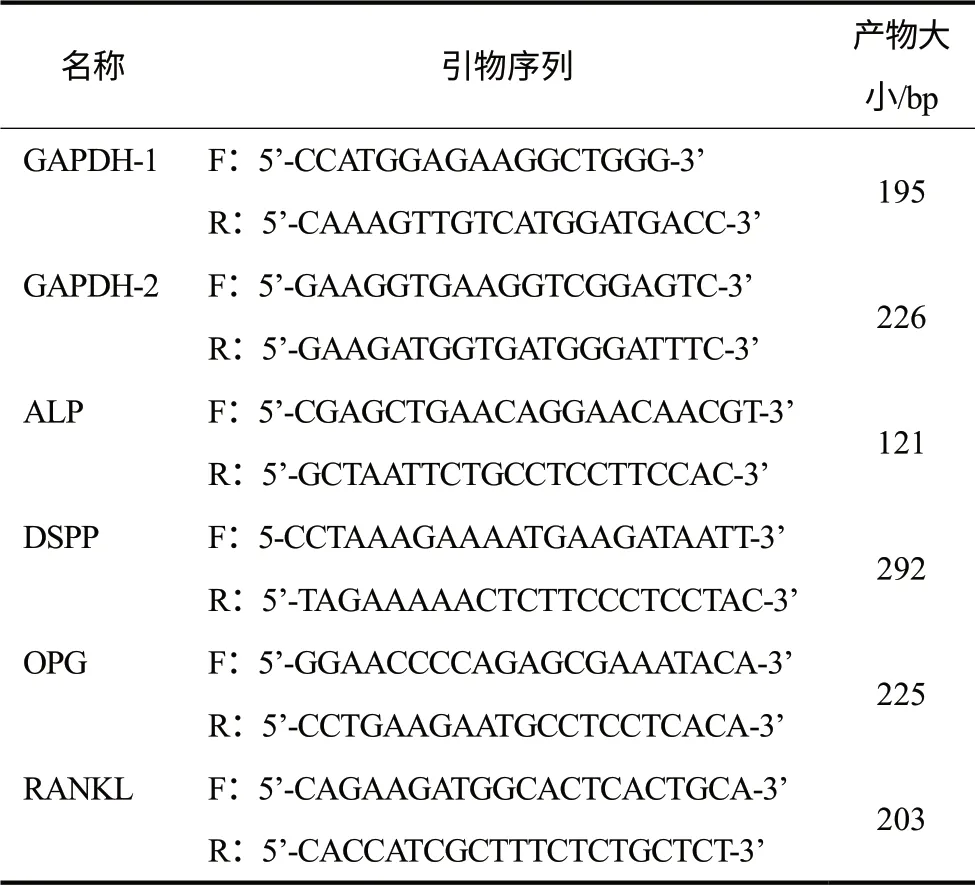
表1 real time PCR引物序列Tab 1 real time PCR primers
2 结果
2.1 牙髓细胞增殖
MTA对乳牙和恒牙牙髓细胞增殖均有促进作用,乳牙从第6天开始、恒牙从第8天开始显著高于各自的对照组(F乳牙=1 835.065,P<0.01;F恒牙=1 792.301,P<0.01),分别于第9天和第10天达到对照组最大增殖率的118.40%和104.15%(图1)。氢氧化钙对乳牙和恒牙牙髓细胞增殖均有抑制作用(F乳牙=1 792.301,P<0.01;F恒牙=19 413.11,P<0.01),分别于第9天和第10天达到各自对照组最大增殖率的89.70%和84.48%(图1)。
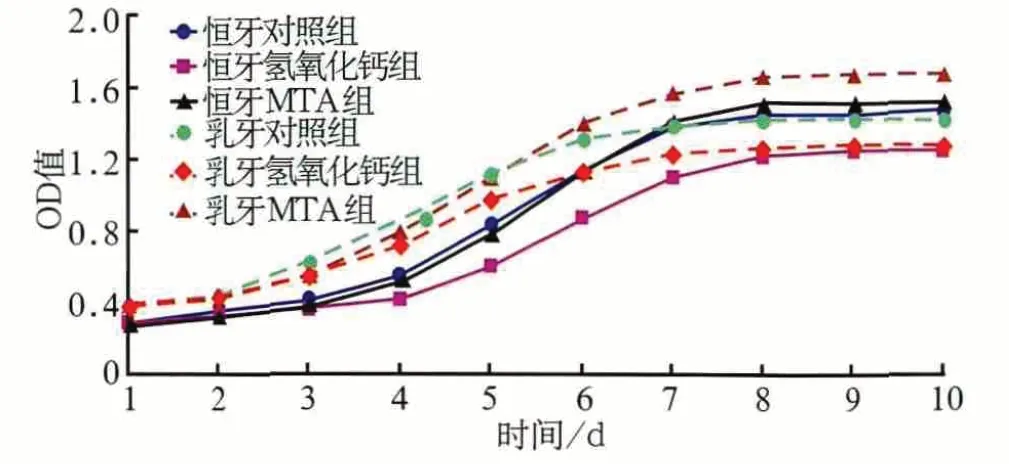
图1 牙髓细胞生长曲线Fig 1 Growth curve of dental pulp cells
2.2 Von kossa染色结果
牙髓细胞连续培养4周后,MTA组和氢氧化钙组乳、恒牙牙髓细胞的染色均呈阳性,在倒置显微镜下可见Von kossa染色阳性的钙结节,而对照组两种细胞染色均呈阴性(图2)。
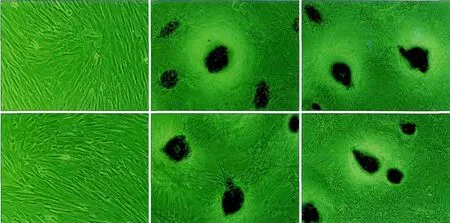
图2 各组乳、恒牙牙髓细胞的观察结果 Von kossa染色× 100Fig 2 Observation of dental pulp cells from primary and permanent teeth in every group Von kossa staining× 100
2.3 ALP、DSPP、OPG和RANKL表达的检测结果
各组乳、恒牙牙髓细胞ALP、DSPP、OPG和RANKL表达的检测结果见图3~6。实时荧光定量PCR的产物经测序证实为目的基因的特异扩增。乳牙氢氧化钙组ALP、DSPP和OPG的表达显著低于对照组,MTA组上述因子的表达显著高于对照组(FALP=39.48,P<0.01;FDSPP=170.72,P<0.01;FOPG=54.29,P<0.01);氢氧化钙组RANKL的表达显著高于对照组(F=112.43,P<0.01),MTA组RANKL表达则与对照组无显著差异(F=1.20,P>0.05)。
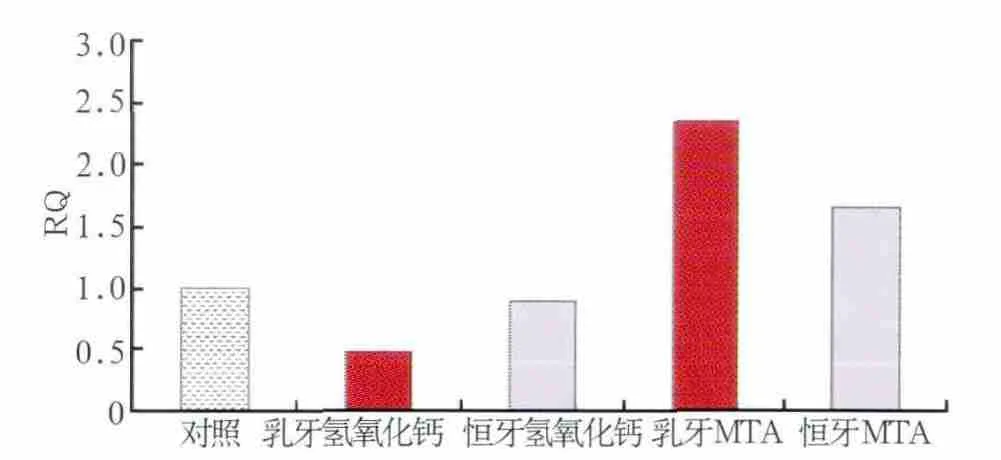
图3 乳牙、恒牙牙髓细胞ALP的表达Fig 3 ALP expression of dental pulp cells from primary and permanent teeth
3 讨论
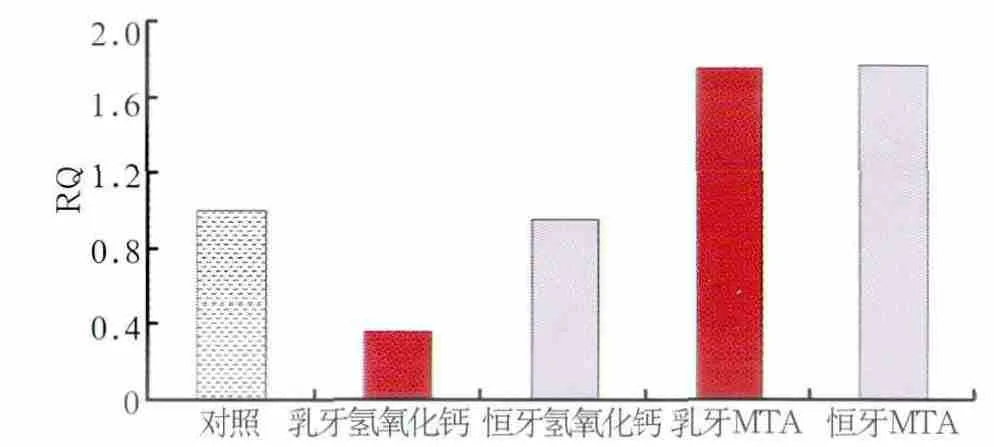
图4 乳牙、恒牙牙髓细胞DSPP的表达Fig 4 DSPP expression of dental pulp cells from primary and permanent teeth

图5 乳牙、恒牙牙髓细胞OPG的表达Fig 5 OPG expression of dental pulp cells from primary and permanent teeth
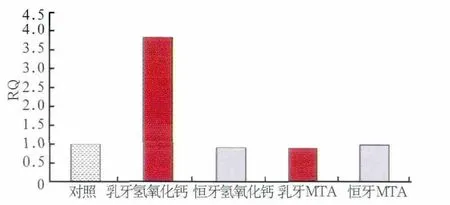
图6 乳牙、恒牙牙髓细胞RANKL表达Fig 6 RANKL expression of dental pulp cells from primary and permanent teeth
恒牙氢氧化钙组ALP和DSPP的表达与对照组相比无显著差异(FALP=1.37,P>0.05;FDSPP=0.14,P>0.05),MTA组ALP和DSPP表达显著增加(FALP=23.76,P<0.01;FDSPP=52.13,P<0.01)。3组间OPG、RANKL表达均无显著差异(FOPG=0.32,P>0.05;FRANKL=0.73,P>0.05)。
本研究观察到实验条件下氢氧化钙对乳牙和恒牙牙髓细胞的增殖均有明显的抑制作用。此现象在以往的研究中曾被间接证实,Alliot-Licht等[11]发现使用氢氧化钙浸提液作用后人牙髓成纤维细胞DNA合成下降。Granchi等[12]发现氢氧化钙通过影响细胞周期的特定环节而抑制细胞增殖。本研究发现MTA可促进乳、恒牙牙髓细胞增殖。以往的研究[13-14]也发现MTA对不同细胞的增殖分化存在促进作用。由此可见,MTA的生物相容性优于氢氧化钙。
虽然本实验显示氢氧化钙和MTA均可使乳牙和恒牙牙髓细胞生成钙化结节,可以部分解释临床上MTA或氢氧化钙盖髓治疗中常见形成牙本质桥,但Mente等[15]对122名接受直接盖髓治疗的患者进行了最长为期80个月的观察,经过临床检查和影像学评估,MTA组取得了78%的成功率,显著高于氢氧化钙组的60%。Nair等[16]在人第三磨牙上分别使用MTA和Dycal进行直接盖髓,分不同时间段拔除牙齿进行分析,MTA组较早出现硬组织覆盖,且其厚度持续增加;Dycal组硬组织形成明显不完整,且通常有炎症表现。说明MTA与氢氧化钙对恒牙牙髓细胞的作用有所不同。本研究观察到,在对乳、恒牙牙髓细胞中ALP和DSPP基因表达水平影响上,MTA与氢氧化钙有所差别,反映其促进形成修复性牙本质和矿化的能力在乳、恒牙牙髓细胞存在差别。乳、恒牙MTA组的ALP/DSPP基因表达水平明显高于氢氧化钙组,提示MTA的促分化能力优于氢氧化钙。乳牙氢氧化钙组的ALP/DSPP表达水平显著低于对照组,而恒牙牙髓细胞的ALP/DSPP表达水平却与对照组没有显著差异,在基因水平反应了乳、恒牙牙髓细胞对氢氧化钙的不同反应。
在破骨细胞分化和骨吸收的过程中,RANK/RANKL/OPG被认为是调节破骨细胞分化和骨吸收功能的终极通路,OPG/RANKL表达的比例决定了骨代谢的进程[17]。研究[18]显示OPG/RANKL也参与了牙髓细胞中破牙细胞的分化以及牙根的吸收。本研究中乳牙氢氧化钙组OPG表达下降,RANKL表达升高,提示牙髓细胞的分化向着有利于破牙本质的方向进展。临床上一些治疗失败的病例中可以观察到氢氧化钙盖髓后导致乳牙牙根吸收[19]。乳牙MTA组OPG表达增加,而RANKL表达没有显著变化,说明MTA可以促进OPG的表达,抑制牙髓细胞向破牙细胞的分化。恒牙氢氧化钙组和MTA组均未观察到OPG和RANKL的显著变化,这与临床上少见恒牙使用氢氧化钙和MTA盖髓后出现根吸收相一致[20]。
本研究在mRNA水平上观察到MTA和氢氧化钙作用后乳、恒牙牙髓细胞ALP/DSPP和OPG/RANKL表达的变化以及差别,但此差别还需要进一步的实验,方能得出更为明确的结论。另外,本研究使用了特定稀释比例的浸提液进行实验,并不能完全反映材料在体内对牙髓组织的作用效果,不同浓度浸提液作用下牙髓细胞的反应并不明确,未来可能需要设计进一步的实验来验证。
本研究表明,MTA可促进乳、恒牙牙髓细胞的增殖,并促使乳牙和恒牙牙髓细胞向成牙本质细胞方向分化,抑制乳牙牙髓细胞向破牙本质细胞方向分化。MTA较氢氧化钙更适合作为乳牙及恒牙的盖髓剂,其优点在乳牙更为显著。
[1]Yoshiba K,Yoshiba N,Nakamura H,et al.Immunolocalization of f ibronectin during reparative dentinogenesis in human teeth after pulp capping with calcium hydroxide[J].J Dent Res,1996,75(8):1590-1597.
[2]Decup F,Six N,Palmier B,et al.Bone sialoprotein-induced reparative dentinogenesis in the pulp of rat’s molar[J].Clin Oral Investig,2000,4(2):110-119.
[3]Liu H,Zhou Q,Qin M.Mineral trioxide aggregate versus calcium hydroxide for pulpotomy in primary molars[J].Chin J Dent Res,2011,14(2):121-125.
[4]王敏永,刘鹤,李盛林,等.三氧化矿物凝聚体对人乳牙牙髓细胞增殖和分化影响的实验研究[J].中华口腔医学杂志,2008,43(9):524-527.
[5]Karabucak B,Li D,Lim J,et al.Vital pulp therapy with mineral trioxide aggregate[J].Dent Traumatol,2005,21(4):240-243.
[6]Witherspoon DΕ,Small JC,Harris GZ.Mineral trioxide aggregate pulpotomies:a case series outcomes assessment[J].J Am Dent Assoc,2006,137(5):610-618.
[7]Agamy HA,Bakry NS,Mounir MM,et al.Comparison of mineral trioxide aggregate and formocresol as pulp-capping agents in pulpotomized primary teeth[J].Pediatr Dent,2004,26(4):302-309.
[8]Holan G,Εidelman Ε,Fuks AB.Long-term evaluation of pulpotomy in primary molars using mineral trioxide aggregate or formocresol[J].Pediatr Dent,2005,27(2):129-136.
[9]Cavalcanti BN,Rode SM,Marques MM.Cytotoxicity of substances leached or dissolved from pulp capping materials[J].Int Εndod J,2005,38(8):505-509.
[10]Takita T,Hayashi M,Takeichi O,et al.Εffect of mineral trioxide aggregate on proliferation of cultured human dental pulp cells[J].Int Εndod J,2006,39(5):415-422.
[11]Alliot-Licht B,Jean A,Gregoire M.Comparative effect of calcium hydroxide and hydroxyapatite on the cellular activity of human pulp f ibroblastsin vitro[J].Arch Oral Biol,1994,39(6):481-489.
[12]Granchi D,Stea S,Ciapetti G,et al.Εndodontic cements induce alterations in the cell cycle ofin vitrocultured osteoblasts[J].Oral Surg Oral Med Oral Pathol Oral Radiol Εndod,1995,79(3):359-366.
[13]Yoshimine Y,Ono M,Akamine A.In vitrocomparison of the biocompatibility of mineral trioxide aggregate,4MΕTA/MMA-TBB resin,and intermediate restorative material as root-end-filling materials[J].J Εndod,2007,33(9):1066-1069.
[14]Paranjpe A,Smoot T,Zhang H,et al.Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells[J].J Εndod,2011,37(12):1691-1695.
[15]Mente J,Geletneky B,Ohle M,et al.Mineral trioxide aggregate or calcium hydroxide direct pulp capping:an analysis of the clinical treatment outcome[J].J Εndod,2010,36(5):806-813.
[16]Nair PN,Duncan HF,Pitt Ford TR,et al.Histological,ultrastructural and quantitative investigations on the response of healthy human pulps to experimental capping with mineral trioxide aggregate:a randomized controlled trial[J].Int Εndod J,2008,41(2):128-150.
[17]Bucay N,Sarosi I,Dunstan CR,et al.osteoprotegerin-def icient mice develop early onset osteoporosis and arterial calcif ication[J].Genes Dev,1998,12(9):1260-1268.
[18]Yildirim S,Yapar M,Sermet U,et al.The role of dental pulp cells in resorption of deciduous teeth[J].Oral Surg Oral Med Oral Pathol Oral Radiol Εndod,2008,105(1):113-120.
[19]Oliveira TM,Moretti AB,Sakai VT,et al.Clinical,radiographic and histologic analysis of the effects of pulp capping materials used in pulpotomies of human primary teeth[J].Εur Arch Paediatr Dent,2013,14(2):65-71.
[20]Εskandarizadeh A,Shahpasandzadeh MH,Shahpasandzadeh M,et al.A comparative study on dental pulp response to calcium hydroxide,white and grey mineral trioxide aggregate as pulp capping agents[J].J Conserv Dent,2011,14(4):351-355.
