检测鸭1 型甲肝病毒抗体间接ELISA 方法的建立
2015-03-11傅秋玲傅光华陈红梅程龙飞万春和施少华林建生
刘 伟,傅秋玲,黄 瑜,傅光华,陈 珍,陈红梅,程龙飞,万春和,施少华,林建生
(1.福建农林大学动物科学学院,福建 福州350002 ;2.福建省农业科学院畜牧兽医研究所,福建 福州350013)
鸭病毒性肝炎(Duck viral hepatitis,DVH)是鸭肝炎病毒(Duck hepatitis virus,DHV)感染雏鸭引起的一种传播迅速的高度致死性传染病,以角弓反张和肝脏肿大、出血为主要临床特征。最初将DHV 分为3 个血清型,分别是1 型、2 型、3 型鸭肝炎病毒(DHV),但最新研究表明,传统的血清2型和3 型均属星状病毒[1],不宜将它们称为DHV的2 个血清型。根据2008 年后的分类,将引起鸭甲型病毒性肝炎的病毒归属于小RNA 病毒科的禽肝炎病毒属鸭甲型肝炎病毒种,称为鸭甲型肝炎病毒(duck hepatitis A virus,DHAV)。目前发现,DHAV 包含3 种基因型(或血清型),分别命名为DHAV-1、2 型和3 型[2],其中DHAV-1 型即为传统的血清1 型鸭肝炎病毒[3],DHAV-2 型和DHAV-3型分别为近来报道的台湾新型[4]和韩国新型[5]。
2011 年,我国福建、浙江、广东等省的部分养鸭场10~30 日龄雏番鸭、半番鸭发生以胰腺泛黄、出血(俗称胰腺炎)为特征的疫病,其发病率和病死率分别达10%~30%、25%~40%,经实验室的病原学研究确定其病原为鸭1 型甲肝病毒(DHAV-1)[6-7],但其在易感宿主、组织嗜性和特征肉眼病变上均不同于经典的肝炎型鸭1 型甲肝病毒。为区别起见,将其暂定为胰腺炎型DHAV-1。我们经血清交叉中和试验等进一步研究发现,胰腺炎型DHAV-1 与肝炎型DHAV-1 间的抗原相关值(R)为0.62,表明胰腺炎型DHAV-1 与经典的肝炎型DHAV-1 相比其抗原性发生了较大变异,定名为鸭1 型甲肝病毒亚型(DHAV-1a)(见另文报道)。
国内外尚未建立检测鸭1 型甲肝病毒亚型抗体的间接ELISA 方法,因此建立一种快速灵敏的抗体检测方法十分必要。本研究以纯化、浓缩的鸭1 型甲肝病毒亚型为包被抗原,通过优化反应条件,建立了可检测鸭1 型甲肝病毒亚型抗体的间接ELISA 方法,且具有特异性强、重复性好、敏感性高等优点。
1 材料与方法
1.1 病毒株 MPZJ1206 株胰腺炎型鸭1 型甲肝病毒(即鸭1 型甲肝病毒亚型)由福建省农业科学院畜牧兽医研究所禽病研究室分离、鉴定和保存。
1.2 主要试剂 羊抗鸭IgG-HRP,购自KPL 公司;TMB 显色液,购自武汉博士德公司;酶标板,购自Corning 公司。
1.3 间接ELISA 检测方法的建立
1.3.1 病毒浓缩液的制备 以鸭胚成纤维细胞蚀斑纯化的MPZJ1206 株胰腺炎型鸭1 型甲肝病毒经尿囊腔途径接种12 日龄鸭胚,37 ℃温箱孵化,逐日照蛋,弃去24 h 内死胚,无菌收取48~96 h 内死亡鸭胚的尿囊液。8 000 r/min 离心2 h,取上清,50 000 r/min 离心3 h,弃上清,取沉淀以PBS 悬浮,经蔗糖密度梯度离心纯化浓缩病毒。
1.3.2 最佳抗原包被浓度和血清稀释度的确定
采用方阵滴定法将纯化的病毒浓缩液用pH 值9.6 的碳酸盐缓冲液按照1∶200~1∶3 200 倍比稀释,每个稀释度包被一横行,每孔100 μL,37 ℃作用1 h 后,4 ℃包被过夜(14 h);倒空液体,PBST 洗涤3 次,5 min/次,甩干;10%脱脂乳37 ℃封闭2 h;弃去脱脂乳,洗涤同上,甩干;阳性血清和阴性血清分别按照1∶50~1∶400 的倍比稀释,每个稀释度加一纵行,每孔加100 μL,37 ℃孵育60 min;洗板同上,甩干;加入羊抗鸭酶标抗体(1∶500),100 μL/孔,37 ℃孵育45 min;洗板同上,甩干;每孔加入100 μL TMB 显色液室温避光显色10 min;每孔加入100 μL 0.5 mol/L 硫酸终止显色;酶标仪测定OD450nm 值,P/N 比值最大时为最佳的抗原包被浓度和血清稀释度。
1.3.3 抗原最佳包被条件的确定 采用最佳抗原包被浓度和最佳血清稀释度,分别以37 ℃1 h 后4 ℃过夜(14 h)、37 ℃2 h、4 ℃过夜(14 h)3 种不同的包被条件包被,其他同上,确定抗原的最佳包被条件。
1.3.4 最佳血清工作时间的确定 血清分别以37 ℃45 min、60 min、90 min 过夜(14 h)3 种不同的孵育时间进行孵育,其他同上,测定确定最佳血清工作时间。
1.3.5 酶标二抗最佳工作时间的确定 羊抗鸭酶标二抗分别作用30、45、60 min 后进行测定,以确定酶标二抗的最佳工作时间。
1.3.6 临界值的确定 取32 份DHAV-1 阴性鸭血清,按照已建立的检测方法进行测定,并将数据进行统计学分析,求出OD450nm 平均值和标准差SD。根据统计学原理,OD450nm≥平均OD450nm值+3 SD 时,判为阳性。OD450nm<平均OD450nm值+3 SD 时,判为阴性。
1.3.7 特异性试验 以建立的分别检测鸭抗H9N2 亚型禽流感病毒、鸭瘟病毒、水禽新城疫病毒、鸭坦布苏病毒、雏番鸭细小病毒、鸭呼肠孤病毒的6 种病毒的高免阳性血清和经典肝炎型鸭1型甲肝病毒高免阳性血清,同时设阳性血清对照,检测其特异性。
1.3.8 重复性试验 (1)批内重复试验:用同批次制备病毒浓缩液,选取6 份不同抗体水平的阳性血清样品及1 份阴性血清样品,分别于第1、2、3 天进行批内重复检测,并对检测结果进行统计学分析;(2)批间重复试验:用3 份不同批次制备的胰腺炎型鸭1 型甲肝病毒浓缩液,选取6 份阳性血清样品及1 份阴性血清样品,进行批间重复检测,并对检测结果进行统计学分析。
1.3.9 敏感性试验 将胰腺炎型鸭1 型甲肝病毒高免阳性血清做1∶800~1∶25 600 倍比稀释,进行间接ELISA。
1.3.10 符合率试验 以建立的试验方法对经过血清中和试验检验为阳性的12 份鸭血清和检验为阴性的8 份鸭血清进行检测,比较间接ELISA试验方法和血清中和试验的符合率。
2 结果与分析
2.1 纯化病毒的蛋白定量 将纯化的全病毒用Thermo Scientific NanoDrop 2000 微量紫外分光光度计测定蛋白浓度,检测结果显示,蛋白质浓度为2 502 μg/mL。
2.2 抗原最佳包被浓度和最佳血清稀释度的确定 方阵滴定法结果显示,当纯化抗原的稀释浓度为1∶800(即每孔抗原包被量为0.3128 μg),血清的稀释度为1∶200 时,阳性血清的OD450nm 值为1.120,接近1,阳性与阴性OD450nm 比值最大为8.549。因此,抗原的最佳包被浓度为0.3128 μg/孔,血清的最佳稀释度为1∶200(表1)。
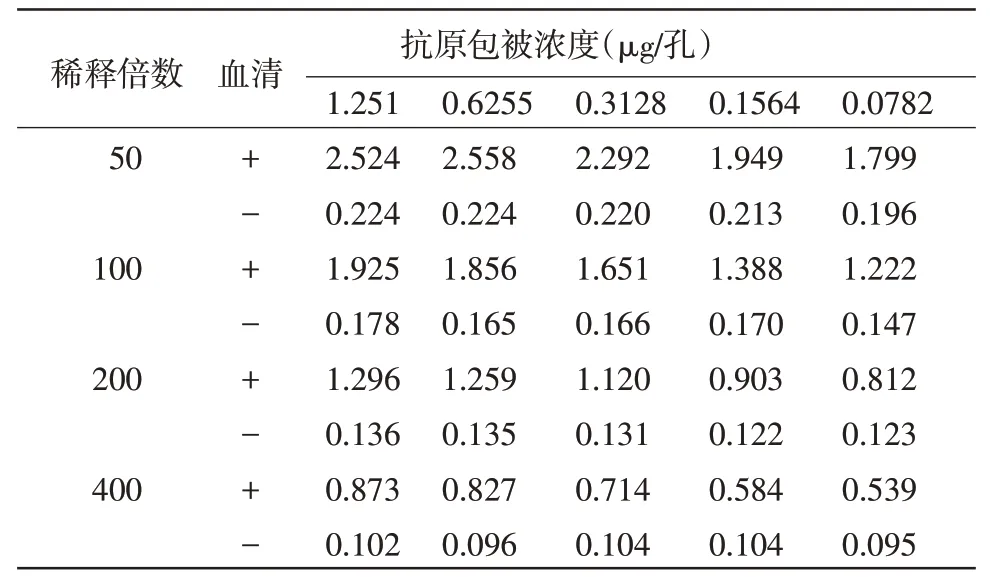
表1 抗原和血清最适稀释度测定
2.3 抗原最佳包被条件的确定37 ℃1 h 后4 ℃包被过夜P/N 值最高,包被效果较好(表2)。
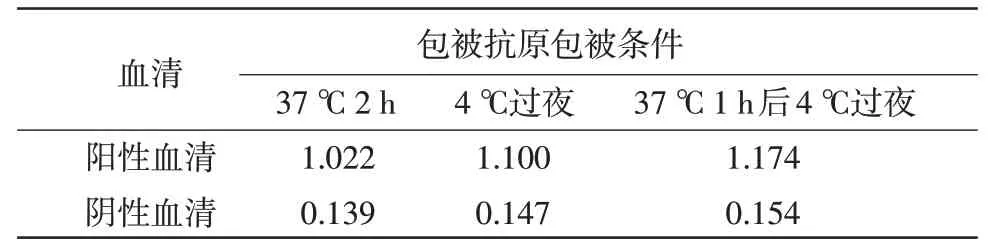
表2 抗原最佳包被条件的确定
2.4 最佳血清工作时间的确定 当鸭血清作用时间为60 min 时,P/N 值最高,灵敏度好(表3)。
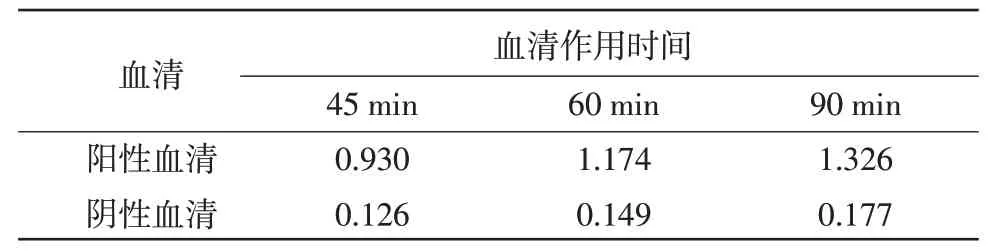
表3 最佳血清工作时间的确定
2.5 酶标二抗最佳工作时间的确定 羊抗鸭IgG-HRP 二抗37 ℃作用45 min 时P/N 比值最大(表4)。
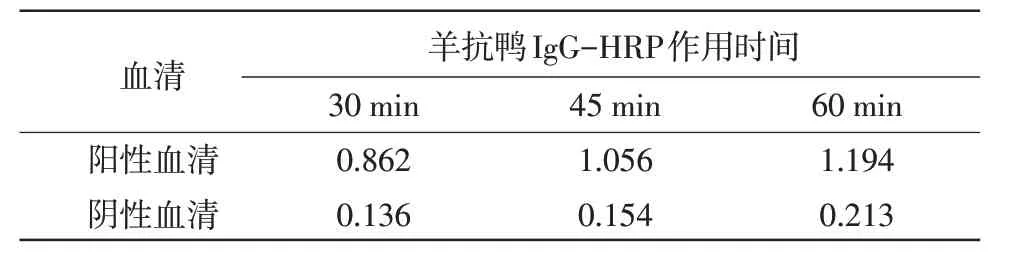
表4 酶标二抗最佳工作时间的确定
2.6 临界值的确定 对32 份阴性血清的检测结果进行统计学分析,计算其平均OD450nm 值为0.139,标准偏差(SD)为0.0128,根据判定标准,即当OD450nm≥0.177时判为阳性,OD450nm<0.177时判为阴性。
2.7 特异性试验 用上述已知的病毒高免阳性血清进行ELISA 试验,其OD450nm 值均小于阴阳性临界值,均呈阴性;而经典肝炎型DHAV-1 阳性血清和胰腺炎型DHAV-1 阳性血清的OD450nm 值分别为0.855 和1.167,均明显高于阴阳性临界值,即均为阳性,表明该方法特异性强。
2.8 重复性试验 间接ELISA 重复性试验结果显示,批内重复性试验的变异系数为1.5%~5.1%,批间重复性试验的变异系数为3.2%~5.3%,均小于10%,结果表明该间接ELISA方法重复性较好(表5)。
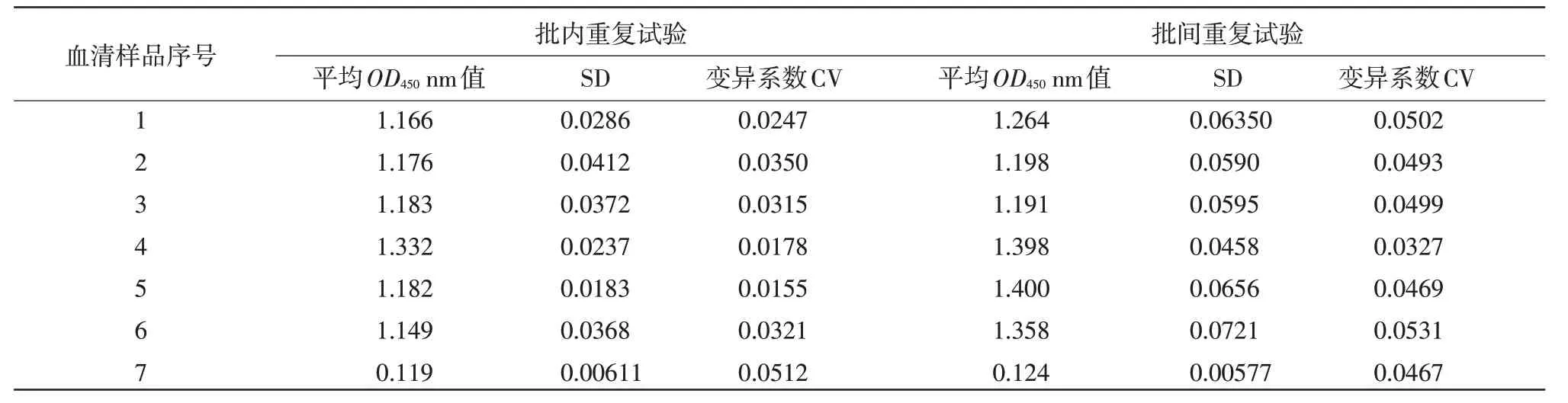
表5 间接ELIS A 批内重复试验和批间重复试验结果
2.9 敏感性试验 将胰腺炎型鸭1 型甲肝病毒阳性血清分别做1∶800~1∶12 800 倍比稀释,进行间接ELISA。结果显示,1∶6 400 稀释后仍可检测为阳性,而1:12 800 稀释的阳性血清检测结果低于0.177,无法判定(表6)。
2.10 符合率试验 对经血清中和试验检测为阳性的12 份血清样品和检测为阴性的8 份血清样品,以建立的间接ELISA 方法分别进行检测,结果与中和试验检测结果的阳性符合率、阴性符合率均为100%。
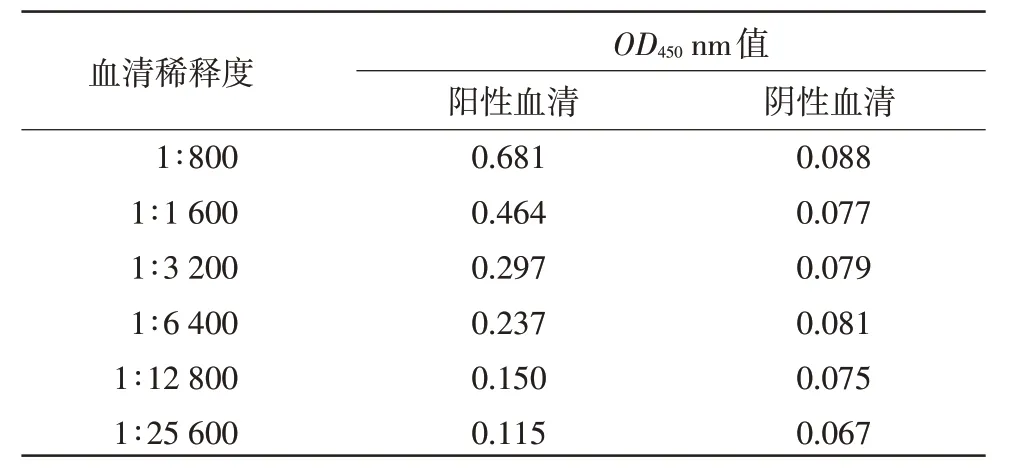
表6 间接ELIS A 敏感性试验结果
3 小结
本研究建立了检测胰腺炎型DHAV-1,即鸭1型甲肝病毒亚型(DHAV-1a)抗体的间接ELISA方法,并提出了判定标准。检测雏鸭体内鸭1 型甲肝病毒亚型的抗体,有较强的特异性和准确性,能快速检测抗体,从而判断是否存在该病毒的感染。该方法的建立为DHAV-1a 感染的预防和控制提供了一种新的检测方法,既适宜于鸭群中大批量鸭1 型甲肝病毒亚型抗体的监测,还可用于鸭群接种疫苗后血清抗体消长规律的测定及对疫苗免疫效果的评价。
该间接ELISA 方法虽有简便、快速、特异性强等优点,但仍存在抗原制备较复杂、制备要求高等不足,且不能区别胰腺炎型DHAV-1(即DHAV-1a)抗体与经典肝炎型DHAV-1 抗体,今后将进一步研制单抗,以期建立可鉴别两者抗体的血清学方法。
[1] Todd D,Smyth V J,Ball N W,et al.Identification of chicken enterovirus-like viruses,duck hepatitis virus type 2 and duck hepatitis virus type 3 as astroviruses[J] . Avian Pathology,2009,38(1):21-29.
[2] Wang L,Pan M,Fu Y,et al.Classification of duckhepatitis virus into three genotypes based on molecularevolutionary analysis[J] .Virus Genes,2008,37:52-59.
[3] Ding C,Zhang D.Molecular analysis of duck hepatitisvirus 1[J].Virology,2007,361:9-17.
[4] Tseng C H,Tsai H J.Molecular characterization of a newserotype of duck hepatitis virus[J].Virus Res,2007,126:19-31.
[5] Kim M C,Kwon Y K,Joh S J,et al.Recent Korenisolates of duck hepatitis virus revealed t he presence of a newgeno2and serotype when compared to duck hepatitis virustype 1type strain[J].Arch Virol,2007,152:2059-2072。
[6] 傅光华,陈红梅,黄瑜,等.雏番鸭胰腺炎型鸭1 型甲肝病毒分离鉴定及VP1 基因分析[J].福建农业学报,2012,27(9):945-950.
[7] 陈珍,傅秋玲,陈红梅,等.胰腺炎型,经典型鸭1 型甲肝病毒对雏鸭的致病性差异[J].福建农业学报,2013,28(10):939-942.
