温度与降水协同作用对短花针茅生物量及其分配的影响
2015-03-10吕晓敏王玉辉周广胜许振柱谭丽萍
吕晓敏, 王玉辉, 周广胜,3,*, 许振柱, 陈 军, 谭丽萍, 刘 涛
1 中国科学院植物研究所植被与环境变化国家重点实验室, 北京 100093 2 中国科学院大学,北京 100049 3 中国气象科学研究院,北京 100081
温度与降水协同作用对短花针茅生物量及其分配的影响
吕晓敏1,2, 王玉辉1, 周广胜1,3,*, 许振柱1, 陈 军1,2, 谭丽萍1,2, 刘 涛1,2
1 中国科学院植物研究所植被与环境变化国家重点实验室, 北京 100093 2 中国科学院大学,北京 100049 3 中国气象科学研究院,北京 100081
采用人工气候箱法模拟研究温度变化(对照、增温1.5、2.0、4.0、6.0 ℃)、降水变化(W-30%、W-15%、对照W0、W+15%、W+30%) (以1978—2007年6—8月的月均温和月均降水量为对照)及其协同作用对内蒙古荒漠草原优势种短花针茅生物量及其分配的影响表明:温度和降水协同作用显著影响短花针茅生物量及其分配。增温使短花针茅总生物量、叶和根生物量增加,茎生物量和根冠比分别在在增温1.5 ℃、4 ℃后随增温而减小。干旱高温使总生物量减小,增温和降水增加使总生物量、根和叶生物量增加,茎生物量在增温小于2 ℃时随降水增加而增加,则适当的增温和增加降水可促进短花针茅生物量的积累。短花针茅的各器官生物量分配对温度和降水协同作用的敏感性为茎生物量比>叶生物量比>根生物量比,最敏感性器官为茎。这表明,短花针茅可根据不同器官生物量对水热变化的敏感性,调节干物质累积分配来适应气候变化。
降水变化; 温度升高; 协同作用; 短花针茅; 生物量
全球气候变化及由此引起的一系列生态安全问题已成为不争的事实。政府间气候变化专门委员会(IPCC)第4次评估报告预测,从现在开始到2100年,全球平均气温将升高1.8—4.0 ℃,降水时空异质性增强[1],极端降水事件增多[2]。据预测,我国气候也将发生相应变化,中国西部干旱半干旱区降水尤其是夏季降水有增加趋势,内蒙古地区气温将有所上升[3]。
温度和水分是干旱半干旱区植物生长的主要限制因子[4- 5]。植物对水热变化的响应与适应将对植物的生理生态过程、干物质积累与分配及生态系统结构和功能产生深远影响[4- 6]。国内外学者采用人工温室、红外加热、整树生长箱控制系统、土壤增温以及模型模拟等方法就温度、降水变化对植物可能影响开展了大量研究[7- 10]。研究表明,荒漠草原植被变化与降水的相关性大于温度[11]。通常轻度土壤干旱不会导致植物生物量明显减少,而中度或更严重的干旱则使植物光合能力显著降低[12- 14]。夜晚增温将使典型草原植物开花和结实时间显著提前[10],温度降低则使草地植物根冠比增大[15- 16]。由于温度或降水变化会改变植物营养物质利用,进而改变植物生物量分配[17],按照平衡生长假说,植物体在受到生长限制因素的限制时,生长策略往往是将受限制的资源优先分配给受限制因素影响最大的器官或组织以维持个体生长率最大[18- 19],但已有研究中干旱或高温对植物影响的报道较多,但二者协同作用对植物的生物量及其碳分配策略的研究较少。
目前我国关于荒漠草原植物生物量及其分配的研究还主要集中在单因子变化(温度、降水、CO2、放牧等)的影响方面[20- 22],且温度或水分梯度变化较窄,测量指标较多,水热协同作用对器官敏感性影响的研究仍较缺乏。多因子协同变化会引发生态系统结构和功能复杂的相互作用[5,23],其与单因子效应的简单整合显著不同[5]。因此,评估多因子协同作用对典型植物的影响对理解草原生态系统对全球变化的响应至关重要。
短花针茅(Stipabreviflora) 为多年生密丛型禾草,茎秆细弱,叶线状,是荒漠草原区主要的优势种[24],具有耐干旱、返青早、生产力高等特点。本研究试图以荒漠草原优势植物短花针茅为研究对象,采用人工气候箱法,探讨温度和降水协同作用对短花针茅生物量及其分配的影响,获取短花针茅生物量分配中对水热变化的敏感器官,揭示其生物量对水热变化的自适应程度,为预测未来气候情景下短花针茅生物量变化趋势提供依据,并为荒漠草原适应全球变化的研究提供依据。
1 实验材料与方法
1.1 实验材料
短花针茅种子采自内蒙古自治区乌兰察布盟四子王旗的自然草地(41°43′N,111°52′E,海拔1420—1500 m),供实验用的短花针茅实生苗由种子萌发培养得到。
1.2 实验方法
表1 1978—2007年(30a)6—8月份昼/夜均温和日均温/℃
Table 1 Average daytime/nighttime average temperature and daily average temperature of 6—8 months during 1978—2007 (30 a)
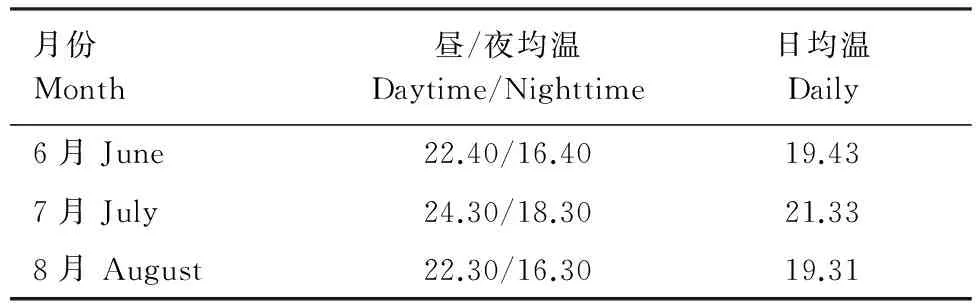
月份Month昼/夜均温Daytime/Nighttime日均温Daily6月June22.40/16.4019.437月July24.30/18.3021.338月August22.30/16.3019.31
实验通过短花针茅种子萌发的实生苗探讨温度和降水协同作用对其生物量及分配的影响。短花针茅种子播种前用5%的高锰酸钾溶液对种子消毒8 min,再用清水冲洗后备播。所用盆均为聚乙烯塑料盆(0.56 L),内衬塑料薄膜以防漏水,内装0.63 kg取自内蒙古锡林郭勒典型草原的烘干栗钙土,土壤混匀后平均含有机碳12.3 g/kg,全氮1.45 g/kg。实验基于未来气候变化情景,根据短花针茅种源地内蒙古乌兰察布盟四子王旗6、7、8月30a(1978—2007年)的月均温度和月均降水量为对照,进行5个温度梯度和5个水分梯度的处理。其中,5个温度梯度分别为:对照温度(CK, 30a月均温度);增温1.5 ℃(T1.5);增温2.0 ℃(T2.0);增温4.0 ℃(T4.0);增温6.0 ℃(T6.0)。考虑到昼夜温度的差异,实验根据基准月昼夜温度的不同分别进行加温处理,表1为基准气候条件下不同月份的昼夜均温情况。5个水分梯度分别为:对照降水(W0, 30a月均降水);降水增加15%(W+15%);降水增加30%(W+30%);降水减少15%(W-15%);降水减少30%(W-30%)。换算为各处理每月(6、7、8月)的总浇水量,每月均分10次浇入,月均降水量和各水分处理每次浇水量见表2。每个处理6个重复。
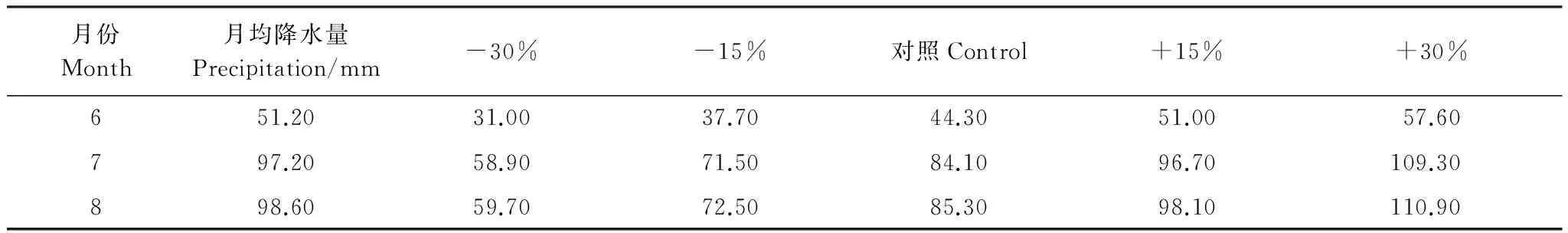
表2 1978—2007年 (30a) 6—8月月均降水及其不同处理的每次浇水量/mLTable 2 Average monthly precipitation of 6—8 during 1978—2007 (30 years) and the irrigation amount every time
在进行降水和温度控制实验前先进行育苗、间苗及定苗管理。育苗:所有播种后的盆均放在中国科学院植物研究所温室中进行育苗(最大光强1000mol m-2s-1,昼夜温度26—28 ℃/18—20 ℃,土壤相对含水量60%—80%)。间苗及定苗:当出苗至第1片叶完全展开后进行间苗,直到幼苗第3片叶完全展开时(3—4星期)定苗至每盆4株。随后将150盆实验材料随机移入5个RXZ智能型多段编程人工气候箱(RXZ- 500D,宁波东南仪器公司)进行3个月的水分和温度处理(分别模拟植物生长盛期6、7、8月的温度和降水变化)。控制实验开始后,每隔3d将同一人工气候箱内同一层的植株位置进行对换(主要是气候箱内中心位置和边缘位置的对换),每隔1周将同一人工气候箱内上下两层的植株进行对换,每隔2周对不同人工气候箱的植株进行对换,以减小实验误差。
植株在人工气候箱中生长3个月后收获分叶片、茎和根,利用烘箱于80 ℃烘至恒重后用天平称其质量,分别获取干重。茎和根每个处理6个重复,叶片每个处理3个重复(另外3个重复用于叶片其他含量测定)。相关指标计算如下:
(1)
根冠比(R/S)=根生物量/地上部分生物量
叶生物量比(LMR)=叶生物量/总生物量
茎生物量比(SMR)=茎生物量/总生物量
根生物量比(RMR)=根生物量/总生物量
(2)
变异系数(CV)=标准差/平均值×100%
1.3 数据处理
数据分析采用SPSS16.0(SPSS,Chicago,IL,USA) 进行二因素方差分析(two-way ANOVA)和差异显著性分析(Duncan 多重比较法),显著性水平为0.05。用SigmaPlot10.0软件绘图。
2 结果分析
2.1 温度和降水协同作用对短花针茅总生物量的影响
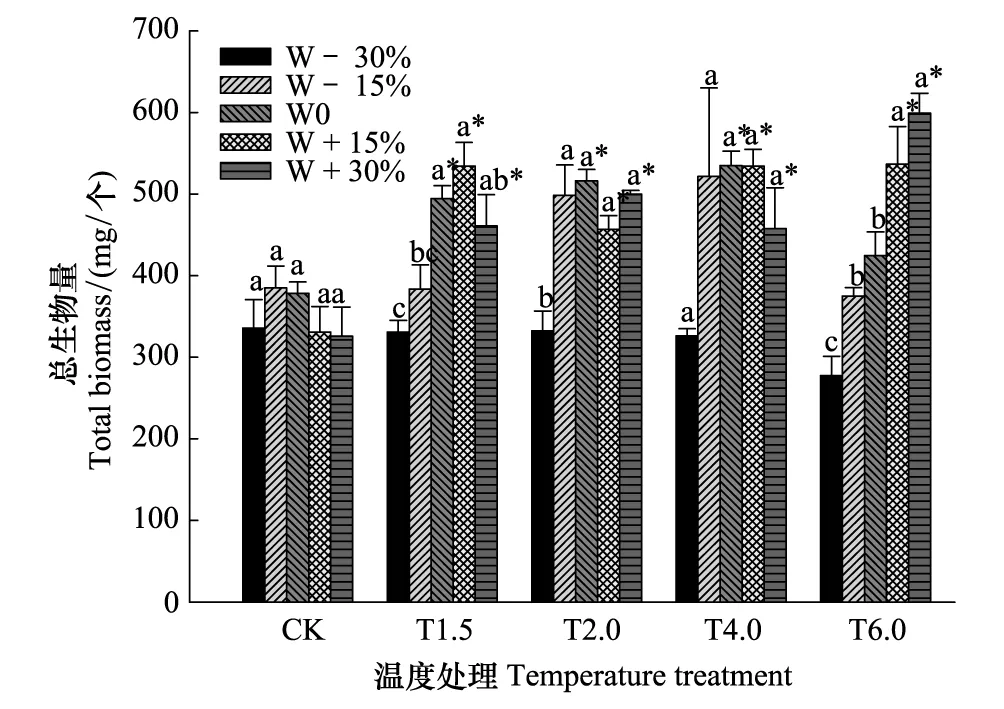
图1 温度和降水协同作用对短花针茅总生物量的影响 Fig.1 Effects of temperature and precipitation changes on total biomass of whole plants in Stipa breviflora不同小写字母表示同一温度下不同降水处理之间在P<0.05水平有显著差异;*表示同一降水处理下不同温度处理与对照相比在P<0.05水平有显著差异;数据表示是平均值±标准误差(n=3); W0表示对照降水处理,W-30%, W-15%, W+15%, W+30%分别表示降水量在对照基础上-30%、-15%、+15%和+30%; CK表示对照温度,T1.5, T2.0, T4.0, T6.0分别表示温度在对照基础上增加1.5℃、2.0℃、4.0℃、6.0℃
二因素方差分析显示,温度和降水协同作用对短花针茅总生物量具有极显著的交互作用(P<0.01, 表4)。除W-30%,其它增温和降水处理下,总生物量均比对照(CK、W0)显著增加,总生物最大时对应的降水量随温度增加而增加(图1)。
相同温度条件下(除T6.0),短花针茅总生物量随降水量增加先增后减,但是随着温度的增加,短花针茅总生物量达到最大值时对应的降水量不同,分别为:W-15%(CK),W+15%(T1.5),W0(T2.0和T4.0)。各温度处理下,总生物量在W-30%时与W0相比分别显著减少了11.2%(CK),33.1%(T1.5),35.6%(T2.0),39.0%(T4.0)和34.7%(T6.0)。在T6.0处理下,总生物量随降水增加而增加,且各处理间均有显著差异(除W-15%) (P<0.05, 图1)。
在W-30%、W-15%、W0处理下,短花针茅总生物量随温度增加呈单峰型曲线变化,最适温度分别为T2.0、T4.0、T4.0。W+15%和W+30%处理下,总生物量在各增温处理下与CK相比显著增加,且增至6.0℃时总生物量达到最大,分别为536.7 mg/个和599.2 mg/个(图1)。
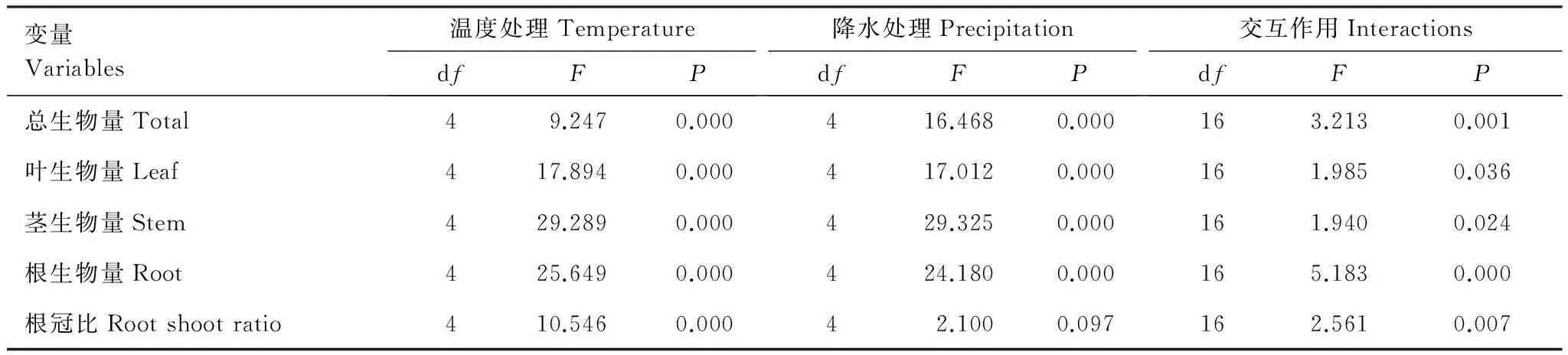
表4 温度和降水变化对短花针茅各器官生物量影响的二维方差分析Table 4 Two-way ANOVA on organ biomass of Stipa breviflora under different temperature and precipitation treatments
2.2 温度和降水协同作用对短花针茅叶、茎、根生物量和根冠比的影响
2.2.1 叶生物量
二因素方差分析显示,温度和降水协同作用对短花针茅叶生物量具有显著的交互作用(P<0.05, 表4)。各增温和降水处理下短花针茅叶生物量均比对照(CK,W0)增加(除T2.0、W-30%),各温度处理下(除T2.0),叶生物量最大均为W+30%处理(图2)。
相同温度下,短花针茅叶生物量随降水量的增加呈增加趋势,在T6.0,W+30%时达到最大值137.5 mg/个。在T4.0和T6.0时,叶生物量在W-30%与W0相比分别显著减少30.1%、27.4%(P<0.05),W+30%时与W0相比差异性不显著,说明短花针茅叶生物量在相同温度下对干旱更加敏感。相同降水条件下,叶生物量随温度升高而增加,5个降水处理(W-30%、W-15%、W0、W+15%、W+30%)下,叶生物量在T6.0时与CK相比分别显著增加50.0%、30.0%、57.2%、69.8%和55.7% (P<0.05, 图2)。
2.2.2 茎生物量
二因素方差分析显示,温度和降水协同作用对短花针茅茎生物量有显著的交互作用(P<0.05, 表4)。茎生物量最适温度和降水组合为T1.5、W+30% (图2)。
在CK、T1.5和T2.0温度处理下,短花针茅茎生物量随降水量增加而增加,在W+30%时达最大值,分别为:47.9 mg/个(CK), 55.0 mg/个(T1.5),41.5 mg/个(T2.0),降水增加处理与降水减少相比有显著性差异(P<0.05)。在T4.0和T6.0处理下,茎生物量随降水量增加先减少后增加,但差异不显著(除W+30%)。相同降水条件下,茎生物量随温度增加而减小,除W+30%的各降水处理下,T2.0、T4.0、T6.0处理与CK相比均有显著性差异(P<0.05, 图2)。
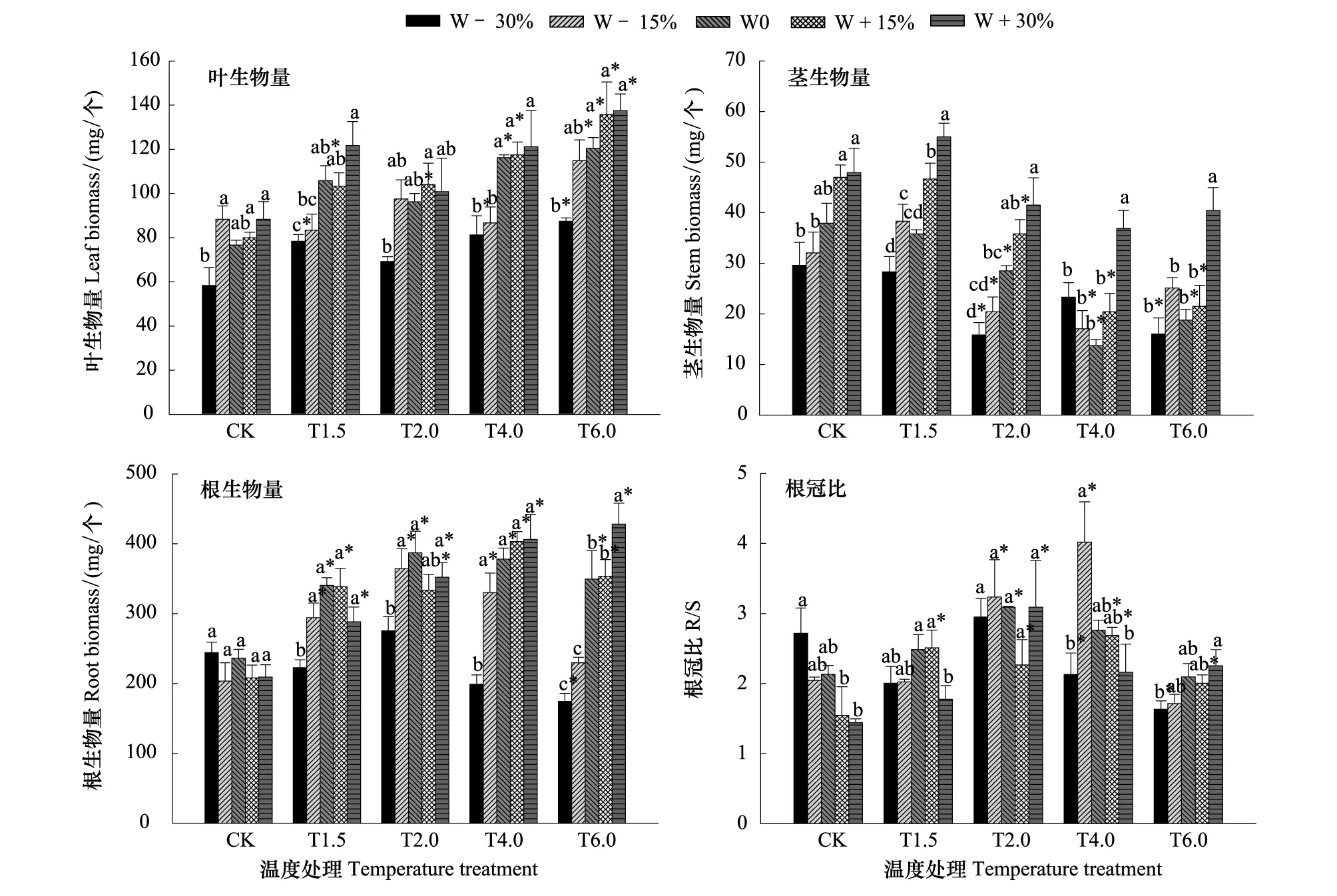
图2 温度和降水协同作用对短花针茅叶生物量、茎生物量、根生物量和根冠比的影响Fig.2 Effects of temperature and precipitation changes on leaf biomass, stem biomass, root biomass and root shoot ratio (R/S) of whole plants in Stipa breviflora. 数据表示是平均值±标准误差(n=3—6)
2.2.3 根生物量
二因素方差分析显示,温度和降水协同作用对短花针茅根生物量有极显著的交互作用(P<0.01, 表4)。根生物量在各增温和降水处理下均比对照(CK,W0)显著增加(除W-30%),且在T6.0、W+30%处理下根生物量达最大值427.9 mg/个(图2)。
相同温度处理(除CK)下,根生物量在W-30%时与W0相比分别显著减少了34.5%(T1.5),28.8%(T2.0),47.4%(T4.0),50.0%(T6.0)。相同降水处理(除W-30%)下,短花针茅根生物量随温度增加先增加后减小,各增温处理下与CK相比有显著性差异(图2)。
2.2.4 根冠比(R/S)
二因素方差分析显示,温度和降水协同作用对短花针茅R/S有极显著的交互作用(P<0.01, 表4)。R/S在所有处理下均大于1,且在T4.0、W-15%时达最大值4.02(图2)。
CK处理下,R/S随降水增加而减小,T6.0处理下,R/S随降水增加而增加,但差异性不显著。各增温处理(除T6.0)下,R/S在W+15%、W+30%时与W0相比均减少。相同降水处理下,R/S随温度增加先增加后减小,其中在W+15%下,R/S在各增温处理下与CK相比均达显著性差异(图2)。
2.3 温度和降水协同作用下短花针茅生物量分配的敏感性分析
不同温度下,短花针茅根生物量比(RMR)、茎生物量比(SMR)、叶生物量比(LMR)随降水变化的变异程度不同。由表5中各器官生物量比的变异系数看出,各温度处理下,SMR随降水变化的变异系数最大为33.86%,即短花针茅茎对温度和降水协同作用最敏感。各温度处理下,各器官生物量比随降水变化的变异系数为SMR>LMR>RMR,即对于温度和降水的协同作用,短花针茅的各器官敏感性为茎>叶>根。随着温度的增加,RMR随降水变化的变异系数基本不变,保持在3.75%—9.33%,说明对于增温和降水的协同作用,短花针茅RMR较为稳定。
表5 不同温度处理下短花针茅叶生物量比、茎生物量比、根生物量比随降水变化的变异系数
Table 5 Thecoefficientofvariation(CV) of LMR, SMR, RMR ofStipabrevifloraunder different temperature and precipitation changes
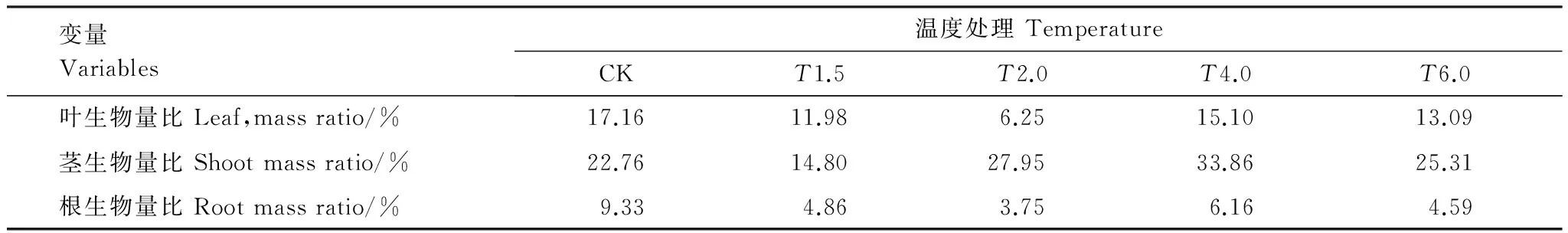
变量Variables温度处理TemperatureCKT1.5T2.0T4.0T6.0叶生物量比Leaf,massratio/%17.1611.986.2515.1013.09茎生物量比Shootmassratio/%22.7614.8027.9533.8625.31根生物量比Rootmassratio/%9.334.863.756.164.59
3 讨论
3.1 短花针茅生物量对温度、降水及其协同作用的响应
温度变化可以影响植物体内有机物的合成和运输等,进而影响植物生物量的分配。植物生长及干物质分配对温度的响应取决于不同物种和所处的环境[25- 26],Morgan等[27]研究表明,在未来温度升高2.6 ℃的条件下,美国矮草草原的生产力将增加。Bachelet等[28]采用平衡模型(MAPSS: Mapped Atmosphere-Plant-Soil System)和动态模型(MCI)模拟结果显示升温4.5 ℃是美国主要生态系统受到干旱胁迫的温度阈值。本研究表明,在降水量增加30%时,短花针茅总生物量随温度增加而增加,且在增温6 ℃时生物量达到最大值(图1),这因为降水充足时,一定范围的升温可促进植物细胞的分裂和生长,对植物生长有一定的促进作用,从而增加了其生物量[29]。本研究还表明,增温使短花针茅总生物量增加,根冠比在增温4 ℃后随增温而减小(图1, 图2),这说明短花针茅根据增温幅度的不同改变其生物量分配策略,以此来保证总生物量的积累,有利于其整体对未来增温环境的适应,这与Carlen等[30]对欧洲两种草本植物(鸭茅Dactylisglomerata和草甸羊茅Festucapratensis)的研究结果一致,表明植物可通过自身生物量分配策略来适应温度变化。
降水亦是限制干旱半干旱地区植被生长的关键因素之一。适度的增加降水会提高植物的光合能力[31],增加植被的净初级生产力[32- 33];干旱则会抑制植物生长,改变干物质分配比例,降低干物质积累。本研究表明,相同温度下,降水减少30%使短花针茅生物量较小,抑制了其生长,降水减少15%对其生物量影响不显著(P>0.05),说明轻度干旱对短花针茅生物量影响较小,过度干旱使其生物量显著减少,这与许振柱和周广胜[34]研究一致,验证了短花针茅实生苗对干旱的较高耐性,反映了其对轻度干旱的适应性。程回军等[35]指出,干旱使荒漠地区草本植物根冠比增加,减小发育后期生物量的积累。本研究与其结果一致,在对照温度下,根冠比随降水减少而增大,即短花针茅通过增加根的生长,减少光合产物向叶和茎的分配来缓解水分胁迫下对水分需求平衡[36]。
温度和降水的协同作用不同于其单独作用,亦会对植物产生显著影响,如增温和加倍降水使高草草地的净初级生产力增加[37],干旱高温使羊草光合速率和生物量减小[34]。本研究表明,短花针茅总生物量在降水减少30%、增温6 ℃时最小,各器官生物量都在降水增加30%,不同的增温幅度下达到最大值(图1, 图2),说明高温加强了干旱对生物量积累的限制作用,一定幅度的增温和降水增加可促进短花针茅生物量积累。各温度处理(除T6.0)下,根冠比在W+15%、W+30%时与W0相比均减少,说明在增温增水时,短花针茅减小地下根的生长而增加地上生物量的积累,这符合平衡生长假说[18- 19],即增温时将水分优先分配给地上器官来维持生长。其中根生物量在增温大于1.5 ℃时,随降水减少而降低,这可能是因为增温使土壤蒸发增大[17],进一步加强了干旱对短花针茅根生长的限制,减弱了其对干旱环境的适应性。本研究还表明,温度和降水对短花针茅生物量和根冠比均有显著的交互作用,这与Fay等[38]认为降水的季节性变化和增温的协同作用对草地植被影响较小的结果不一致,可能是植物类型不同或野外实验与室内控制实验中的植株密度与均匀度等不一致的原因[39],因此控制实验的研究结果还需要进一步与野外实验原位观测相结合。
3.2 短花针茅生物量分配对温度和降水协同作用的敏感性
敏感性是一个系统对气候变化的响应程度[1],不同植物的器官对环境变化的响应程度有所差异。尉秋实等[40]研究表明,沙漠葳(Chilopsislinearis)各构件生物量随土壤水分胁迫的加重而降低,其幅度大小为叶>茎>根,即叶对水分胁迫最敏感。本研究通过对不同温度下,短花针茅生物量分配在不同降水处理下的变异系数比较分析表明,短花针茅各器官生物量分配对温度和降水协同作用的最敏感器官是茎,其变异幅度在14.80%—33.86%,这可能是因为短花针茅为密丛型禾草,茎秆细弱,易受水热变化的影响,而沙漠葳为沙生灌木,茎秆粗壮不易受影响。在各温度处理下,各器官生物量比随降水变化的变幅为SMR>LMR>RMR,即对于温度和降水的协同作用,短花针茅各器官的敏感性为茎>叶>根,根生物量的稳定分配保证了短花针茅对干旱环境的适应性,反映了该物种各器官对温度和降水协同变化的敏感性程度和整体性,也说明了短花针茅对环境胁迫有一定的自我保护调节能力。
4 结论
采用人工气候箱法模拟研究温度变化(对照、增温1.5 ℃、2.0 ℃、4.0 ℃、6.0 ℃)、降水变化(W-30%、W-15%、W0、W+15%、W+30%) (以1978—2007年月均温和月均降水量为基准)及其交互作用对荒漠草原优势种短花针茅生物量及其分配的影响表明:温度和降水协同作用显著影响短花针茅生物量及其分配。
(1) 增温使短花针茅总生物量、叶生物量和根生物量增加,茎生物量和根冠比分别在增温1.5、4 ℃后随增温而减小;降水减少15%对短花针茅生物量影响不显著,而降水减少30%使其生物量显著减小。
(2) 增温和降水增加使总生物量、根和叶生物量增加,茎生物量在增温小于2 ℃时随降水增加而增加,则适当的增温和增加降水可促进短花针茅生物量的积累。
(3) 短花针茅的各器官生物量分配对温度和降水协同作用的敏感性为SMR>LMR>RMR,最敏感性器官为茎。
研究表明,温度和降水协同作用不同于其单独作用。水分状况改变了其对温度的敏感性,反之亦然;二者存在明显的交互作用,因此在预测评价荒漠草原植物对未来气候变化适应时需要综合考虑水分和温度的协同作用。
致谢:感谢李晖老师对种苗的管理与培育,感谢宋健、蒋延玲、贾丙瑞、王宇、孙敬松、殷晓洁、颜亮、王慧、石耀辉、胡天宇、侯彦会、杨志香等在实验工作中给予的帮助。
[1] IPCC. Climate change 2007: synthesis report // Core Writing Team, Pachauri R K, Reisinger A, eds. Contribution of Working Groups I, II and III to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Geneva, Switzerland: IPCC, 2007.
[2] Tramblay Y, Badi W, Driouech F, El Adlouni S, Neppel L, Servat E. Climate change impacts on extreme precipitation in Morocco. Global and Planetary Change, 2012, 82- 83: 104- 114.
[3] 时忠杰, 高吉喜, 徐丽宏, 冯朝阳, 吕世海, 尚建勋. 内蒙古地区近25年植被对气温和降水变化的影响. 生态环境学报, 2010, 20(11): 1594- 1601.
[4] Norby R J, Hartz-Rubin J S, Verbrugge M J. Phenological responses in maple to experimental atmospheric warming and CO2enrichment. Global Change Biology, 2003, 9(12): 1792- 1801.
[5] Barnabás B, Jäger K, Fehér A. The effect of drought and heat stress on reproductive processes in cereals. Plant, Cell & Environment, 2008, 31(1): 11- 38.
[6] Butler S M, Melillo J M, Johnson J E, Mohan J, Steudler P A, Lux H, Burrows E, Smith R M, Vario C L, Scott L, Hill T D, Aponte N, Bowles F. Soil warming alters nitrogen cycling in a New England forest: implications for ecosystem function and structure. Oecologia, 2012, 168(3): 819- 828.
[7] Slaney M, Wallin G, Medhurst J, Linder S. Impact of elevated carbon dioxide concentration and temperature on bud burst and shoot growth ofborealNorwayspruce. Tree Physiology, 2007, 27(2): 301- 312.
[8] Stange C F. A novel approach to combine response functions in ecological process modeling. Ecological Modelling, 2007, 204(3/4): 547- 552.
[9] Zavalloni C, Vicca S, Büscher M, de la Providencia I E, de Boulois H D, Declerck S, Nijs I, Ceulemans R. Exposure to warming and CO2enrichment promotes greater above-ground biomass, nitrogen, phosphorus and arbuscular mycorrhizal colonization in newly established grasslands. Plant and Soil, 2012, 359(1/2): 121- 136.
[10] Xia J Y, Wan S Q. The effects of warming-shifted plant phenology on ecosystem carbon exchange are regulated by precipitation in a semi-arid grassland. PLoS One, 2012, 7(2): e32088.
[11] 张清雨, 吴绍洪, 赵东升, 戴尔阜. 内蒙古草地生长季植被变化对气候因子的响应. 自然资源学报, 2013, 28(5): 754- 764.
[12] 许振柱, 于振文, 李晖, 余松烈. 限量灌水对冬小麦光合性能和水分利用的影响. 华北农学报, 1997, 12(2): 65- 70.
[13] Fereres E, Soriano M A. Deficit irrigation for reducing agricultural water use. Journal of Experimental Botany, 2007, 58(2): 147- 159.
[14] Chaves M M, Flexas J, Pinheiro C. Photosynthesis under drought and salt stress: regulation mechanisms from whole plant to cell. Annals of Botany, 2009, 103(4): 551- 560.
[15] Fan J W, Wang K, Harris W, Zhong H P, Hu Z M, Han B, Zhang W Y, Wang J B. Allocation of vegetation biomass across a climate-related gradient in the grasslands of Inner Mongolia. Journal of Arid Environments, 2009, 73(4/5): 521- 528.
[16] Norbyr R J, Jackson R B. Root dynamics and global change: seeking an ecosystem perspective. New Phytologist, 2000, 147(1): 3- 12.
[17] Hou Y, Wang K Y, Zhang C. Effects of elevated CO2concentration and temperature on nutrient accumulation and allocation inBetulaalbo-sinensisseedlings. Chinese Journal of Applied Ecology, 2008, 19(1): 13- 19.
[18] Bloom A J, Chapin E S III, Mooney H A. Resource limitation in plants-an economic analogy. Annual Review of Ecology and Systematics, 1985, 16(1): 363- 392.
[19] Chapin F S III, Bloom A J, Field C B, Waring R H. Plant responses to multiple environmental factors. BioScience, 1987, 37(1): 49- 57.
[20] 孙羽, 张涛, 田长彦, 李晓林, 冯固. 增加降水对荒漠短命植物当年牧草生长及群落结构的影响. 生态学报, 2009, 29(4): 1859- 1868.
[21] 卫智军, 闫瑞瑞, 运向军, 褚文彬, 杨静. 放牧制度下荒漠草原主要植物生物量及能量分配研究. 中国沙漠, 2011, 31(5): 1124- 1130.
[22] 方楷, 宋乃平, 魏乐, 安慧. 荒漠草原不同地形条件下土壤水分和地上生物量的时空分异. 干旱区研究, 2012, 29(4): 641- 647.
[23] Fuhrer J. Agroecosystem responses to combinations of elevated CO2, ozone and global climate change. Agriculture, Ecosystems & Environment, 2003, 97(1/3): 1- 20.
[24] 张庆, 牛建明, 丁勇, 康萨如拉, 董建军. 短花针茅生物学与生态学研究现状与展望. 中国草地学报, 2010, 32(3): 93- 101.
[25] Kudernatsch T, Fischera A, Bernhardt-Römermann M, Abs C. Short-term effects of temperature enhancement on growth and reproduction of alpine grassland species. Basic and Applied Ecology, 2008, 9(3): 263- 274.
[26] 李娜, 王根绪, 杨燕, 高永恒, 柳林安, 刘光生. 短期增温对青藏高原高寒草甸植物群落结构和生物量的影响. 生态学报, 2011, 31(4): 895- 905.
[27] Morgan J A, Lecain D R, Mosier A R, Milchunas D G. Elevated CO2enhances water relations and productivity and affects gas exchange in C3and C4grasses of the Colorado shortgrass steppe. Global Change Biology, 2001, 7(4): 451- 466.
[28] Bachelet D, Neilson R P, Lenihan J M, Drapek R J. Climate change effects on vegetation distribution and carbon budget in the United States. Ecosystems, 2001, 4(3): 164- 185.
[29] 窦晶鑫, 刘景双, 王洋, 赵光影. 模拟土壤温度升高对湿草甸小叶章生长及生理特性的影响. 应用生态学报, 2009, 20(8): 1845- 1851.
[30] Carlen C, Kölliker R, Nösberger J. Dry matter allocation and nitrogen productivity explain growth responses to photoperiod and temperature in forage grasses. Oecologia, 1999, 121(4): 441- 446.
[31] Zeng F J, Bleby T M, Landman P A, Adams M A, Arndt S K. Water and nutrient dynamics in surface roots and soils are not modified by short-term flooding of phreatophytic plants in a hyperarid desert. Plant and Soil, 2006, 279(1/2): 129- 139.
[32] Guo Q, Hu Z M, Li S G, Li X R, Sun X M, Yu G R. Spatial variations in aboveground net primary productivity along a climate gradient in Eurasian temperate grassland: effects of mean annual precipitation and its seasonal distribution. Global Change Biology, 2012, 18(12): 3624- 3631.
[33] Hsu J S, Powell J, Adler P B. Sensitivity of mean annual primary production to precipitation. Global Change Biology, 2012, 18(7): 2246- 2255.
[34] 许振柱, 周广胜. 不同温度条件下土壤水分对羊草幼苗生长特性的影响. 生态学杂志, 2005, 24(3): 256- 260.
[35] 程军回, 张元明. 水分胁迫下荒漠地区2种草本植物生物量分配策略. 干旱区研究, 2012, 29(3): 432- 439.
[36] 王淼, 代力民, 姬兰柱, 李秋荣. 长白山阔叶红松林主要树种对干旱胁迫的生态反应及生物量分配的初步研究. 应用生态学报, 2001, 12(4): 496- 500.
[37] Luo Y Q, Gerten D, Le Maire G, Parton W J, Weng E S, Zhou X H, Keough C, Beier C, Ciais P, Cramer W, Dukes J S, Emmett B, Hanson P J, Knapp A, Linder S, Nepstad D, Rustad L. Modeled interactive effects of precipitation, temperature, and CO2on ecosystem carbon and water dynamics in different climatic zones. Global Change Biology, 2008, 14(9): 1986- 1999.
[38] Fay P A, Blair J M, Smith M D, Nippert J B, Carlisle J D, Knapp A K. Relative effects of precipitation variability and warming on grassland ecosystem function. Biogeosciences Discussions, 2011, 8(4): 6859- 6900.
[39] 贺金生, 方精云, 马克平, 黄建辉. 生物多样性与生态系统生产力: 为什么野外观测和受控实验结果不一致? 植物生态学报, 2003, 27(6): 835- 843.
[40] 尉秋实, 赵明, 李昌龙, 李爱德. 不同土壤水分胁迫下沙漠葳的生长及生物量的分配特征. 生态学杂志, 2006, 25(1): 7- 12.
Interactive effects of changing precipitation and elevated temperatures on plant biomass and its allocation ofStipabreviflora
LÜ Xiaomin1,2, WANG Yuhui1, ZHOU Guangsheng1,3,*, XU Zhenzhu1, CHEN Jun1,2, TAN Liping1,2, LIU Tao1,2
1StateKeyLaboratoryofVegetationandEnvironmentalChange,InstituteofBotany,ChineseAcademyofSciences,Beijing100093,China2UniversityofChineseAcademyofSciences,Beijing100049,China3ChineseAcademyofMeteorologicalSciences,Beijing100081,China
Although many studies have studied the effects of single environmental factor (temperature, precipitation, CO2etc.) on plants, the interactive effects of changing precipitation and temperature on plants, especially of multiple precipitation and temperature regimes have drawn few attention to date.Stipabreviflora, which is one of the dominant species of desert steppe in the arid region, would be highly sensitive to changes of temperature and precipitation. Our objectives of this study are to determine the interactive effects of changing precipitation and elevated temperatures on biomass and its allocation ofS.breviflora, and to discover its sensitive organs, in order to provide a reference for the biomass change ofS.breviflorain the future climate scenarios and the adaptability of desert steppe to future climate change. In this paper, five artificial control chambers were used to simulate the elevated temperatures (control,T1.5,T2.0,T4.0,T6.0) and changing precipitation (W-30%,W-15%, controlW0,W+15% andW+30%) (based on the average monthly temperature and precipitation of 6—8 months during 1978—2007 in Siziwangqi county, Inner Mongolia). There are six replicates for every temperature and precipitation treatment. The seeds were sowed and well watered before control experiment in greenhouse. Then, 150 pots of plants (four plants per pot) with consistent growing vigor were randomly selected and placed into five artificial control chambers as different treatments. Temperature treatments were controlled by artificial control chambers with different daytime and nighttime temperatures, each precipitation treatment was converted to irrigation amounts of every month and then divided into 10 times to water. The biomasses ofS.breviflorawere measured based on leaves, stems and roots after 3 months. The results showed that the interactive effects of elevated temperature and changing precipitation on biomass and its allocation ofS.breviflorawere significant. Total biomass, leaf biomass and root biomass increased due to warming, stem biomass and root shoot ratio (R/S) decreased with the increase of temperature when warming was more than 1.5 ℃ and 4 ℃. With the warming of 6 ℃ and decreased precipitation of 30%, total, leaf and root biomasses decreased significantly, but stem biomass andR/Swere not affected significantly. With warming and increasing precipitation, total, root and leaf biomasses ofS.brevifloraincreased, stem biomass increased only when warming was less than 2 ℃, so warming and increased precipitation within an appropriate range might promote biomass accumulation. Under interactive effects of warming and changing precipitation, the sensitivity of organ biomass allocation ofS.breviflorawas ranged as shoot mass ratio (SMR)> leaf mass ratio (LMR)> root mass ratio (RMR), the stem was the most sensitive organ.S.breviflorawould adapt to the future climate change by adjusting the biomass allocation into different organs based on its sensitivity. There was difference between the interactive effects of temperature and precipitation and its single effect, therefore we should consider the scene of interactive effects of temperature and precipitation in predicting the adaption of desert grassland plants.
changing precipitation; elevated temperature; interactive effects;Stipabreviflora; biomass
国家重点基础研究发展计划(973计划) (2010CB951300); 中国科学院战略性先导科技专项-应对气候变化的碳收支认证及相关问题(XDA05050400)
2013- 04- 15;
日期:2014- 04- 03
10.5846/stxb201304150710
*通讯作者Corresponding author.E-mail: gszhou@ibcas.ac.cn
吕晓敏, 王玉辉, 周广胜, 许振柱, 陈军, 谭丽萍, 刘涛.温度与降水协同作用对短花针茅生物量及其分配的影响.生态学报,2015,35(3):752- 760.
Lü X M, Wang Y H, Zhou G S, Xu Z Z, Chen J, Tan L P, Liu T.Interactive effects of changing precipitation and elevated temperatures on plant biomass and its allocation ofStipabreviflora.Acta Ecologica Sinica,2015,35(3):752- 760.
