白藜芦醇对大鼠脑缺血/再灌注损伤后星形胶质细胞活化的影响
2015-02-26余萍萍唐凡人周露玲宋晓松陈吉祥
余萍萍,王 莉,唐凡人,周露玲,曾 立,宋晓松,陈吉祥,杨 琴
(重庆医科大学附属第一医院神经内科,重庆 400016)
白藜芦醇对大鼠脑缺血/再灌注损伤后星形胶质细胞活化的影响
余萍萍,王 莉,唐凡人,周露玲,曾 立,宋晓松,陈吉祥,杨 琴
(重庆医科大学附属第一医院神经内科,重庆 400016)
中国图书分类号:R-332;R284.1;R322.81;R743.310.22;R743.310.531;R977.6
摘要:目的 研究白藜芦醇对大鼠脑缺血/再灌注损伤后星形胶质细胞活化的影响。方法 45只SD♂大鼠随机分成假手术组(Sham)、对照组(Con)和白藜芦醇组(30 mg· kg-1,Res),每组15只。于缺血/再灌注后3 h使用白藜芦醇或溶剂治疗,连用7 d。脑缺血24 h时,TTC法检测脑梗死体积,HE染色检测病理变化,Longa评分行神经功能评分,免疫组织化学检测缺血半暗带皮质半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)的表达。脑缺血14 d时,免疫组织化学及免疫荧光法检测胶质纤维酸性蛋白(glial fibrillary acidic pro-tein,GFAP)和神经元NeuN蛋白表达。结果 白藜芦醇治疗较对照组能明显改善神经功能、减小梗死体积、减少神经元脱失及凋亡,抑制星形胶质细胞的活化与增殖(P<0.01)。结论 白藜芦醇治疗可抑制星形胶质细胞的异常活化,保护缺血半暗带神经元,改善神经功能。
关键词:白藜芦醇;脑缺血;再灌注损伤;星形胶质细胞;神经元;活化
网络出版时间:2015-8-10 14:37 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150810.1437.010.html
缺血性脑血管病具有高发病率、高致残率、高死亡率的特点,严重威胁患者健康甚至危及患者生命。脑缺血发生后,病理生理十分复杂,包括兴奋性氨基酸毒性、氧化应激损伤、线粒体功能障碍、钙超载、炎症因子介导等[1-2]。近年研究显示,星形胶质细胞异常活化也在脑缺血性损伤中扮演重要角色。其可影响神经元生存,导致神经元死亡,从而介导脑缺血后的继发性神经损伤[3-4]。因此,采用各种有效手段抑制脑缺血后星形胶质细胞异常活化,对减轻脑缺血损伤后神经修复具有重要意义。
白藜芦醇(resveratrol,Res)是一种含有芪类结构非黄酮类多酚化合物的植物抗毒素,存在于葡萄皮、花生及中药虎杖、藜芦、决明等72种植物中,具有抗肿瘤、抗炎、清除自由基、抗氧化、抗血小板聚集、抗动脉粥样硬化、雌激素样作用等多方面药理活性[5-6]。摄入富含白藜芦醇的饮食能明显减少心脑血管疾病的发生。随后在体内外实验性脑卒中模型的研究中观察到白藜芦醇预处理具有神经保护作用。我们前期的研究也显示,白藜芦醇预处理能通过抗凋亡、抗氧化等作用改善脑缺血后大鼠神经功能、减小脑梗死体积,增强氧糖剥夺模型原代皮质神经元活力及神经干细胞增殖等[7-11]。在脑缺血之后,给予白藜芦醇治疗,其能否通过影响星形胶质细胞的活化,从而改善神经功能,目前尚不清楚。
因此,本实验拟采用大鼠大脑中动脉栓塞缺血/再灌注模型(middle cerebral artery ischemia/reperfu-sion,MCA I/R),在缺血后3 h给予白藜芦醇治疗,观察白藜芦醇对神经功能、梗死体积、细胞凋亡及星形胶质细胞(glial fibrillary acidic protein,GFAP)和神经元核抗原NeuN蛋白表达的影响,为白藜芦醇的临床前应用提供依据。
1 材料与方法
1.1实验动物 SPF级♂3个月200~250 g SD大鼠,由重庆医科大学动物实验中心提供。动物合格证号:SCXK(渝)2012-0001。
1.2药物与主要试剂 白藜芦醇(纯度度≥98%)购于陕西慈缘生物技术有限公司,2,3,5-氯化三苯基四氮唑(TTC)购于索莱宝公司,多克隆兔抗Caspase-3、多克隆兔抗GFAP购于Abcam公司,单克隆鼠抗NeuN购于Millipore公司。免疫组化试剂盒PV-9001、荧光二抗(山羊抗鼠RFITC)和山羊血清封闭液购于北京中杉金桥生物技术有限公司,DAPI和抗荧光淬灭封片液购于碧云天生物技术公司,水合氯醛购自成都市科龙化工试剂公司。其他试剂均为国产分析纯。
1.3大鼠大脑中动脉缺血/再灌注模型的建立 大鼠MCA I/R模型制备采用Longa等[12]的改良线栓法。选用进口鱼线,直径0.23~0.26 mm,长4.0
cm,头端去棱角使其光滑,在距离头端2.0 cm处做黑色标记,乙醇消毒后备用。大鼠术前禁食12 h,自由饮水,经腹腔注射10%水合氯醛0.3 ml/100 g麻醉后,仰卧位固定,消毒后颈部正中切口,分离右侧颈总动脉,颈内外动脉,结扎颈总动脉近心端及颈外动脉远心端,在颈内动脉近端备线,远端放置动脉夹,颈总动脉分叉膨大处切口,松开动脉夹,向颈内动脉插入鱼线18~20 mm(据体重而定),结扎颈总动脉并固定鱼线,外留10 mm线头,缝合皮肤。缺血60 min后,将线栓拉出至颈总动脉结扎端进行再灌注,术后用白炽灯加热维持大鼠体温,苏醒后放回鼠笼,自由饮食。
1.4动物分组及给药 将45只SD大鼠随机分为假手术组(Sham)、对照组(Con)、白藜芦醇组(Res),每组15只。白藜芦醇组于MCA I/R后3 h经腹腔注射白藜芦醇(30 mg·kg-1,无水乙醇稀释),每天1次,连续7 d。假手术组,只分离右侧颈总动脉及颈内外动脉,但不插线。对照组给予MCA I/R。假手术组与对照组每日经腹腔注射等容量的无水乙醇,每天1次,连续7 d。
1.5神经功能缺损评分 按照Longa等[12]评分标准:0分为正常,无神经学征象;1分为动物不能完全伸展左前肢;2分为动物左侧肢体瘫痪,行走时向左侧转圈,出现追尾现象;3分为动物行走向左侧跌倒,或动物不能站立或动物打滚;4分为无自发活动,有意识障碍。神经功能缺损评分在1~3分为模型成功,0分和4分均剔除,各组分别于术后24 h进行行为学评分。
1.6TTC法测定脑梗死体积 各实验组随机取4只大鼠,在术后24 h断头取脑,在-20℃冰箱速冻15 min,剔除嗅脑、低位脑干及小脑,冠状位将其切成6等份切片,置于2%TTC溶液中,37℃避光孵育30 min,白色为梗死灶,红色为正常脑组织,4%多聚甲醛液固定,数码相机拍照。按颜色小心分离梗死组织及正常组织,分别固定、拍照、分离、称重。脑梗死体积/%=苍白区重量/(苍白区重量+非苍白区重量)×100%。
1.7HE染色检测脑梗死区域病理形态的改变缺血24 h,每组选取1只大鼠,麻醉、灌注取脑后,放入4%多聚甲醛固定1 d,石蜡包埋切片,常规苏木精-伊红染色,光学显微镜下观察缺血侧皮质病理形态学改变。
1.8免疫组化技术检测 缺血14 d,每组随机取4只大鼠,经麻醉、开胸,主动脉插管,依次灌注生理盐水250 mL和4%多聚甲醛200 mL,断头取脑,放入4%多聚甲醛固定1 d,常规石蜡包埋切片。按照免疫组织化学试剂盒说明书,采用石蜡切片微波修复抗原免疫组化PV二步法染色程序。4 μm厚石蜡切片于60℃烤箱烤片30 min;二甲苯Ⅰ、Ⅱ各10 min、乙醇梯度脱水各5 min;将切片浸入0.01 mol· L-1枸橼酸盐缓冲液,微波炉进行热修复15 min,室温冷却后用0.1 mol·L-1PBS洗涤2 min×3次;3%H2O2去离子水孵育10 min,以阻断内源性过氧化物酶;PBS洗涤,滴加稀释的一抗Caspase-3(1∶100)、GFAP(1∶100),置于湿盒中,4℃冰箱过夜;PBS洗涤2 min×3次;滴加试剂1(polymer Help-er),37℃孵育20 min,PBS洗涤2 min×3次;滴加试剂2(poly-HRP anti-rabbit IgG),37℃孵育20 min,PBS洗涤2 min×3;应用DAB溶液显色,自来水充分冲洗、复染、脱水、透明、中性树胶封片。显微镜下观察Caspase-3和GFAP的阳性细胞数,每组选取8张(每只大鼠选取2张)进行计数统计。
1.9免疫荧光技术检测 缺血14 d,每组随机取4只大鼠,经麻醉、开胸,主动脉插管,灌流取脑,4%多聚甲醛固定24 h,蔗糖梯度脱水沉底后,制成10 μm厚的脑组织冰冻切片,将切片晾干后,用丙酮室温固定30 min,PBS洗3次;用0.2%Triton100破膜20 min,37℃孵育,PBS洗3次;山羊血清封闭2 h,去除多余血清,不洗;加一抗(NeuN 1∶100),4℃过夜;PBS洗3次,加荧光二抗(抗体工作浓度1∶100),37℃避光孵育1.5 h;PBS漂洗3次DAPI染核5 min;用PBS漂洗3次,用荧光淬灭剂封片,共聚焦下观察照相。激光共聚焦下观察NeuN的阳性细胞数,每组选取8张(每只大鼠选取2张)进行计数统计。
1.10统计学分析 应用SPSS 17.0统计软件进行统计分析,实验数据以±s表示。多组数据的比较采用单因素方差分析,两组间数据的比较采用LSD检验。
2 结果
2.1动物的存活情况 在45只实验大鼠中,对照组和白藜芦醇组各有1只神经功能评分为4,被剔除。模型组有1只在MCA I/R 24 h时死亡,解剖可见颅底大量血凝块,考虑血管破裂导致蛛网膜下腔出血。成活42只。
2.2白藜芦醇对MCA I/R后24 h大鼠神经功能的影响 神经功能评分显示,假手术组无神经功能缺损,对照组和白藜芦醇组均出现了明显的神经行为障碍,但白藜芦醇组较对照组症状得到明显改善,神经行为学评分明显降低(P<0.01,Fig 1)。
2.3白藜芦醇对MCA I/R后24 h大鼠脑梗死体积的影响 TTC染色显示假手术组无梗死灶,对照组和白藜芦醇组缺血侧脑组织有明显的梗死灶,但白藜芦醇组梗死灶体积较对照组明显缩小(P<0.01)(Fig 2)。
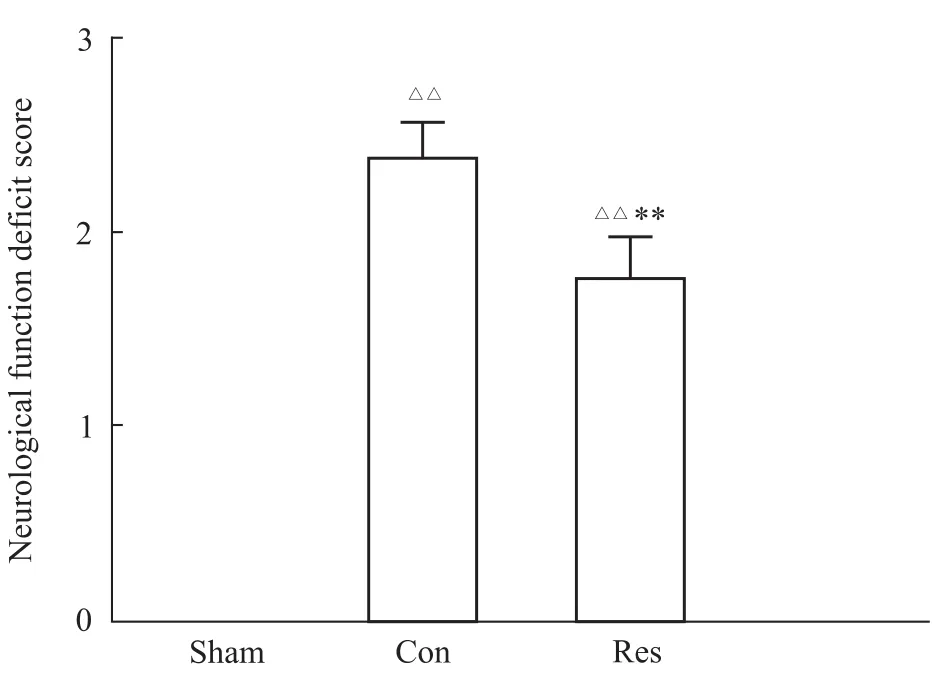
Fig 1 Effects of resveratrol on neurological function after 24h for MCAI/R in rats
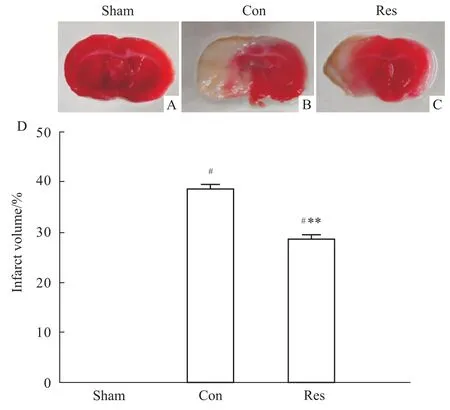
Fig 2 Effects of resveratrol on the cerebral infarction volume after 24h for MCA I/R in rats
2.4白藜芦醇对MCA I/R后24 h脑缺血大鼠皮质病理学和Caspase-3蛋白表达的影响 HE染色显示,假手术组(Fig 3A)大鼠皮质神经元密集,细胞质丰富,细胞核居中染色清楚,形态正常,组织结构完整。在大鼠脑缺血24 h,对照组(Fig 3B)大鼠皮质神经元排列散乱,细胞间质疏松,细胞膜皱缩,细胞核固缩或碎裂;白藜芦醇组(Fig 3C)神经细胞核固缩减轻,多数细胞核仁清晰,结构较完整。
在大鼠脑缺血24 h,免疫组化显示对照组(Fig 3E)和白藜芦醇组(Fig 3F)皮质Caspase-3阳性细胞数均明显多于假手术组(Fig 3D,P<0.01),但白藜芦醇组较对照组Caspase-3阳性细胞数明显减少(P <0.01,Fig 3E和F)。
2.5白藜芦醇对MCA I/R后14 d脑缺血大鼠皮质GFAP和NeuN蛋白表达的影响 在大鼠脑缺血14 d,免疫组化显示对照组(Fig 4 B)和白藜芦醇组(Fig 4C)皮质GFAP阳性细胞数均明显多于假手术组(Fig 4A),且细胞体积增大,突起增大、增多,GFAP阳性强度更强(P<0.01),但白藜芦醇组较对照组明显减少(P<0.01,Fig 4)。
免疫荧光显示对照组(Fig 4E)和白藜芦醇组(Fig 4F)皮质NeuN阳性细胞明显少于假手术组(Fig 4 D,P<0.01),但白藜芦醇组NeuN表达较对照组明显增加(P<0.01,Fig 4)。
3 讨论
白藜芦醇是一天然的植物抗毒素。流行病学资料显示,地中海地区饮食习惯能明显减少心脑血管疾病的发生率,其原因是食物中含丰富的白藜芦醇。随后的研究也显示白藜芦醇预处理能减轻缺血性脑损害,这表明白藜芦醇可用于脑血管疾病的预防。在脑缺血发生之后,白藜芦醇有治疗作用吗?研究证实,在脑缺血后24 h内给予白藜芦醇也能通过抗氧化、抗炎、抗凋亡等途径保护脑组织,减小脑梗死体积,改善神经功能[13-14]。在本研究中,我们于大鼠脑缺血后3 h给予白藜芦醇治疗,结果显示白藜芦醇能明显改善神经功能、减小脑梗死体积、减少神经元脱失。我们的研究结果结合以往的文献均表明,白藜芦醇对缺血性脑损害有治疗作用。
缺血性脑损伤可导致神经组织和神经细胞严重受损,其病理变化包括神经元和胶质细胞的变化。以往关注的焦点是采取各种措施减轻脑缺血对神经元的损伤。近年来,星形胶质细胞对脑缺血后神经功能恢复积极或消极的影响,逐渐被神经科学研究者关注。星形胶质细胞占神经细胞的50%~60%,具有维持神经元的正常功能、神经细胞内外离子浓度、pH值平衡,调控脑血流量,调节体液平衡,参与新陈代谢及突触可塑性,构成血脑屏障等多种生物学功能[15]。大量研究表明,星形胶质细胞不再局限于对脑保护及营养支持作用。其对缺血缺氧及酸中毒较敏感[16]。在脑缺血缺氧损伤早期,星形胶质细胞引起炎症反应,促进谷氨酸、S-100β释放,激活水通道蛋白4,上调血管内皮生长因子、基质金属蛋白
酶的表达,释放一氧化氮,从而导致脑水肿,损害神经元,对损伤后恢复造成不利影响;在脑缺血损伤晚期,星形胶质细胞可异常活化及形成胶质疤痕、以及释放炎症因子和神经毒性分子,从而加重神经元对损伤因素的易损性、敏感性和轴突再生障碍,阻止神经功能的恢复,最终引起神经细胞发生继发性损伤[17]。因此,寻找有效的手段抑制星形胶质细胞过度活化及胶质疤痕形成,有利于改善脑缺血后的神经功能,具有重大的临床意义。
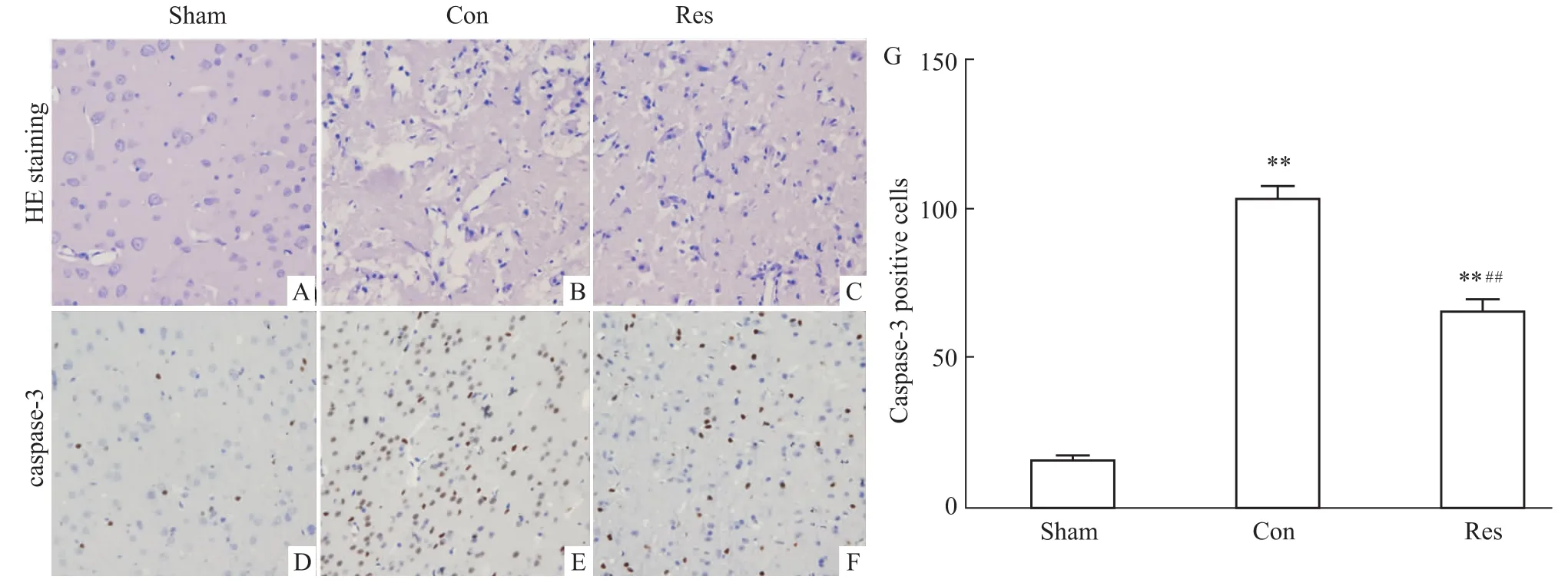
Fig 3 Effects of resveratrol on pathological change(HE staining)and protein expression of caspase-3(immunohistochemistry)of cortex after 24h for MCA I/R in rats(×400)
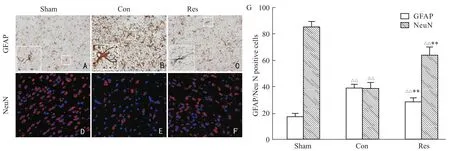
Fig 4 Effects of resveratrol on protein expression of GFAP(immunohistochemistry)and NeuN(immunofluorescence,RFITC,DAPI)after 14d for MCA I/R in rats(×400)
GFAP是星形胶质细胞的特异性标志蛋白。NeuN是一种表达在成熟神经元的特异性蛋白,广泛用于研究和鉴别成熟神经元。Catrinel等在大鼠全脑缺血10 min的脑缺血模型中,于7 d时观察到海马CA1区GFAP阳性细胞数明显增多,细胞形态增大肿胀,突起增多增粗,而神经元数量减少约50%。给予白藜芦醇预处理21 d再全脑缺血10 min,于7 d时海马CA1区GFAP阳性细胞数明显低于对照组,而神经元数量明显多于对照组,表明脑缺血引起了星形胶质细胞的活化,损害了神经元,而白藜芦醇预处理能抑制星形胶质细胞的活化,减少神经元的脱失[18]。我们在大鼠MCA I/R后14 d也观察到模型组缺血半暗带皮质区GFAP的表达明显增强,GFAP阳性细胞数明显增加,且细胞体积增大,突起多而粗;而NeuN阳性细胞数明显减少。在MCA I/R后3 h给予白藜芦醇治疗,24 h时缺血半暗带皮质区caspase-3阳性细胞数明显低于对照组,14 d时缺血半暗带皮质区GFAP的表达及GFAP阳性细胞数明显低于对照组,且细胞体积较对照组小,突起没有对照组多而粗;而NeuN阳性细胞数明显较对照组多。也表明脑缺血损伤导致了细胞凋亡,星形胶质细胞的异常活化和增殖,破坏了神经元,而白藜芦醇治疗能减少细胞凋亡,抑制星形胶质细胞的活化
和增殖,减少神经元的脱失。文献及我们的研究表明脑缺血前预防性或脑缺血后治疗性使用白藜芦醇均能减少细胞凋亡,抑制星形胶质细胞的活化和增殖,减少神经元的脱失。
我们的前期研究表明白藜芦醇预处理有神经保护作用。目前我们在脑缺血后3 h给予白藜芦醇治疗也显示能减少梗死体积,减少细胞凋亡,抑制星形胶质细胞的活化和增殖,减少神经元的脱失,从而促进神经功能恢复。这是对前期工作的延伸。白藜芦醇抑制星形胶质细胞的活化和增殖的机制如何,则有待我们进一步阐明。
参考文献:
[1] Warlow C,Sudlow C,Dennis M,et al.Stroke[J].Lancet,2003,362(9391):1211-24.
[2] Sabri M,Lass E,Macdonald R L.Early brain injury:a common mechanism in subarachnoid hemorrhage and global cerebral ische-mia[J].Stroke Res Treat,2013,2013:394036.
[3] Anderson M F,Blomstrand F,Blomstrand C,et al.Astrocytes and stroke:networking for survival[J].Neurochem Res,2003,28 (2):293-305.
[4] Chen Y,Swanson R A.Astrocytes and brain injury[J].Cereb Blood Flow Metab,2003,23(2):137-49.
[5] Brisdelli F,D′Andrea G,Bozzi A.Resveratrol:a natural poly-phenol with multiple chemopreventive properties[J].Curr Drug Metab,2009,10(6):530-46.
[6] KPL B,Kosmeder J W,Pezzuto J M.Biological effects of resvera-trol[J].Antioxid Redox Signal,2001,3(6):1041-64.
[7] Ren J,Fan C,Chen N.et al.Resveratrol pretreatment attenuates cerebral ischemic injury by upregulating expression of transcription factor Nrf2 and HO-1 in rats[J].Neurochem Res,2011,36 (12):2352-62.
[8] 任俊伟,陈 娜,范层层,等.白藜芦醇对脑缺血/再灌注后细胞凋亡及Caspase-3表达的影响[J].中成药,2011(4):570 -3.
[8] Ren J W,Chen N,Fan C C,et al.Effect of resveratrol on apopto-sis and expression of Caspase-3 in rats with focal cerebral ischemia and reperfusion[J].Chin Tradit Patent Med,2011,33(4):570 -3.
[9] 沈长波,黄家贵,张黎黎,等.白藜芦醇在缺血缺氧再灌注损伤不同时间窗皮质神经元氧化应激的影响[J].第二军医大学学报,2013,34(7):708-3.
[9] Shen C B,Huang J G,Zhang L L,et al.Effect of resveratrol on oxidative stress of rat primary cortical neurons during different time windows of oxygen-glucose deprivation/reperfusion injury[J].Acad J Second Milit Med Univ,2013,34(7):708-13.
[10]成 薇,沈长波,王 莉,等.白藜芦醇预处理对氧糖剥夺/再复氧损伤大鼠皮质神经干细胞增殖的影响[J].中国药理学通报,2015,31(1):113-8.
[10]Cheng W,Shen C B,Wang L,et al.Effect of resveratrol pretreat-ment on proliferation of cortical neural stem cells after oxygen-glu-cose deprivation/reperfusion injury in rats[J].Chin Pharmacol Bull,2015,31(1):113-8.
[11]Cheng W,Yu P,Wang L M,et al.Sonic hedgehog signaling me-diates resveratrol to increase proliferation of neural stem cells after oxygen-glucose deprivation/reoxygenation injury in vitro[J].Cell Physiol Biochem,2015,35:2019-32.
[12]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[13]Shin J A,Lee H,Lim Y K,et al.Therapeutic effects of resvera-trol during acute periods following experimental ischemic stroke [J].Neuroimmunol,2010,227:93-100.
[14]Li Z,Pang L,Fang F,et al.Resveratrol attenuates brain damage in a rat model of focal cerebral ischemia via up-regulation of hipp-ocampal Bcl-2[J].Brain Res,2012,1450,116-24.
[15]Sofroniew M V,Vinters H V.Astrocytes:biology and pathology [J].Acta Neuropathol,2010,119(1):7-35.
[16]Fern R.Ischemia:astrocytes show their sensitive side[J].Prog Brain Res,2001,132:405-11.
[17]Zhao Y,Rempe D A.Targeting astrocytes for stroke therapy[J].Neurotherapeutics,2010,7(4):439-51.
[18]Girbovan C,Plamondon H.Resveratrol downregulates type-1 glu-tamate transporter expression and microglia activation in the hippo-campus following cerebral ischemia reperfusion in rats[J].Brain Res,2015:203-14.
Effects of resveratrol on astrocyte activation after cerebral ischemia/reperfusion injury in rats
YU Ping-ping,WANG Li,TANG Fan-ren,ZHOU Lu-ling,ZENG Li,
SONG Xiao-song,CHEN Ji-xiang,YANG Qin (Dept of Neurology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China)
Abstract:Aim To investigate the effect of resveratrol on astrocyte activation after cerebral ischemia/reperfusion injury in rats.Methods 45 male Sprague-Dawley rats were divided into sham,control and resveratrol groups,15 rats in each group.Resveratrol or solvent was intra- peritoneally perfused into the rats for 7 consecutive days after 3h for MCA I/R.Cerebral infarction volume with TTC,neurological function score with Longa score,and pathological change with HE staining,the protein expressions of Caspase-3 with immunohistochemistry
at 24h after MCA I/R were examined.The protein ex-pressions of GFAP and NeuN in penumbra were detec-ted with immunohistochemistry and immunofluores-cence at 14d after MCA I/R.Results Resveratrol treatment significantly improved the neurological func-tion score,decreased the infarct volume,reduced neu-ron loss,and inhibited the activation and proliferation of astrocytes,compared with the control group.Con-clusion Resveratrol can inhibit the excessive activa-tion of astrocytes,protect neurons in penumbra and im-prove neurological function.
Key words:resveratrol;cerebral ischemia;reperfusion injury;astrocyte;neuron;activation
作者简介:余萍萍(1988-),女,硕士生,E-mail:465430809@qq.com;杨 琴(1970-),女,博士,教授,研究方向:脑血管疾病与干细胞移殖,E-mail:xyqh200@126.com
基金项目:国家自然科学基金面上项目(No 81071119);卫计委国家临床重点专科建设项目资金资助(卫办医政函[2012]649号)
收稿日期:2015-05-12,修回日期:2015-06-21
文献标志码:A
文章编号:1001-1978(2015)09-1228-06
doi:10.3969/j.issn.1001-1978.2015.09.010
