LBH589对OVCAR-3细胞增殖、侵袭和血管内皮生长因子表达的影响*
2015-02-23晁宏图李晓凤寇馨歆杨晓霞王莉英
晁宏图,李晓凤,寇馨歆,李 雷,杨晓霞,王莉英,王 莉
河南省肿瘤医院(郑州大学附属肿瘤医院)妇瘤科 郑州 450003
LBH589对OVCAR-3细胞增殖、侵袭和血管内皮生长因子表达的影响*
晁宏图,李晓凤,寇馨歆,李雷,杨晓霞,王莉英,王莉#
河南省肿瘤医院(郑州大学附属肿瘤医院)妇瘤科 郑州 450003
关键词组蛋白去乙酰化酶抑制剂;OVCAR-3细胞;增殖;侵袭;VEGF;PI3K/Akt通路
摘要目的:观察LBH589对上皮性卵巢癌OVCAR-3细胞增殖、侵袭和VEGF表达的影响。方法:采用MTT法和Transwell实验分别检测1、5、10 μmol/L的LBH589对OVCAR-3细胞活性和侵袭细胞数的影响,采用Western blot法检测Ki67、MMP-2、VEGF、p-PI3K、p-Akt蛋白的表达水平。采用MTT和Western blot法分别检测PI3K抑制剂LY294002对细胞活性以及MMP-2、VEGF表达水平的影响。结果:LBH589降低OVCAR-3细胞活性(F=5.324,P<0.001),减少穿过Transwell基质膜的细胞数量(F=84.325,P<0.001),Ki67、MMP-2、VEGF、p-PI3K、p-Akt蛋白的表达水平亦降低(F=9.191、7.623、6.340、6.221、4.690,P均<0.001)。与对照组相比,LY294002抑制MMP-2和VEGF蛋白的表达,并降低OVCAR-3细胞活性(P均<0.05)。结论:LBH589可能通过调控PI3K/Akt信号通路下调MMP-2和VEGF表达水平,继而抑制上皮性卵巢癌OVCAR-3细胞增殖、侵袭和血管生成。
AbstractAim: To observe the effects of LBH589 on the proliferation, invasion and VEGF expression of OVCAR-3 cells.Methods: The effects of 1, 5, and 10 μmol/L LBH589 on the relative viability and invasion of OVCAR-3 cells were determined using MTT and Transwell assay, respectively. The effects of LBH589 on the expression levels of Ki67, MMP-2, VEGF, p-PI3K, and p-Akt were measured using Western blot analysis. Finally, the effects of PI3K inhibitor LY294002 on the relative viability and the expression levels of MMP-2 and VEGF were detected using MTT assay and Western blot analysis, respectively.Results: LBH589 lowered the relative viability of OVCAR-3 cells(F=5.324,P<0.001), reduced the number of transferred cells(F=84.325,P<0.001). Also, the expression levels of Ki67, MMP-2, VEGF, p-PI3K, and p-Akt decreased(F=9.191,7.623,6.340,6.221,4.690,P<0.001). Compared with the control group, LY294002 down-regulated the expressions of MMP-2 and VEGF, and lowered the relative viability of OVCAR-3 cells(P<0.05).Conclusion: LBH589 down-regulates the expressions of MMP-2 and VEGF by mediating the PI3K/Akt signaling pathway, resulting in the inhibition of proliferation, invasion and angiogenesis of OVCAR-3 cells.
LBH589属新型异羟肟酸类组蛋白去乙酰化酶抑制剂,能够激活特定基因转录,对多种肿瘤细胞有明显的抑制作用[1]。上皮性卵巢癌是妇科恶性程度最高的肿瘤,被发现时大多数患者已处于晚期[2-3]。多烯紫杉醇联合铂类药物是治疗卵巢癌的有效方法,但容易出现耐药性。前期研究[4]发现LBH589对卵巢癌OVCAR-3细胞有抑制作用,但相关机制尚未完全清楚。该实验观察了不同剂量LBH589对上皮性卵巢癌OVCAR-3细胞增殖、侵袭和VEGF表达的影响,报道如下。
1材料与方法
1.1主要材料上皮性卵巢癌OVCAR-3细胞购于美国菌种保藏中心;LBH589购于美国Selleck Chemicals公司;基质胶购于美国BD公司;Transwell侵袭小室购于美国Corning公司;RPMI 1640、胰蛋白酶和胎牛血清购于美国Gibco公司,MTT、SDS和LY294002购于美国Sigma公司;p-Akt、p-PI3K、VEGF单克隆抗体购于美国Santa Cruz公司;兔抗人Ki67单克隆抗体和鼠抗人MMP-2单克隆抗体购于英国Abcam公司;鼠抗人β-actin单克隆抗体购于美国Ambion公司。
1.2细胞培养OVCAR-3细胞于37 ℃、体积分数5% CO2及饱和湿度条件下,培养于含体积分数10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的RPMI 1640培养基中,每2~3 d传代一次。
1.3相对细胞活性的检测采用MTT法。胰蛋白酶消化对数期OVCAR-3细胞成单细胞悬液,接种于96 孔培养板(每孔2×103个细胞),孵育24 h后加入1、5、10 μmol/L的LBH589继续培养48 h(低、中、高剂量组)。每孔加入5 g/L的MTT 20 μL,37 ℃继续孵育4 h后终止实验。弃上清液,每孔加150 μL DMSO,结晶紫混匀后用酶标仪于560 nm波长处测各组OD值。另外,验证PI3K/Akt通路对细胞增殖影响时,加入5 μmol/L的LY294002处理8 h,同样方法测定细胞OD值。相对细胞活性=实验组OD值/对照组OD值。实验重复3次。
1.4细胞侵袭能力的检测采用Transwell实验。将OVCAR-3细胞分为4组,消化成单细胞悬液并接种于培养板,每组10个复孔,加入1、5、10 μmol/L的LBH589,体积分数5% CO2、37 ℃条件下培养24 h(低、中、高剂量组)。将各组细胞置于无血清培养基中重悬,细胞密度调整为2.0×105mL-1。取200 μL细胞悬液接种于Transwell小室的上室,小室中置8 μm PET膜,下室加600 μL含体积分数10%胎牛血清的DMEM培养基,培养12 h后用中性甲醇固定30 min,用棉签擦去未迁移细胞,结晶紫染色后于200倍倒置显微镜下观察细胞迁移数目。实验重复3次。
1.5OVCAR-3细胞中Ki67、MMP-2、VEGF、PI3K、p-PI3K、Akt、p-Akt蛋白的检测收集经不同剂量LBH589处理48 h后的各组细胞(同1.3),用蛋白裂解液处理后提取细胞内总蛋白。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳完毕后,转至硝酸纤维素膜上,用脱脂牛奶于37 ℃封闭30 min,加入Ki67、MMP-2、VEGF、PI3K、p-PI3K、Akt、p-Akt、β-actin(内参)一抗4 ℃过夜。与二抗反应1 h后用洗膜缓冲液清洗3次。用WB成像软件(Image Quant LAS4000)分析各条带灰度值,用目的条带与内参条带灰度值的比值表示目的蛋白的相对表达量。用5 μmol/L的PI3K抑制剂LY294002作用OVCAR-3细胞24 h后,同样方法检测MMP-2和VEGF蛋白的表达。实验重复3次。
1.6统计学处理采用SPSS 19.0进行统计学分析。LBH589处理OVCAR-3细胞后各指标的比较采用单因素方差分析及LSD-t检验;LY294002处理OVCAR-3细胞后MMP-2和VEGF蛋白相对表达量的比较采用两独立样本的t检验。检验水准α=0.05。
2结果
2.1LBH589对OVCAR-3细胞增殖能力和Ki67蛋白表达的影响结果见图1和表1。
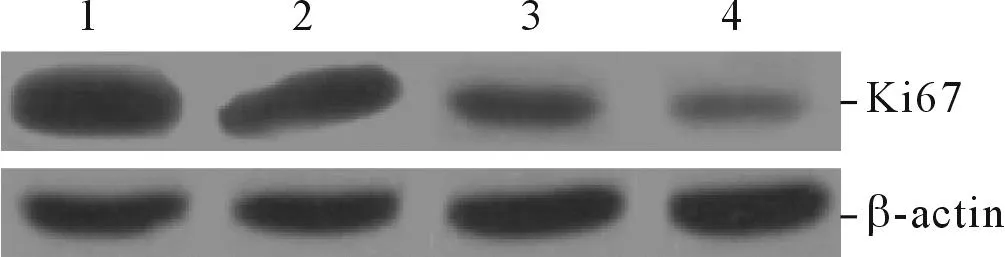
图1 各组细胞Ki67蛋白的表达
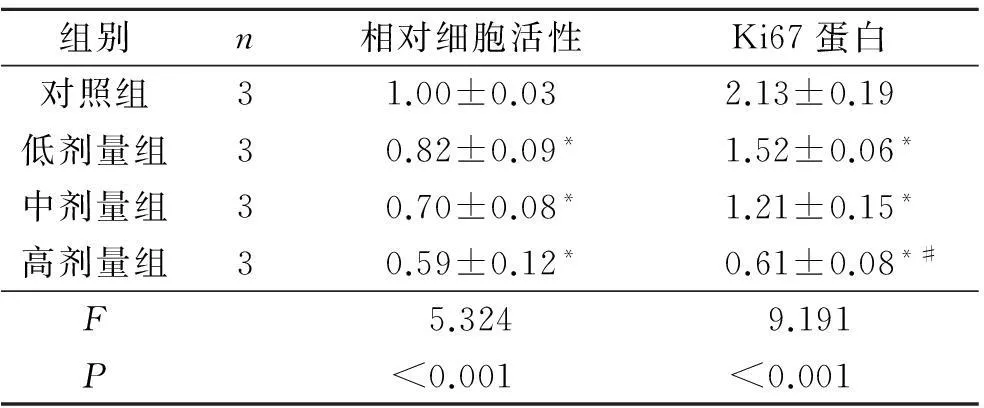
组别n相对细胞活性Ki67蛋白对照组31.00±0.032.13±0.19低剂量组30.82±0.09*1.52±0.06*中剂量组30.70±0.08*1.21±0.15*高剂量组30.59±0.12*0.61±0.08*#F5.3249.191P<0.001<0.001
*:与对照组比较,P<0.05;#:与中剂量组比较,P<0.05。
2.2LBH589对OVCAR-3细胞侵袭能力和MMP-2蛋白表达的影响结果见图2、3和表2。
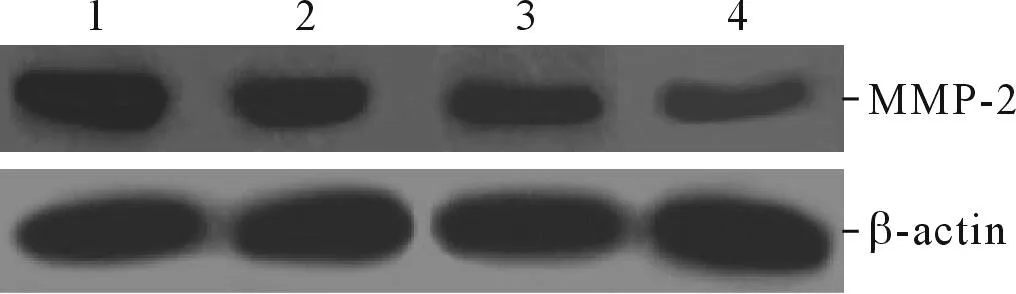
图2 各组细胞MMP-2蛋白的表达
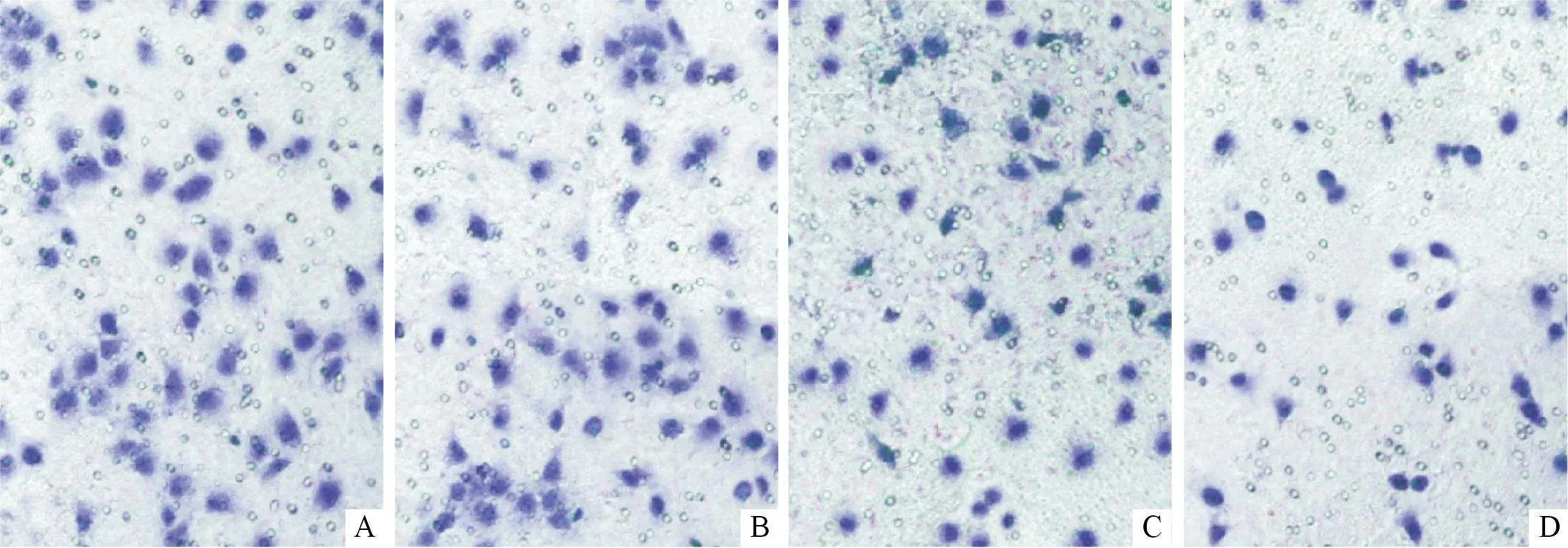
图3 各组细胞侵袭细胞数的变化(×200)
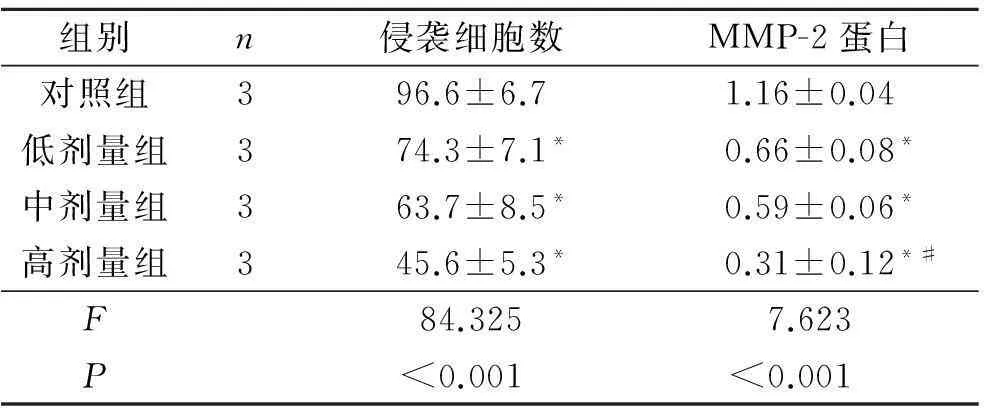
组别n侵袭细胞数MMP-2蛋白对照组396.6±6.71.16±0.04低剂量组374.3±7.1*0.66±0.08*中剂量组363.7±8.5*0.59±0.06*高剂量组345.6±5.3*0.31±0.12*#F84.3257.623P<0.001<0.001
*:与对照组比较,P<0.05;#:与中剂量组比较,P<0.05。
2.3LBH589对OVCAR-3细胞VEGF蛋白表达的影响结果见图4和表3。
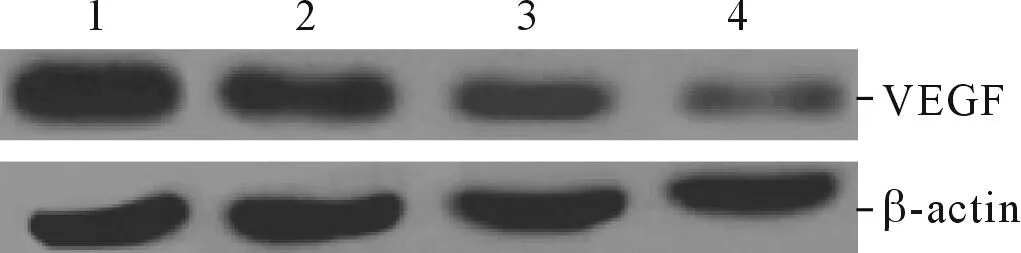
图4 各组细胞VEGF蛋白的表达
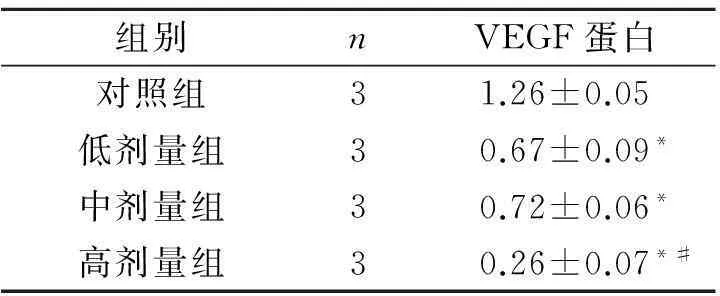
组别nVEGF蛋白对照组31.26±0.05低剂量组30.67±0.09*中剂量组30.72±0.06*高剂量组30.26±0.07*#
F=6.340,P<0.001;*:与对照组比较,P<0.05;#:与中剂量组比较,P<0.05。
2.4LBH589对OVCAR-3细胞PI3K/Akt信号通路的影响结果见图5和表4。
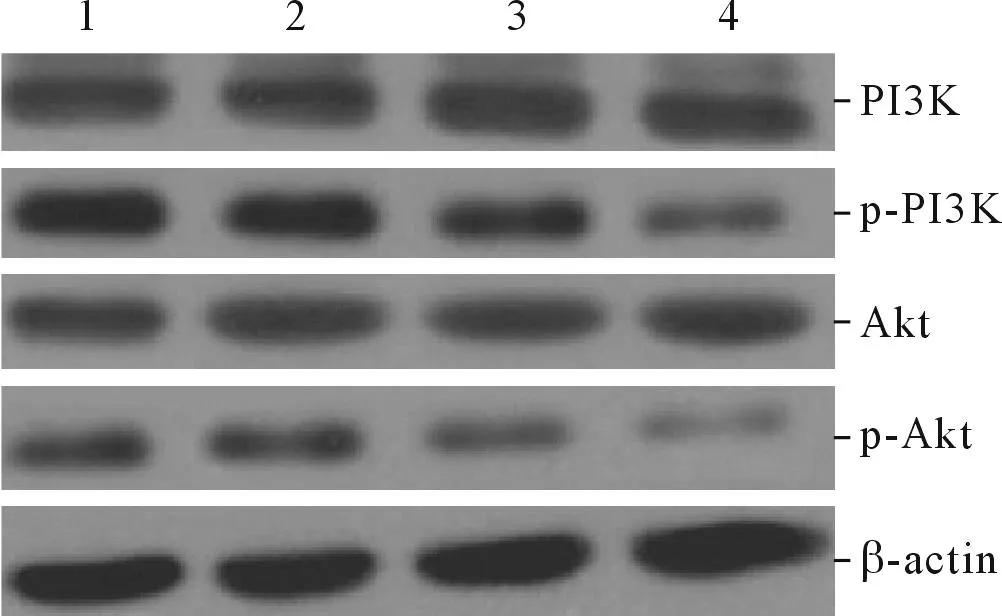
图5 LBH589处理后各组细胞PI3K、p-PI3K、Akt和p-Akt蛋白的表达
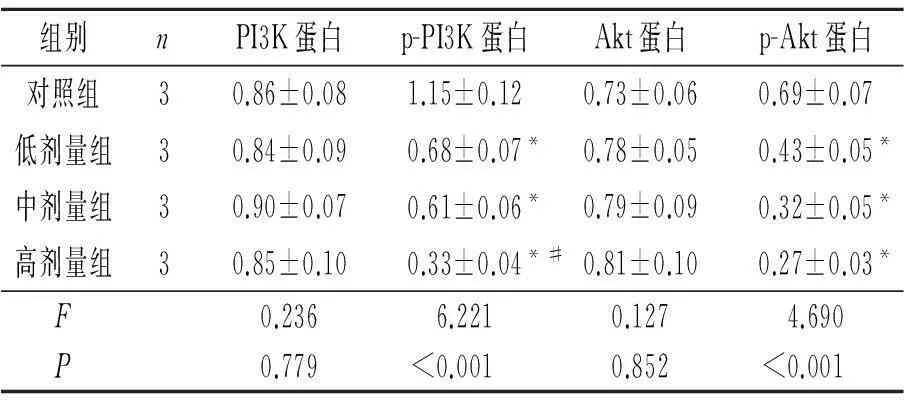
表4 不同剂量LBH589对
*:与对照组比较,P<0.05;#:与中剂量组比较,P<0.05。
2.5LY294002对MMP-2和VEGF蛋白表达及相对细胞活性的影响结果见图6和表5。
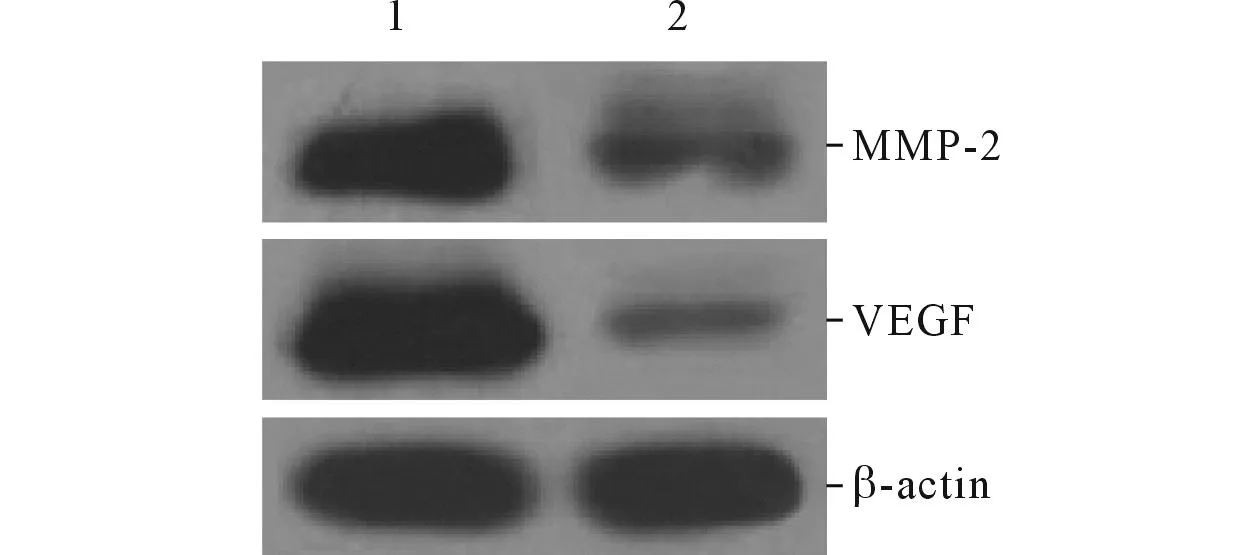
图6 LY294002处理后各组细胞MMP-2和VEGF蛋白的表达
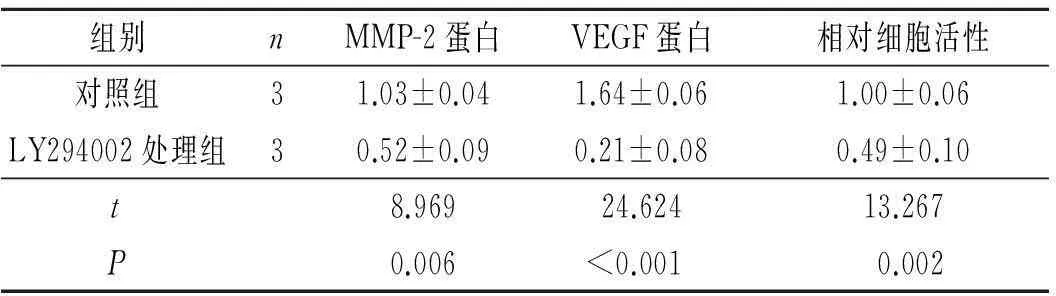
组别nMMP-2蛋白VEGF蛋白相对细胞活性对照组31.03±0.041.64±0.061.00±0.06LY294002处理组30.52±0.090.21±0.080.49±0.10t8.96924.62413.267P0.006<0.0010.002
3讨论
该实验观察到LBH589明显抑制上皮性卵巢癌OVCAR-3细胞增殖、侵袭,MMP-2蛋白的表达量亦随LBH589作用剂量的增加而降低。MMP-2是MMPs家族的重要成员之一,其作用是降解基底膜和基质的主要成分、促进血管和淋巴管生成以及调控细胞间黏附作用,在肿瘤的浸润、侵袭和转移中起重要作用[5]。作为卵巢癌转移的早期调控因子,MMP-2普遍表达于卵巢癌中,参与卵巢癌的侵袭转移[6]。MMP-2可降解细胞外基质中的纤连蛋白和玻连蛋白,降解成分可与卵巢癌细胞结合并增强与腹膜中有关受体结合能力,促进卵巢癌细胞转移[7]。因此推测,该实验中LBH589对OVCAR-3细胞增殖和侵袭的影响可能是通过调控MMP-2实现的。
VEGF是目前所发现的各种促血管形成因子中作用最强的一种,其通过旁分泌及自分泌的方式与血管内皮细胞上的酪氨酸受体特异性结合,使内皮细胞快速分裂、增殖,最终形成新血管,肿瘤获得血液灌注而加快生长速度[8]。该实验中,LBH589作用于OVCAR-3细胞48 h后,VEGF蛋白表达降低,表明LBH589有抑制OVCAR-3细胞血管生成的作用。OVCAR-3细胞受到VEGF刺激后,增加OVCAR-3细胞以及周围纤维细胞和血管内皮细胞MMP-2等的表达,消除基质膜和细胞间基质的屏障,使OVCAR-3细胞更易移出和转移[9]。另一方面,VEGF与MMP-2协同参与肿瘤细胞血管形成、侵袭和转移[10-11]。因此,LBH589通过降低MMP-2和VEGF表达水平共同抑制OVCAR-3细胞侵袭、转移和肿瘤血管形成,对卵巢癌起治疗作用。
该实验观察到,LBH589显著降低上皮性卵巢癌OVCAR-3细胞中p-PI3K和p-Akt的表达,说明LBH589抑制PI3K/Akt信号通路。PI3K下游的靶蛋白Akt是信号通路中重要的一种蛋白激酶,其活化强度与肿瘤的发生发展紧密关联,持续激活Akt可增强肿瘤细胞的凋亡耐受性,导致肿瘤细胞增殖、代谢的异常活跃[12]。研究[13]表明,PI3K/Akt通路还可上调MMP-2 mRNA和蛋白表达水平,促进肿瘤细胞的侵袭和转移。此外,PI3K/Akt信号的激活可通过其他途径增加低氧诱导因子的表达水平,从而启动VEGF转录,增加VEGF表达水平,最终导致肿瘤细胞新生血管形成,促进肿瘤细胞增殖、运动、侵袭和转移[14-18]。该研究采用LY294002抑制PI3K/Akt通路后,OVCAR-3细胞的活性受到显著抑制。基于以上实验,推断LBH589通过抑制PI3K/Akt信号通路降低MMP-2和VEGF的表达,继而调控OVCAR-3细胞增殖、侵袭和血管生长。
综上,LBH589抑制OVCAR-3细胞增殖、侵袭和VEGF表达水平。此作用可能是通过调控PI3K/Akt信号通路,降低MMP-2和VEGF的表达水平而实现。
参考文献
[1]张灵,马艳萍,贾谷.组蛋白去乙酰化酶抑制剂LBH589诱导多发性骨髓瘤细胞凋亡及其逆转耐药的机制研究[J].中华血液学杂志,2012,33(11):926
[2]晁宏图,邓君丽,马一鸣,等.LBH589或联合多烯紫杉醇对人卵巢癌OVCAR-3细胞增殖和凋亡的研究[J].中国肿瘤临床,2013,40(10):567
[3]王海娟,孟希亭,栾青春,等.反转录病毒介导的Luciferase基因稳定转染细胞株的建立及其生物发光成像检测[J].解放军医学杂志,2012,37(5):409
[4]晁宏图,邓君丽,马一鸣,等.LBH589对人上皮性卵巢癌OVCAR-3细胞增殖的抑制作用及机制探讨[J].中国肿瘤临床,2013,40(3):131
[5]文彬,孙海涛,贺松其,等.鳖甲煎丸对Wnt信号通路中β-catenin/TCF4复合物活性及信号分子cyclin D1、MMP-2的影响[J].南方医科大学学报,2014,34(12):1758
[6]Su Y,Gao L,Teng L,et al.Id1 enhances human ovarian cancer endothelial progenitor cell angiogenesis via PI3K/Akt and NF-κB/MMP-2 signaling pathways[J].J Transl Med,2013,11(1):132
[7]Kenny HA,Kaur S,Coussens LM,et al.The initial steps of ovarian cancer cell metastasis are mediated by MMP-2 cleavage of vitronectin and fibronectin[J].J Clin Invest,2008,118(4):1367
[8]宋星月,李进伟.针对EGFR和VEGF/VEGFR靶点的肿瘤分子靶向药物研究进展[J].中国实用内科杂志,2014,34(增刊2):63
[9]Zhang A,Meng L,Wang Q,et al.Enhanced in vitro invasiveness of ovarian cancer cells through up-regulation of VEGF and induction of MMP-2[J].Oncol Rep,2006,15(4):831
[10]郭茂华,郑瑞锋,申培红,等.乳腺肿瘤组织中BCSG1、MMP-2、TIMP-2和VEGF蛋白的表达[J].郑州大学学报:医学版,2015,50(3):439
[11]贾宗良,柴明明,贾一凡.甲状腺乳头状癌中MMP2、COX-2、VEGF和MVD的表达及临床意义[J].西安交通大学学报:医学版,2015,36(3):362
[12]Polivka J,Janku F.Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway[J].Pharmacol Ther,2014,142(2):164
[13]Yang N,Hui L,Wang Y,et al.SOX2 promotes the migration and invasion of laryngeal cancer cells by induction of MMP-2 via the PI3K/Akt/mTOR pathway[J].Oncol Rep,2014,31(6):2651
[14]Bae IH,Park MJ,Yoon SH,et al.Bcl-w promotes gastric cancer cell invasion by inducing matrix metalloproteinase-2 expression via phosphoinositide 3-kinase, Akt, and Sp1[J].Cancer Res,2006,66(10):4991
[15]薛雯,赵维莅.弥漫大B细胞淋巴瘤细胞信号通路调控的靶向治疗进展[J].中国实用内科杂志,2014,34(2):203
[16]范磊,徐卫,李建勇.弥漫大B细胞淋巴瘤预后新指标[J].中国实用内科杂志,2015,35(2):81
[17]路瑾.慢性淋巴细胞白血病分层治疗[J].中国实用内科杂志,2015,35(2):96
[18]杨静宜,周可树,宋永平.Ibrutinib治疗慢性淋巴细胞白血病研究进展[J].中国实用内科杂志,2015,35(3):263
*河南省医学科技攻关基金资助项目200903006;郑州大学大学生创新实验项目101045907
Effects of LBH589 on proliferation,invasion,and VEGF expression of OVCAR-3 cells
CHAOHongtu,LIXiaofeng,KOUXinxin,LILei,YANGXiaoxia,WANGLiying,WANGLi
DepartmentofGynecologicOncology,HenanCancerHospital(theAffiliatedCancerHospital,ZhengzhouUniversity),Zhengzhou450003
Key wordshistone deacetylase inhibitor;OVCAR-3 cell;proliferation;invasion;VEGF;PI3K/Akt pathway
doi:10.13705/j.issn.1671-6825.2015.06.011
中图分类号R737.31
通信作者#,女,1964年8月生,本科,主任医师,研究方向:妇科肿瘤,E-mail:13837196622@163.com