HF酸对玻璃浅层蚀刻模型的研究
2015-02-07李椿方
秦 静,庞 东,袁 騉,李椿方,刘 通
(1. 北京市工业技师学院,北京 100023; 2. 中国寰球工程公司,北京 100012)
HF酸对玻璃浅层蚀刻模型的研究
秦 静1,庞 东2,袁 騉1,李椿方1,刘 通1
(1. 北京市工业技师学院,北京 100023; 2. 中国寰球工程公司,北京 100012)
为控制石英玻璃与HF酸的反应,实现石英玻璃精密元件的化学蚀刻和对石英玻璃工艺品的精确加工,探讨了化学反应机理和腐蚀的动力学过程。重点探究了影响整个蚀刻过程的重要因素,HF酸溶液的浓度c、反应的温度T和反应的时间t与蚀刻深度之间的关系。结合power law幂率模型的原理,建立了适用于石英玻璃浅层蚀刻的数学模型。验证时,选取了10,20 ℃等温度下,4种不同浓度的HF酸体系,通过模拟曲线和实验数据的对比,得知误差基本维持在5%以内。因此,该模型可以对玻璃的浅层蚀刻进行比较准确的模拟。
HF酸;玻璃;浅层蚀刻;数学模型
石英玻璃是典型的脆硬材料,可加工性能差,常规的机械加工导致残余应力和亚表层损伤等缺陷严重。利用HF酸溶液对石英玻璃进行腐蚀作用,对精密、复杂石英玻璃元器件表面进行化学蚀刻、化学抛光等加工,则不仅精度高,还可避免产生加工缺陷,同时,加工不受器件表面形状限制、加工效率较高,对改善石英玻璃元器件质量、拓展应用领域具有重要意义。
对于硅酸盐玻璃与HF酸的反应过程,已有很多研究[1-8],目前为止,没有一套完整而统一的理论,但大多数研究者一致认为反应至少分为两步进行:第一步在SiO2表面形成硅烷醇(Si-OH)结构,第二步是HF与硅烷醇结构反应。
首先,由于HF酸溶液中H+的作用,石英玻璃表面上形成一定浓度的 SiOH2+和 SiOH。随后,HF 酸中的活性成分(HF)2或 2HF2-吸附于石英玻璃表面,对Si原子产生亲核性侵蚀,导致紧临的Si-O键中电子云偏移、键的极性提高,Si-O键强度减弱而易于断裂。反应过程可用下式表达:
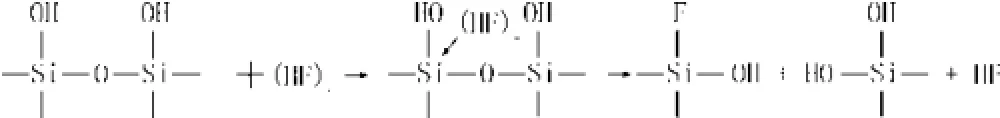
同时,玻璃表面上吸附的H+对O原子的亲电性侵蚀能进一步削弱 Si-O 键键强,对反应起催化作用。此过程可表示如下:
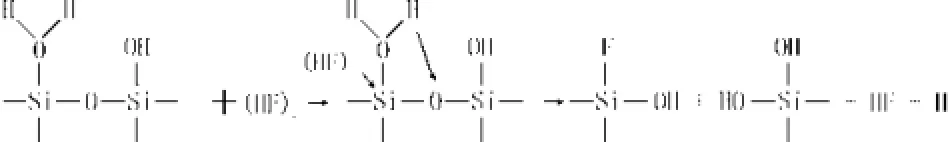
反应过程中,这种催化反应与非催化反应是同时存在的[5]。由于这一过程中Si-O键键强很大, Si-O键的断裂成为反应中最慢的一步,即是反应速率的决定性步骤。一旦Si-F键形成,由于其强烈的极化作用导致紧临的Si-O键键强大为减弱,将使下一步反应速率大大加快,最终,反应形成SiF4并从石英玻璃表面脱离,SiF4在HF酸溶液中强烈水解生成氟硅酸H2SiF6和硅酸H2SiO3。
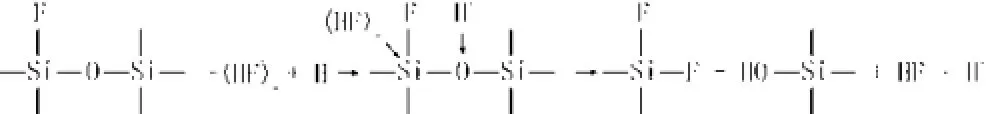
腐蚀的总的反应方程式可以表示如下:
6HF + SiO2= H2SiF6+ 3H2O
为精确控制石英玻璃在HF酸中的化学反应,在一定条件下掌握蚀刻的深度,系统研究了主要因素对整个过程的影响关系及化学反应动力学方程与表观活化能,并结合power law幂率模型[9,10]的基本原理建立了玻璃浅层蚀刻模型。最后用实验数据对模型进行验证。
1 实验部分
1.1 正交试验寻找重要影响因素
采用规格为76 cm×26 cm×1 cm的载玻片,优级纯HF酸和去离子水配制不同浓度的酸液,用聚四氟乙烯容器盛放,将载玻片浸泡于过量酸液中。采用水浴恒温箱精确控制酸液温度。反应结束时立即取出样品,用去离子水充分清洗,再烘干至恒重。石英玻璃在HF酸中的反应速率r 以反应前后质量损失计算。采用分析天平测量样品质量m。已知玻片密度ρ,腐蚀面积A。现提出反应的动力学方程:
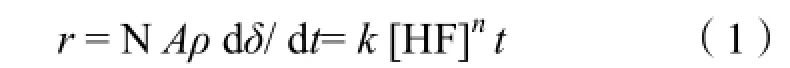
见图1左侧图,为蚀刻工艺的示意图,为避免反应过程中样品表面积的变化对反应速率的影响,将玻璃片侧面和底面用PVC薄膜密封,仅留其上表面裸露部分参与反应(总反应面积基本恒定)。图1右侧图为蚀刻工艺品计算机模拟图。

图1 蚀刻工艺示意图和模拟图Fig.1 The etching process diagram and simulation diagram.
为找出影响蚀刻过程的重要因素,我们采用正交试验设计法。设计因素-水平表见表1。
采用L16(45)正交表,试验结果见表2。
用k值分析法分析实验结果:通过计算得知A的极差为28.43,B为53.06,C为27.00,D为21.60,E为21.59。所以,B(蚀刻的浓度c),A(反应温度 T),C(蚀刻的时间 t)为重要因素,应该重点考察,而:D(玻璃的形状), E(冰乙酸的添加量)为次要因素,可以忽略。
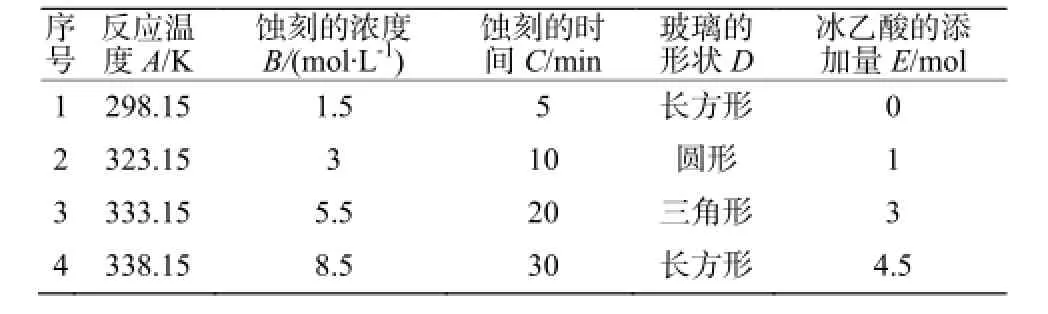
表1 因素-水平表Table 1 Factor- level table
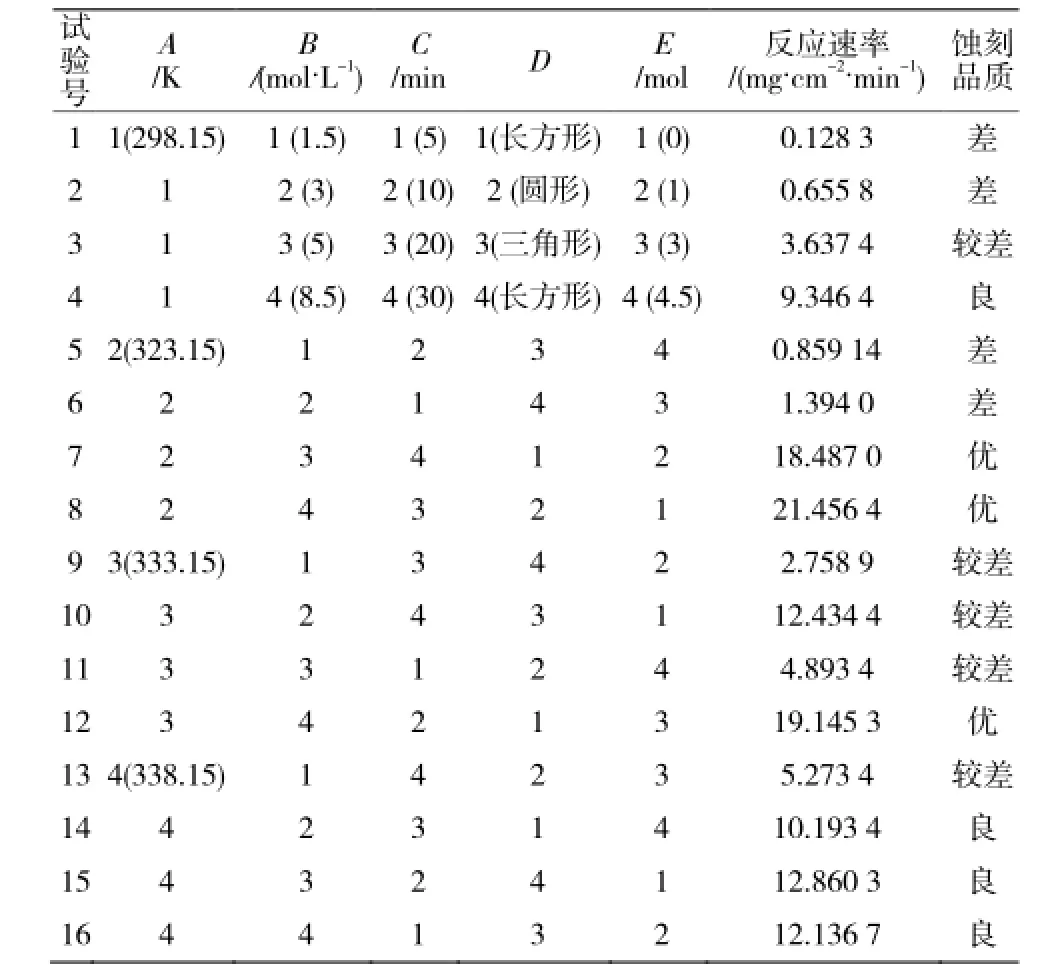
表2 L16(45)正交试验表Table 2 The orthogonal tests results
1.2 各影响因素与蚀刻模型的关系探究
1.2.1 蚀刻深度与时间的关系
取一块长方形载玻片,在室温(25 ℃)下,初始浓度8.5 mol/L的HF酸中浸蚀不同时间。实验中所选的时间段为0~120 min,前30 min每5 min测定一次质量损耗,后30 min每10 min测定一次玻璃片的质量损耗,分析蚀刻深度δ与反应时间t的关系。见图2,为蚀刻深度δ与反应时间t的关系曲线。
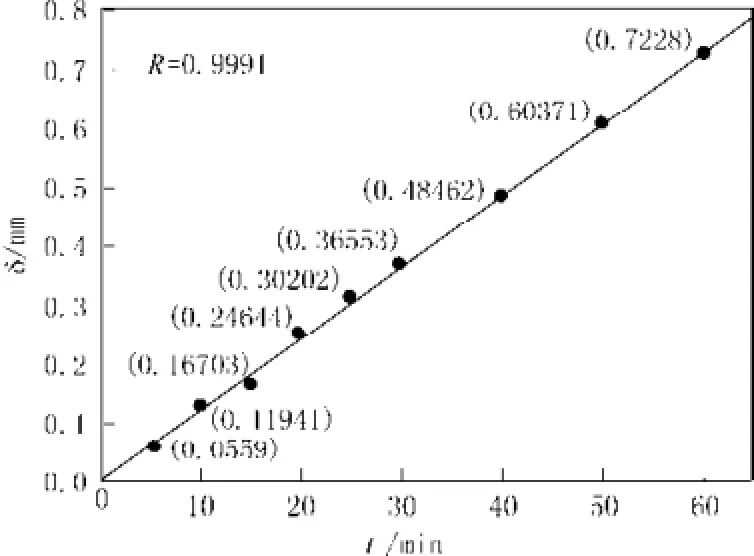
图2 蚀刻深度δ与反应时间t的关系曲线Fig. 2 The relationship curve of etching depth δ and the reaction time t.
从图中可见,1 h内δ与时间t成较好的线性关系,线性相关系数非常高,R=0.999 1。
1.2.2 蚀刻深度与浓度关系的研究
为了将蚀刻深度与浓度的关系引入最终的数学模型,需要对反应的级数进行测定。
室温(25℃)下,在不同浓度的HF酸中浸蚀10 min,分析反应速率与HF酸浓度的关系。对公式(1)两边取对数得:
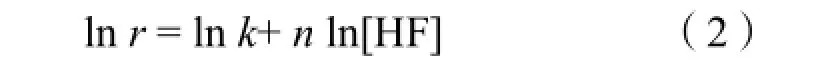
以ln r 对ln [HF]作图,斜率即反应级数n。图3为ln r 与ln [HF]关系图像。
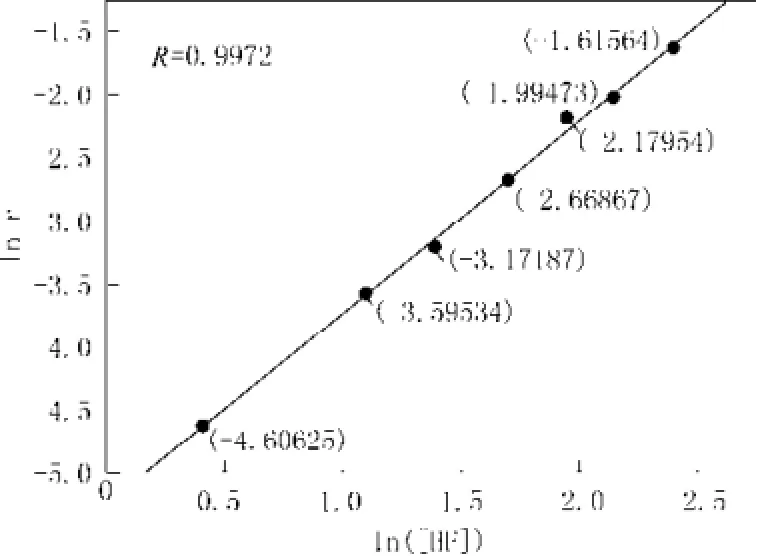
图3 1n r与In[HF] 的关系图Fig.3 The relationship diagram between lnr and ln[HF]
通过拟合得到:δ=1.5164 ln[HF]-5.2381,线性相关系数R =0.9972。因此,反应级数取n =1.5。
1.2.3 活蚀刻深度与温度的关系
为了深入研究蚀刻深度与温度的关系,我们首先需要测定反应的活化能。不同温度下,石英玻璃在5.5 mol/L的HF酸中浸蚀10 min。根据所测数据计算反应的活化能。
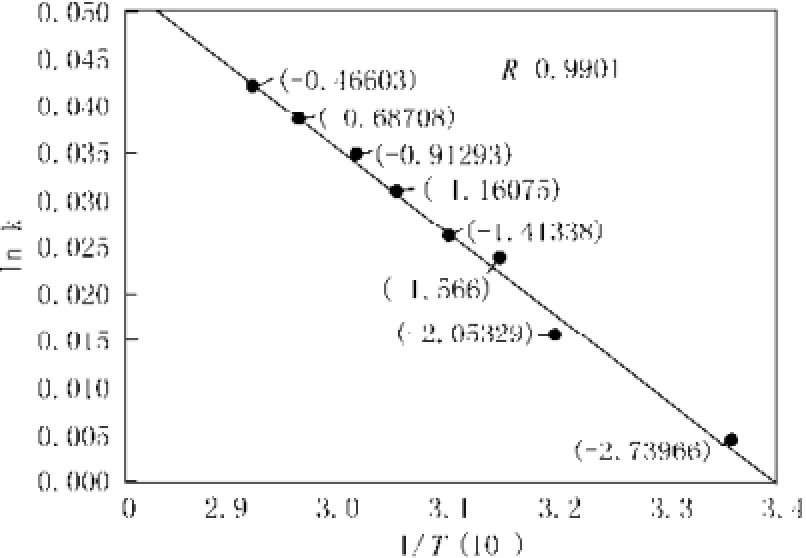
图4 1n k与1/T的关系图Fig.4 The relationship diagram between 1n k and 1/T
由阿伦尼乌斯方程:

两边取对数整理成:
以1n k对1/T作图,即可求得活化能Ea。见图4,为1n k与1/T的关系图像。
曲线拟合得到: 1n k=-5.385×103×1/T+2.73,进而求得Ea=44.77 kJ/mol。通过查阅相应文献[11]可知,HF酸与石英类玻璃反应的表观活化能为36.18 kJ/mol,即探究值与理论值相近。
1.2.4 小结
探究得知,当温度和HF酸浓度一定时,腐蚀的深度与反应时间成正比,线性相关度较高(R=0.999 1);当温度和时间一定时,腐蚀深度的自然对数与 HF酸浓度的自然对数成正比(R=0.9972),由实验数据拟合得到反应级数为1.5;当时间和HF酸浓度一定时,由实验数据求出反应的活化能Ea=44.77 kJ/mol,与文献值相近。以上三组关系的确定对建立腐蚀深度的数学模型有着重要作用。
2 这蚀刻模型
2.1 power law 幂率模型介绍
Power-law模型是由Monk提出的,它是解决牺牲层腐蚀模拟的有一个比较好的模型[12,13]。由化学反应动力学方程得:
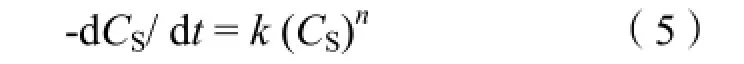
其中 n和 k分别为反应阶常数和反应速率常数,它们都可以由实验拟合得到。
然而测量腐蚀溶液随时间的变化比较困难,因此Power-law模型以蚀刻深度随时间的变化表示反应速率。所以上式可以变为下式:
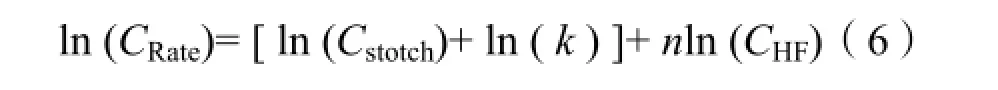
其中 Cstotch为转换因子,将以浓度表示的反应速率转化为由蚀刻深度表示的反应速率。进一步转化(6)式得到:
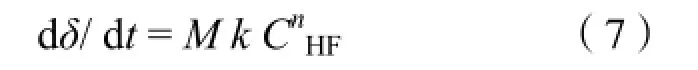
δ表示蚀刻深度。
对(7)式不定积分得:
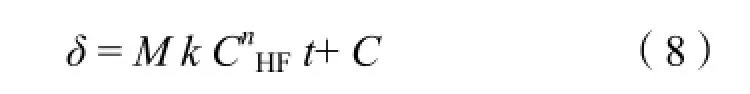
当CHF为0时,δ= 0,所以C = 0,得:

由上式可知,power-law模型从数学形式上与化学反应的动力学方程相近,但它没有体现温度这个重要因素的影响。下面,结合我们实验本身,对这一模型做出修正,得到适合玻璃浅层蚀刻的数学模型。
2.2 蚀刻模型的建立
由第一部分实验内容可知,
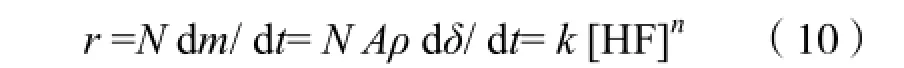
根据阿伦尼乌斯方程:

k为表观反应速率常数,Ea为表观反应活化能,T为进行反应时的温度。
将(11)式代入(10)式,得:
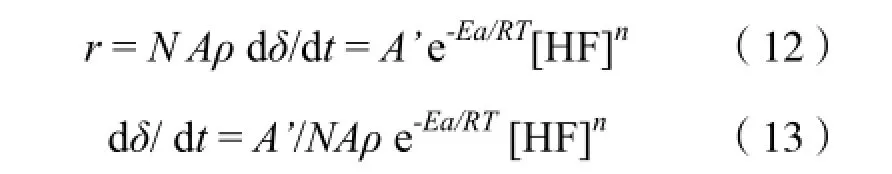
令M = A’/NAρ,得:
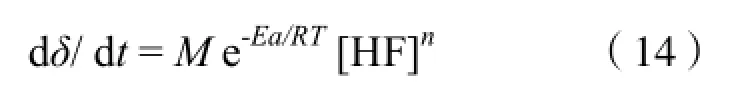
由于M[HF]n为常数,对上式不定积分得:
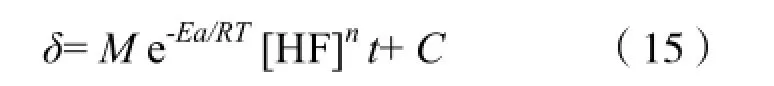
当HF酸浓度为0 mol/L的时候,δ必然为零,所以C值为0,故得:
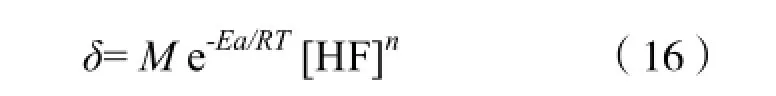
其中M为常数,也是(16)的系数,可以对已知的实验数据进行拟合来得到。由于对相应的[HF],t,T,只有M是未知量,所以选择多项式拟合,通过数学软件MATLAB中提供的polyfit()函数实现。最终我们得到M的值为0.3078,模拟值和实验数据的误差为3.06%,较小,于是,得到了最终的腐蚀模型表达式:
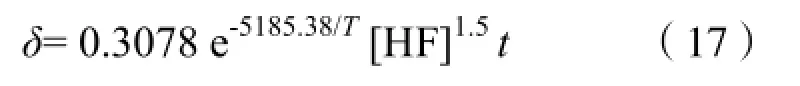
2.3 模型的验证
为验证腐蚀模型(17)的准确度,选取两个温度值10和20 ℃,分别测得两组数据用来验证。见图5,为283.15 K下,不同浓度HF酸体系中,腐蚀的模拟曲线与实验数据的对比,见图6,为293.15 K下,不同浓度HF酸体系中,腐蚀的模拟曲线与实验数据的对比。
通过模拟曲线和实验数据的对比,模拟值和实验数据的误差基本维持在5% 以内。误差除了模型自身不够完善的原因外,主要是由于实验拟合常数k和n等有一定的误差,另外数值求解过程中也会带来误差。
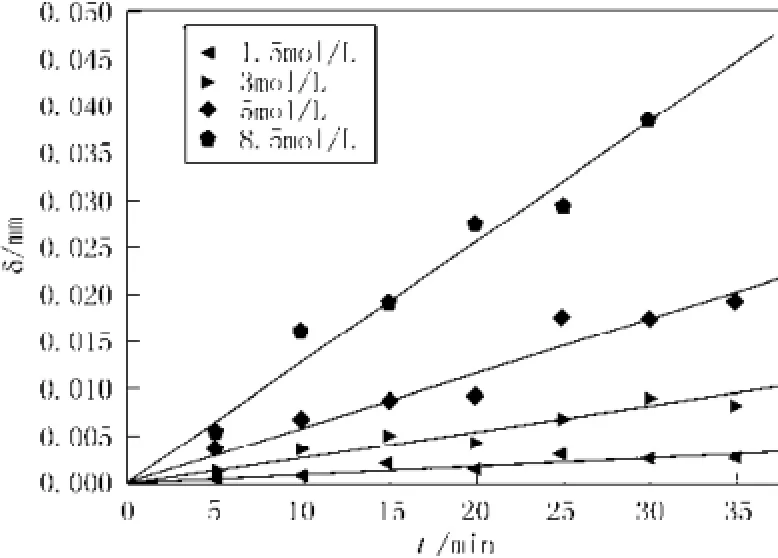
图5 10 ℃下,不同浓度HF酸体系中,腐蚀的模拟曲线与实验数据的对比Fig.5 At 10 ℃, in different concentrations of HF acid system, comparison of the simulation curves and the experimental data
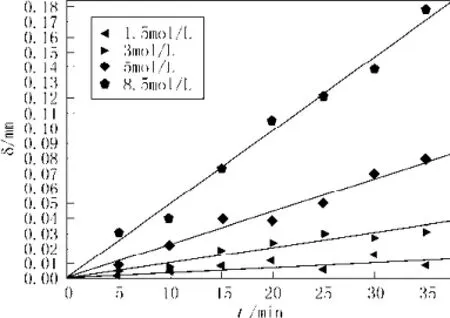
图6 20 ℃下,不同浓度HF酸体系中,腐蚀的模拟曲线与实验数据的对比Fig.6 At 20 ℃, in different concentrations of HF acid system, comparison of the simulation curves and the experimental data
3 结 论
本文重点讨论了影响玻璃浅层蚀刻过程的重要因素,即HF酸溶液的浓度c、反应的温度T和反应的时间t。结合power law幂率模型的原理,建立了适用于石英玻璃浅层蚀刻的数学模型δ= 0.307 8 e-5185.38/T[HF]1.5t。最后,分别选取了10,20 ℃温度下,4种不同浓度的HF酸体系,通过模拟曲线和实验数据的对比,得知误差基本维持在5%以内。
总体说来,实验室条件下,玻璃浅层蚀刻模型是一个可以在比较宽的浓度范围内对玻璃腐蚀进行比较准确模拟的模型。实验中我们也得到了质地比较好的蚀刻工艺品,今后可以在建立二维模型上多做研究,从而使得玻璃的化学蚀刻模型具有普遍的适用性。
[1] Spierings G. A. C. M., Dijk J. van. The dissolution of Na2O /MgO/ CaO /SiO2glass in aqueous HF [J]. J. Mater. Sci, 1987, 22∶ 1869-1874.
[2] Verhaverbeke S, Teerlinck I, Vinckier C, et al. The etching mechanism of SiO2in hydrofluoric acid [J]. J. Electrochem Soc, 1994, 141(10)∶2852-2857.
[3] Spierings G. A. C. M. Wet chemical etching of silicate glasses in hydrofluoric acid based solutions[J]. J Mater Sci, 1993, 28∶6261-6273.
[4] Monk D. J., Soane D. S. A review of the chemical reaction mechanism and kinetics for gydrofluoric acid etching of silicon dioxide for surface micromaching applications [J]. Thin Slid Films, 1993, 232∶1-12.
[5] Kline W. E., Fogler H. S. Dissolution kinetics∶ catalysis by strong acids [J]. J Colloid Interface Sci, 1981, 82(1)∶ 93-102.
[6] Prokopowiczprigoginem. Reactivity of a silica network of glass [J]. Glastech Ber, 1989, 62∶249-255.
[7] Judge J. S. A study of the dissolution of SiO2in acidic fluoride solutions [J]. J Electrochem Soc, 1971, 118∶ 1772-1779.
[8] Dnotter D. M. Etching mechanism of vitreous silicon dioxide in HF Based solutions [J]. J Am Chem Soc, 2000, 122∶ 4345-4351.
[9] Ron Hanestad, Jeffery W. Butterbaugh.Stiction-Free Release Etch with Anhydrous HF/Water Vapor Processes [C]. Proc. SPIE, 2001, 4557∶58-68
[10]Witvrouw A. B, Du Bois P, De Moor, et al. A comparison between wet HF etching and vapor HF etching for sacrificial oxide removal [J]. Proc. SPIE, 2000, 4174∶130-141.
[11] 苏英, 周永恒, 黄武, 等. 石英玻璃与 HF酸反应动力学的研究[J]. 硅酸盐学报, 北京∶中国建筑材料科学研究院, 2004,32 (3)∶287-293.
[12] Monk D. J,Soane D. S,Howe R T.Hydroflouric Acid Etching of Silicon Dioxidc Sacrificial Layer.I.Experimental Observations [J]. Journal of the Elcetrochemical Society, 1994, 141:246-249.
[13]Monk D. J.Hydroflouric Acid Etching of Silicon Dioxide Sacrificial Layers II Modeling [J]. Journal of the Electrochemical Society, 1994, 141 (1)∶ 270-273.
Study on Superficial Chemical Etching Model for the Hydroflouric Acid/Silicon Dioxide System
QIN Jing1, PANG Dong2, YUAN Kun1, LI Chun-fang1, LIU Tong1
(1. Beijing Industrial Technician College, Beijing 100023, China; 2. China Huanqiu Contracting & Engineering Corporation, Beijing 100012, China)
In order to control the reaction of HF/SiO2system and realize an accurate fabrication of precise element and glass handiwork, the chemical reaction mechanism and kinetics were discussed. The major factors to affect the etching process were investigated, such as concentration of HF, temperature and time. Combined with power law model, a superficial chemical etching model was established to describe the etching technology. Then the model was verified at 10 ℃and 20 ℃ with four different concentrations of HF. Analog curve plotted by the mathematical model was compared with experimental data. The results show that the range of error is within 5%. So the superficial chemical etching model has the ability to carry out an accuracy simulation.
HF; SiO2; Superficial etching; Mathematical model
TQ 028
A
1671-0460(2015)09-2120-04
2015-08-12
秦静(1983-),女,山东日照人,博士,2015年毕业于北京化工大学化学工程与技术专业,研究方向:无机化学。E-mail:qinjing1234@sohu.com。
