不稳定型心绞痛患者血管内皮功能与血尿酸水平的相关性研究
2015-01-19刘燕梁金锐吴永全
刘燕,梁金锐,吴永全
· 论著 ·
不稳定型心绞痛患者血管内皮功能与血尿酸水平的相关性研究
刘燕,梁金锐,吴永全
目的通过对不稳定型心绞痛(UAP)患者内皮功能及血尿酸(UA)的检测,探讨血管内皮功能与血尿酸之间的关系。方法对202例临床确诊为不稳定型心绞痛的患者,利用Endo-PAT 2000仪器采用外周动脉张力测定(PAT)技术评价血管内皮细胞功能,并计算血管反应性充血指数(RHI)。空腹抽取静脉血测定血尿酸水平,根据血尿酸水平将入选患者分为高尿酸血症组及尿酸正常组。结果高尿酸血症组男性性别比例高于尿酸正常组(73.17% vs. 56.67%,P=0.018),尿酸正常组及高尿酸血症组间RHI值无统计学差异(Z=-0.811,P=0.417),血尿酸与RHI值无直线性相关关系(r=-0.097,P=0.169)。结论血尿酸指标不能作为不稳定型心绞痛患者血管内皮功能受损的早期预测指标。
不稳定型心绞痛;外周动脉张力测定;血管内皮细胞功能;血尿酸;血管反应性充血指数
随着人口老龄化及人们生活方式的不断改变,不稳定型心绞痛的发病率和死亡在率逐年增加,严重影响着当代人们的生活质量[1]。
血管内皮细胞功能障碍(ED)是冠状动脉粥样硬化性心脏病的始动因素[2],贯穿于心血管系统疾病的整个过程,导致血管弹性异常,使内皮细胞失去正常的生理功能[3-5],进而引发不稳定型心绞痛等心血管事件。因此寻找血管内皮功能障碍的检测指标和对其危险因素的识别是近年来研究的热点,希望通过有效的、实用的方法来判断血管内皮细胞功能障碍,以便早期预测冠状动脉粥样硬化的发生,减少心血管事件[5]。
目前有多种方法检测血管内皮功能障碍,其中外周动脉张力测定(PAT)技术检测血管内皮细胞功能的原理是基于反应性充血时内皮细胞所介导的血管舒张反应[7],其敏感性高、以自身为对照、且不依赖超声科专门技师,故更具临床优点,是目前新兴的技术,是无创评价血管内皮功能的新方法,临床中逐渐被认识和使用。
尿酸是体内嘌呤代谢的产物,血尿酸浓度过高会对血管内皮造成损伤,导致血管内皮功能障碍,其机制有尿酸对血管壁直接刺激、尿酸介导的氧化应激、尿酸介导的血管炎性反应等;高尿酸血症可导致血管内皮功能障碍,引起一系列心血管系统疾病,尤其是不稳定型心绞痛患者中的高发[8-12]。
本研究的目的在于通过PAT技术检测血管内皮功能,检测不稳定型心绞痛(UAP)患者血尿酸(UA)水平;通过探讨血尿酸与血管内皮功能关系,了解高尿酸血症是否为不稳定型心绞痛患者中血管内皮功能受损的早期检测指标。
1 研究对象与方法
1.1 研究对象研究对象选取2011年9月至2013年6月在北京友谊医院心脏中心收治的临床确诊为不稳定型心绞痛的患者。
1.2 纳入与排除标准根据2007ACC/AHA不稳定型心绞痛和非ST段抬高心肌梗死诊断与治疗指南,明确诊断为不稳定型心绞痛的患者;年龄介于18~80岁;同意入选该试验。排除标准:年龄<18岁或年龄>80岁;急性心力衰竭;严重肝肾功能不全;感染性疾病;恶性肿瘤;风湿免疫性疾病活动期;意识或精神障碍;制动困难;手指畸形;雷诺现象;正在服用降尿酸药物;使用噻嗪类利尿剂者;不同意进行试验者。
1.3 资料采集
1.3.1 病史资料2011年9月至2013年6月入选205例符合不稳定型心绞痛诊断标准的患者,采集所有入选患者的病史资料,包括性别、年龄、身高、体重、基础心率、收缩压(SBP)、舒张压(DBP)、吸烟史、既往史、家族史,其中冠心病家族史指一级亲属中有早发冠心病史(男性<50岁,女性<55岁);体质指数(BMI)=体重/身高2(kg/m2)。
1.3.2 血清学指标所有患者清晨空腹抽取肘动脉血,检测总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG)、空腹血糖(FBG)、糖化血红蛋白HbA1C、高敏C反应蛋白(hs-CRP)等指标。
1.3.3 辅助检查采集患者心电图、超声心动图,记录左房内径、左室舒张期左室内径(LVEDD)、左心室射血分数(LVEF),根据E/A比值了解患者心脏舒张功能。
1.3.4冠脉造影检查结果,记录冠脉病变数量,植入支架血管。
1.4 内皮依赖性血管舒张功能测定所有患者入院72 h内利用Endo-PAT 2000仪器测定内皮细胞依赖性血管舒张功能,利用专用计算机软件计算血管反应性充血指数(RHI),以反映血管内皮细胞的功能。
具体测定方法如下:受试对象休息30 min,双侧上肢放松伸直置于躯干两侧,选择非惯用侧上臂佩戴可充气袖带作为测试上肢,另一侧上肢作为对照。双手食指各佩戴一指套状带有传感器及充气装置的探针,嘱患者勿使用其他手指触碰食指,以免影响测试信号。使用配套计算机软件下达指令,Endo-PAT 2000通过管道为探针指套充气,使其压力均匀地包裹于食指指端,而探针内传感器将指端动脉血管床血流信号通过Endo-PAT 2000输入计算机软件。在计算机显示指端血管床血流信号稳定后即正式开始血管内皮细胞功能测定,测试过程分为三个阶段,共15 min。第一阶段:记录双侧食指指端血管床血流作为基底信号,5 min。第二阶段:在第一阶段的基础上立即对袖带快速充气使压力维持200 mmHg(1mmHg=0.133kPa)以上,此时计算机软件显示测试上臂指端血流信号消失,而对照侧上臂指端血流信号未消失,此阶段记录5 min。第三阶段:立即快速将袖带放气使压力归零,此时可见被阻断的指端血流信号恢复,5 min后测试结束。计算血管反应性充血指数RHI。以上测试过程要求停止应用硝酸酯类药物、ACEI、CCB类药物已达12 h以上。
1.5 血尿酸水平测定入院第2 d清晨采集空腹静脉血3 ml,分离血清。用比色法测定尿酸浓度(测定仪器为日立公司Hitachi7600全自动生物化学分析仪)。
1.6 分组方法根据血尿酸水平,将纳入的不稳定型心绞痛分为两组,血尿酸416≥ μmol/L者为高尿酸血症组,血尿酸<416 μmol/L为尿酸正常组。
1.7 统计学分析对纳入本研究的变量根据变量类型选择不同的统计分析方法。定量变量首先进行正态分布检验,正态分布计量资料描述用均数±标准差表示,组间比较采用独立样本t检验;非正态分布计量资料采用中位数、四分位数间距表示,组间比较采用秩和检验;计数资料组间比较采用卡方检验;多组间两两比较,方差齐时采用方差分析,方差不齐时采用秩和检验;采用Spearman相关分析评价血尿酸水平与血管内皮功能的相关性。所有统计分析均应用SPSS13.0软件包进行分析,P<0.05为差异具有统计学意义。
2 研究结果
205例不稳定型心绞痛患者进行采样,其中2例因Endo-PAT信号合格率<85%被剔除,1例因不能配合检测被除外。进入统计样本量n=202,本研究中高尿酸血症组82例,尿酸正常组120例。
2.1 组间基本资料对比
2.1.1 病史资料组间对比两组年龄、BMI、基础心率、SBP、DBP均呈正态分布,组间病史资料对比无统计学差异(P>0.05);两组性别有统计学差异,高尿酸血症组男性性别比例大于尿酸正常组(P<0.05)(表1)。
2.1.2 生化指标组间对比两组患者间TC、LDL-C、TG、FBG、HbA1C、hs-CRP等对比无统计学差异(P<0.05)(表2)。
2.1.3 超声心动图与冠状动脉造影结果组间资料对比两组患者间LVEDD有统计学差异(P=0.001),高尿酸血症组LVEDD大于尿酸正常组左室EDD。两组间左房内径、左心室射血分数、E/A比值对比及两组间冠状动脉病变支数均无统计学差异(P>0.05)(表3)。
2.2 应用PAT检测血管内皮功能图示(图1):
结合图1,通过测试上肢及对照上肢三个测试阶段所得的波形计算RHI值,通过自身对照排除自身因素对检测结果可能造成的干扰。本研究中RHI值由计算机软件计算得出。
2.3 尿酸正常组与高尿酸血症组与RHI的关系:

表1 尿酸正常组与高尿酸血症组患者组间病史资料对比
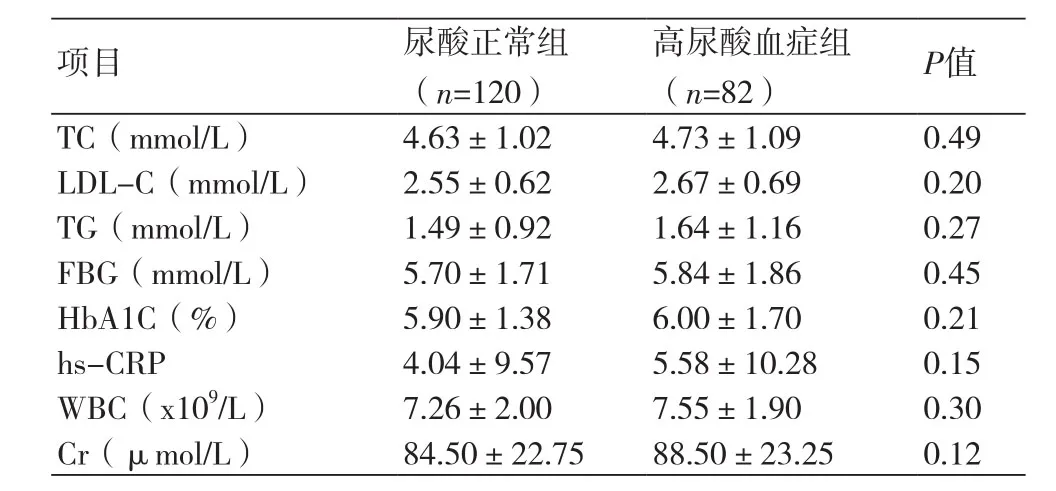
表2 尿酸正常组与高尿酸血症组患者组间血清学指标资料对比
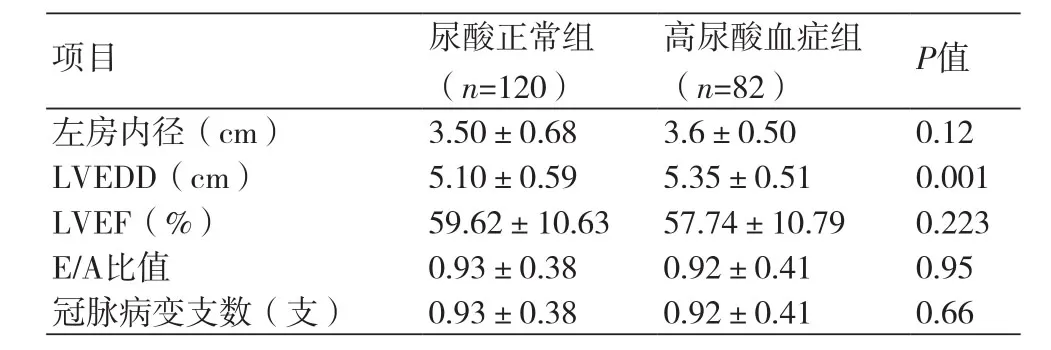
表3 尿酸正常组与高尿酸血症组患者组间辅助检查指标资料对比

图1 PAT检测血管内皮功能:高反应(左)及低反应(右)图示RHI值的计算:RHI= [Xh(phase 3)/Xh(phase 1)]/[Xc(phase 3)/Xc(phase 1)](X, pulse amplitude; h, hyperaemia finger; c, control finger. )
尿酸正常组RHI 1.57±0.35,高尿酸治疗组RHI 1.54±0.41,对两组RHI进行秩和检验,Z=-0.811,P=0.417,P>0.05,故认为尿酸正常组及高尿酸血症组两组间RHI值无统计学差异。
2.4 血尿酸水平与RHI值间的相关性研究首先绘制散点图,观察血尿酸水平与RHI间有无直线相关性(图2):上图提示,在散点图上血尿酸指标与RHI值间无直线线性相关关系,进一步进行统计学假设检验可得:相关系数r=-0.097,P=0.169,两者之间无直线相关关系。

图2 不稳定心绞痛患者中血尿酸水平与RHI值的相关性
3 讨论
内皮细胞是人体血管壁的第一道屏障,有重要的生理作用,包括血管收缩、舒张及内皮细胞的分泌功能。在内皮细胞中,很重要的一方面为舒张血管的作用,其通过内源性一氧化氮调节血管的舒张功能。内源性一氧化氮的减少,无论是生成减少还是生物利用度下降,均可导致动脉粥样硬化病变,其机制主要包括:提高炎症因子的表达;促进单核细胞粘附并向内皮下迁移、形成泡沫细胞,促进血管平滑肌增生;促进血小板聚集等[13-16] 。
内皮功能障碍是冠状动脉粥样硬化发生的重要的始动因子[17,18]。造成内皮功能障碍的因素很多,以往有证据表明,高尿酸血症在血管内皮功能受损的病理进程中发挥了重要作用[19]。
尿酸是体内嘌呤代谢的终产物,在过去几十年内,人们一直认为尿酸的抗氧化作用使其有抗衰老、抵抗氧化应激及抵抗氧化应激性细胞损伤的作用。但近期流行病学及更多的临床证据表明,高尿酸血症可能是心血管系统疾病的危险因素[20],其可通过多种途径导致心血管疾病的发生,很重要的一个因素是内皮细胞功能障碍。尿酸盐结晶可直接损伤血管壁,高尿酸血症导致的氧化应激也可导致血管内皮细胞功能障碍。表明,高尿酸血症导致血管内皮细胞功能障碍,从而进一步导致心血管疾病的发生及发展。有动物实验证实,尿酸可导致一氧化氮的生成减少,从而导致内皮依赖性血管舒张功能受损,即使没有心血管疾病,也可观察到上述现象[21]。故对于高尿酸血症的研究越来越多,在临床上也逐渐受到更多重视。
不稳定型心绞痛是急性冠脉综合征的主要表现形式,其主要病理生理机制是不稳定的冠状动脉粥样斑块破裂、继发急性血栓形成,从而导致冠状动脉血流中断。目前虽已有包括他汀的调脂治疗和冠状动脉内置入支架、冠状动脉搭桥等很多成熟的诊疗手段,但其发病率仍居高不下。因此,对不稳定型心绞痛危险因素的控制及对疾病的早期检测和发现也就显得尤为重要。有临床实验证实,测定内皮细胞功能可能有助于从临床上识别“不稳定”的ACS患者[22],故对内皮功能障碍的早期检测极为需要。
血管内皮细胞的检测有多种方法,目前公认的金标准方法为向冠状动脉左前降支中段注射不同浓度(分别为10~6 mol/L,10~5 mol/L,10~4 mol/L)的乙酰胆碱,在冠状动脉造影下测量冠状动脉血流(CBF)和管径[%ΔCAD(Ach)]的变化,根据上述数值判断内皮细胞依赖性舒张功能。对冠状动脉内皮功能的分级如下:内皮功能正常为percent change in CBF>50%或%ΔCAD(Ach)>20%,轻微内皮功能障碍为percent change in CBF在0%至50%或%ΔCAD(Ach)在-20%至20%,严重内皮功能障碍为percent change in CBF<0%或%ΔCAD(Ach)<-20%为严重内皮功能障碍[23]。此项检查方法需在造影条件下通过导管观测,操作过程复杂,操作本身也会对内皮功能产生一定影响,而且向冠状动脉内注射药物的过程可能导致冠状动脉供血不足,检查风险大大增加。在临床上,这种有创检查方法最大的限制是无法在症状出现前对内皮功能进行检测,即无法起到早期检测的作用,故在临床上的应用受到很大限制。所以,无创检查方法在临床上广泛应用。无创检查方法中敏感性和特异性都很高的可采用PET技术和MRI技术,但这两项检查的成本高,所以逐渐出现了无创外周血管检测方法,其代表为通过高分辨力超声测定肱动脉内皮依赖性舒张功能[24],这种方法由Celermajer于1992年首创[25],并逐渐成为对外周动脉内皮功能无创评价的常用研究方法。但此项检查需要专门的超声科技师,且整个检测过程都十分依赖操作者,故其在临床上的应用也受到一定限制,故新出现的无创评价血管内皮功能的技术逐渐被广泛应用,即外周动脉张力测定(PAT)技术。PAT技术的检测原理与高分辨力超声测定肱动脉内皮依赖性舒张功能的原理相似,但更具临床应用的优势。其原理是通过测定血管内皮细胞介导的血管张力的变化,反映血管内皮细胞功能状态,上述张力变化是通过肱动脉阻断法引起的动脉反应性充血实现的,而对侧上肢血管张力的变化作为同步对照排除非内皮细胞依赖性血管张力变化对实验过程造成的干扰,利用相关的计算机软件计算反应性充血指数,从而判断内皮功能[7]。PAT技术操作方便,不需专门超声科技师,且通过自身对照校正检测过程中其他因素,故应用广泛。
作为较新出现的一门技术,目前已有多项利用PAT技术与传统技术进行比较的研究。有研究证实PAT技术所测得的血管内皮依赖性舒张功能由一氧化氮介导[26],更有研究将PAT技术测得的血管内皮功能与金标准进行比较,PAT技术的敏感度 82%,特异度 77%[8]。
本研究首次运用PAT技术对不稳定型心绞痛患者血尿酸水平与血管内皮功能的关系进行了临床研究,研究所纳入不稳定型心绞痛患者中,高尿酸血症组男性性别比例大于尿酸正常组,与既往研究结论相符[27];高尿酸血症组LVEDD大于尿酸正常组LVEDD并有统计学意义,但LVEDD的差异原因本研究并未涉及,高尿酸血症通过什么机制导致左心室扩大需进一步探讨。
本研究显示尿酸正常组与高尿酸血症组血管内皮功能无统计学差异,血尿酸水平与血管内皮功能之间无线性相关,本研究结果与已发表研究得出的结论即高尿酸血症患者内皮功能下降[27]的结论不相一致,分析产生此结果的原因,可能涉及以下几方面:①样本量不足;②样本是否具有代表性:根据临床分期,高尿酸血症和痛风的患者可分为无症状性高尿酸血症期、急性痛风发作期、发作间期及痛风进展期[28]。此研究纳入的患者均为无症状性高尿酸血症患者,是否需纳入高尿酸血症导致痛风发作的患者,需进一步研究;③高尿酸血症时间的长短对研究的影响:此次入选患者中,均为入院后初次采集尿酸水平数据,既往尿酸水平情况不详,此项研究结果为阴性的原因,不除外因为高尿酸血症持续时间短,在未对内皮功能造成损伤的情况下进行了内皮功能的检测导致;④其他代表内皮依赖性舒张功能的血清标记物没有纳入研究范围,有研究证实,高尿酸血症患者中内皮功能障碍是尿酸通过影响血清一氧化氮及内皮素-1水平,从而影响内皮依赖性血管舒张功能[29]。此项研究中只有根据测试计算出的RHI值反应血管内皮依赖性舒张功能,应纳入上述相应的血清学指标,检验所的结论与血清学指标是否是平行关系,所得结果更具说服力;⑤PAT技术的相对有限性:临床研究中,任何检查手段或测试措施与金标准相比都是有一定局限性的,换而言之,PAT技术所测得的血管内皮依赖性功能的结果不能代替金标准,故考虑本研究所得的阴性结果与此有一定关系;⑥药物影响:所纳入不稳定型心绞痛患者,需进行冠心病二级预防药物治疗,控制冠心病的危险因素及影响预后的各项因素,受试患者在接受测试前均已停用血管活性药物达12 h以上,但未控制12 h外的用药情况,不除外此项因素可以影响测试结果。但有研究证实临床上在测定血管内皮功能之前应用血管活性药物与否不会造成对结果显著的影响[30],可选部分患者在应用血管活性药物前后分别测定血管内皮依赖性舒张功能,以除外此项干扰因素。
因此,血尿酸指标不能作为不稳定型心绞痛患者血管内皮功能受损的早期预测指标。
[1] Murray CJ,Lopez AD. Alternative projections of mortality and disability by cause 1990-2020: Global Burden of Disease Study[J]. Lancet, 1997,349(9064):1498-504.
[2] Heitzer T,Schlinzig T,Krohn K,et al. Endothelial dysfunction, oxidative stress, and risk of cardiovascular events in patients with coronary artery disease[J]. Circulation,2001,104:2673-8.
[3] Jeffrey T,Kuvin A,Ayan R,et al. Assessment of peripheral vascular endothelial function with finger arterial pulse wave amplitude[J]. American Heart Journal,2003,146(1):168-74.
[4] Celermajer D. Endothelial function: does it matter? Is it reversible[J]?J Am Coll Cardiol ,1997,30:325-33.
[5] Vane J,Anggard E,Botting R. Regulatory function of the vascular endothelium[J]. N Engl J Med,1990,323:27-36.
[6] Scott K, Peter Ganz. Am J Cardiol,2000,86(suppl):10J-14J.
[7] Naomi M. Hamburg, Emelia J. Benjamin. Assessment of Endothelial Function Using Digital Pulse Amplitude Tonometry. Trends Cardiovasc Med,2009,19:6-11.
[8] Piero O. B,Geralyn M. P,Stuart T. H,et al. Noninvasive identification of patients with early coronary atherosclerosis by assessment of digital reactive hyperemia[J]. J Am Coll Cardiol,2004,44:2137-41.
[9] Waring WS,Mc Knight JA,Webb DJ,et al. Uric acid restores endothelial function in patients with type 1 diabetes and regular smokers[J]. Diabetes,2006,55 (11):3127-32 .
[10] 叶瑛,贾楠. 高尿酸血症—心血管事件的独立危险因素. 国际心血管病杂志[J]. 2010,7:229-31.
[11] Leyva F,AnkerSD,GodslandI,et al. Uric acid in chronic heart failure: a marker of chronic inflammation[J]. Eur Heart J,1998,19:1814-22.
[12] Kanellis J,Watanabe S,LI JH,et al. Uric acid stimulates monocyte chemoat tractant pro tein-1 production in vascular smooth muscle cells viamitogen-activated protein kinase and cycloo xygenase-2[J]. Hypertension,2003,41:1287-93.
[13] Cooke JP,Singer AH,Tsao P,et al. Antiatherogenic effects of L-arginine in the hypercholesterolemic rabbit[J]. J Clin Invest,1992,90(3):1168-72.
[14] Furchgott RF,Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine[J]. Nature,1980, 288(5789):373-6.
[15] De Caterina R,Libby P,Peng HB,et al. Nitric oxide decreases cytokineinduced endothelial activation. Nitric oxide selectively reduces endothelial expression of adhesion molecules and proinflammatory cytokines[J]. J Clin Invest, 1995,96(1):60-8.
[16] van der Wal AC,Becker AE,van der Loos CM,et al. Site of intimal rupture or erosion of thrombosed coronary atheroscleroti plaques is characterized by an inflammatory process irrespective of the dominant plaque morphology[J]. Circulation,1994,89:36-44.
[17] Fish RD,Nabel EG,Selwyn AP,et al. Responses of coronary arteries of cardiac transplant patients to acetylcholine[J]. J Clin Invest, 1988,81(1):21-31.
[18] Brown BG,Zhao XQ,Sacco DE,et al. Lipid lowering and plaque regression. New insights into prevention of plaque disruption and clinical events in coronary disease[J]. Circulation, 1993,87(6):1781-91.
[19] Anoop Shankar,Barbara EK,Klein F,et al. Association between serum uric acid level and peripheral arterial disease[J]. Atherosclerosis,2008, 196:749-55.
[20] Giuseppe L,Martina M,Massimo F,et al. The paradoxical relationship between serum uric acid and cardiovascular disease[J]. Clinica Chimica Acta, 2008,392:1-7.
[21] Kato M,Hisatome I,TomikuraY,et al. Status of endothelial dependent vasodilation in patientswith hyperuricemia[J]. AmJ Car-diol,2005, 96(11):1576- 8.
[22] Stephan F,Susanne B,Andreas M,et al. Prognostic Value of Systemic Endothelial Dysfunction in Patients With Acute Coronary Syndromes: Further Evidence for the Existence of the "Vulnerable" Patient[J]. Circulation,2004,110:1926-32.
[23] Jassim AS,Shuichi H,Stuart T,et al. Long-Term Follow-Up of Patients With Mild Coronary Artery Disease and Endothelial Dysfunction[J]. Circulation,2000,101:948-54.
[24] 阮骊韬, 曹铁生, 段云友. 内皮功能的超声检测[J]. 中国医学影像技术,2000,16(8):688.
[25] Celermajer DS,Sorensen KE,Gooch VM,et al. Noninvasive detect ion of endothelial dysfunction in children and adult s at risk of atherosclerosis[J]. Lancet,1992,340(8828):1111-5.
[26] Nohria A,Gerhard-Herman M,Creager MA,et al. Role of nitric oxide in the regulation of digital pulse volume amplitude in humans[J]. J Appl Physiol,2006,101:545-8.
[27] Rubinshtein R,Kuvin JT,Soffler M,et al. Assessment of endothelial function by non-invasive peripheral arterial tonometry predicts late cardiovascular adverse events[J]. Eur Heart J,2010,31:1142-8.
[28] 贺玉泉,李迪,杨萍. 血清尿酸水平与高血压患者血管内皮功能的相关性研究[J]. 中国实验诊断学,2010,8(14):1220-2.
[29] Davide G,Livia F,Giovambattista D,et al. Chronic Hyperuricemia, Uric Acid Deposit and Cardiovascular Risk[J]. Current Pharmaceutical Design,2013,19:2432-8.
[30] 周传,鲁跃华,葛正庆. 高尿酸血症对血清一氧化氮及内皮素水平的影响[J]. 现代临床医学,2011,37:427-8.
Correlation between vascular endothelial function and blood uric acid in patients with unstable angina pectoris
LIU Yan*, LIANG Jin-rui, WU Yong-quan.*Center for Cardiovascular Diseases, Beijing Friendship Hospital of Capital University of Medical Sciences, Beijing 100050, China.
ObjectiveTo discuss the relationship between vascular endothelial function and blood uric acid (BUA) in patients with unstable angina pectoris (UAP).MethodsVascular endothelial function was reviewed and reactive hyperemia index (RHI) was calculated by using peripheral arterial tension (PAT) detection with Endo-PAT 2000 (Itamar Medical Inc., Caesarea, Isarel) in UAP patients (n=202). All patients were divided into high BUA group and normal BUA group according to fast venous BUA level.ResultsThe percentage of male cases was higher in high BUA group than that in normal BUA group (73.17% vs. 56.67%, P=0.018). RHI had no statistical difference (Z=-0.811, P=0.417) between 2 groups, and BUA and RHI had no linear correlation (r=-0.097, P=0.169).ConclusionBUA cannot be taken as early-stage predictive index for injured vascular endothelial function in UAP patients.
Unstable angina pectoris; Peripheral arterial tension; Vascular endothelial function; Blood uric acid; Reactive hyperemia index
R541.4
A
1674-4055(2015)01-0103-05
2014-08-20)
(责任编辑:张灵)
100050 北京,首都医科大学附属北京友谊医院 心血管病诊治中心
梁金锐,E-mail:jr.liang@hotmail.com
10.3969/j.1674-4055.2015.01.32
