运动性心房颤动兔模型的建立
2015-01-19袁斗谭琛姚建民李丹黄思慧徐威
袁斗,谭琛,姚建民,李丹,黄思慧,徐威
· 论著 ·
运动性心房颤动兔模型的建立
袁斗,谭琛,姚建民,李丹,黄思慧,徐威
目的建立由运动诱发的心房颤动(房颤)动物模型并评价其效果。方法24只成年健康新西兰大耳白兔,分为对照组(n=8)、中强度组(n=8)、高强度组(n=8)。对照组不进行任何训练,中强度组和高强度组采用兔实验跑台不同强度运动,每天1 h或一次性力竭(不足1 h),每周5 d,持续12周(第一周为适应性训练)。于运动前、运动后8周、12周通过超声心动图检测各组兔心房大小;运动结束后,24只兔采用离体心脏Langendorff系统进行灌流,行心房早搏程序刺激(S1S2)诱发房颤,记录房颤的诱发率。结果与对照组比较,中强度组和高强度组左、右房前后径在运动训练8周后均增加,12周后也增加,差异有统计学意义(P均<0.05)。与中强度组比较,高强度组左、右房前后径在运动训练8周后均增加,12周后也增加,差异有统计学意义(P均<0.05)。与对照组比较,中强度组(45% vs. 60%)和高强度组(45% vs. 90%)房颤发生率增加,差异有显著统计学意义(P均<0.01)。结论长期高强度的跑台运动训练可使兔心房内径增加,房颤的诱发率增加。
兔;耐力运动;心房内径;心房颤动
心房颤动(房颤)为临床上最常见的快速型心律失常之一,目前其发生机制还未完全阐明。规律适度的体力运动有益于身体健康,而与同龄非运动员相比,长期高强度锻炼的运动员却容易发生心律失常、甚至心源性猝死[1]。Karjalainen等[2]研究指出,与正常对照组相比,耐力训练组房颤的发生率增加。由于训练强度与房颤发生的相关性不明确,使受训者无法科学的控制训练强度。同时,耐力训练导致房颤的机制尚未明了,因此无法研制出针对靶点的房颤治疗药物。本研究拟建立耐力运动相关的房颤动物模型,用于运动相关性房颤的研究
1 材料与方法
1.1 兔跑台的制备跑台整体采用平面式设计(如图1),总体积405L(长150 cm*宽90 cm*高30 cm);采用整体化大跑道(长150 cm*宽90 cm)保持运动的同步性,内置支架隔离成4跑道(长150 cm*宽22 cm);跑道尾部一个防夹式电刺激金属杆丛,可提供电刺激(电流0.05~4 mA),仅在兔子停留超过3 s才开始放电,同时也可提供光、声刺激。跑台角度为全自动可调式(0~35°),跑道速度整体控制(0~0.67m/s)。兔跑台由北京智鼠多宝生物科技有限公司制作。
1.2 动物运动模型的制备实验动物采用24只成年健康新西兰大耳白兔,体重2.5~3.0kg,雌雄不限,由北京海淀兴旺实验动物养殖场提供。适应性喂养7 d后,将实验兔随机分为对照组(n=8)、中强度组(n=8)、高强度组(n=8)。对照组笼内生活,自由饮食,不进行任何训练。中强度组和高强度组采用兔实验跑台运动,每天1 h[3,4]或一次性力竭(不足1 h),每周5 d,持续12周(第一周为适应性训练)。中强度:坡度0度,速度0.25 m/s;高强度:坡度0度,速度0.5 m/s。
1.3 心房内径的测量适应性喂养7 d后,首次检测各组兔左、右心房大小,之后分别于训练完成后第8、12周,再次检测,一共3次。用0.5%戊巴比妥经耳缘静脉麻醉后,胸部备皮,取左侧卧位,采用IE33型(飞利浦,荷兰)心脏彩超检测仪经胸超声检测,留取标准心动周期的心尖四腔切面(如图2)进行分析,测量左、右心房前后径。
1.4 实验模型准备训练目标完成后,各组实验兔,用3%戊巴比妥经耳缘静脉麻醉后,开胸取出心脏,在温度37°C、速度20 ml/min下行Langendorff经主动脉逆向灌流,灌流液为改良的Krebs-Henseleit缓冲液(单位:mmol/L;NaCl:118,KCl:2.8,KH2PO4:1.2,CaCL2:2.5,MgSO4:0.5,丙酮酸:2.0,葡萄糖:5.5, Na2EDTA:0.57,NaHCO3:25)。于右心耳置入双极特氟龙涂层的起搏导线,基础频率3.3Hz,电刺激脉冲脉宽3 ms,刺激电压幅度是起搏阈值的3倍以下,应用心脏期前刺激法(S1S2)诱导房颤。每次刺激重复5次,记录房颤(S1S2刺激后心电图跟随出现快速而不规则心房激动,同时心室也呈不规则反应并持续1000 ms以上)诱发的次数,若出现持续性房颤(持续时间大于1 min)使用Grass-S88X型刺激仪(Astro-Med公司,美国)给予Burst刺激终止。采用具备Wilson终端的模拟的非接触式12导联心电图记录系统(Harvard Apparatus公司,美国)采集心电信号,并经Biopac心电放大系统(Harvard Apparatus公司,美国)处理后存储于计算机。
1.5 统计学处理采用SPSS 19.0统计软件进行分析,计量资料以均数±标准误表示,组间比较采用方差分析;计数资料采用例数(百分比)表示,组间比较采用卡方检验。以P<0.05为差异具有统计学意义。
图2 兔心脏超声影像(心尖四腔切面)
2 结果
2.1 运动训练情况兔跑台可同时训练4只实验兔,节省了大量时间。本研究共纳入40只实验兔,最终筛选出24只实验兔接受耐力训练,中强度组13只、高强度组11只,中、高强度组各有8只完成整个耐力训练过程。
2.2 各组大鼠心房前后径与对照组比较,中强度组和高强度组左、右房前后径在运动训练8周后均增加,12周后也增加,差异有统计学意义(P均<0.05)。与中强度组比较,高强度组左、右房前后径在运动训练8周后均增加,12周后也增加,差异有统计学意义(P均<0.05)(表1)。
2.3 房颤诱发情况训练12周后,经心房程序刺激诱发房颤心电图如图3。与对照组比较,中强度组(45% vs. 60%)和高强度组(45% vs. 90%)房颤发生率增加,差异有显著统计学意义(P均<0.01)(表2)。
3 讨论
自19世纪末瑞典医生Henschen提出运动心脏概念后,许多研究证实了运动员有心脏肥大和心功能改变,又称为运动员心脏综合症(athletic heart syndrome)。近年来多项研究[5-7]均证实接受长时间、高强度的耐力训练后房颤发生率明显增高。建立相应的实验动物模型是相关研究的基础。虽然鼠循环系统、神经系统等方面与人类相似,但有一定局限性[4]。兔与人的心脏结构相似,具备四腔,血液循环包括体循环和肺循环,心脏电生理方面与人也更为接近[8]。在动物运动模型的研究中,国内外学者多以鼠为对象建立跑步机运动[9]、自主滚轮运动[10]、游泳训练[11]和负重爬[12]等运动模型。跑步机运动训练具有安全、简单、易操作等特点,并能够对运动强度和时间进行精确控制。运动强度与跑台的速度和角度密切相关,运动强度根据Bedford[13]的最大摄氧量确定,运动超过最大摄氧量90%为高强度运动,中等强度运动则为60%~70%。Gaustad等[14]开创了单跑道测摄氧量兔运动跑台,研究表明(0.51± 0.09)m/s的速度就能达到最大摄氧量,跑台的角度(0~20°)对兔摄氧量无明显影响。本实验跑台在Gaustad跑台基础上改良,采用多跑道、大马力电机速度,可控性强,同时本跑台去掉了传统的电击、高频声音及强光等刺激方式,避免应激反应、心理压力增大、受伤等因素对神经系统的影响。如兔停止运动,为保证训练质量,实验员轻拍其背部,使其继续跑动。本实验均采用0°角,中等强度训练取0.25 m/s的速度,高强度运动训练采用0.5 m/s的速度。
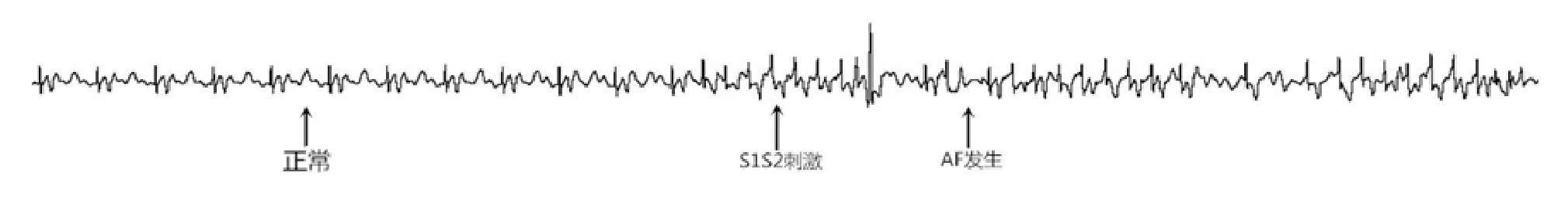
图3 S1S2刺激诱发房颤心电图
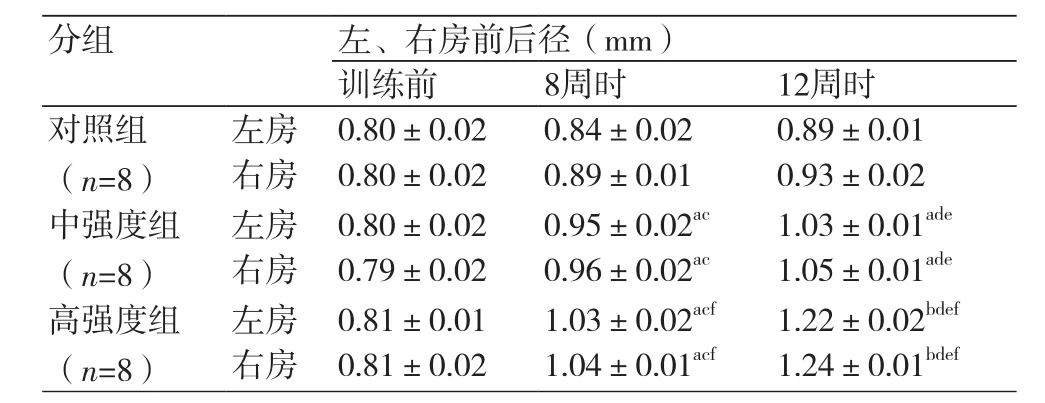
表1 不同训练强度不同时间兔的左、右房前后径大小的比较

表2 不同强度训练的兔房颤诱发情况
本研究发现高强度运动训练12周可导致兔心房扩大,诱导房颤增加,与先前研究结果一致[15]。中强度运动训练12周也能导致兔心房扩大,但诱导房颤发生率并未增加。根据心房扩大与房颤关系的研究[16],运动性房颤发生的机理可能为长期高强度耐力训练过程中心脏前负荷增加及心室压力增高,心房压力增高以维持对心室的灌注,继而心房壁张力增加,导致心房增大,心房细胞受到牵张;心房增大,从而房内容纳更多的子波数,易于发生折返,进而引起房颤发生;心房细胞受到牵张刺激可激活机械牵张敏感性离子通道而缩短ADP90及AERP,导致房颤的发生。
有研究[17]指出,心房的大小与房颤的稳定性呈正相关。然而中等强度运动训练也使心房增大,但未能增加房颤,提示不同训练强度对实验兔心房电活动影响不同,原因有待进一步探讨。
本研究第一次应用自行设计的多跑道兔跑台进行不同强度的耐力运动训练,节省时间,方法可行;高强度长时间的耐力训练可使实验兔心房内径增加,易于诱发房颤,为进一步研究运动性房颤的机制提供参考依据。
[1] Siscovick DS,Weiss NS,Fletcher RH,et al. The incidence of primary cardiac arrest during vigorous exercise[J]. N Engl J Med,1984,311(14):874-7
[2] Karjalainen J,Kujala UM,Kaprio J,et al. Lone atrial fibrillation in vigorously exercising middle aged men: case-control study[J]. BMJ, 1998,316(7147):1784-5.
[3] Gao L,Wang W,Liu D,et al. Exercise training normalizes sympathetic outflow by central antioxidant mechanisms in rabbits with pacing-induced chronic heart failure[J]. Circulation, 2007,115(24):3095-102.
[4] De Moraes R,Valente RH,Leon IR,et al. Chronic dynamic exercise increases Apolipoprotein A-I expression in rabbit renal cortex as determined by proteomic technology[J]. Br J Sports Med,2008,42(5):386-8.
[5] Mont L,Tamborero D,Elosua R,et al. Physical activity, height, and left size are independent risk factors for lone atrial fibrillation in middleaged healthy individuals[J]. Europace,2008,10(1):15-20.
[6] Wilhelm M,Roten L,Tanner H,et al. Atrial remodeling, autonomic tone, and lifetime training hours in nonelite athletes[J]. Am J Cardiol, 2011,108(4):580-5
[7] Elosua R,Arquer A,Mont L,et al. Sport practice and the risk of lone atrial fibrillation: a case control study[J]. Int J Cardiol,2006,108(3):332-7.
[8] Yuan W,Ginsburg KS,Bers DM. Comparison of sarcolemmal calcium channel current in rabbit and rat ventricular myocytes[J]. J Physiol, 1996,493(Pt3):733-46.
[9] Bellafiore M,Sivverini G,Palumbo D,et al. Increased cx43 and angiogenesis in exercised mouse hearts[J]. Int J Sports Med,2007,28(9):749-55.
[10] Yancey SL,Overton JM. Cardiovascular responses to voluntary and treadmill exercise in rats[J]. J Appl Physiol,1993,75(3):1334-40.
[11] Edwards JG. Swim training increases ventricular atrial natriuretic factor (ANF) gene expression as an early adaptation tochronic exercise[J]. Life Sci,2002,70(23):2753-68.
[12] 陈彩珍,卢健,苏有存,等. 抗阻训练对D-半乳糖衰老模型大鼠骨骼肌线粒体膜的影响[J]. 西安体育学院学报,2011,28(1):83-8.
[13] Bedford TG,Tipton CM,Wilson NC,et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol,1979,47(6):1278-83.
[14] Gaustad SE,Rolim N,Wisløff U,et al. A valid and reproducible protocol for testing maximal oxygen uptake in rabbits[J]. Eur J Cardiovasc Prev Rehabil,2010,17(1):83-8.
[15] Guasch E,Benito B,Qi X,et al. Atrial fibrillation promotion by endurance exercise: demonstration and mechanistic exploration in an animal model[J]. J Am Coll Cardiol, 2013,62(1):68-77.
[16] Fuster V,Rydén LE,Asinger RW,et al. ACC/AHA/ESC Guidelines for the management of matients with atrial fibrillation: executive summary a report of the american college of cardiology/american heart association task force on practice guidelines and the european society of cardiology committee for practice guidelines and policy conferences (committee to develop guidelines for the aanagement of patients with atrial fibrillation) developed in collaboration with the north american society of pacing and electrophysiology[J]. Circulation, 2001,104(17):2118-50.
[17]Verhorst PM,Kamp O,Welling RC,et al. Transesophageal echocardiographic predictors for maintenance of sinus rhythm after electrical cardioversion of atrial fibrillation[J]. Am J Cardiol,1997,79 (10):1355-9.
Establishment of rabbit model of exercise atrial fibrillation
YUAN Dou*, TAN Chen, YAO Jian-min, LI Dan, HUANG Si-hui, XU Wei.*Second College of Clinical Medicine, Shanxi Medical University, Taiyuan 030001, China. Corresponding author: YAO Jian-min, E-mail: jimyao@vip.sina.com; TAN Chen,E-mail:happytanchen@126.com
ObjectiveTo establish the animal model of exercise atrial fibrillation (AF) and review its results.MethodsHealthy adult New Zealand rabbits (n=24) were divided into control group, mid-intensity group and highintensity group (each n=8). The control group did not do any exercises and other groups did treadmill running with different intensity (for 1 h or one-time exhaustive exercise) for 5 d a week for 12 w. The size of atrium was detected by using echocardiogram before exercise and 8 w and 12 w after exercise. After exercise finished, Langendorff system is employed for isolated heart perfusion in all rabbits, and AF was induced by using S1S2 and induction rate of AF was recorded.ResultsCompared with control group, the left atrial anteroposterior diameter and right atrial anteroposterior diameter increased in mid-intensity group and high-intensity group after 8 w and after 12 w (all P<0.05). Compared with mid-intensity group, the left atrial anteroposterior diameter and right atrial anteroposterior diameter increased in high-intensity group after 8 w and after 12 w (all P<0.05). Compared with control group, the incidence of AF increased in mid-intensity group (45% vs. 60%) and high-intensity group (45% vs. 90%, all P<0.01).ConclusionLong-term and high-intensity treadmill running can enlarge atrial inner diameter and increase AF incidence in rabbits.
Rabbits; Endurance Exercise; Atrium dimension; Atrial Fibrillation
R541.75
A
1674-4055(2015)01-0094-03
2014-09-25)
(责任编辑:姚雪莉)
030001 太原,山西医科大学第二临床医学院(袁斗);北京军区总医院心血管疾病研究所(袁斗,谭琛,姚建民,徐威);超声科(李丹);北京大学第一医院心内科(黄思慧)
姚建民,E-mail:jimyao@vip.sina.com;
谭琛,E-mail:happytanchen@126.com
10.3969/j.1674-4055.2015.01.29
