微生物中抗耐药菌活性天然产物的研究进展
2015-01-11褚福鑫白志强朱红惠
褚福鑫,白志强,朱红惠*
1 广东省微生物研究所省部共建华南应用微生物国家重点实验室 广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室,广州 510070;2 华南农业大学兽医学院,广州 510000
微生物广泛分布于各种生态环境中,其次级代谢产物种类多样、结构新颖、活性独特[1,2]。据不完全统计,从微生物中发现的活性天然产物已达22500 种之多,应用于临床的微生物药物有150 余种[3]。因此,从微生物中寻找药物先导化合物是目前创新药物研究最活跃的领域之一[4,5]。
抗生素是临床上用于抗感染治疗的主要药物[6]。然而伴随其广泛使用,耐药性病原菌不断出现,如耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)、耐青霉素肺炎链球菌(Penicillin-resistant Streptococcus pneumonia,PRSP)、耐万古霉素肠球菌(Vancomycin-resistant Enterococcus,VRE)、超广谱β-内酰胺酶(Extended Spectrum Beta-Lactamases,ESBLs)产生菌和多药耐药性结核杆菌等[7,8]。耐药性的提高降低了抗菌药物的效果,导致患病率、死亡率和医药费用的增加,已成为公共卫生领域的主要威胁[9,10]。新型抗耐药菌抗生素类药物的开发已迫在眉睫[11]。目前,抗菌药物的研究已从针对各种普通细菌转向耐药细菌[12,13]。
1 抗耐药菌活性天然产物的筛选方法
近年来细菌耐药性问题不断加剧,而传统的抗生素筛选方法效率低下,已不能满足医疗卫生的需要,急需新的高效的筛选方法[14]。
1.1 随机筛选
随机筛选是最传统的方法,又称为抗生素产生菌与活性物质的双重筛选。经典流程是:从采集的样品中分离出菌株,并对每一菌株进行发酵,然后用发酵液或粗提物进行抗菌活性初筛,抗菌活性的检测以常见的细菌及耐药菌为指示菌,如MRSA、VRE、PRSP 等。初筛以后要进行复筛,以确定其对病原生物的实际效果[15]。
1.2 定向筛选
1.2.1 筛选模型
目前,已有许多筛选模型应用到初筛中,实现了定向筛选。如郭长伟等建立了万古霉素耐药菌模型,成功筛选出SIPI-2001-542 等4 株抗耐药菌阳性菌株,并从中分离出高效抗耐药菌化合物SIPI-2001-542 等[16]。
1.2.2 抗生素合成基因簇
随着微生物次级代谢产物生物合成机制研究的不断深入,已证实微生物次级代谢产物的生物合成基因具有呈簇排列特征,即与特定产物合成相关的结构基因、调节基因、耐药性基因和转运蛋白基因等集中位于染色体的一段连续区域[17]。目前,已有大量抗生素合成基因簇被分析研究,如聚酮类化合物合成酶(PKS)生物合成基因簇,梅岭霉素生物合成簇等[18,19]。
结合已知的抗生素合成基因簇,可以运用宏基因组学技术在样品中直接定向筛选特定类型抗生素的合成菌,也可以采用特异性引物和PCR 技术从大量微生物中快速确定具有合成某类化学结构次级代谢产物潜力的菌株[20,21]。
1.2.3 抗菌靶点

图1 化合物1~3 的化学结构Fig.1 Chemical structures of compounds 1~3
数以百计的细菌关键蛋白被确定为抗菌药物的潜在靶点,然而只有少数作为临床药物的有效靶点。这些靶点包括:青霉素结合蛋白,D-Ala-D-Ala 连接酶,MruA,十一异戊烯焦磷酸酶,细胞壁上的丙氨酸消旋酶,30S 和50S 核糖体蛋白,延伸因子G,参与蛋白质合成的Ile-tRNA 合成酶,参与RNA 合成的RNA 聚合酶,参与脂肪酸合成的InhA(FabI),参与细胞代谢的二氢叶酸还原酶(FolA)和p-氨基苯甲酸合成酶,参与DNA 合成的DNA 促旋酶和扑拓异构酶IV[22]。最近还有一些新的抗菌靶点陆续被发现,如合成细菌活性关键物质lipidA 所必须的锌依赖脱乙酰酶LpxC,革兰氏阳性(Gram Positive,G+)菌表面的蛋白质锚定酶Sortase 等[23,24]。
针对一种新靶点抑制剂的筛选方法分为两种[25]。一种是经验型筛选,即采用活细胞建立筛选模型,然后探讨其作用机理,并在此基础上根据需要进行化学修饰,以降低毒性、提高药效。这种方法能确保药物的生物活性,但这种方法会筛选出许多选择性差,毒性强的化合物。另一种则完全脱离生物体,以化学反应为基础,直接测定可能对靶标有作用的系列化合物的活性。这种方法效率更高,但是还需要大量的后续工作去验证筛得的化合物在细胞内是否能够发挥良好的作用。
简述几种针对靶点的新筛选方法:
1.2.3.1 双平板敏感性差异实验(Agar-diffusion two-plate differential sensitivity assay)
通过反义RNA 等途径抑制靶点蛋白表达作为缺陷组,无靶点蛋白抑制作为对照组,分别接种两块平板。再通过杯碟法测定抑菌圈,抑菌圈大小即反映了抗生素最小抑菌浓度(Minimal inhibition concentration,MIC)水平。如果化合物对靶点有抑制活性,则对照组抑菌圈较缺陷组显著变大;否则对照组和缺陷组抑菌圈无显著性差异。运用此方法,Katherine Young 等从250000 种天然化合物中筛选出全新的FabH/FabF 抑制剂Phomallenics[22,26]。Phomallenics 是一类新的真菌产物,包括A、B、C(1~3,图1)三种化合物,都有抗MRSA、流感嗜血杆菌和枯草芽孢杆菌活性。其中Phomallenic C 的抗耐药菌效果最好(MIC=3.9,3.9,15.6 μg/mL),Phomallenic B 活性次之(MIC=12.5、7.8、31.3 μg/mL)。
1.2.3.2 计算机辅助药物设计(Computer Aided Drug Design,CADD)
CADD 是利用计算化学基本原理,通过模拟受体生物大分子与药物的相互作用或通过分析药物结构与活性内在关系,合理筛选、设计新型先导化合物的药物设计方法,主要又包括虚拟筛选和药效团设计两个方法[27,28]。虚拟筛选是基于小分子数据库开展的活性化合物筛选,主要包括分子对接、药效团筛选和片段搜索等方法,高效快速的在天然化合物中挖掘先导化合物,是发现药物靶点作用的最有效的方法。药效团设计可以针对筛得化合物进行优化,提高活性、减少毒性,加快药物研发进程。
1.2.3.3 抗菌靶点模型筛选
对抗菌靶点蛋白进行体外克隆表达、分离纯化、分析和活性检测,并在此基础上借助合理方法,展开抗菌物质的筛选。董国霞等对抗菌靶点E.faecium PDF 进行了克隆表达、分离纯化,对获得的纯度较高的目的蛋白进行Western blotting 分析和活性检测,并以之为靶点建立筛选模型,然后运用高通量筛选方法,对20261 个微生物发酵样品进行了筛选。最终发现I03A-00723 和I03A-05772 的发酵产物对多种耐药G+菌如MRSA、MRSE、E.faecalis HH22 和VRE 等有抗菌活性,另外菌株I06A-01113 的发酵产物对VRE 有抗菌活性但不抗MRSA[29]。
2 抗耐药菌活性天然产物研究进展
2.1 甾体和萜类
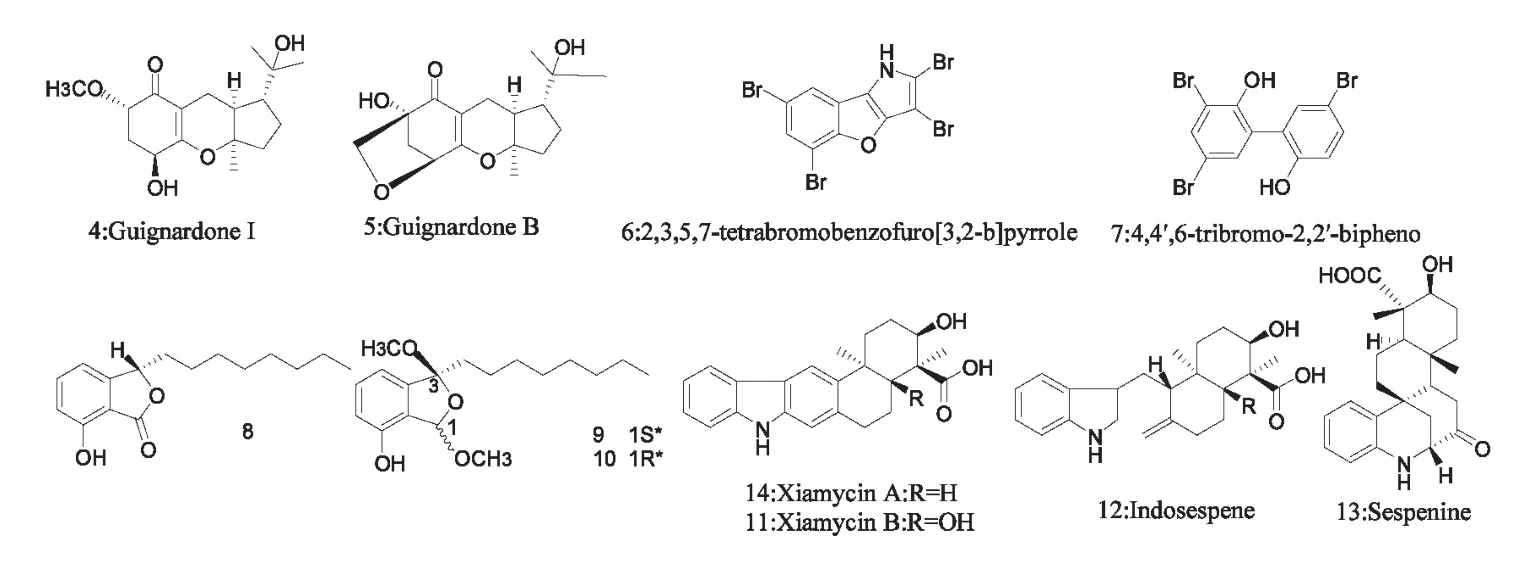
图2 化合物4~14 的化学结构Fig.2 Chemical structures of compounds 4~14
Wen 等从红树林瓶花木Scyphiphora hydrophyllacea 中的一株内生真菌中分离出四种新单萜类化合物Guignardones F-I 和两种已知化合物Guignardones A and B[30]。其中Guignardone I(4,图2,下同)抗MRSA 活性明显,抑菌圈为11 mm;Guignardone B(5)抗MRSA 活性较弱,抑菌圈为8 mm。Domonkos Fehér 等报道从源于卡内奥赫湾海蛞蝓的交替假单胞菌菌株(Pseudoalteromonas sp.)CMMED 290 中分离到的多溴代物2,3,5,7-tetrabromobenzofuro[3,2-b]pyrrole(6)和4,4',6-tribromo-2,2'-bipheno(7)对MRSA 的IC50分别为1.93 和2.19 μM(万古霉素的IC50为0.91 μM)[31]。Liu 等从来源于水母内部组织的Paecilomyces variotii 中分离到四种聚酮化合物,其中三个(8~10)对MRSA(MIC 分别为>40,20,40 μg/mL)及多重耐药副溶血性弧菌(MIC>40 μg/mL)都有一定的抗菌活性[32]。Ling等报道,厦门红树林中分离到的内生菌Streptomyces sp.HKI0595 能产生新的吲哚倍半萜类化物Xiamycin B(11)、Indosespene(12)和Sespenine(13)及已知化合物Xiamycin A(14),对包括MRSA 和VRE在内的多种细菌有抑制活性[33]。其中Xiamycin A和Indosespene 对包括多重耐药菌株在内的多种革兰氏阴性(Gram Negatine,G-)和G+菌株都有抗菌活性。
2.2 黄酮类和醌类化合物
江等报道在土壤中分离的链霉菌SIPI-434 能生产抗耐药菌活性物质Genistein(金雀异黄素)(15,图3,下同)[34]。在市场上有以Genistein 为主原料的保健品,该文首次发现并报道其有抗MRSA 活性。
Schneemann 等在源于波罗的海海绵中的链霉菌(Streptomyces sp.)HB202 中分离出Mayamycin(16)[35,36],其对MRSA 活性明显(IC50=1.25 μM),对肺炎杆菌、痤疮丙酸杆菌等在内的8 株菌株也有活性(IC50=2.5~8.4 μM),另外对HepG2,HT-29等8 种人肿瘤细胞(IC50=0.13~0.33 μmol/L)和鼠成纤维细胞NIH-3T3(IC50=0.22 μmol/L)都有细胞毒活性。Socha 等在海洋链霉菌属Streptomyces 菌株N1-78-1 中分离出BE-43472 A-D(17~20)[37,38]。日本学者早在十年前就已分离得到这些化合物,但只作为抗癌物质研究[39]。Socha 等发现,BE-43472 A-D 不仅对HCT-116 有细胞毒性,抗MRSA 和VRE活性同样明显。又以BE-43472 B 活性最好,对MRSA 和VRE 的MIC 为0.11-0.45 μM,对MRSA 临床株和VRE 临床株的MIC 分别为0.91~3.6 μM,29 μM。(+)-BE-43472B 的非天然对映异构体(-)-BE-43472B 有着相似的活性。Mercado 等从链霉菌新属新种CNQ-525 中分离出三种新的、及两种已经报道过的chlorine-containing terpenoid dihydroquinones[40]。其中三种Chlorinated dihydroquinones 1,3,4(21~23)抗MRSA(MIC 分别为1.95、1.95、1.90μg/mL)和 VRE(MIC 分别为3.90、1.95、3.90μg/mL)活性明显。黄等从海洋放线菌佛州小单孢菌利福霉素亚种(Micromonospora floridensis subsp.rifamycetica)菌株AM105 的发酵液中分离到活性成分AM105-II,被鉴定为安莎霉素类抗生素利福霉素,这是佛州小单胞菌产生利福霉素的首例报道[41]。AM105-II 由Rifamyein S(24)和其异构体Isorifamyein S(25)两种化合物构成,其中Isorifamyein S 为新结构化合物。在抑菌试验中,AM105-II 抗MRSA(MIC=0.03~0.25 μg/mL)活性明显,对其它几种G+、G-菌活性同样明显,且活性较临床药物Riafmyein SV 更好。
Platencin(26)和Platensimycin(27)是由默克公司研究人员最近发现的抗耐药菌天然化合物[42,43]。其中Platencin 从西班牙马略卡岛收集的Streptomyces platensis MA7339 中提取出,Platensimycin 则从南非收集的同种细菌MA7327 中分离到。它们的抗耐药菌活性明显,作用菌株包括MRSA(MIC=0.5 μg/mL)、VRE(MIC=0.1 μg/mL)、耐万古霉素金黄色葡萄球菌(Vancomycin-Resistant Staphylococcus aureus,VRSA)(MIC=0.1 μg/mL)、耐利奈唑胺和耐大环内脂类抗生素病原菌等多种耐药菌。Platencin和Platensimycin 细胞毒性低,作用机制独特,与传统抗生素不存在交叉耐药性。Sunga 等从海洋放线菌类菌株NPS8920 中分离出一类具有独特抗生素活性的新2-亚烷基-4-恶唑烷酮化合物,共包含Lipoxazolidinones A,B,C(28~30)三种化合物[44,45]。其中Lipoxazolidinone A 的抗MRSA 和VRE 活性最好(MICs=1~2 μg/mL)。在筛选抑制细菌脂肪酸生物合成物质的研究中,Singh 等在假单胞菌(Pseudomonas sp.)F92S91 中筛选出对MRSA,VRE及其它一些细菌有抗菌活性的亲脂性α-吡喹酮化合物α-Pyrone I(31),II(32)及其衍生物Furanone III(33)[46]。它们的抗MRSA 活性明显(MIC 分别为4,16,16μg/mL),又以α-Pyrone I 抗MRSA 和VRE 活性最好(MIC 分别为2~4 μg/mL 和2~64 μg/mL)。
Süssmuth 等 通 过 对 para-aminobenzoic acid(pABA)靶点的筛选,从日本海沉积物样品中分离到菌株Verrucosispora AB-18-032,并分离出Abyssomicin B,C(34),D,G,H,及Abyssomicin C 异构体atrop-Abyssomicin C(35)[47,48]。后Niu 等又从陆生菌株Streptomyces sp.HKI0381 中分离到Abyssomicin E[49]。Abyssomicin C 抗MRSA 和VRSA 活性明显(MIC=4-13 μg/mL),其异构体atrop-Abyssomicin C抗MRSA 活性更好[50]。Cueto 等报道从海洋真菌Pestalotia sp.CNL-365 和另一株海洋耐药细菌CNJ-328 的混合培养物中分离到一种新的氯化苯甲酮抗生素Pestalone(36)[51,52]。该化合物只有在二者共同培养时才会产生。Pestalone 抗MRSA(MIC=37 ng/mL)和VRE(MIC=78 ng/mL)活性明显。Kuimoto 等从日本土壤中分离到的Amycolatopsis sp.菌株ML630-mFI 中分离出新的抗菌化合物Kigamicin A~E(37~41)[53]。Kigamicins 对一些G+菌抗菌活性明显,且对MRSA 的MIC 均在0.10~0.78 μg/mL内,并以Kigamicin A 活性最好;同时Kigamicin D 对各种小鼠肿瘤细胞均有很好的活性。Banskota 等报道通过基因分析,从万古霉素生产菌东方拟无枝菌酸菌(Amycolatopsis orientalis)ATCC 43491 的发酵液中分离到新的糖苷聚酮类化合物 ECO-0501(42)[54]。ECO-0501 对多种G+菌活性明显,特别是对MRSA(4 μg/mL)和VRE(8~16 μg/mL),同万古霉素的活性相似。
2.3 生物碱类化合物
McArthur 等报道从Marinispora sp.NPS12745 菌株的发酵液中分离出卤化双吲哚吡咯化合物Lynamicins A~E(43~47,图4,下同)[55]。它们对MRSA、VRE 和VSE 均有一定的活性。其中Lynamicins A-D 活性明显,对MRSA、VRE 和VSE 的MIC分别在1~3,2~8,1.5~8 μg/mL 的范围内;又以Lynamicins B 活性最好,对这三种菌的MIC 分别达到1、2、1.5 μg/mL。

图3 化合物15~42 的化学结构Fig.3 Chemical structures of compounds 15~42
甘等报道在云南省双柏县仓房河的土壤中分离到链霉菌IO8A1776 能生产水溶性活性成分链丝菌素E[Streptothricin E(48)][56]。链丝菌素是首次利用亲水作用色谱分离纯化微生物发酵液中的水溶性活性化合物得到的。链丝菌素E 对多种G+、G-菌抗菌活性明显,同时还有明显的体外抗耐药结核分枝杆菌活性(MIC=0.25~1 μg/mL)。Phillips 等报道在源于中非共和国森林土壤的新属Kibdelosporangium 的菌株发酵液中分离出全新结构的抗生素Kibdelomycin[57,58]。Kibdelomycin(49)是一种细菌II 型拓扑异构酶抑制剂,对G+菌活性显著,对耐甲氧西林、新生霉素、库马霉素、环丙沙星金黄色葡萄球菌MIC 值分别为0.5、0.5、4、0.5 μg/mL;同时对G-菌也有一定的活性。Hughes 等从源于海洋沉积物的海洋链霉菌新种Streptomyces sp.(CNQ-418)的发酵液中分离出Marinopyrroles A(50)and B(51),而又经过发酵条件优化,得到Marinopyrroles C(52)~F[59-61]。Marinopyrroles A、B、C 抗MRSA 活性明显(MIC90 分别为0.31、0.63、0.16 μg/mL),同时对人类癌细胞(HCT-116)有细胞毒性,Marinopyrroles A非天然结构(+)-Marinopyrrole A 抗MRSA 活性同样明显(MIC=0.31 μM)。Jung 等从源于韩国海洋淤泥样品的Streptomyces 菌株AM045 的发酵液中分离出Actinomyccetes,其抗MRSA 活性比万古霉素和替考拉宁要好[62]。该化合物后被证实为放线菌素V(Actinomycin V)(53)。
和田霉素(Hetiamacin)是刘等从源于塔克拉玛干沙漠的枯草芽孢杆菌(Bacillus subtilis)PJS 中分离得到的一类新型抗耐药菌化合物[63,64]。其中,Hetiamacin A(54)和Hetiamacin B(55)为Amicoumacin类新抗生素,抗耐药菌活性明显。尤其是Hetiamacin A,对耐苯唑西林葡萄球菌如金黄色葡萄球菌(ORSA/MRAS)和表皮葡萄球菌均有强体外抗菌活性(MIC=1~2 μg/mL);且其细胞毒性较低,有望成为新抗MRSA 感染先导化合物。Furumai 等从海洋放线菌Streptomyces platensis TP-A0598 中分离出抗MRSA 活性(MIC=3~13 μg/mL)产物TPU-00370-A~D(57~60)[65]。这些化合物结构与从土样中得到的Streptomyces lydicus 培养物中分离出的已知抗生素Lydicamycin(56)极其相似,Lydicamycin抗MRSA 的MIC 为6 μg/mL[66,67]。Sherman 等从海洋沉积物分离到的类似链霉菌菌株Streptomyces sp.307-9 的发酵液中分离出具有相似化学结构的四种化合物TirandamycinA~D(61~64),它们对VRE 的MIC 分别为2.25、100、110 和>9 μmol/L[68]。
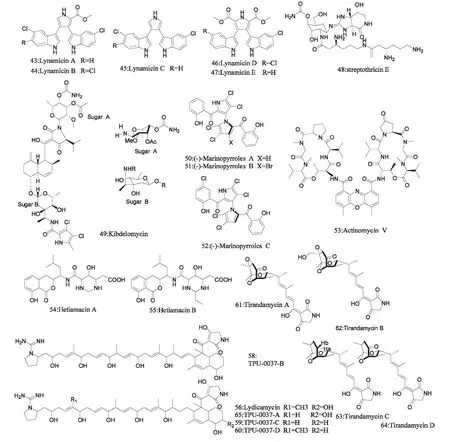
图4 化合物43~64 的化学结构Fig.4 Chemical structures of compounds 43~64
2.4 多肽类化合物
达托霉素(Daptomycin,图5,下同)(65)是由玫瑰孢链霉菌(Streptomyces roseosporus)发酵衍生的一种酸性酯肽类抗生素,2003 年经FDA 批准上市,对包括MRSA 和VRE 的G+菌抗菌活性明显[69,70]。达托霉素能引起细菌胞内钾离子外流,改变细胞膜电位,阻断DNA、RNA 及蛋白质合成。达巴万星(Dalbavancin)(66)是一种浓度依赖性的抗G+菌糖肽类抗生素,2014 年经FDA 批准上市,是替考拉宁类似糖肽(A-40926)的半合成衍生物[71,72]。达巴万星的先导化合物A-40926 从野野村放线菌属菌株Nonomuraea sp.ATCC 39727 的发酵液中分离出,该化合物不仅能够有效抑制万古霉素敏感菌,且对万古霉素中敏金黄色葡萄球菌、VRSA、vanB VRE 等万古霉素耐药菌同样显示出较强的抗菌活性[73]。达巴万星能够抑制细菌细胞壁的合成,抗MRSA 活性(MIC50=0.06 mg/L)与万古霉素(MIC50=1 mg/L)、替考拉宁(MIC50=0.5 mg/L)相比大大提高,同时对PRSP 和耐青霉素化脓性链球菌抗菌活性同样明显(MIC50≤0.06 mg/L),且具有优秀的临床安全性[72,74,75]。奥利万星(Oritavancin,LY333328)(67)是在第一代糖肽抗生素万古霉素的基础上开发的第二代糖肽抗生素,是Amycolatopsis Orientalis 发酵产生的LY264826 的衍生物,2014 年经FDA 批准上市,用于治疗G+菌引起的感染[76]。该抗生素能抑制细菌细胞壁的形成,作用机制同万古霉素相似[77]。Patel 等报道了该抗生素对临床分离的35 株VRE、33 株MRSA 和29 株PRSP 的MIC 分别为为2 mg/L、1 mg/L 和<0.1125 mg/L;其抗MRSA、VRE活性较万古霉素、替考拉宁、奎奴普丁/达福普汀等抗生素更显著[78-80]。
李子强等人在游动放线菌(Actinpplanes sp.)PDF-1 中分离到诺西肽(Nosiheptide)(68)[81]。诺西肽有抗G+球菌活性,特别是对MRSA(MIC<0.004 μg/mL)和VRE(MIC=0.004~0.015 μg/mL)抗菌活性明显。李益等筛选出能分泌抗MRSA活性物质环(L-缬-L-脯)二肽(69)和环(L-异亮-L-脯)二肽(70)的海洋放线菌Micromonospora sp.(No.69)[82]。近年来,环二肽相继被报道具有介导细胞间通讯、抗菌和抗肿瘤等作用,此报道首次发现了环二肽的抗MRSA 作用[83]。Andersen 研究组在新几内亚的海洋蠕虫组织中分离到杆状细菌MKPNG-276A,培养后分离到单环状多肽Loloatin B(72)[84]。抑菌试验显示Loloatin B 抗MRSA、VRE及PRSP(MIC=1~2 μg/L)活性突出。该研究组后续分离到Loloatin A(71)、C(73)、D(74),loloatin A~D 对上述3 种耐药菌的体外抑菌试验MIC 平均分别为4、2、0.5、8 μg/mL,可见Loloatin C 抗菌活性最好[85-87]。
Singh 等 在 从 Amycolatopsis fastidiosa ATCC 202099 的提取物中分离到一系列噻唑基多肽类化合物[88]。其中Thiazomycin E2(75)、Thiazomycin C(76)和Thiazomycin D(77)对MRSA 菌株MB5395(MIC 分别为0.02、0.05、0.031 μg/mL),VRE 菌株CL5791(MIC 分别为0.004、0.1、0.01 μg/mL)抗菌活性明显。该类化合物抗菌作用方式异于常用抗菌药物,其活性不易受病原体耐药性的影响,值得研究和开发。Sun 等报道从源于斐济海洋沉积物的Streptomyces sp.CNS-575 中分离出新缩肽类化合物Fijimycins A~C 和已知化合物Etamycin A[89]。其中Fijimycins A(78)、C(79)及Etamycin A(80)抗MRSA 活性明显,对临床及社区分离的MRSA 抗菌活性明显(MIC100=4~32 μg/mL)。Engelhardt 等从源于挪威特隆赫姆海湾样品的一株拟诺卡氏菌(Nocardiopsis sp.)TFS65-07 中分离出环肽化合物TP-1161(81)[90,91]。经试验证实,TP-1161 对多种耐万古霉素的G+菌抗菌作用突出(MIC=0.25~1.0 μg/mL)。Andersen 等从热带珊瑚礁栖息地收集的细菌Bacillus sp.中分离到新型多肽类抗生素Bogorol A(82)[92],其对人源MRSA(MIC=2 μg/mL)和VRE(MIC=10 μg/mL)抗菌活性明显;对大肠埃希氏菌有中等的抗菌活性(MIC=35 μg/mL)。该化合物揭示了一个“阳离子多肽抗生素”的全新结构模板。郭等报道通过万古霉素耐药菌模型筛选出微黄链霉菌(S.flavesens)菌株SIPI-2001-542,并分离出SIPI-2001-542(83)[16]。SIPI-2001-542 对万古霉素耐药菌458V20 及MRSA 菌株9913 和9914 的抗菌活性(MIC 分别为0.25、0.25、0.25 mg/L)比万古霉素(MIC 分别为>6.25、1.56、1.56 mg/L)和替考拉宁(MIC 分别为0.78、3.13、3.13 mg/L)好。另外也首次报道了放线菌素D 对耐药G+菌的抑菌活性。李等报道在土壤中筛选分离的链霉菌菌株SIPI-1140 能合成抗耐药菌活性化合物Quinomycins[93],此次共分离出两种有效化合物QuinomycinA(84)和Quinomycin C(85),它们是已经报道过的抗肿瘤抗生素,此次报道了其优良的抗MRSA 活性。
多粘类芽孢杆菌是少数能够产生具有临床应用价值抗生素的细菌[94]。Octapeptin B5、B7 是在钱等从其发现的Paenibacillus 属新种菌株F6-B70 中分离出的新多粘菌素类脂肽类抗生素,属于Octapeptin家族新成员[95]。Octapeptin B5、B7 对G+、G-菌均有较好的抗菌活性,特别是Octapeptin B5,具有抗菌活性好、产量高的特点,被命名为八肽菌素(battacin)(86)[96]。在钱等的研究中,八肽菌素对所有测试过的G-菌均具有显著的抗菌作用(MIC=2~16 μg/mL),包括铜绿假单胞菌、大肠杆菌及17 株临床分离株。这些临床分离菌株中有47%是多重耐药菌,其中23%是对所有测试过的临床常用抗生素耐药的超级耐药菌。另外,八肽菌素对G-杆菌的MIC/MBC 均同目前已在上市的多粘菌素B 相当,且安全性要更好,暗示了这类化合物的应用潜力。Nocathiacins 是从诺卡菌属(Nocardia sp.)菌株ATCC 202099 的发酵液中分离出,包括Nocathiacin I、II、III(87~89)及Nocathiacin I 衍生物BMS-461996(90)和BMS-411886(91)[97,98]。Nocathiacins 抗G+菌活性明显,主要通过粘附于细菌23S rRNA 上,阻止细菌蛋白质的合成。特别是Nocathiacin I 及其衍生物BMS-461996 和BMS-411886,对耐药菌株MRSA(MIC 分别为0.007、0.007、0.06 μg/mL),VRE(MIC 分别为0.03、0.015、0.03 μg/mL),PRSP(MIC分别为0.0005、0.015、0.003 μg/mL)活性均突出,且比万古霉素(抗MRSA、VRE、PRSP 的MIC 分别为0.06、0.03、0.003 μg/mL)要好。
2.5 大环内脂类化合物
泰利菌素(Telithromycin)(92,图6,下同)是首个上市的第三代大环内酯类抗生素_酮内酯类药物,也是半合成的大环内酯-林可酰胺-链阳霉素B 家族中第一个药物,于2001 年上市[99,100]。该抗生素通过直接与细菌核糖体50S 亚基结合,阻碍细菌蛋白质的合成。泰利菌素抗菌谱广泛,不仅对包括肺炎链球菌、肺炎球菌、嗜血流感杆菌、莫拉汉菌等在内的G+、G-菌有明显的活性,同样对MRSA、PRSP 以及大环内脂耐药菌等多重耐药菌临床活性显著[101-103]。喹红霉素(Cethromycin)(93)是一种新的广谱大环内酯类抗生素,其作用机制同泰利菌素大致相同,且毒性小、抗菌谱更广,目前正处于III 期临床阶段[104,105]。喹红霉素对耐药的呼吸道致病菌如肺炎链球菌、黏膜炎莫拉菌、金黄色葡萄球菌、流感嗜血杆菌、肺炎支原体和嗜肺军团菌等均有很强的抗菌活性。Igarashi 等从土壤中收集的诺卡氏菌(Nocardia sp.)MK703-102F1 中分离到含有反式十氢化萘骨架的十六元大环内酯类化合Tubelactomicin A(94)[106]。Tubelactomicin A 对耐巴龙霉素、卡那霉素和链霉素的结核分枝杆菌ATCC607 菌株抗菌活性良好(MIC=0.1 μg/mL)。Kwon 等从源于加州拉荷亚海洋沉积物的海洋放线菌新种Marinispora CNQ-140 的发酵液中分离出多烯多元醇化合物Marinomycins A~D(95~98)[107]。Marinomycin A 抗耐药菌的活性最强,对MRSA 和VRE 抗菌活性突出(MIC 均为0.13 μM),而Marinomycin B、C、D 仅对MRSA 有活性(MIC 均为0.25 μM)。Ling 等从红树林中分离到内生菌Streptomyces sp.HKI0576 可以代谢产生新的大环内酯类化合物Divergolides A~D(99~102)[108]。Divergolides A、B、D 对MRSA 有抗菌活性(每孔50 μg 时,抑菌圈直径11~19 mm),Divergolides C 对VRE 同样有活性(每孔50 μg 时,抑菌圈直径14 mm),另外这四种化合物对枯草芽孢杆菌和牡牛分枝杆菌均有活性(每孔50 μg 时,抑菌圈直径10~19 mm)。Okujo 等从源于马来西亚土壤的Microbispora sp.菌株A34030 的发酵液中分离出一系列大环内酯类化合物Bispolides[109]。Bispolides 共包含Bispolide A1、A2、A3、B1、B2a、B2b 和B3(103~109)七种化合物,这些化合物均对临床分离的MRSA 活性明显(MIC=1~4 μg/mL)。
2.6 其他
奎奴普丁(110,图7,下同)/达福普汀(111)是从链霉菌(Streptomyces)中分离到的链阳霉素类已上市抗生素,是普那霉素(Pristinamycin)两个组分的半合成衍生物,统称为Synercid[110,111]。Synercid 作用于细菌核糖体,抑制蛋白质的合成,对大多数多重耐药G+菌抗菌活性良好[112]。Synercid 对链球菌(包括青霉素敏感和青霉素耐药链球菌)的MIC 为0.125~1 mg/L,同时对金黄色葡萄球菌(甲氧西林敏感和甲氧西林耐药)和屎肠球菌(万古霉素敏感和万古霉素耐药)的MIC 均小于1 mg/L[113]。随后,RPR-106972 作为RPR-106950(112)和RPR-112808(113)的55∶45 的混合物被筛选出,结构较Synercid 简单,但抗耐药菌活性更显著[114]。替加环素(Tigecycline)(114)是一种新型的甘氨酰四环素类新抗生素,2005 年经FDA 批准上市,对众多致病菌包括G+菌,需氧、厌氧G-菌及拟杆菌活性明显,对绿脓杆菌无活性,对阳性吲哚变形杆菌和奇异变形杆菌的活性也很低[115,116]。替加环素对包括MRSA、VRE、PRSP 的高度耐药菌,都有明显活性[117]。

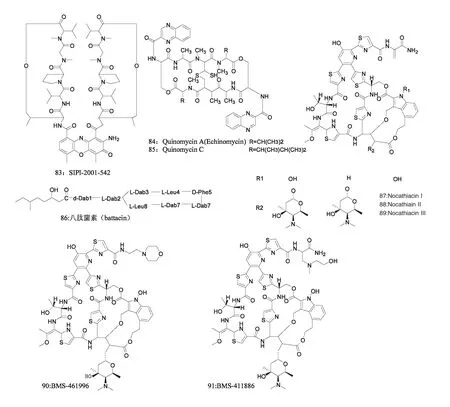
图5 天然产物65~91 的化学结构Fig.5 Chemical structures of compounds 65~91
矫等从其发现的海洋链霉菌新种星海链霉菌中分离出新型亚砜类抗耐药菌活性物质星海霉素(Xinhaiamine)[118]。亚砜类化合物普遍具有广谱抗菌、杀虫和抗肿瘤活性。此文是首次在微生物中分离出亚砜类化合物的报道。Xinhaiamine A(115)和B 都对S.auresu、B.subtilis、E.coli、A.baumanii 和P.earuginosa 抗菌活性明显(Xinhaiamine A 的MIC 分别为0.69、0.35、0.17、2.76 和11.04 μM;Xinhaiamine B 的MIC 分别为0.35、0.17、0.17、5.52 和11.04 μM),它们对临床MRSA 分离株也显示出一定的抑菌活性(MIC 分别为2.76~5.52 μM 和5.52 μM),但效果均不如万古霉素。Istamycin(116)是从一株海洋放线菌中分离得到的新型氨基糖苷类抗生素[119]。Istamycin 对G+、G-细菌,特别是对耐氨基糖苷类细菌活性极强(MIC=0.1~3.0 μg/mL),很可能成为临床应用的抗感染药物。Kintana 等报道从源于海泥的假单胞菌Pseudomonas sp.CB-104 的发酵液中分离到含硫七元化合物Thiotropocin(117)[120]。Thiotropocin 对耐药G+、G-菌均有抗菌活性,对植物病原体和支原体也有抑制活性(MIC=0.78~12.5 μg/mL)。Doshida 等报道从源于海绵mycale adhaerens 的 Exophiala pisciphila 菌 株NI10102 的培养液中分离到β-羟基饱和长脂肪链化合物Exophilin A(118)[121]。Exophilin A 能有效抑制G+菌的生长,对粪链球菌的MIC 为12.5 μg/mL,对MRSA 的MIC 为50 μg/mL。

图6 天然产物92~109 的化学结构Fig.6 Chemical structures of compounds 92~109
Singh 等从源于南非纳马夸兰土壤样品的游动放线菌(Actinoplanes philippinensis)菌株MA7347 中提取到新的噻唑肽苷化合物Philipimycin(119)[122]。Philipimycin 对MRSA 菌株MB5393 抗菌活性良好(MIC=0.125 μg/mL),且同样可以抑制万古霉素、利奈唑酮和大环内酯类化合物耐药的粪大肠杆菌群(MIC=0.03 μg/mL)。Asolkar 等报道从分离自大巴哈马群岛的海鞘中的居沙盐孢菌(Salinispora arenicola)CNR-647 中筛选出一种新糖苷类化合物Arenimycin(120)[123]。Arenimycin 抗MRSA 活性突出,对耐利平和甲氧西林金黄色葡萄球菌的MIC=1.06 μg/mL,对其他MRSA 菌株的MIC 在0.05~1.03 μg/mL 范围内,同时抗其它G+致病菌和分支杆菌的活性也很好(MIC=0.05~1.0 μg/mL)。Isnansetyo 等报道从一株红藻Ceratodiction spongiosum表面分离到一株Pseudomonas sp.(strain AMSN),该菌株产生的2,4-Diacetylphloroglucinol(DAGP)(121)显示出抗MRSA、VRSA 和VRE 活性(MIC=1~8 μg/mL)[124,125]。DAGP 活性稳定,可在70 ℃下以及pH 2~7 的条件下保持结构稳定性,且细胞毒性较低。Shiozawa 等从海洋细菌Alteromonas rava SANK 73390 中分离到含硫代谢物Thiomarinols A~G(122~128)[126-129]。Thiomarinols 作用方式为抑制异亮氨酰转移RNA 合成酶,抗菌谱广,对G+、G-菌均有活性,特别是对G+菌及MRSA 活性显著(MIC≤0.01 μg/mL)。Isnansetyo 等又在海洋细菌Pseudoalteromonas phenolica O-BC30T中分离出MC21-A(129)和MC21-B(130)[130,131]。它们的抗MRSA 活性(MICs=1~4 μg/mL)同万古霉素(MIC=0.25~2 μg/mL)相似。MC21-A 同样对肠球菌、屎肠球菌和粪肠球菌活性明显。MC21-A 对人细胞没有细胞毒性,MC21-B 对人细胞有细胞毒性。Kanoh 等报道从帕劳共和国硬珊瑚中分离到的Zygosporium sp.KNC52 能 产 生Sulfoalkylresorcinol(131)[132]。Sulfoalkylresorcinol 对MRSA 抗菌活性明显(MIC=12.5 μg/mL),同时对Mycobcterium tuberculosis(MDRTB),M.bovis BCG、M.avium、Pseudomonas aeruginosa(MDRP)都存在一定活性。
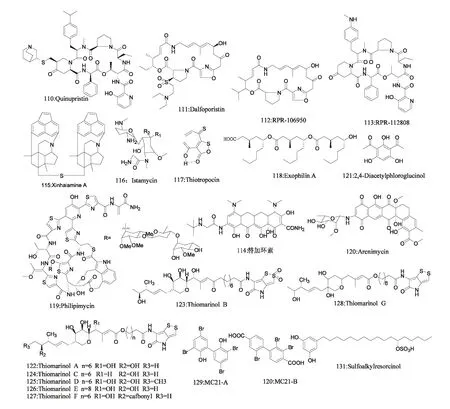
图7 天然产物110~131 的化学结构Fig.7 Chemical structures of compounds 110~131
3 讨论
放线菌是公认的第一大药源微生物类群,本文列举的新型抗耐药菌化合物同样主要源于放线菌[133]。在过去五十年中,从陆生放线菌中共收获了100,000 种化合物,这其中囊括了70%的天然抗生素[3]。研究表明,放线菌仍是新活性物质的最主要生产菌,在新抗生素开发中地位依然十分重要[3,134]。
另一方面,虽然陆生菌来源的抗生素对人类健康做出了巨大贡献,然而随着细菌抗耐药性的不断增加和陆生菌资源的日渐枯竭,陆生菌来源的抗生素已不能满足人类健康的需要[135]。海洋微生物种类丰富,生存环境特殊,产生化合物种类繁多、结构新颖,且开发程度尚低[136,137]。因此,海洋微生物已成为人类寻找、开发新型抗生素的重点和热点[136,138]。本文中提到的新型抗耐药菌化合物中,很多源自海洋。
目前,新型抗耐药菌化合物的筛选多针对MRSA、VRE 在内的G+性耐药菌[139]。然而随着细菌耐药性的不断适应和进化,G-菌耐药性及危害性也趋严重[140,141]。2011 年临床分离的耐药菌中,G-菌占71.5%,种类多样且抗药性突出[142]。泛耐药G-杆菌的出现和不断增多,已成为全世界临床面临的另一重大挑战[143,144]。因此,筛选针对G-菌,特别是产ESBLs 及泛耐药的G-菌的抗生素,同样要引起高度重视。
随着样品来源的不断丰富,对抗菌化合物筛选技术的不断提高,以及对活性化合物分析的不断深入,人类必定能够不断筛选出高效安全的新型抗生素,从而解决细菌耐药性带来的巨大威胁,保证人类的健康生存。
1 Singh SB,Barrett JF.Empirical antibacterial drug discoveryfoundation in natural products.Biochem Pharmacol,2006,71:1006-1015.
2 Newman DJ,et al.Natural products as sources of new drugs over the period 1981-2002.J Nat Prod,2003,66:1022-1037.
3 Berdy J.Bioactivemicrobial metabolites.J Antibiot,2005,58:1-26.
4 Newman DJ,Cragg GM.Natural products as sources of new drugs over the 30 years from 1981 to 2010.J Nat Prod,2012,75:311-335.
5 Fischbach MA,Walsh CT.Antibiotics for emerging pathogens.Science,2009,325:1089-1093.
6 Bérdy J.Thoughts and facts about antibiotics:where we are now and where we are heading.J Antibiot,2012,65:385-395.
7 Liu HY(刘云红).临床常见耐药性细菌的耐药机制.Chin J Modern Pharm(中国现代医药杂志),2009,6:129-130.
8 Zhao J(赵捷),et al.Treatment strategy of common resistant bacteria infection.Drugs Clin(药品评价),2014,10:19-22.
9 Coast J,Smith RD,Millar MR.Superbugs:should antimicrobial resistance be included as a cost in economic evaluation?J Health Econ,1996,5:217-226.
10 Lv Y(吕媛),et al.Introduction to international and internal antim icrobial resistance surveillance.Chin J Clin Pharmacol(中国临床药理学杂志),2011,4:311-317..
11 Stanton TB.A call for antibiotic alternatives research.Trends Microbiol,2013,21:111-113.
12 Xiao YH(肖永红).Progress in the research of antibacterial agents against drug-resistant bacterial infections.Infect Dis Info(传染病信息),2011,24:68-71.
13 Boucher HW,et al.Bad bugs,No Drugs:No Eskape!An update from the infectious diseases society of america.Clin Infect Dis,2009,48:1-12.
14 Ma YJ(马寅姣),et al..Methods for the screening of antibiotics.Chin J Antibiot(中国抗生素杂志),2010,9:654-658.
15 Chen FF(陈菲菲),et al.Advance in research and development of natural products from marine microorganisms.Chin J Appl Environ Biol(应用与环境生物学报),2011,17:287-294
16 Guo CW(郭长伟).Construction of vancomycin-resistant screening model and isolation of antibiotic substance against drug-resistant stains.Shanghai:Shanghai Institute of Pharmaceutical Industry(上海医药工业研究院),PhD.2003.
17 Chater KF.The Improving prospects for yield increase by genetic engineering in antibiotic-producing streptomycetes.Nat Biotechnol,1990,8:115-121.
18 Rascher A,et al.Insights into the biosynthesis of the benzoquinone ansamycins Geldanamycin and Herbimycin,obtained by gene sequencing and disruption.Appl Environ Microb,2005,71:4862-4271.
19 Bai LQ(白林泉),Deng ZX(邓子新).Secondary metabolic pathway genes and new drug discovery.Chin J Antibiot(中国抗生素杂志),2006,2:80-86.
20 Li RL(栗若兰),et al.A method of screening for antibiotic microorganism producing strains from soil by metagenomics.Microbiol Chin(微生物学通报),2011,7:1125-1130.
21 Wu Y(武英),Wang L(王辂).The methods of exploiting the natural products of microbes.World Notes Antibio(国外医药,抗生素分册),2010,21:1-6+12
22 Young K,et al.Discovery of Fabh/Fabf inhibitors from natural products.Antimicrob Agents Chemother,2006,50:519-526.
23 Whittington DA,et al.Crystal structure of lpxc,a zinc-dependent deacetylase essential for endotoxin biosynthesis.Proc Natl Acad Sci,2003,100:8146-8150.
24 Mazmanian SK,et al.Staphylococcus aureus sortase,an enzyme that anchors surface proteins to the cell wall.Sci,1999,285:760-763.
25 Luo W(罗威),Gu JF(顾觉奋).Novel-type antibiotics using Fab as target and Platensimycin.Chin J Antibiot(中国抗生素杂志),2008,6:321-324.
26 Ishigami K,et al.Enantioselective synthesis of phomallenic acid C,an inhibitor of FAS II pathway.Tetrahedr Lett,2008,49:5077-5079.
27 Sun WT(孙文腾).Research for drug knowledge oriented compound-target network model.Shanghai:East China University of Science and Technology(华东理工大学),MSc.2013
28 Qiao LS(乔连生),Zhang YL(张燕玲).Application of CADD on multi-target drug R&D in natural products.Chin J Chin Mater Med(中国中药杂志),2014,11:1951-1955.
29 Dong GX(董国霞).以pdf 为靶点的新药筛选及活性组分的分离纯化、结构鉴定与活性研究.Beijing:Peking Union Medical College(中国协和医科大学),PhD.2009.
30 Mei WL,et al.Meroterpenes from endophytic fungus A1 of mangrove plant Scyphiphora hydrophyllacea.Mar Drugs,2012,10:1993-2001.
31 Fehér D,et al.Highly brominated antimicrobial metabolites from a marine Pseudoalteromonas sp.J Nat Prod,2010,73:1963-1966.
32 Liu J,et al.Antibacterial polyketides from the jellyfish-derived fungus Paecilomyces variotii.J Nat Prod,2011,74:1826-1829.
33 Ling D,et al.A Family of multicyclic indolosesquiterpenes from a bacterial endophyte.Org Biomol Chem,2011,9:4029-4031.
34 Jiang Y(江勇),The studies on antibiocits against antibioticrersistant baeetria and antitumor agents from micerogranisms.Shanghai:Shanghai Institute of Pharmaceutical Industry(上海医药工业研究院),MSc.2005.
35 Schneemann I,et al.Mayamycin,a cytotoxic polyketide from a streptomyces strain isolated from the marine sponge Halichondria panicea.J Nat Prod,2010,73:1309-1312.
36 Wang K,et al.Synthesis study toward Mayamycin.Chin J Chem,2013,31:93-99.
37 Socha AM,et al.Antibiotic Bisanthraquinones produced by a streptomycete isolated from a cyanobacterium associated with Ecteinascidia turbinata.J Nat Prod,2006,69:1070-1073.
38 Socha AM,et al.New Bisanthraquinone antibiotics and semisynthetic derivatives with potent activity against clinical Staphylococcus aureus and Enterococcus faecium isolates.Bioorgan Med Chem 2006,14:8446-8454.
39 Kushida H,et al.Be-43472 manufacture with Streptomyces.Jpn Patent,1996,81:435-469
40 Soria-Mercado IE,et al.Antibiotic terpenoid chloro-dihydroquinones from a new marine actinomycete.Nature,2005,68:904-910.
41 Huang HQ(黄惠琴).Studies on sereening of marine aetinomycetes with anti-MRSA activity and the active compounds produced by strain AM105.Guangzhou:South China university of Tropical Agriculture(华南热带农业大学),PhD.2005
42 Wang J,et al.Discovery of Platencin,a dual Fabf and Fabh inhibitor with in vivo antibiotic properties.Proc Natl Acad Sci,2007,104:7612-7616.
43 Wang J,et al.Platensimycin is a selective Fabf inhibitor with potent antibiotic properties.Nature,2006,441:358-361.
44 VR Macherla,et al.Lipoxazolidinones A,B,and C:antibacterial 4-oxazolidinones from a marine actinomycete isolated from a guam marine sediment.J Nat Prod,2007,70:1454-1457.
45 Sunga MJ,et al.Seawater requirement for the production of Lipoxazolidinones by marine actinomycete strain Nps8920.J Ind Microbiol Biotechnol,2008,35:761-765.
46 Singh MP,et al.Novel alpha-Pyrones produced by a marine Pseudomonas sp.F92s91:taxonomy and biological Activities.J Nat Prod,2003,56:1033-1044.
47 Bister B,et al.Abyssomicin C-a polycyclic antibiotic from a marine Verrucosispora strain as an inhibitor of the p-aminobenzoic acid/tetrahydrofolate biosynthesis pathway.Angew Chem Int Ed,2004,43:2574-2576.
48 Keller S,et al.Abyssomicins G and H and atrop-Abyssomicin C from the marine Verrucosispora strain Ab-18-032.J Antibiot,2007,60:391-394.
49 Niu XM,et al.Abyssomicin E,a highly functionalized polycyclic metabolite from Streptomyces Sp.Org Lett,2007,9:2437-2440.
50 Nicolaou KC,Harrison ST.Total synthesis of abyssomicin C and atrop-Abyssomicin C.Angew Chem Int Ed,2006,45:3256-3260.
51 Cueto M,et al.Pestalone,a new antibiotic produced by a marine fungus in response to bacterial challenge.J Nat Prod,2001,64:1444-1446.
52 Augner D,et al.On the antibiotic and antifungal activity of Pestalone,Pestalachloride A,and structurally related compounds.J Nat Prod,2013,76:1519-1522.
53 Kunimoto S,et al.Kigamicins,novel antitumor antibiotics.I.taxonomy,isolation,physico-chemical properties and biological activities.J Antibiot,2003,56:1004-1011.
54 Banskota AH,et al.Genomic analyses lead to novel secondary metabolites.J Antibiot,2006,59:533-542.
55 McArthur KA,et al.Lynamicins A-E,chlorinated bisindole pyrrole antibiotics from a novel marine actinomycete.J Nat Prod,2008,71:1732-1737.
56 Gan ML(甘茂罗),et al.Water-soluble streptothricins from Streptomyces sp.Chin J Antibiot(中国抗生素杂志),2012:599-603+606.
57 Phillips JW,et al.Discovery of Kibdelomycin,a potent new class of bacterial type II topoisomerase inhibitor by chemicalgenetic profiling in Staphylococcus aureus.Chem Biol,2011,18:955-965.
58 Lu J,et al.Structures of Kibdelomycin bound to Staphylococcus aureus gyrb and pare showed a novel U-shaped binding mode.Chem Biol,2014,9:2023-2031.
59 Stach JEM,et al.Statistical approaches for estimating actinobacterial diversity in marine sediments.Appl Environ Microb,2003,69:6189-6200.
60 Hughes CC,et al.The Marinopyrroles,antibiotics of an unprecedented structure class from a marine Streptomyces sp.Org Lett,2008,10:629-631.
61 Hughes CC,et al.Structures,reactivities,and antibiotic properties of the Marinopyrroles A-F.J Org Chem,2010,75:3240-3250.
62 Chang JH,et al.Structure elucidation of a potent anti-MRSA antibiotic,Am3,produced by Streptomyces sp.Agrl Chem Bio,1995,38:516-521
63 Han XY(韩晓艳),et al.Research progress of Amicoumacin group antibiotic.World Notes Antibio(国外医药,抗生素分册),2013,3:106-115.
64 Liu SW,et al.Pjs,a novel isocoumarin with hexahydropyrimidine ring from Bacillus subtilis Pjs.J Antibiot,2013,66:281-284.
65 Furumai T,et al.Tpu-0037-A,B,C and D,novel Lydicamycin congeners with anti-MRSA activity from Streptomyces platensis Tp-A0598.J Antibiot,2002,55:873-880.
66 Hayakawa Y,et al.Lydicamycin,a new antibiotic of a novel skeletal type.I.taxonomy,fermentation,isolation and biological activity.J Antibiot,1991,44:282-287.
67 Hayakawa Y,et al.Lydicamycin,a new antibiotic of a novel skeletal type.II physico-chemical properties and structure elucidation.J Antibiot,1991,44:288-292.
68 Carlson JC,et al.Isolation and characterization of Tirandamycins from a marine-derived Streptomyces sp.J Nat Prod,2009,72:2076-2079.
69 Steenbergen JN,et al.Daptomycin:a lipopeptide antibiotic for the treatment of serious gram-positive infections.J Antimicrob Chemother,2005,55:283-288.
70 Carpenter CF,Chambers HF.Daptomycin:another novel agent for treating infections due to drug-resistant gram-positive pathogens.Clin Infect Dis,2004,38:994-1000.
71 Malabarba A,Goldstein BP.Origin,structure,and activity in vitro and in vivo of Dalbavancin.J Antimicrob Chemother,2005,55:15-20.
72 Lin Z(林忠),et al.Advances in research of a new antibiotics Dalbavancin.Chin J Model Appl Pharm(中国现代应用药学),2013:809-814.
73 Chen M(陈明),et al.Progress in A40926,a natural lipoglycopeptide antibiotic.Chin J Antibiot(中国抗生素杂志),2013:308-313.
74 Seltzer E,et al.Dalbavancin safety in the phase 2/3 clinical development program.J Crit Care,2008,12:27.
75 Jauregui LE,et al.Randomized,double-blind comparison of once-weekly Dalbavancin versus twice-daily Linezolid therapy for the treatment of complicated skin and skin structure infections.Clin Infect Dis,2005,41:1407-1415.
76 Tan L(谭玲),et al.A new glycopeptide antimicrobial-oritavancin.Chin J New Drugs(中国新药杂志),2007:1141-1144.
77 Zhanel GG,et al.Oritavancin:mechanism of action.Clin Infect Dis,2012,54:214-219.
78 Patel R,et al.In vitro activity of Ly333328 against Vancomycin-resistant Enterococci,Methicillin-resistant Staphylococcus aureus,and Penicillin-resistant Streptococcus pneumoniae.Diagn Microbiol Infect Dis,1998,30:89-92.
79 Schwalbe RS,et al.In vitro activity of Ly333328,an investigational glycopeptide antibiotic,against Enterococci and Staphylococci.Antimicrob Agents Chemother,1996,40:2416-2419.
80 Baltch AL,et al.Comparison of inhibitory and bactericidal activities and postantibiotic effects of Ly333328 and Ampicillin used singly and in combination against Vancomycin-resistant Enterococcus faecium.Antimicrob Agents Chemother,1998,42:2564-2568.
81 Li ZQ(李子强),et al.Purification and characterization of anti multi-drug-resistant bacterial constituents from fermentation broth of Actinoplanes sp.PDF-1.Chin J Antibiot(中国抗生素杂志),2012:366-371.
82 Li Y(李益),et al.Study of anti-MRSA bioactive constituents from a marine actinomycetes Micrmonospora sp.(NO.69).Chin J Mar Drugs(中国海洋药物),2010,29:16-21.
83 Zhou J,Tan NH.Application of a new tlc chemical method for detection of cyclopeptides in plants.Chin Sci Bull,2000,45:1825-1831.
84 Gerard JM,et al.Loloatin B,a cyclic decapeptide antibiotic produced in culture by a tropical marine bacterium.Tetrahedr lett,1996,37:7201-04.
85 Gerard JM,et al.Loloatins A-D,cyclic decapeptide antibiotics produced in culture by a tropical marine bacterium.J Nat Prod,1999,62:80-85.
86 Krachkovskii SA,et al.Isolation,biological properties,and spatial structure of antibiotic Loloatin A.Russ.J Bioorgan Chem,2002,28:269-273.
87 Chen HR.Preparation and biological evaluation of the Loloatins and their analogues.Hong Kong:Hong Kong University of Science and Technology,PhD.2002.
88 Zhang CW,et al.Thiazomycins,thiazolyl peptide antibiotics from Amycolatopsis fastidiosa.J Nat Prod,2009,72:841-847.
89 Sun P,et al.Fijimycins A-C,three antibacterial etamycinclass depsipeptides from a marine-derived Streptomyces sp.Bioorgan Med Chem,2011,19:6557-6562.
90 Engelhardt K,et al.Production of a new thiopeptide antibiotic,Tp-1161,by a marine Nocardiopsis species.Appl Environ Microb,2010,76:4969-4976.
91 Engelhardt K,et al.Isolation and characterization of the gene cluster for biosynthesis of the Thiopeptide antibiotic Tp-1161.Appl Environ Microb,2010,76:7093-7101.
92 Barsby T,et al.Bogorol a produced in culture by a marine Bacillus sp.reveals a novel template for cationic peptide antibiotics.Org Lett,2001,3:437-440.
93 Li GK(李公克),et al.Studies on compounds SIPI-1140A and B with inhibitory activity against antibiotic-resistant microbes from microorganisms.Chin J Nat Med(中国天然药物),2004,3:189-192.
94 Yang SB(杨少波),Liu XL(刘训理).Research advances in paenibacillus polymyxa and their bioactive substances.Microbiol Chin(微生物学通报),2008,35:1621-1625.
95 Qian ZD(钱朝东).In vitro/in vivo antibacterial activities and mode of action of lipopeptide antibiotics produced bv Paenibacillus tianmuensis sp.nov.Hangzhou:Zhejiang University(浙江大学),PhD.2013.
96 Qian CD,et al.Battacin(Octapeptin B5),a new cyclic lipopeptide antibiotic from Paenibacillus tianmuensis active against multidrug-resistant gram-negative bacteria.Antimicrob Agents Chemother,2012,56:1458-1465.
97 Li WY,et al.Nocathiacins,new thiazolyl peptide antibiotics from Nocardia sp.I.taxonomy,fermentation and biological activities.J Antibiot,2003,56:226-231.
98 Pucci MJ,et al.Antimicrobial evaluation of Nocathiacins,a thiazole peptide class of antibiotics.Antimicrob Agents Chemother,2004,48:3697-3701.
99 Balfour JAB,Figgitt DP.Telithromycin.Drugs,2001,61:815-829.
100 Douthwaite S.Structure-activity relationships of ketolides vs.macrolides.Clin Microbiol Infect,2001,7:11-17.
101 Felmingham D.Microbiological profile of Telithromycin,the first ketolide antimicrobial.Clin Microbiol Infect,2001,7:2-10.
102 Baltch AL,et al.Inhibitory and bactericidal effects of Telithromycin(Hmr 3647,Ru 56647)and five comparative antibiotics,used singly and in combination,against Vancomycin-resistant and Vancomycin-susceptible Enterococci.Chemother,2001,47:250-260.
103 Credito KL,et al.Activity of Telithromycin(Hmr 3647)against anaerobic bacteria compared to those of eight other agents by time-kill methodology.Antimicrob Agents Chemother,1999,43:2027-2031.
104 Li ZY(李喆宇),et al.Progress in studies of macrolide antibotics.World Notes Antibiot(国外医药,抗生素分册),2013,34:6-15.
105 Plata DJ,et al.The synthesis of ketolide antibiotic Abt-773(Cethromycin).Tetrahedron,2004,60:10171-10180.
106 Igarashi M,et al.Tubelactomicin a,a novel 16-membered lactone antibiotic,from Nocardia sp.I.taxonomy,production,isolation and biological properties.J Antibiot,2000,53:1096-1101.
107 Kwon HC,et al.Marinomycins A-D,antitumor-antibiotics of a new structure class from a marine actinomycete of the recently discovered genus“Marinispora”.J Am Chem Soc,2006,128:1622-1632.
108 Ding L,et al.Divergolides A– D from a mangrove endophyte reveal an unparalleled plasticity in ansa-macrolide biosynthesis.Angew Chem Int Ed,2011,50:1630-34.
109 Okujo N,et al.Bispolides,novel 20-membered ring macrodiolide antibiotics from Microbispora.J Antibiot,2007,60:216-219.
110 Lamb HM,et al.Quinupristin/Dalfopristin.Drugs,1999,58:1061-1097.
111 Hershberger E,et al.Quinupristin-Dalfopristin resistance in gram-positive bacteria:mechanism of resistance and epidemiology.Clin Infect Dis,2004,38:92-98.
112 Bearden DT.Clinical pharmacokinetics of Quinupristin/Dalfopristin.Clin Pharmacokinet,2004,43:239-252.
113 Miao L(苗丽),Deng WJ(邓万俊).Treatment progress of multidrug-resistant gram-positive bacteriaassociated infections with Quinupristin/Dalfopristin.World Notes Antibiot,国外医药,抗生素分册,2008,3:118-124.
114 Chu DTW.Recent progress in novel macrolides,Quinolones,and 2-pyridones to overcome bacterial resistance.Med Res Rev,1999,19:497-520.
115 Wang MH(王明华),Wang MG(王明贵).Tigecyeline:a new glycylcyeline antimic robial agent.Chin J Infect Chemother(中国感染与化疗杂志),2006,63:350-355.
116 Bradford PA.Tigecycline:a first in class glycylcycline.Clin Microbiol Newsl,2004,26:163-168.
117 Cheng SH(程仕虎),Wang R(王睿).Research development of Tigecycline:a new glycylcycline antimicrobial agent.Sci Tech Eng(科学技术与工程),2007,7:4123-4130.
118 Jiao WC(矫文策).Characterization of two marine-derived streptomycetes and studies on their bioactive secondary metabolites.Dalian:Dalian University of Technology(大连理工大学),PhD.2013.
119 Okami Y.New aminoglycoside antibiotics,Istamycins A and B.J Antibiot(Tokyo),1979,32:964-966.
120 Kintaka K,et al.Thiotropocin,a new sulfur-containing 7-membered-ring antibiotic produced by a Pseudomonas sp.J Antibiot,1984,37:1294-1300.
121 Doshida J,et al.Exophilin a,a new antibiotic from a marine microorganism Exophiala pisciphila.J Antibiot,1996,49:1105-1109.
122 Zhang CW,et al.Isolation,structure,and antibacterial activity of Philipimycin,a thiazolyl peptide discovered from Actinoplanes philippinensis Ma7347.J Am Chem Soc,2008,130:12102-12110.
123 Asolkar RN,et al.Arenimycin,an antibiotic effective against Rifampin-and methicillin-resistant Staphylococcus aureus from the marine actinomycete Salinispora arenicola.J Antibiot,2010,63:37-39.
124 Isnansetyo A,et al.Antibacterial activity of 2,4-diacetylphloroglucinol produced by Pseudomonas sp.AMSN isolated from a marine alga,against vancomycin-resistant Staphylococcus aureus.Int J Antimicrob Ag,2003,22:545-547.
125 Kamei Y,Isnansetyo A.Lysis of methicillin-resistant Staphylococcus aureus by 2,4-Diacetylphloroglucinol produced by Pseudomonas sp.amsn isolated from a marine alga.Int J Antimicrob Ag,2003,21:71-74.
126 Shiozawa H,et al.Thiomarinols D E F and G,new hybrid antimicrobial antibiotics produced by a marine bacterium;isolation,structure,and antimicrobial activity.J Antibiot(Tokyo),1997,50:449-452.
127 Shiozawa H,et al.Thiomarinol,a new hybrid antimicrobial antibiotic produced by a marine bacterium,fermentation,isolation,structure,and antimicrobial activity.J Antibiot,1993,46:1834-1842.
128 Shiozawa H,Takahashi S.Configurational studies on Thiomarinol.J Antibiot,1994,47:851-853
129 Shiozawa H,et al.Thiomarinols B and C,new antimicrobial antibiotics produced by a marine bacterium.J Antibiot(Tokyo),1995,48:907-909.
130 Isnansetyo A,Kamei Y.Mc21-A,a bactericidal antibiotic produced by a new marine bacterium,Pseudoalteromonas phenolica sp.Nov.O-Bc30t,against methicillin-resistant Staphylococcus aureus.Int J Antimicrob Ag,2009,34:131-135.
131 Isnansetyo A,Kamei Y.Anti-methicillin-resistant Staphylo-coccus aureus(MRSA)activity of Mc21-B,an antibacterial compound produced by the marine bacterium Pseudoalteromonas phenolica O-Bc30t.Int J Antimicrob Ag,2009,34:131-135.
132 Kanoh K,et al.New sulfoalkylresorcinol from marine-derived fungus,Zygosporium sp.Knc52.J Antibiot,2008,61:192-194.
133 Newman DJ,Cragg GM.Natural products as sources of new drugs over the last 25 years.J Nat Prod,2007,70:461-77.
134 Yang J(杨静),Liao MD(廖美德).放线菌资源及其应用.World Pestic(世界农药),2014,1:22-26.
135 Ren XM(任香梅),et al.Aromatic amide metabolites from the marine-derived Streptomyces lusitanus SCSIO LR3.Nat Prod Res Dev(天然产物研究与开发),2011,4:591-595.
136 Blunt JW,et al.Marine natural products.Nat Prod Rep,2013,30:237-323.
137 Blunt JW,et al.Marine natural products.Nat Prod Rep,2012,29:144-222.
138 Jiao BH(焦炳华),et al.The research prog ress on the marine microorganism-derived novel antibiotics.Ant Inf Pharm(抗感染药学),2004,1:1-9.
139 Rahman H,et al.Novel anti-infective compounds from marine bacteria.Marine Drugs,2010,8:498-518.
140 Sun H(孙慧),et al.Nosocomial infection pathogens:their drug-resistance analysis and distribution.J Disease Monit Control,2014,1:4-6.
141 He KL(何卡乐),et al.Distribution of clinical isolated strain and resistance monitoring in our hospital during 2008-2012.Chin Pharm(中国药房),2014,26:2429-2431.
142 Zhu DM(朱德妹),et al.CHINET 2009 surveillance of bacteral resistance in China.Chin J Infect Chemother(中国感染与化疗杂志),2011,5:321-329.
143 Yang QW,et al.Phenotypic and genotypic characterization of Enterobacteriaceae with decreased susceptibility to carbapenems:results from large hospital-based surveillance studies in China.Antimicrob Agents Chemother,2010,54:573-577.
144 Wang P,et al.Susceptibility of extended-spectrum-β-Lactamase-producing Enterobacteriaceae according to the new clsibreakpoints.J Clin Microbiol,2011,49:3127-3131.
