蚯蚓葡萄糖氧化酶的提取纯化研究
2015-01-11荣永海
李 娇,原 琳,荣永海,荣 龙
北京航空航天大学生物与医学工程学院,北京 100191
蚯蚓,又称地龙,属寡毛纲环节动物门。在我国入药已有四千余年的历史,具有解热、镇痉、活络、平喘等功效,是一种常见的动物药材[1]。近年来,研究者发现蚯蚓含有多种生物活性成分,并且具有多方面的药理作用和临床疗效,引起了人们的广泛关注[2]。目前,研究主要集中在蚯蚓纤溶酶、抗肿瘤蛋白[3]、抗菌肽[4]等成分的提取和纯化方面。研究表明,蚯蚓体内还含有丰富的抗氧化酶,它们具有重要的生理功能,可以清除体内多余的自由基,能够治疗疾病,延缓衰老。
蚯蚓体内的抗氧化酶类包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽还原酶(GSH-R)、葡萄糖氧化酶(GOD)等,其中,我室对蚯蚓中SOD 和CAT 提取的相关研究已经比较成熟[5]。有氧条件下能专一性地催化β-D-葡糖生成葡萄糖酸和过氧化氢[6],在各行业具有广泛的应用。在食品工业中,GOD 可用于去葡萄糖[7]、脱氧[8]、杀菌、测定葡萄糖含量等;在医药行业,GOD 可以用于尿糖试纸,血糖试纸和葡萄糖酸的生产等;在生物方面,GOD 是生物传感器领域最主要的工具酶[9]。目前,GOD 的提取来源主要有黑曲霉和青霉属菌株[8],动植物组织中GOD 的含量极其低,未见从蚯蚓中提取纯化GOD的相关报道。如果从蚯蚓中提取并纯化得到GOD,这不仅将拓宽GOD 的来源,并且能够扩展蚯蚓的应用范围,对蚯蚓的进一步开发利用具有重要意义。
在此前的研究中,本实验室采用闪式提取法对铁皮石斛多糖[10]、罗汉果多酚[11]、柑橘柠檬苦素[12]、罗汉果甜苷[13]等生物成分进行提取,与传统提取方法相比,在提取时间,提取效率方面具有明显的优势,因此,从节能高效方面考虑,本研究采取闪式提取这一新型方法对GOD 进行提取。
1 材料与方法
1.1 主要材料与试剂
实验用赤子爱胜蚯蚓(Eisenia fetida)由天津蚓福生物科技开发有限公司提供;羧甲基纤维素CM-22 购买自英国Whatman 公司;二乙胺基乙基纤维素(DEAE-Cellulose)购自上海试剂二厂;GOD 活性检测用苯酚和葡萄糖购自北京化工厂,4-氨基安替比林和Triton X-100 均购自国药集团化学试剂有限公司;蛋白检测用考马斯亮蓝G-250 购自美国Amresco公司;其他试剂均从北京化工厂购买;全部试剂均为分析纯或色谱纯等级;实验过程中所使用双蒸水由实验室自己制得。
1.2 主要仪器与设备
ArantiTMJ-25 型低温高速离心机,美国Beckman Coulter 公司;SP-756P 型分光光度计,上海光谱仪器有限公司;JHBE-50S 型闪式提取器,北京金鼐科技发展有限公司;蛋白分离纯化层析柱,上海锦华层析设备厂;868 型酸度计,美国Orion 公司;双蒸水过滤器,美国PALL 公司。
1.3 试验方法
1.3.1 蚯蚓的预处理
取100 g 冷冻新鲜蚯蚓(已洗净),剪碎,以1∶4(m/v)的体积加入已预冷的50 mmol/L pH 4.8 的醋酸缓冲液(1 mmol/L EDTA),使用闪式提取器进行提取(转速5500 rpm,提取两次,每次30 s,每次间隔5 min),闪提后使用800 W 超声提取器提取30 min,冻存(-70 ℃)12 h。冻存液溶化后使用低温离心机离心(转速10000 rpm,时间50 min),离心得到的上清液为粗酶液,测定酶活及蛋白浓度。
1.3.2 预处理条件的正交优化
1.3.2.1 单因素实验
对于蚯蚓的预处理步骤,影响酶活的主要因素有缓冲液的pH 值、固液比、闪提时间、闪提转速及超声时间。为优选正交试验的条件及水平,先对各因素进行单因素实验。单因素实验的因素及水平见表1。
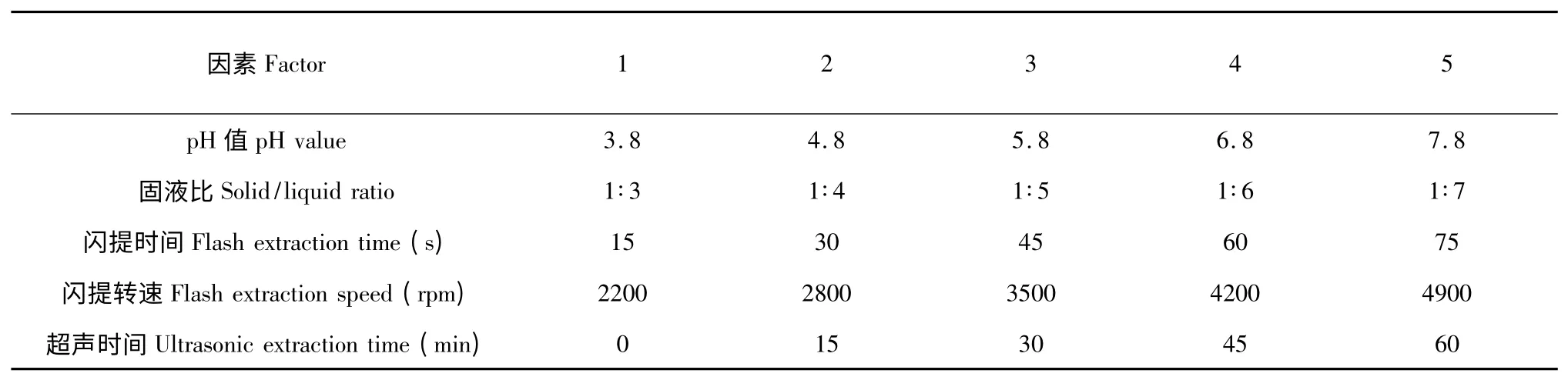
表1 单因素实验因素水平表Table 1 Factors and levels of single factor experimental design
1.3.2.2 正交试验
根据单因素实验的结果,选取对酶活影响较大的因素作为正交试验的考察因素,正交试验的因素水平表见表2。

表2 正交试验因素水平表Table 2 Factors and levels of orthogonal test
1.3.3 GOD 的纯化
1.3.3.1 酸沉淀
用醋酸将粗提液的pH 调至4.5,冰箱中(-20℃)放置15 min,离心(转速10000 rpm,4 ℃,50 min),离心后取上清,测酶活,测蛋白浓度。
1.3.3.2 CM-22
CM-22 离子交换柱填料按说明处理,装柱后用50 mmol/L pH 4.5 的醋酸缓冲液平衡。酸沉淀后的上清液pH 调至4.5,上CM-22 柱(2.5 cm×45 cm),流速2 mL/min,用同缓冲液洗净。CM-22 吸附柱用0.6 mol/L pH 5.0 醋酸缓冲液进行洗脱,流速1 mL/min,收集液即为GOD 粗提液,测定酶活,蛋白浓度。收集液用2.5 mmol/L pH 7.6 的磷酸缓冲液透析4 h。
1.3.3.3 DEAE-Cellulose
DEAE-Cellulose 离子交换柱填料按说明处理,装柱后用2.5 mmol/L pH 7.6 的磷酸缓冲液平衡。透析后的酶粗提液上DEAE-C 柱(1.6 cm×30 cm),用同缓冲液洗净,然后用0.6 mol/L 的NaCl 溶液进行洗脱,流速1 mL/min,收集液即为GOD 酶液,测定酶活,测定蛋白含量。
1.3.4 GOD 活性测定
[14,15]的方法,反应体系为3 mL,其中包含pH 7.0 0.1 mol/L 的磷酸缓冲液,16 mmol/L的苯酚及4 mmol/L 的Triton X-100,7.5 mmol/L 的4-氨基安替吡啉,0.55 mol/L 的葡萄糖溶液以及0.1 mg/mL 的辣根过氧化物酶,上述混合溶液震荡混匀后,加入0.1 mL 葡萄糖氧化酶溶液,SP-756P 型分光光度计,于37 ℃、λ=500nm 自动记录随时间变化的吸光度值。酶活力单位定义为:在上述条件下,每毫升溶液中每分钟催化葡萄糖水解产生1 μmol 产物的酶量。比活力定义为:每毫克酶蛋白所具有的酶活力单位数。
1.3.5 蛋白浓度的测定
蛋白质浓度采用考马斯亮蓝法测定,参考文献[16],以标准牛血清蛋白为标准品绘制曲线。
1.3.6 热稳定性
在含0.1 mol/L pH7.0 的磷酸缓冲液中,将GOD 酶液分别置于-18、4、10、20、30、40、50、60、70、80 ℃水浴中,保温2 h,分别测定酶活性。
1.3.7 pH 值稳定性
将GOD 酶液置于0.1 mol/L 磷酸氢二钠-柠檬酸缓冲液(pH 2~8)、0.1 mol/L 的甘氨酸-氢氧化钠缓冲液(pH 9~10)、0.1 mol/L 的磷酸氢二钠-氢氧化钠缓冲液(pH 11)中,4 ℃保温2 h 后,分别测定酶活性。
1.3.8 最适温度
将酶反应体系在22~77 ℃下孵育30 min,分别测定GOD 的活性。
1.3.9 最适pH
将GOD 酶液置于用0.1 mol/L 磷酸氢二钠-柠檬酸缓冲液(pH 2~8)、0.1 mol/L 的甘氨酸-氢氧化钠缓冲液(pH 9~10)、0.1 mol/L 的磷酸氢二钠-氢氧化钠缓冲液(pH 11)配制成的反应体系中反应,计算反应后酶活。
2 实验结果
2.1 蚯蚓预处理的优化
2.1.1 单因素实验结果及分析
2.1.1.1 pH 值如图1 所示,当缓冲液的pH 值由3.8 升到4.8时,GOD 的比活上升,随后下降,但是变化趋势不明显,因此,正交试验时不考虑此因素。当pH 为4.8时,GOD 的比活最高,因此,闪提时缓冲液的pH 选为4.8。
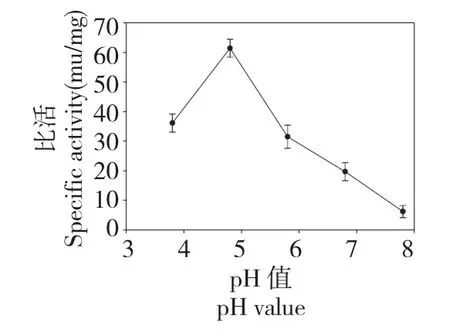
图1 pH 值对比活的影响Fig.1 Effect of pH value on the specific activity of GOD
2.1.1.2 固液比
图2 表明,GOD 的比活先随液固比升高而升高,当液固比为4∶1(mL/g)时,酶的比活达到最高,随后下降,且趋势明显,因此,该因素被选为正交试验的考察因素。

图2 固液比对比活的影响Fig.2 Effect of solid/liquid ratio on the specific activity of GOD
2.1.1.3 闪提时间
图3 表明,随着闪提时间的增加,GOD 的比活有升高的趋势,当闪提时间达到45 s 后,比活开始下降,趋势明显,因此闪提时间可选为正交试验的考察因素。
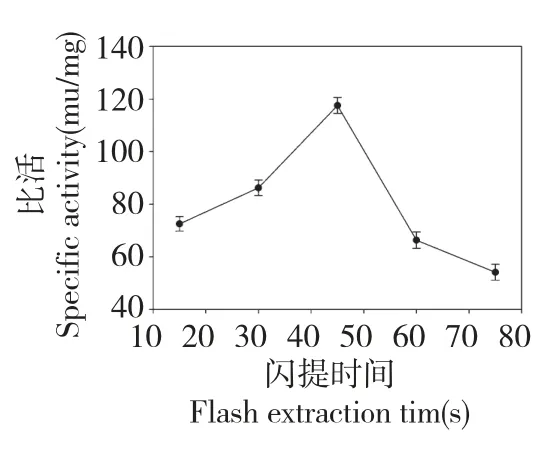
图3 闪提时间对比活的影响Fig.3 Effect of flash extraction time on the specific activity of GOD
2.1.1.4 闪提转速
如图4 所示,随着闪提转速的增加,GOD 的比活略有升高,当转速达到2800 rpm 后,比活开始下降,当转速由2200 rpm 升高到3500 rpm 的过程中,GOD 的比活变化很小,因此排除此因素,在实验过程中,选取2800 rpm 为实验转速。
2.1.1.5 超声时间
图5 表明,随着超声时间的增长,GOD 的比活升高,当超声时间达到30 min 后,比活开始下降,且整个过程变化趋势明显,因此该因素可选为正交试验的考察因素。
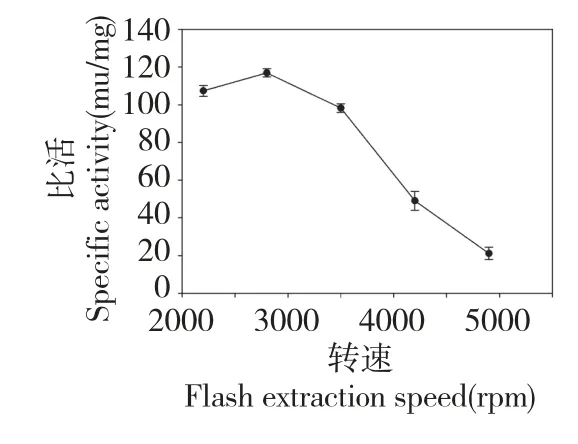
图4 闪提转速对比活的影响Fig.4 Effect of flash extraction speed on the specific activity of GOD
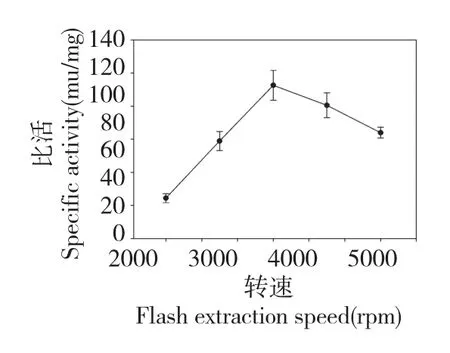
图5 超声时间对比活的影响Fig.5 Effect of Ultrasonic extraction time on the specific activity of GOD
2.1.2 正交试验的结果及分析
如表3 所示,影响蚯蚓GOD 比活的因素主次影响顺序为A>B>C,即固液比>超声时间>闪提时间。三个因素的最佳搭配组合为A3B2C2,即固液比1∶4.5(g/mL),超声时间30 min,闪提时间45 s,在此条件下,蚯蚓预处理部分效果最好。
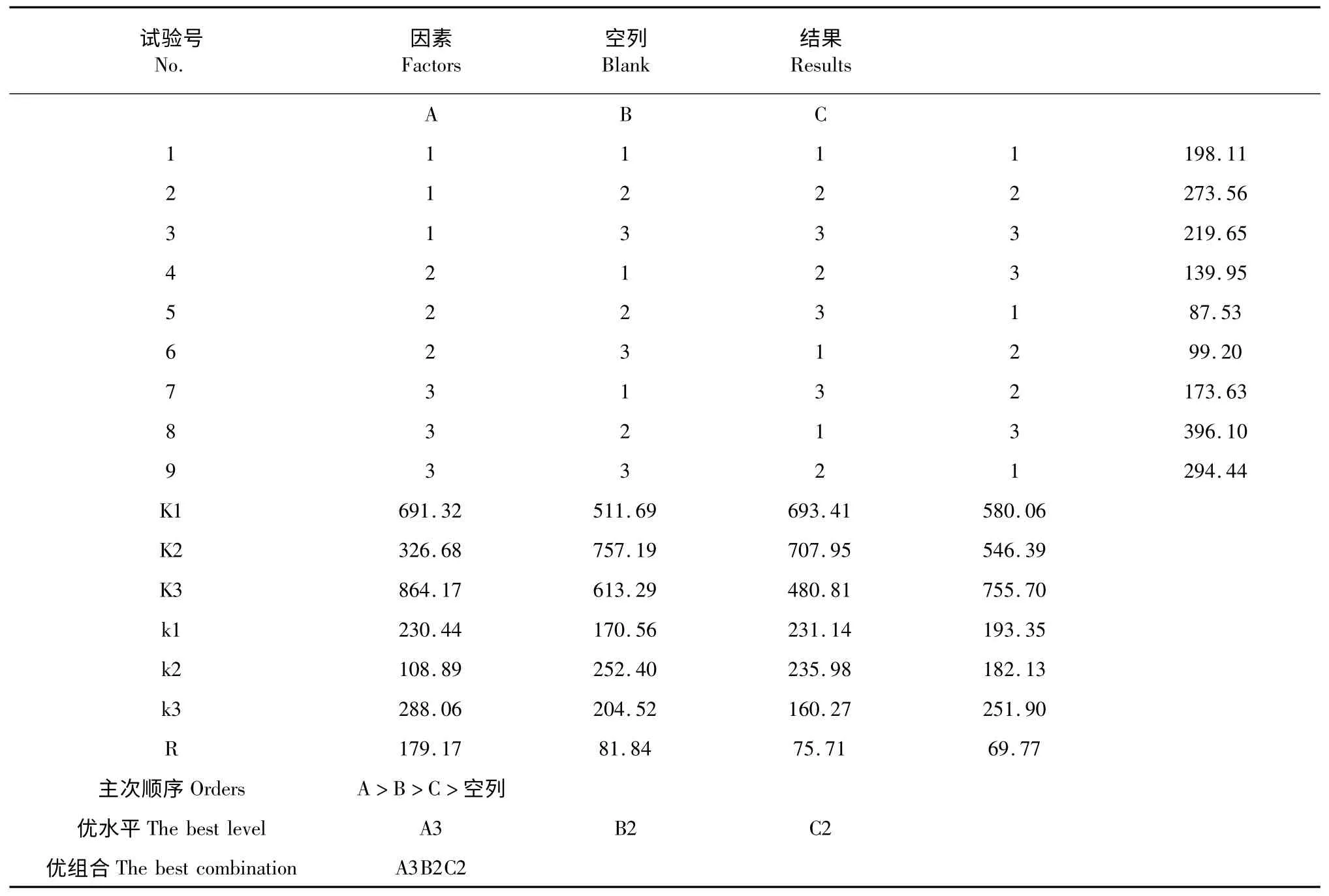
表3 正交试验结果Table 3 Results of L9(34)experimental design for the extraction of GOD
正交试验的方差分析结果如表4 所示。料液比对蚯蚓GOD 的酶活影响比较显著,而超声时间和闪提时间两因素对GOD 酶活的影响相对不显著,影响主次顺序为料液比>闪提时间>超声时间,这与极差分析的结果有一定不同,不过从数据可以看出,闪提时间与超声时间对GOD 提取的影响显著性差距不大,因此会出现分析结果的差异,以方差分析结果为准,即料液比>闪提时间>超声时间。
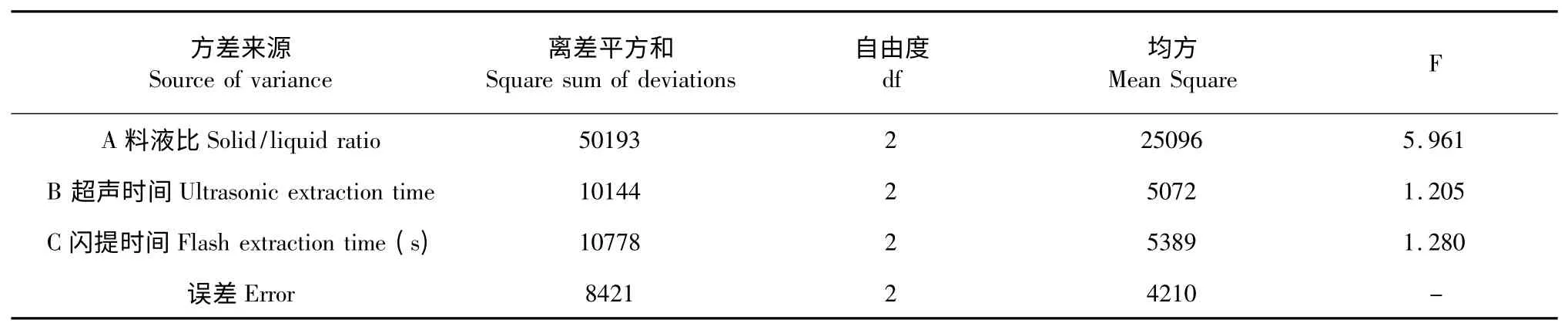
表4 方差分析Table 4 ANOVA of the GOD extraction
2.2 蚯蚓GOD 的纯化
GOD 粗酶液经酸沉淀后,比活为131.87 mU/mg。CM-22 的洗脱收集液液,比活为368.13 mU/mg。DEAE 柱的洗脱收集液,比活为2684.21 mU/mg,纯化倍数达到了37 倍,如表5 所示。
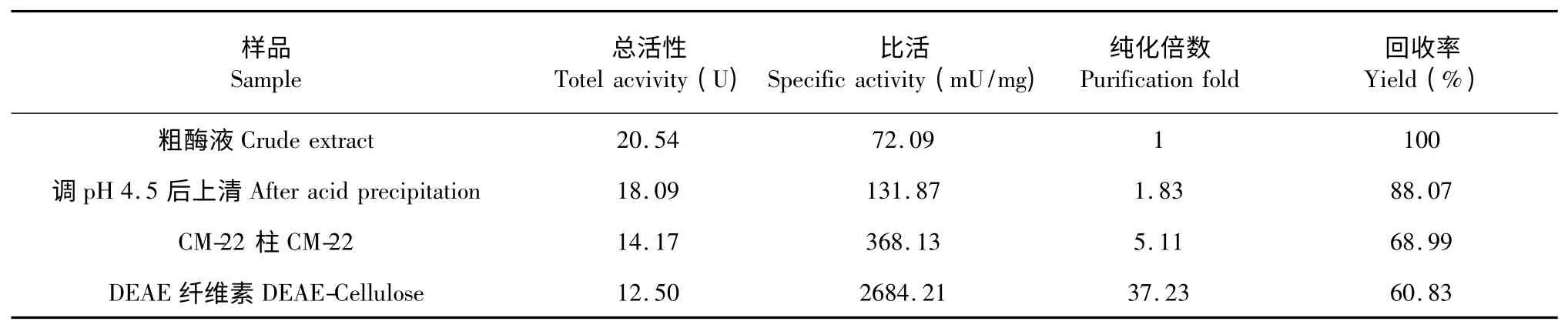
表5 蚯蚓GOD 纯化结果Table 5 Purification results of GOD from the earthworm
GOD 的提取纯化现状如表6 所示,GOD 主要来源于青霉与黑曲霉[15,17],提取纯化工艺比较成熟,纯化方法包括超滤浓缩、硫酸铵盐析、DEAE-纤维素离子交换层析、Sephadex 凝胶过滤纯化等,倍数大约为20~30,回收率约为30%,本实验中GOD 的纯化倍数达到了37 倍,回收率达到了61%,与已知的青霉菌与黑曲霉的纯化工艺相比,纯化步骤简单,回收率高,纯化倍数高,达到了很好的提取效果。
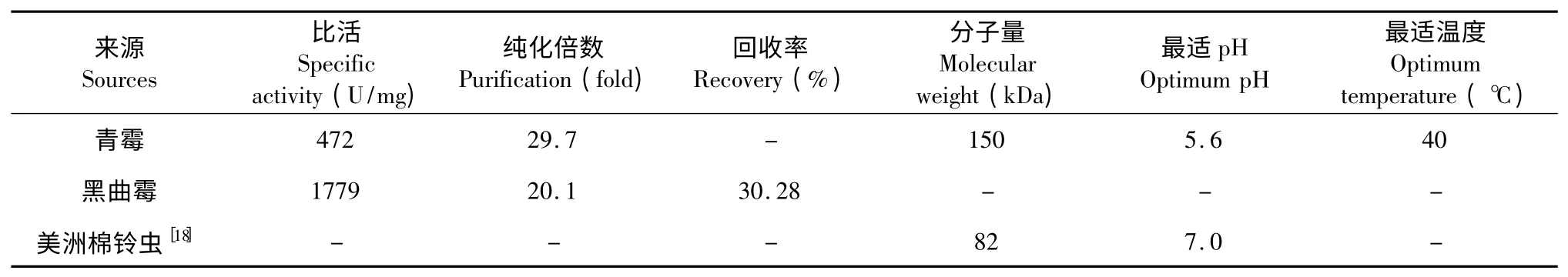
表6 GOD 的提取纯化现状Table 6 Extraction and purification status of GOD
2.3 蚯蚓GOD 的稳定性
2.3.1 GOD 的温度稳定性
如图6 所示,蚯蚓GOD 在20 ℃时稳定性最好,在4~30 ℃之间具有较好的稳定性,当温度达到60℃时,GOD 几乎丧失全部活性。
2.3.2 GOD 的pH 值稳定性
结果如图7 所示,蚯蚓GOD 在pH4~7 之间具有良好的稳定性(相对活性在80%以上),与昆虫来源的GOD 近似[17]。当pH 8 时,相对酶活也在60%以上,当pH 为2 及pH 大于9 时,GOD 几乎完全失活。根据GOD 对不同pH 值的敏感性,在实验过程中,缓冲体系的pH 一直保持在pH4~7 之间。
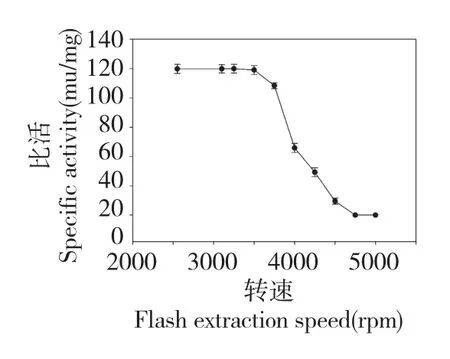
图6 蚯蚓GOD 的热稳定性Fig.6 Temperature stability of GOD
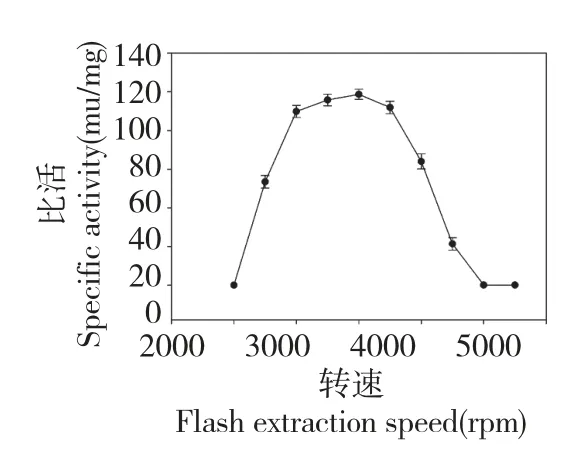
图7 蚯蚓GOD 的pH 值稳定性Fig.7 pH stability of GOD
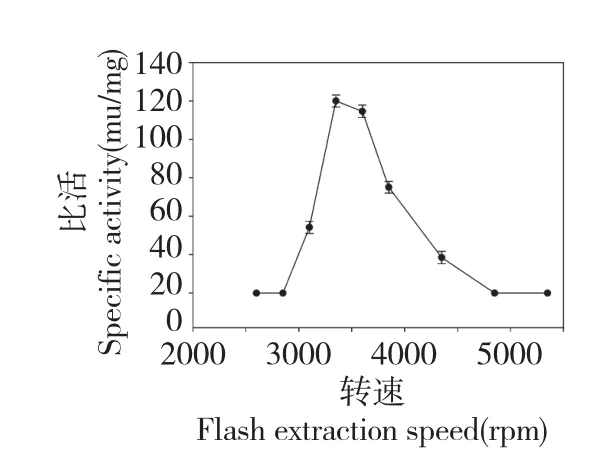
图8 蚯蚓GOD 的最适反应温度Fig.8 The optimal reaction temperature of GOD
2.4 蚯蚓GOD 的最适反应温度
如图8 所示,GOD 的最适反应温度为37 ℃,这与青霉菌来源的GOD[17]基本是一致的,当温度低于32 ℃或者高于57 ℃时,相对酶活性下降至40%以下。所以,我们在实验中检测GOD 酶活性时温度控制在37 ℃。
2.5 蚯蚓GOD 的最适pH 值
如图9 所示,GOD 的反应活性对pH 值非常敏感,它的最适反应pH 值为7,当pH 值大于7 时,酶活迅速降低,当pH 值小于6 时,相对酶活降低到60%以下。所以,在检测GOD 活性时,反应体系的pH 一定要严格控制为7。
3 结论
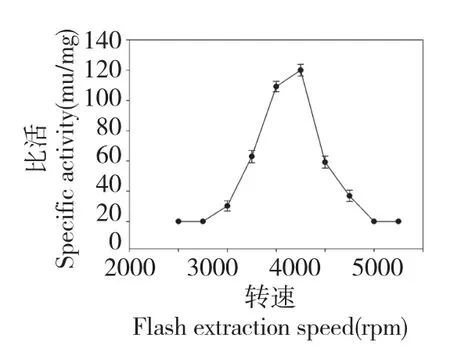
图9 蚯蚓GOD 的最适pH 值Fig.9 The optimal reaction pH value of GOD
在本研究中,我们利用闪式提取技术提取蚯蚓葡萄糖氧化酶(GOD),并采用正交试验法优化了闪提及超声实验条件,得到的最优条件为:固液比1∶4.5(g/mL),闪提时间45 s,超声时间30 min。
利用柱层析等方法对蚯蚓GOD 进行纯化,最终回收率达到了60.8%,纯化倍数达到了37.2。本实验提纯的GOD 最适pH 为7,酶在pH4~7 区间较稳定,酶活保持在80%以上,酶最适温度为37 ℃,温度升高时,酶迅速失活,此结果表明蚯蚓来源的GOD 与真菌来源GOD 在稳定性方面具有一定差异性,这对进一步的研究及工业应用具有一定的指导意义。本研究成功从蚯蚓中纯化得到GOD,不仅拓宽了GOD 的生物来源,同时提高了蚯蚓的综合利用率。
参考文献
1 Sun XD(孙晓东),Fang ZH(房泽海).Pharmacological effects and clinical research progress of earthworms.Sci Technol Innov Herald(科技创新导报),2009,12:2-3.
2 Cheng G(程果),Xu S(徐晟),Xiao X(肖湘),et al.Purification technique and pharmacologic action of active ingredients in earthworms.J Economic Animal(经济动物学报),2011,15:114-119.
3 Xie JB(谢江碧),Guo ZQ(郭振泉),Weng N(翁宁),et al.Purification,identification and partial characterization of an apoptosis-related serine protease from earthworm.Prog Biochem Biophys(生物化学与生物物理进展),2003,30:453-459.
4 Yan QL,Zhen JS,Chong W,et al.Purification of a novel antibacterial short peptide in earthworm Eisenia foetide.Acta Biochim Biophysic Sin,2004,36:297-302.
5 Liao Y(廖怡),Rong YH(荣永海),Rong L(荣龙).Combined extraction of superoxide dismutase and catalase from earthworm Eisenia fetida.Nat Prod Res Dev(天然产物研究与开发),2012,11:1538-1544.
6 Zhao XF(赵晓芳),Zhang HF(张宏福).The function of glucose oxidase and its application in animal husbandry.Guangdong Feed(广东畜牧),2007,16:34-35.
7 Xu YQ(徐雅琴),Yang YJ(杨严俊),Cao RY(曹如燕).Study on removal of glucose in egg white by glucose oxidase.Food Ferment Ind(食品与发酵工业),2005,31(2):55-58.
8 Liu C(刘超),Yuan JG(袁建国),Wang YX(王元秀),et al.Progress on glucose oxidase.Food Drug(食品与药品),2010,12:285-288.
9 Zhang GD(张广栋),Luo CX(罗仓学).Biosensor and its application in food industry.Food Res Dev(食品研究与开发),2005,26:133-134.
10 Li J(李娇),Rong YH(荣永海),Rong L(荣龙).Flash extraction of polysaccharide from Dendrobium officinale.Chin Med Mat(中药材),2013,9:1524-1527.
11 Liu C,Rong YH,Rong L.Flash extraction of polyphenols from fruits of Siraitia grosvenorii.Food Sci,2010,31(22):50-53.
12 Liu J(刘静),Liu C(刘灿),Rong YH(荣永海),et al.Optimization of homogenate extraction process of limonin via statistical methods.J South China Univ Technol,Nat Sci(华南理工大学,自科版),2011,39(9):28-33.
13 Liu Z(刘兆),Rong YH(荣永海),Rong L(荣龙).Flash extraction of mogroside from fruits of Siraitia grosvenorii.Nat Prod Res Dev(天然产物研究与开发),2011,23:561-564.
14 Liao JH(廖金花),Chen Q(陈巧),Chen QX(陈清西),et al.Purification and characterization of alkaline Phosphatase from Haliotis diversicolor.J Xiamen Univ,Nat Sci(厦门大学学报,自科版),2005,44:272-275.
15 Zhang Q(张茜),Fu WH(傅婉辉),Kang JH(康劲翮),et al.Purification and characterization of glucose oxidase from Penicillium amagasakiense.J Xiamen Univ,Nat Sci(厦门大学学报,自科版),2009,48:99-102.
16 Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,1976,72:248-254.
17 Wang ZX(王志新),Li N(李宁),Han J(韩军),et al.Extraction and purification of glucose oxidase from Aspergillus niger A9.J Chin Inst Food Sci Technol(中国食品学报),2007,7:64-67.
18 Hu YH(胡永红),Wang CZ(王琛柱).Glucose oxidase ininsects and its function.Chin Bull Entomol(昆虫知识),2009,46:337-342.
