榅桲总多酚的纯化工艺及PTP1B 抑制作用研究
2015-01-11哈及尼沙阿力木江阿布力孜阿米娜阿吉艾克拜尔艾萨
哈及尼沙,阿力木江·阿布力孜,阿米娜,阿吉艾克拜尔·艾萨*
1 新疆医科大学药学院;2 中国科学院干旱区植物资源化学重点实验室 中国科学院新疆理化技术研究所,乌鲁木齐 830011
榅桲(Cydonia oblonga Mill.)是蔷薇科(Rosaceae)榅桲属(Cydonia)植物榅桲的成熟果实[1]。榅桲有浓郁香味,酸甜,性温无毒。榅桲在新疆民间被当作水果、药品及调料品使用,具有补身益心、增益精神力、助胃利水、止渴止咳、止血止泻、开胃等作用,相传已有数百年应用历史[2]。据典籍记载及现代研究表明,榅桲具有较高的食用和药用价值,是维吾尔医常用药材[3,4]。榅桲中主要有效成分是多酚类化合物[5-7],具有抗氧化、抗菌、抗炎和抗病毒等活性[8-12]。目前对榅桲中多酚类物质的提取、纯化方面没有发现相关文献报道。
大孔树脂为一种有机高聚物吸附剂,具有吸附、富集、分离不同母核结构化合物的功能[13]。该方法具有设备简单、操作方便、节省能源、成本低、产品纯度高、不吸潮等优点,应用于多酚类成分的富集、纯化有较好的效果[14]。
本研究从11 种大孔吸附树脂中筛选出对榅桲总多酚具有良好吸附和解吸性能的树脂,探索适宜的纯化条件;同时对榅桲总多酚进行PTP1B 抑制作用的研究,为合理开发利用榅桲资源提供科学依据。
1 材料与方法
1.1 材料与仪器
榅桲采自新疆克州上阿图什乡,经中科院新疆生态与地理研究所植物分类研究室沈观冕研究员鉴定为蔷薇科榅桲属植物榅桲(Cydonia oblonga Mill.)的果实;HPD-100、HPD-300、HPD-450、HPD-750 型大孔吸附树脂,上海五维化工科技有限公司;D101 型大孔吸附树脂,上海摩速科学器材有限公司;D140、NKA-9、AB-8、X-5、DM130 型大孔吸附树脂,南开大学化工厂;ADS-17 型大孔吸附树脂,山东鲁抗医药股份有限公司;没食子酸对照品(批号:110831-20120),中国食品药品检定研究院;其他试剂均为国产分析纯。
UV-2550 型紫外分光光度仪,日本岛津;Buchi R-210 型旋转蒸发仪,瑞士Buchi 公司;YP5120 型电子分析天平,上海光正医疗仪器有限公司;HH-4 型智能数显恒温水浴锅,巩义市予华仪器有限责任公司;HZQ-F160 型全温震荡培养箱,金坛市万华实验仪器厂;SpectraMax MD5 型酶标仪,美谷分子仪器有限公司;DZF-6020 型真空干燥箱,上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 没食子酸标准曲线的绘制
精密称取没食子酸对照品6.1 mg,加水溶解并定容至100 mL,摇匀,制成浓度为61 μg/mL 的对照品溶液。准确吸取没食子酸对照品溶液0、0.5、1.0、2.0、3.0 和4.0 mL 于25 mL 容量瓶中,加磷钼钨酸溶液1.0 mL,加蒸馏水14 mL,再用29%碳酸钠溶液稀释至刻度,摇匀,放置30 min。以没加对照品的溶液作为空白,在500~900 nm 波长范围光谱扫描,确定757 nm 处的最大吸收为检测波长,测定各标准溶液的吸光度。以吸光度(A)为纵坐标,浓度(C,μg/mL)为横坐标,绘制标准曲线,其线性回归方程为A=0.1196C+0.0408,相关系数r=0.9993。结果表明,在没食子酸质量浓度为1.22~9.76 μg/mL 范围内吸光度和浓度保持较好的线性关系。
1.2.2 榅桲总多酚粗提物的制备
称取榅桲果实粉末约250 g,在乙醇体积浓度60%、料液比1∶40(g/mL)、提取时间1 h、温度80 ℃的条件下回流提取2 次,合并提取液减压浓缩至无乙醇味,干燥得粗多酚浸膏,加蒸馏水超声溶解配制榅桲总多酚提取液(药液质量浓度为1.630 g/mL),备用。
1.2.3 大孔吸附树脂的预处理
分别称取AB-8、D-140、X-5、HPD-100、HPD-450、HPD-300、HPD-750、ADS-17、D-101、DM-130、NKA-9 型等11 种大孔吸附树脂各3.0 g,分别加入30 mL 无水乙醇浸泡24 h,使其充分溶胀,用湿法装柱。用无水乙醇以2 BV/h 的流速淋洗树脂至流出液加入蒸馏水后不呈现白色浑浊为止,再用蒸馏水以同样的流速洗至无醇味。然后用5% HCl 溶液以2 BV/h 流速通过树脂并浸泡3 h,用蒸馏水洗至中性。再用2% NaOH 溶液,以2 BV/h 流速通过树脂并浸泡3 h,用蒸馏水洗至中性。
1.2.4 大孔吸附树脂的筛选
1.2.4.1 大孔树脂对榅桲总多酚吸附率的测定
准确称取预处理过的大孔树脂各2.0 g,置于磨口锥形瓶中,分别加入样品液30 mL,密封,摇匀,在室温放置24 h,时时振摇至吸附平衡。分别精密量取各树脂吸附后的溶液0.4 mL 于25 mL 容量瓶中,显色后于757 nm 处测定吸光度,计算各滤液中总多酚的浓度,按下面的公式计算总多酚吸附量和吸附率。
吸附量(mg/g 树脂)=[(C0-C1)×V1]/W
吸附率(%)=[(C0-C1)/C0]×100
式中:C0为初始样品液质量浓度(mg/mL);C1为吸附后上清液中样品液质量浓度(mg/mL);V1为加入样品液体积(mL);W 大孔吸附树脂质量(g)。
1.2.4.2 大孔树脂对榅桲总多酚解吸率的测定
将上述吸附饱和的11 种大孔树脂过滤后,加入60%的乙醇溶液30 mL,密封后摇匀,在室温放置24 h,时时振摇,使榅桲总多酚解吸附,过滤,精密量取各树脂解吸附后的溶液0.4 mL,于25 mL 容量瓶中,显色,测定吸光度,计算各种树脂对榅桲总多酚的解吸率。
解吸率t(%)=[(C2×V)/(W×CA)]×100
式中:CA 为吸附量(mg/g 树脂);C2为解吸液中多酚液质量浓度(mg/mL);V 为所加乙醇的体积(mL);W 为大孔吸附树脂质量(g)。
1.2.5 大孔树脂动态吸附-解吸条件的优化
由筛选实验选出一种理想大孔吸附树脂,按
1.2.3 方法先进行预处理,湿法装入1.5×25.0 cm层析柱中,分别考察上样液质量浓度、上样量、上样流速和洗脱液浓度、洗脱液用量、洗脱流速等进行动态吸附及解吸实验,确定最佳工艺条件。
1.2.6 PTP1B 抑制作用的研究
将用大孔吸附树脂纯化前后的榅桲多酚按照文献[15]方法,即样品用适量DMSO 溶解,取1 μL 加入至200 μL 反应体系中(pH 6.0,1 mmol/L EDTA,0.1 mol/L NaCl,5 mmol/L DDT,50 mmol/L 柠檬酸),加入底物pNPP 至10 mmol/L,加人人重组PTP1B(PROSPEC)0.5 μg 开始反应,37 ℃保温30 min,加入10 mmol/L NaOH 20 μL 终止反应,用酶标仪在405 nm 测定吸收度(A)值,以原钒酸钠作为阳性对照,以不加PTP1B 为空白对照,计算抑制率:
抑制率=(OD405空白-OD405样品)/OD405空白×100%
应用Origin 软件计算IC50值,以此判断榅桲总多酚对PTP1B 的抑制能力。
2 结果与分析
2.1 大孔树脂的筛选
如表1 所示,11 种大孔吸附树脂对榅桲多酚的吸附率和解吸率均有不同。其中对榅桲多酚的吸附量较大的三种树脂依次为HPD-300、HPD-100、AB-8型树脂。这可能是大孔树脂的吸附原理主要为物理吸附,比表面积越大,表面张力随之增大,吸附量就会提高。这三种树脂的解吸率看,前两种树脂的解吸率低,AB-8 型大孔树脂的解吸率在11 种树脂中最高(79.68%)。AB-8 型大孔树脂比表面积中等,且具有较大的孔径,吸附-解吸综合性能比较合理,因此选择AB-8 型大孔吸附树脂来分离纯化榅桲总多酚。

表1 11 种大孔树脂的性质和静态吸附与解吸数据Table 1 Physical properties and static adsorption-desorption rate of 11 macroporous resins
2.2 大孔吸附树脂动态吸附条件的优化
2.2.1 上样液浓度的选择
将榅桲多酚样品液稀释成0.02、0.04、0.06、0.08、0.16 g/mL 等不同浓度的上样液,以2 BV/h的流速上样,测定流出液中榅桲总多酚的浓度,计算吸附量。结果如图1 所示,当样液浓度小于0.04 g/mL 时,随着样液浓度的增加,吸附量增大,但高于0.04 g/mL 后多酚吸附率又有所降低。所以,并不是浓度越大吸附效果越好,药液的澄清度也会影响树脂的吸附效果,上样液浓度过大时,榅桲多酚在树脂内部扩散速度减慢,赌赛树脂空隙而影响吸附。因此,选择上样液质量浓度为0.04 g/mL。

图1 上样液浓度对吸附量的影响Fig.1 Effect of sample concentration on adsorption capacity
2.2.2 上样液流速的选择
取0.04 g/mL 榅桲提取液9 BV,分别以1、2、3、4 BV/h 的流速进行吸附,测定流出液中榅桲多酚的浓度,计算出吸附量。由图2 可知,随着上样流速的增加,吸附量整体呈下降趋势。上样液流速越慢,被吸附物质能充分扩散到树脂的内表面,从而吸附的越完全[16]。为了节省时间,选择上样液流速以2 BV/h 较为适宜。

图2 上样流速对吸附量的影响Fig.2 Effect of sample flow rate on adsorption capacity
2.2.3 上样量的选择
取榅桲粗提取液以2 BV/h 的流速上柱后,分步收集漏出液,每20 mL(1 BV)收集1 个流份,测定漏出液中榅桲多酚的浓度。结果如图3 所示,随着上样量的增加,流出液中榅桲多酚质量浓度不断上升,上样量从9 BV 开始,泄露速度趋于比较稳定,即9~14 BV 达到一个动态平衡。上样量达到15 BV时,流出液与上样液总酚含量几乎相等。但上样量过多,不仅会使纯化周期将延长,工作效率降低,而且会影响多酚总收率。综合考虑,选择上样量为11 BV。

图3 AB-8 大孔树脂对榅桲多酚的动态吸附曲线Fig.3 Adsorption curve of C.oblonga polyphenols on AB-8 resin
2.3 大孔吸附树脂动态解吸条件的优化
2.3.1 除杂用水量的选择
将已吸附榅桲多酚提取液饱和的AB-8 树脂柱,用水以1、2、3、4、5 BV/h 流速洗脱,测定流出液中总多酚含量。由图4 可知,开始时有少量未被吸附的多酚冲洗下来,当用水量到3 BV 时,流出液接近无色,水洗脱体积3 BV 后开始有微量多酚被洗脱,因此选择水洗脱体积为3 BV。能快速淋洗树脂柱以除去蛋白质、多糖等水溶性杂质。

图4 除杂用水量的选择Fig.4 Selection of the volume of elution water
2.3.2 洗脱剂浓度的选择
取0.04 g/mL 榅桲提取液11 BV 上AB-8 大孔树脂柱后,首先用蒸馏水3 BV 洗去杂质,然后依次用30%、40%、50%、60%、70%、80%和90%乙醇水溶液各3 BV 洗脱,每1 BV 收集1 个流份,测定榅桲多酚的质量浓度,计算解吸率。由图5 可知,榅桲多酚的解吸率随着乙醇体积分数不同有差别,乙醇浓度50%和60%时解吸率分别为80%和79%。因此,以50%乙醇溶液作为最佳洗脱剂。
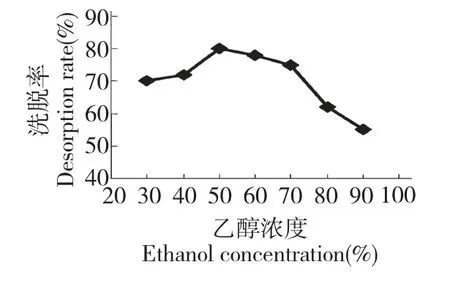
图5 不同乙醇浓度洗脱榅桲多酚曲线Fig.5 Elution curve of C.oblonga polyphenols with different concentrations of ethanol
2.3.3 洗脱液流速的选择
取0.04 g/mL 榅桲提取溶液11 BV,以2 BV/h流量上样吸附,依次用3 BV 体积蒸馏水洗脱,分别用50%的乙醇溶液以1、2、3 BV/h 的速度洗脱,收集洗脱液,分别测定洗脱液中榅桲多酚的浓度。如图6 所示,当洗脱流速小于2 BV/h 时,榅桲多酚质量浓度随着流速的增大而增大;洗脱流速大于2 BV/h 时,质量浓度随着洗脱流速的增大而减小。这是由于洗脱流速太慢时,解吸时间长、解吸的杂质多;2 BV/h 时洗脱液中榅桲多酚达到最大质量浓度,因此选择2 BV/h 为最佳洗脱液流速。

图6 洗脱液流速的选择Fig.6 Selection of elution rate
2.3.4 洗脱液体积的选择
按上述2.2 中选择的上样条件进行层析,吸附之后,用3 BV 蒸馏水快速洗去水溶性杂质。用50%乙醇溶液,流速为2 BV/h 进行洗脱,每1 BV 收集1 个流份,分别测定各流份中榅桲多酚的质量浓度。如图7 所示,洗脱液用量在2 BV 以内时,洗脱液中多酚浓度随洗脱液用量增大而升高,用量大于2 BV 后,50%乙醇洗脱液中多酚量随洗脱体积的增大逐渐减少,到5 BV 时,洗脱液中几乎已无多酚,考虑到生产成本,选择洗脱液体积为4 BV。

图7 洗脱体积的选择Fig.7 Selection of elution volume
2.4 验证试验
按上述所确定的纯化榅桲多酚的吸附和洗脱条件,重复试验3 次,收集洗脱液,浓缩干燥的纯化物浸膏总多酚质量浓度为30.11 mg/g,是粗提物(9.55 mg/g)的3 倍。

表2 榅桲总多酚的PTP1B 抑制活性Table 2 The inhibition activity of total polyphenols from C.oblonga on PTP1B
2.5 榅桲多酚对蛋白酪氨酸磷酸酶1B(PTP1B)抑制作用的研究
将得到的榅桲总多酚提取物进行PTP1B 抑制作用的研究。如表2 所示,榅桲总多酚对PTP1B 有较强的抑制作用,用大孔树脂纯化后活性明显提高。阳性对照原矾酸钠的IC50为1.81 μg/mL。
3 结论
通过考察11 种大孔吸附树脂,确定AB-8 型大孔树脂对榅桲多酚有较好的吸附和解吸性能,适用于榅桲总多酚的纯化。最佳纯化条件为:上样浓度为0.04 g/mL,上样量为11 BV,上样流速为2 BV/h,用3 BV 蒸馏水除杂后,以50%乙醇溶液为洗脱剂,洗脱液用量为4 BV,流速为2 BV/h 进行洗脱。在此条件下,经AB-8 树脂纯化后,榅桲总多酚质量浓度达到了30.11 mg/g,是粗提物的3 倍。而且榅桲总多酚对PTP1B 有较强的抑制作用,其IC50为16.14 μg/mL。实验表明,经树脂纯化,去除了大量的杂质,提高了总多酚的含量和PTP1B 抑制作用,对榅桲总多酚有较好的精制效果。
1 Flora Editorial Committee of Xinjiang(新疆植物志编辑委员会).Flora of Xinjiang(新疆植物志).Urumqi:Xinjiang Science Technology and Health Press,1995.Vol II,287.
2 Chinese Pharmacopoeia Commission(国家药典委员会).The Pharmaceutical Standards of Sanitary Ministry of People’s Republic of China,Uighur Pharmacopoeia Fascicule(中华人民共和国卫生部药品标准,维吾尔药分册).Urumqi:Xinjiang Health Technology Press,1999.105.
3 Editorial Committee of Chinese Medical Encyclopedia(中国医学百科全书编辑委员会).Encyclopedia of Chinese Medicine-Uighur medicine(中国医学百科全书维吾尔医学).Shanghai:Shanghai Science and Technology Press,2005.177.
4 Liu YM(刘勇民),Sawut Y(沙吾提·伊克木).Uyghur Medicine Journal(维吾尔药志).Urumqi:Xinjiang Health Technology Press,1999.Vol I,538.
5 Branca MS,Paula BA,Ana CG,et al.Influence of jam processing upon the contents of phenolics,organic acids and free amino acids in quince fruit(Cydonia oblonga Miller).Eur Food Res Technol,2004,218:385-389.
6 Silva BM,Andrade PB,Ferreres F,et al.Phenolic profile of quince fruit(Cydonia oblanga Miller)(Pulp and Peel).J Agric Food Chem,2002,50:4615-4618.
7 Tuba E,Victor W,Peter W.Dimeric procyanidins screening for B1 to B8 and semisynthetic preparation of B3,B4,B6,and B8 from a polymeric procyanidin fraction of white willow bark(Salix alba).J Agric Food Chem,2010,58:7820-7830.
8 Silva BM,Andrade PB,Valentao P,et al.Quince(Cydonia oblanga Miller)fruit(Pulp,Peel and seed)and jam:antioxidant activity.J Agric Food Chem,2004,52:4405-4712.
9 Hamauzu Y,Takaroni I,Kume C,et al.Antioxidant and antiulcerative properties of phenolics from Chinese quince,quince,and apple fruits.J Agric Food Chem,2006,54:765-772.
10 Sami F,Caboni P,Coroneo V,et al.Antimicrobial activity of tunisian quince(Cydonia oblonga Miller)pulp and peel polyphenolic extracts.J Agric Food Chem,2007,55:963-969.
11 Antonio F,Brigida D,et al.Isolation and structure elucidation of antioxidant polyphenols from quince(Cydonia vulgaris)peels.J Agric Food Chem,2008,56:2660-2667.
12 Gulsimayi A(古丽斯玛依·艾拜都拉),Gulnur M(古丽努尔·买买提),Akbar I(艾克帕尔·斯马依),et al.Antibacterial effect of flavone extract from Xinjiang Cydonia oblonga Mill.Food Sci(食品科学),2009,3:134-136.
13 Wang MT(汪茂田),Xie PS(谢培山),Wang ZD(王忠东),et al.Isolation and Structure Elucidation of Natural Organic Compounds(天然有机化合物提取分离与结构鉴定).Beijing:Chemical Industry Press,2004.100.
14 Reyimgul A(热依木古丽·阿布都拉),Lai HZ(来海中),Liu ZS(刘照胜),et al.A study on the preparation techniques of extracting polyphenols from the pericarpium granati(Punica granaum L.).J Xinjiang Med Univ(新疆医科大学学报),2013,36:723-728.
15 Hu XX(胡辛欣),Yang YF(杨雁芳),et al.Preliminary exploration of inhibitory activities of Salvia species on PTP1B.Acta Pharm Sin(药学学报),2009,44:440-442.
16 Lin YR(林燕如),Cao QY(曹迁永).Study on the purification of flavonoid from the leaves of Cibotium baromeu(L.)J.Sm.by macroporous resin.Hubei Agric Sci(湖北农业科学),2011,50:583-586.
