槟榔油急性毒理试验及其自微乳特性研究
2014-12-27蒋欣欣张海德王伟涛
蒋欣欣 张海德 王伟涛 廖 芸
(海南大学食品学院1,海口 570228)(河北经贸大学生物科学与工程学院2,石家庄 050061)
槟榔油急性毒理试验及其自微乳特性研究
蒋欣欣1张海德1王伟涛1廖 芸2
(海南大学食品学院1,海口 570228)(河北经贸大学生物科学与工程学院2,石家庄 050061)
研究槟榔油的毒理安全性及微乳化特性,研制出槟榔油自乳化传递系统,以便提高槟榔油的生物利用度。通过槟榔籽油对SD大鼠灌胃给药急性毒性试验,研究其安全性;通过溶解度试验、浊点测试、三相图的绘制和星点设计-效应面法的优化等试验,以自微乳乳化前后表征、微乳液粒径,Zeta电位为指标,优化筛选出各组分的最佳组合和最适配比。结果表明,进行毒性试验的动物均未见明显的毒性症状,体重未见明显影响,各主要生命器官剖检均未见异常;槟榔油自微乳的最佳配方为:槟榔油(19.56%)、聚氧乙烯氢化蓖麻油(54.31%)、乙二醇单乙基醚(26.13%),平均粒径为54.34 nm,zeta电位为-33.82 mV。槟榔油安全范围大,无毒副作用,制备槟榔油自微乳稳定性好。
槟榔油 毒理试验 自乳化 星点设计
槟榔果是棕榈科植物槟榔(ArecaCatechuL )的成熟种子,由槟榔壳和槟榔籽组成。槟榔籽具有多种生理活性物质,槟榔籽中含有槟榔油脂10%~18%[1-2],槟榔果所含脂肪酸组成复杂,其脂肪酸类成分对人体有重要生理功能,其主要脂肪酸为:月桂酸19.5%,肉豆蔻酸46.2%,棕榈酸12.7%,硬脂酸1.6%,癸酸0.3%,油酸6.2%,亚油酸5.4%,十二碳烯酸0.3%,十四碳烯酸7.2%[3]。这些活性成分对人体内DPPH自由基、ABTS自由基有良好的清除作用[4-5],也有研究发现槟榔油具有抗炎、抑制微生物生长等作用[6-7],在对大鼠的试验模型研究中,槟榔油和槟榔碱协同作用,能够降低血脂,防止动脉粥样硬化[8]。
自微乳药物传递系统(self-microemulsifying drug delivery system,SMEDDS)为由油相,表面活性剂和助表面活性剂组成的口服制剂,能够使难溶于水的组分在水相中稀释后经轻微搅拌或自发形成动力学和热力学稳定的纳米级微乳[9],药物在人体胃消化系统蠕动过程中形成纳米级微乳,以此提高溶解性,以及在小肠部位获得更大的生物利用度[10]。
本试验研究槟榔籽油对SD大鼠产生的急性毒性反应及严重程度、产生毒性反应的靶器官,确定无毒反应的剂量,以评估槟榔籽油用药的安全性。根据槟榔油的脂肪酸组成特征,选取合适表面活性剂及助表面活性剂,优化出最佳槟榔油自微乳处方。
1 材料与方法
1.1 材料与仪器
实验动物:无特定病原体(SPF级)SD大鼠64只,雌雄各半,雌性无孕,体重180~220 g,湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号:SCXK(湘)2009-0004,实验动物合格证号:HNASLKJ20120444。
槟榔籽:取自新鲜槟榔(海南品种,采自海南五指山农场) ,50 ℃烘干粉碎;吐温20、吐温80、1,2-丙二醇、PEG-400、正丁醇、石油醚:国药集团化学试剂有限公司;Cremophor EL(EL-35,聚氧乙烯氢化蓖麻油):阿拉丁;Labrasol(聚乙二醇-8-甘油辛酸)、 Transcutol(乙二醇单乙基醚):法国Gattefosse公司。
Zetasizer Nano S90激光粒度仪:英国Malvern;CW-2000型超声-微波协同萃取仪:上海新拓微波溶样测试有限公司;RE52CS-2旋转蒸发仪:上海亚荣生化仪器厂; TG16-WS高速离心机:长沙平凡仪器仪表有限公司;85-1恒温磁力搅拌器:常州澳华仪器有限公司。
1.2 试验方法
1.2.1 槟榔籽油及其制备方法[3]
用超声-微波协同萃取法制备槟榔籽油样品,石油醚为萃取剂,提取时间22 min、温度65 ℃、液料比11∶1(mL/g),微波功率50 W,频率40 kHz。
1.2.2 槟榔油对SD大鼠急性毒理试验
依据《中药、天然药物急性毒性研究技术指导原则》和槟榔籽油相关信息,采用“最大给药量”法进行槟榔籽油对SD大鼠灌胃给药急性毒性试验[11-12]。
1.2.2.1 预试验
依据槟榔籽油相关信息,槟榔籽油对SD大鼠可能不存在明显的急性毒性。因此,按最大灌胃给药体积(20 mL/kg)和最大给药浓度进行槟榔籽油对SD大鼠灌胃给药急性毒性预试验。1日内给药2次,时间间隔为4 h,给药前禁食12 h,不禁水。
给药时观察药物对动物的毒性反应情况、死亡数和死亡时间。依据表1每天观察1次动物的一般症状。
1.2.2.2 正式试验
1)动物分组
取60只检疫合格的SPF级SD大鼠,随即分为供试品组、阴性对照组和空白对照组,每组20只,雌雄各半,雌者无孕。供试品组给予槟榔籽油,阴性对照组给予无菌水,空白对照组不给药。
根据预试验结果,4只大鼠在给药后均未见异常。正式试验按“最大给药量”法进行正式试验,按大鼠最大灌胃给药体积20 mL/kg给予供试品槟榔籽油原液。供试品和阴性对照品均为1日内给药2次,时间间隔为4 h,全部药量在20 s内匀速给完。供试品和阴性对照品给药途径均为灌胃给药,给药前禁食12 h,不禁水。
2) 症状观察
给药时观察药物对动物的毒性反应情况、死亡数和死亡时间,从给药当日到给药后14 d,依据表1每天观察动物的一般症状至少1次。
3) 尸体检查
试验期间对死亡动物进行大体剖检,检查各主要生命器官(心脏、肝脏、脾脏、肺脏、肾脏、肾上腺、胸腺、膀胱、睾丸、附睾、子宫、卵巢和肠道等)检查及给药局部是否异常。
4) 体重
给药前和给药后1、3、7和14 d用电子天平各称量1次体重。
5) 病理检查
所有的试验动物均应进行大体解剖,包括试验过程中因濒死而处死的动物、死亡的动物以及试验结束时仍存活的动物。任何组织器官出现体积、颜色、质地等改变时,及时进行复诊,必要时拍照,同时进行组织病理学检查[13]。
1.2.3 槟榔油微乳液的制备及乳化效果评价[14]
选取槟榔油作为油相,Tween 80、Tween 20、EL-35、Labrasol作为乳化剂,丙二醇为助乳化剂,取1 g自乳化液加入到100 mL水中,调整磁力搅拌器转速为中速,室温搅拌5 min成乳。以成乳前各组分的相融性、成乳时的自发性、分散性及成乳后的离心效果作为综合评价标准。
不同乳化剂浊点不同,乳化能力也不同,助表面活性剂可以提高乳化剂浊点。通过考察不同助表面活性剂在添加量为质量分数2%时对10 mg/mL的Tween 80溶液浊点(采用甘油浴加热)的影响,来选取助表面活性剂。
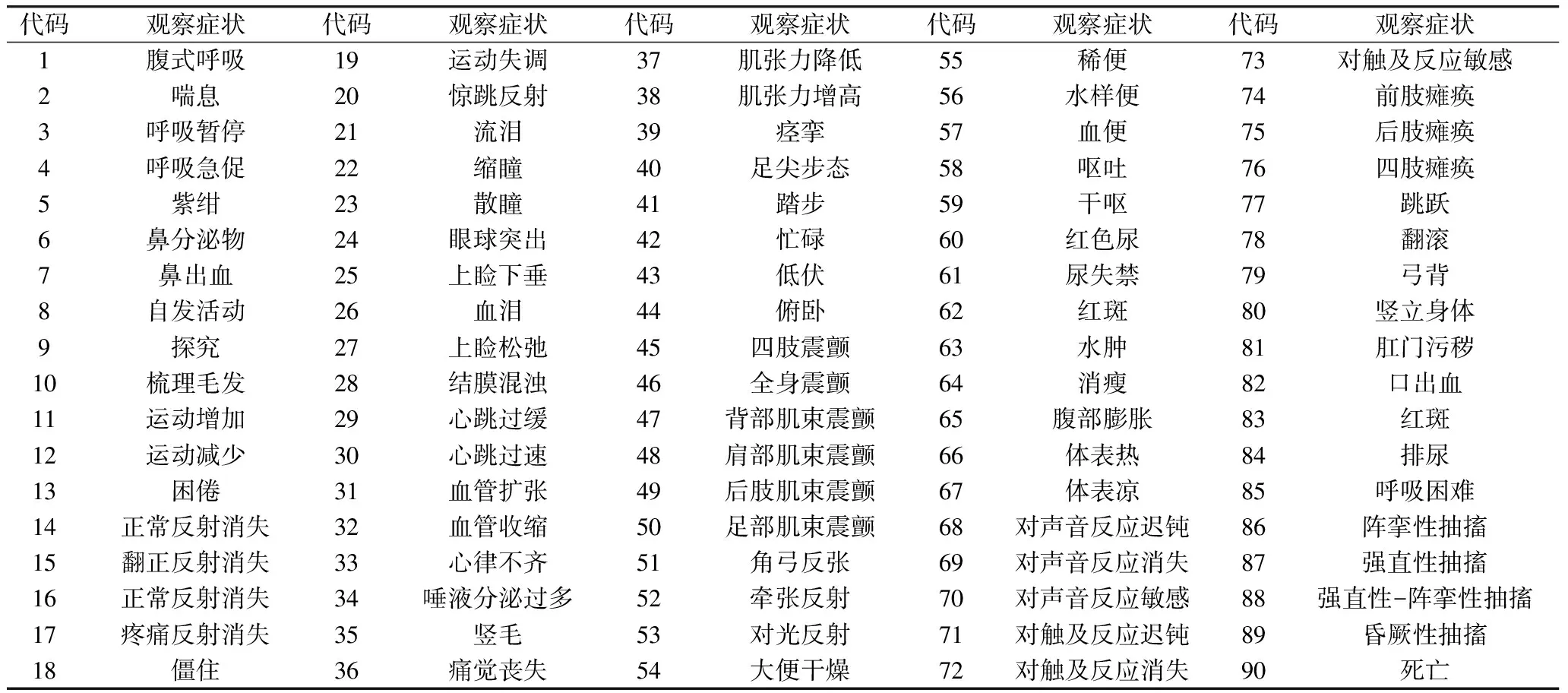
表1 症状观察表
1.2.4 乳液粒径及zeta电位的测定
将不同配比的自微乳在室温下用蒸馏水稀释100倍,用磁力搅拌器混匀5 min。根据动态光散射原理,用激光粒度仪测定微乳液的乳液粒径以及zeta电位,检测波长为633 nm,设置检测散射光检测角度为90°,电位测定选用Zeta dip cell样品槽。
1.2.5 三相图的绘制
以槟榔油为油相,在室温下将表面活性剂与助表面活性剂以不同质量比例(Km)充分混合,再与槟榔油按质量比9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8和1∶9混匀,稀释至100 mL蒸馏水中并用磁力搅拌器搅拌混匀,观察记录不同比例的成乳情况,以形成微乳区域为指标绘制三相图。
2 结果与分析
2.1 槟榔油对SD大鼠急性毒理试验结果
2.1.1 症状观察
在预试验和正式试验中,按照症状观察表的各项指标进行观察,未出现毒性反应情况和死亡,动物在给药后均未见异常。
2.1.2 尸体检查
对恢复期处死动物进行大体剖检,检查各主要生命器官(心脏、肝脏、脾脏、肺脏、肾脏、肾上腺、胸腺、膀胱、睾丸、附睾、子宫、卵巢和肠道等),结果均未见异常。
2.1.3 体重
给药前和给药后1、3、7和14 d各称量1次体重,各供试品给药组动物平均体重分别和阴性对照组动物平均体重用SPSS 13.0统计分析软件对体重数据进行单因素方差分析,根据表2结果表明:给药前和给药后1、3、7和14 d,供试品组大鼠体重和空白对照组比较P>0.05,无统计学意义。说明在此次急性毒性试验中,槟榔籽油对大鼠体重影响和空白对照组比较无明显影响。
表2 大鼠体重增长情况
张海德等[15]对槟榔籽油进行GC-MS成分分析研究,成分主要是中长链脂肪酸以及各种活性成分,并未发现有毒副作用成分。在此基础上进行槟榔油对大鼠的急性毒理试验,动物均未见明显的毒性症状,体重未见明显影响,各主要生命器官剖检均未见异常。这为槟榔油的进一步研究利用提供了安全基础与保障。
2.2 表面活性剂与助表面活性剂的选定
油通过表面活性剂的双亲基团能与水形成乳液,表面活性剂分为离子型表面活性剂与非离子型表面活性剂,考虑长期服用安全性,SMEDDS选取非离子型表面活性剂。表面活性剂的乳化能力多用HLB值来表示,形成水包油型乳液表面活性剂的HLB值一般大于12[16]。试验中槟榔油与Tween 80、EL-35、Labrasol都可以不同程度地混合均匀,但与Tween 20互溶性较差,具体结果见表3。
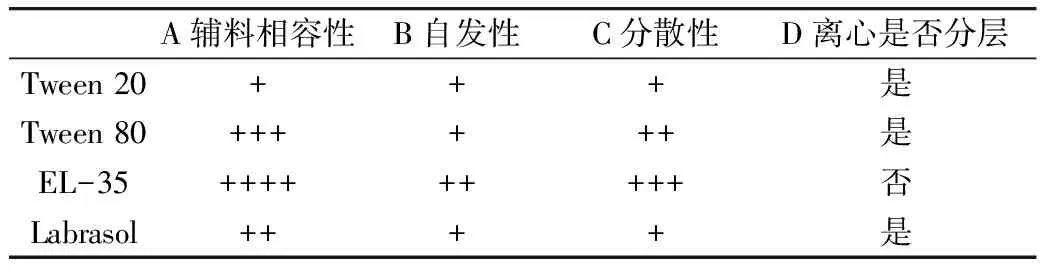
表3 不同组分微乳液的表征
注:A:考察稀释前3种材料的相容性;B:稀释后是否需要物理搅拌以及搅拌时间;C:考察稀释后溶液的透明度以及表面是否出现絮状漂浮或油滴;D:在3 000 r/min条件下离心15 min。
正常乳液不稳定,需要加入助表面活性剂,形成动力学和热力学稳定,油滴粒径小于100 nm的微乳液体系,一般认为助表面活性剂降低了乳液的界面张力,增加界面膜的柔性和流动性,减少微乳液形成时所需要的弯曲能,使微乳液液滴容易形成[17]。选取的几种不同助表面活性剂对Tween 80的浊点都有提高(见表4),其中丙二醇效果最好,但丙二醇为短链醇,挥发性较大,会影响处方组分的变化从而降低微乳体系的稳定性;PEG400吸水性强,自微乳一般选取软胶囊为外包装材料,会导致胶囊壳变硬,因此选取Transcutol为助表面活性剂。

表4 不同助表面活性剂对Tween 80浊点的影响
2.3 三相图的绘制
不同脂肪酸的自乳化特性不同,Shahba[18]等对不同自微乳配方三相图相平衡研究表明,混合单双甘油酯为油相的自微乳的液晶相区域小,自微乳粒径小;中链甘油酯的乳化效果最好。槟榔油主要由各种中长链混合不饱和及饱和脂肪酸,多种功能性活性物质组成。自微乳的制备一般是将难溶于水,不稳定的药物溶解在特定的油相中[19],对川芎油进行自微乳胶囊研究,川芎自微乳胶囊在6个月内品质稳定,吸收利用率是普通川芎油的2.53倍[20]。直接将提取物作为油相也能取得较好乳化效果[21-22]。
以槟榔油为油相,Transcutol为助表面活性剂,对Labrasol ,Tween 80 ,EL-35分别作三相图,绘制出槟榔油微乳化的乳化区域。由图1可知,在以Transcutol为助表面活性剂,槟榔油与三种表面活性剂都能形成微乳液,形成微乳时间<1 min。其中Labrasol成乳载油量在10%以内,效果较差,Tween 80成乳载油量也在10%以内,但表面活性剂的量必须在50%以上,EL-35的乳化面积最大,成乳载油量能达到30%以上,成乳时对表面活性剂的需求量也很低。因此选取EL-35为槟榔油自微乳的表面活性剂,Transcutol为助表面活性剂。

图1 槟榔油微乳化三元相图
2.4 星点-效应面法优化自微乳处方
在三相图基础上,采用星点-效应面法(Central-Composite Design,CCD),选取对槟榔油自微乳影响较显著的2个因素油相比例(X1)和Km值(X2)为响应变量,以-1,0,+1分别代表因素水平,取值范围由三相图结果确定:以为乳液粒径(Y1),zeta电位(Y2)为响应值对微乳液的乳化效果进行评价,以此建立数学模型,优化槟榔油自微乳配方。试验设计因素水平见表5,试验设计及结果见表6。

表5 星点设计因素分析水平及代码
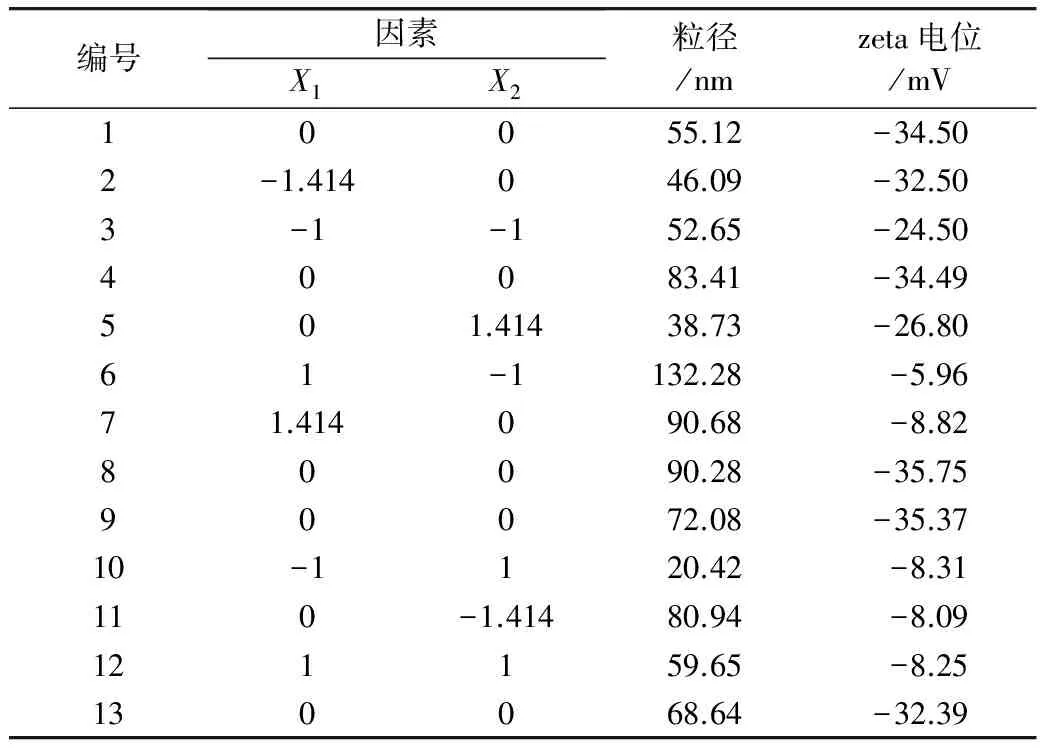
表6 星点设计方案及其试验结果
用Design Expert 8.0.5对数据进行回归分析,得到拟合方程:
粒径:Y1=73.90+22.74X1-20.57X2-10.10X1X2-2.22X12-6.50X22(R2=0.855 1,P=0.007 5)
zeta电位:Y2=-34.50+6.51X1-1.57X2-4.62X1X2+8.74X12+10.35X22(R2=0.820 6,P=0.015 1)。
结果表明:粒径和zeta电位均符合二次多元线性方程,相关系数较高,拟合度较好,差异具有统计学意义。其中油相比例X1对粒径影响最大,其次是Km值X2,交叉作用也有一定的影响;对zeta电位影响较大的依次是Km值二次项X22,油相比例二次项X12和油相比例X1,模型响应值的变化主要来自所选因变量,即油相比例和Km值,因此,回归方程可以较好地描述随机因子与响应值之间的关系。
根据回归方程,做出响应曲面图及其等高线图(图2),可以直观反映各因素之间以及各因素和响应值之间的交互作用。以平均粒径(Y1)为响应值的图2中,固定油相比例,粒径随着Km值的增大而减小,固定Km值时粒径随着油相比例的增大而增大,与等高线的圆心位置也偏外结果一致,同时在2个因素中一个因素X低编码值和高编码值时,响应值Y随着另一因素的变化趋势相差较大,由此可以得出2个因素油相比例(X1)和Km值(X2)之间的交互作用也较大。以zeta电位(Y2)为响应值的图中,固定其中一个因素,响应值都有随另一个因素先减小后增大的趋势,等高线在图内也呈比较圆的形状,2个因子的交互作用也较小,响应值zeta电位(Y2)在2个因子所选的-1~1范围内存在最小值。
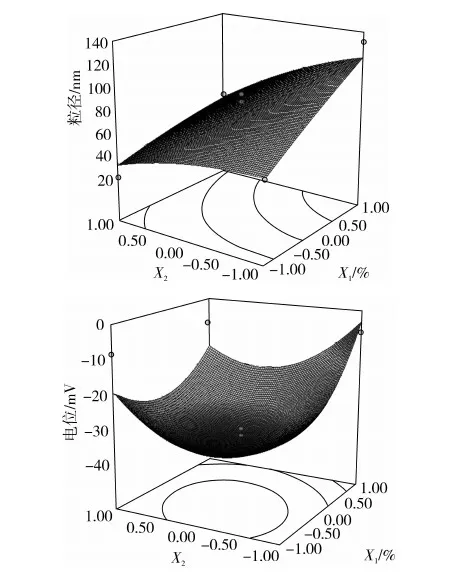
图2 响应面图和等高线图
运用Design Expert 8.0.5对数据预测优化,以粒径<60 nm,zeta电位<32 mV为限制条件,绘制等高线叠加图,见图3,得到槟榔油自微乳的预测最佳值为:油相比例19.56%,Km值2.078 1,微乳液粒径理论值为53.49 nm,zeta电位理论值为-33.96 mV。
按优化处方比例制备自乳化系统,进行粒径,zeta电位考察,对预测结果进行验证,3次平行试验得到的实际平均粒径为54.34 nm,zeta电位为-33.82 mV,与理论预测值相差不大。
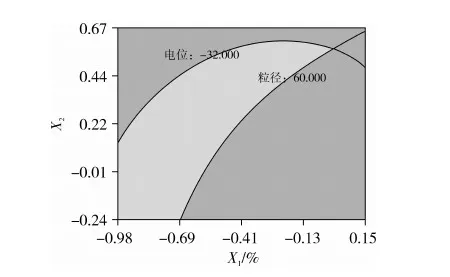
图3 优化处方的效应面等高线叠加图
3 结论
槟榔油功能活性成分多,进行槟榔油对大鼠的急性毒理试验,动物均未见明显的毒性症状,体重未见明显影响,各主要生命器官剖检均未见异常。这为槟榔油的进一步研究利用提供了安全基础与保障。不同脂肪酸的自乳化特性不同,通过三相图相平衡研究,选用安全性高,乳化效果好的EL-35为表面活性剂,Transcutol为助表面活性剂。配方优化后为:槟榔油为自微乳油相(19.56%)、EL-35为表面活性剂(54.31%)、Transcutol为助表面活性剂(26.13%),得到的微乳液平均粒径为54.34 nm,zeta电位为-33.82 mV,自微乳在体内经过微乳化使油滴在人体内自发形成纳米级别的微粒,能极大提高人体对其吸收率,增加生物利用度[23]。
[1]周文化,蒋爱民,普义鑫.响应面法优化槟榔油超临界CO2提取工艺条件的研究[J]. 食品与机械,2010,26(6):116-118
[2]周文化,张海德,何双,等.槟榔油提取技术的研究[J]. 热带作物学报,2008,32(2):1-4
[3]辛晓晨,裴志胜,张海德,等.响应面法优化超声-微波协同萃取槟榔籽油及其脂肪酸组成分析[J]. 食品科学,2012(2):67-71
[4]韩林,黄玉林,张海德.槟榔籽中抗氧化成分的提取及活性研究[J]. 食品与发酵工业,2009,35(9):157-161
[5]张海德,黄玉林,范燕忠.槟榔提取物对DPPH自由基的清除作用研究[J]. 食品科学,2008,29(8):74-78
[6]Reddy G S R,Ramachandraiah O S,Rao S J,et al. Processing of arecanut for the recovery of edible fat [India][J]. Journal of Plantation Crops,1976(4):51-53
[7]Ontengco D C,Talaue M,Cruz L J,et al. MICs [Minimum inhibitory concentration]of betel oil against common clinical pathogens[J]. Acta Manilana,1999,47:61-66
[8]Zhou W H,Jiang A M,Zhang H D,et al. Areca nut oil with arecoline can enhance hypolipidemia in rats[J]. Journal of Medicinal Plants Research,2011,5:2143-2148
[9]Khan B A,Bakhsh S,Khan H,et al. Basics of self micro emulsifying drug delivery system[J]. Journal of Pharmacy and Alternative Medicine,2012(1):13-19
[10]Singh A K,Chaurasiya A,Awasthi A,et al. Oral bioavailability enhancement of exemestane from self-microemulsifying drug delivery system (SMEDDS)[J]. AAPS PharmSciTech,2009,10(3):906-916
[11]GPT 2-1-2003,中药、天然药物急性毒性研究技术指导原则[S]
[12]陈奇.中药药理研究方法学[M]. 北京:人民卫生出版社,2006
[13]GPT 1-1-2005,化学药物急性毒性研究技术指导原则[S]
[14]周立明. CA 自微乳的研制[D]. 石家庄:河北医科大学,2010
[15]张海德,黄玉林,韩林.槟榔油的分离及GC-MS分析[J]. 食品科学,2009 (22):298-300
[16]金谷.表面活性剂化学[M]. 合肥:中国科学技术大学出版社,2008:40-46
[17]王军.乳化与微乳化技术[M].北京:化学工业出版社,2012:70-71
[18]Shahba A A W,Mohsin K,Alanazi F K. The studies of phase equilibria and efficiency assessment for self-emulsifying lipid-based formulations [J]. AAPS Pharm Sci Tech,2012,13(2):522-533
[19]Sprunk A,Strachan C,Graf A. Rational formulation development and in vitro assessment of SMEDDS for oral delivery of poorly water soluble drugs[J]. European Journal of Pharmaceutical Sciences,2012,46(5):508-515
[20]Yao G,Li Y. Preparation,characterization and evaluation of self-microemulsifying drug delivery systems (SMEDDSs) of Ligusticum chuanxiong oil[J]. Biomedicine & Preventive Nutrition,2011,1(1):36-42
[21]Warke S,Warke P,Kale M K,et al. Formulation design and evaluation of herbal self micro emulsifying drug delivery system (SMEDDS)[J]. Research Journal of Pharmacy and Technology,2011,4(7):1135-1140
[22]Kale M K,Suruse P B,Warke S P. Development and evaluation of a self micro emulsifying drug delivery system of a herbal extract[J]. American Journal of Pharm Tech Research,2012,2(1):338-348
[23]Mercuri A,Passalacqua A,Wickham M S J,et al. The effect of composition and gastric conditions on the self-emulsification process of ibuprofen-loaded self-emulsifying drug delivery systems:a microscopic and dynamic gastric model study[J]. Pharmaceutical research,2011,28(7):1540-1551.
Acute Toxicity Test and Study of Arecanut Oil SMEDDS
Jiang Xinxin1Zhang Haide1Wang Weitao1Liao Yun2
(College of Food Science, Hainan University1, Haikou 570228)(College of Biological Science and Engineering, Hebei University of Economics and Business2, Shijiazhuang 050061)
The aim of this research is to investigate the toxicological safety and micro-emulsifying properties of aercanut oil, and to develop the formulations of aercanut oil self-emulsifying system which had a high bioavailability. The acute oral toxicity test in SD rats was adopted to study the safety of areca nut oil; the optimum formulations of aercanut oil SMEDDS were screened by solubility test, cloud point, ternary phase diagram and central composite design-response surface methodology with excipients miscibility, the appearance after aqueous dilution, particle size and zeta electric potential as parameters. As a result, the animals in the acute oral toxicity test showed no obvious toxicity symptoms, body weight had no obvious effect, and major life organs were normal. The optimum self-microemulsifying delivery system was composed of aercanut oil (19.56%), EL-35(54.31%), and Transcutol (26.13%). The mean particle size after the emulsification was 54.34 nm and zeta electric potential was -33.82 mV. Aercanut oil has a large safe range with non-toxic side effects; meanwhile, the prepared of SMEDDS has a good stability.
arecanut oil, acute toxicity test, self-emulsifying, central composite design
TS222
A
1003-0174(2014)06-0057-06
国家科技支撑计划(2007BAD76B03),中西部高校提升综合实力计划学科建设(2014-hdsp-03)
2013-07-03
蒋欣欣,男,1988年出生,硕士,食品工程
张海德,男,1971年出生,教授,农产品加工
